3,5-二溴BODIPY与末端芳炔Sonogashira偶联反应的研究
2016-08-10杨安乐刘园园马懿凡尹守春
何 田,杨安乐,王 韬,陈 珈,魏 斌,刘园园,马懿凡,尹守春
(杭州师范大学材料与化学化工学院,浙江 杭州 310036)
3,5-二溴BODIPY与末端芳炔Sonogashira偶联反应的研究
何田,杨安乐,王韬,陈珈,魏斌,刘园园,马懿凡,尹守春
(杭州师范大学材料与化学化工学院,浙江 杭州 310036)
摘要:以3,5-二溴-8-(4-甲苯基)BODIPY为底物与不同芳炔进行Sonogashira偶联反应合成了3个不同的BODIPY荧光染料,使用红外光谱、核磁氢谱、碳谱、质谱等方法对其结构进行了表征.通过改变反应时间、反应温度、催化剂种类和用量、底物结构追踪Sonogashira偶联反应过程,探索最佳反应条件,发现采用Pd(PPh3)2Cl2和CuI共催化时,且催化剂用量为1∶1(4 mol%),反应温度为45 ℃,时间为5 h时,单取代产物的产率最高,达到40%.利用Sonogashira偶联反应对BODIPY进行功能化,不仅合成简捷、条件温和、产率高,而且可以有效地调控BODIPY的共轭程度,拓宽其应用范围.
关键词:BODIPY;偶联反应;芳炔
分子影像学是被评为未来最具有发展潜力的10个科学前沿领域之一,被誉为21世纪的医学影像学[1].它运用影像学手段观察活体状态下组织水平的细胞和蛋白质等变化状况,以达到直观地对生物学行为在影像方面进行定性和定量研究.在分子影像学中,用于成像的荧光分子是必不可少的.到目前为止,可用的荧光分子仍较少.大多数荧光分子只能在纯有机溶剂中实现的,无法在环境和生命体系的水相环境中得到应用[2-3];有的激发波长在紫外区,会损害细胞或生物体,并且细胞内部成分也可能对荧光分析引起干扰[4-5];有的合成难、成本高、对pH敏感[1];有的荧光量子产率低,达不到成像效果[6].因此,研究开发新型的荧光分子就显得非常迫切而重要.
4,4-二氟-4-硼-3a,4a-二氮杂-s-引达省(BODIPY)荧光染料是近二十几年才发展起来并受到广泛关注的新型荧光化合物[7-9].它以其独特的光学性质而倍受重视,如高摩尔吸收系数、高荧光量子产率、对所处环境和pH不敏感等[10].尤其是长波长的BODIPY类荧光染料分子,更适合于活体细胞内跟踪生命过程的发生和变化,成为近期研究的热点[11].
文章以3,5-二溴-8-(4-甲苯基)BODIPY为底物,通过Sonogashira偶联反应制备了一系列单取代的BODIPY荧光染料衍生物,并对其反应条件进行了优化,为制备长波长BODIPY荧光染料衍生物提供了原料.
1实验部分
1.1主要实验仪器
红外光谱使用Nicolex 5700傅立叶红外光谱仪记录,KBr压片或液膜法(CH2Cl2).质谱分析使用Hewlett-Packard 5989A 质谱仪记录.高分辨质谱使用Kratos MS50TC 质谱仪记录.1H NMR和13C NMR使用AVANCE/DMX-500 Bruker核磁共振仪记录,CDCl3作为溶剂,TMS作为内标.
1.2主要实验试剂
3,5-二溴-8-(4-甲苯基)BODIPY[12-14],对(三甲基硅烷乙炔基)苯乙炔[15],对炔苯甲酸甲酯[16],对炔苯甲醛[17]均参考文献的方法合成;Pd(PPh3)2Cl2、碘化亚铜均来自于Alfa Aesar;薄层层析硅胶(GF54)和柱层层析硅胶(200~300目)均来自于山东青岛海洋化工厂产品;其他试剂和溶剂均为国产分析纯试剂.反应使用的四氢呋喃和三乙胺需重蒸除水后立即使用.
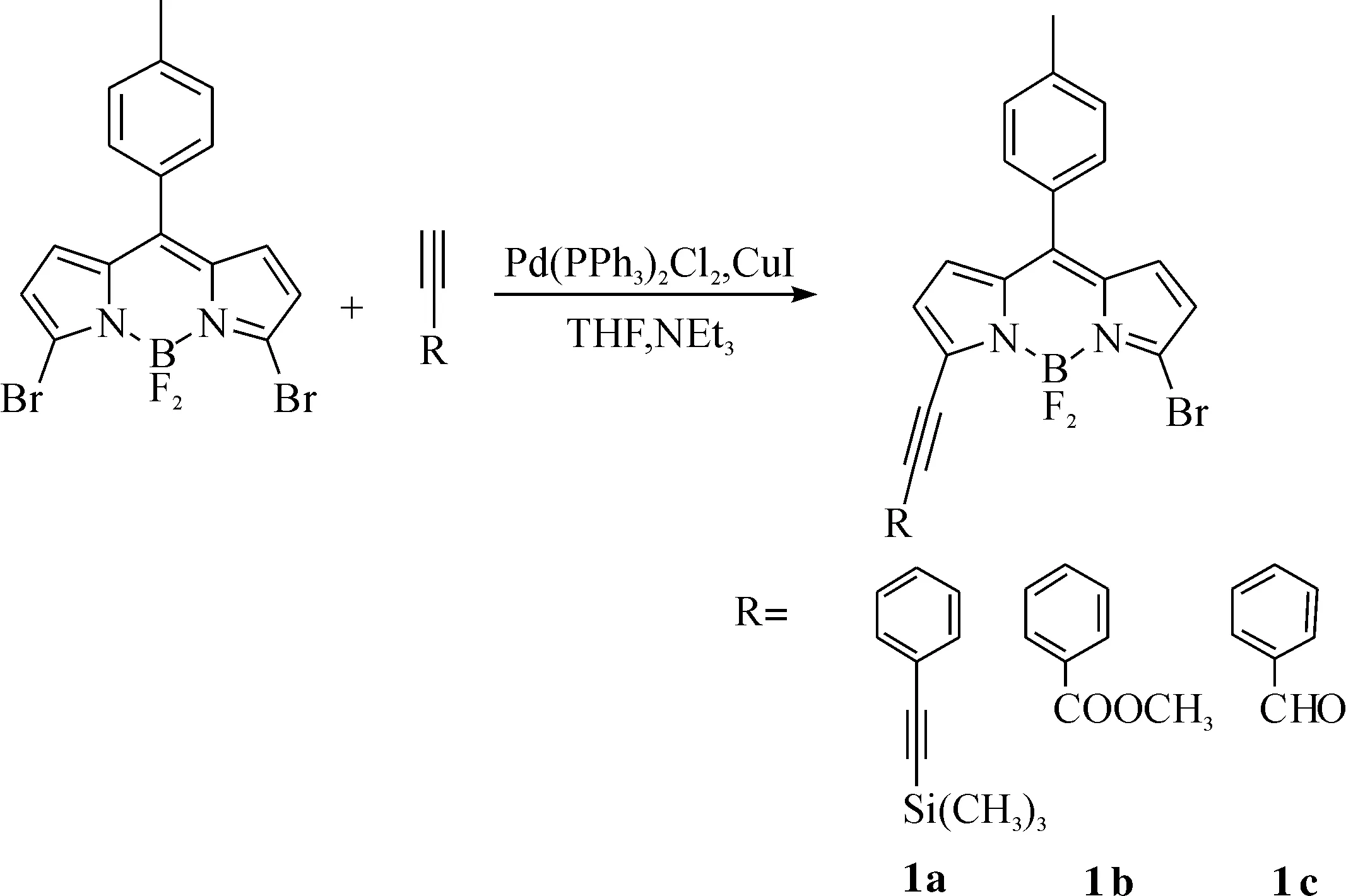
图1 化合物的合成路线Fig. 1 Synthetic route of compounds
1.3BODIPY类荧光染料的合成
1.3.1合成路线(图1)1.3.2化合物合成
将1 mmol 3,5-二溴-8-(4-甲苯基)BODIPY,1 mmol芳炔,0.05 mmol Pd(PPh3)2Cl2和0.05 mmol CuI溶于100 mL无水四氢呋喃和400 μL(2 equiv)无水三乙胺中.在氩气保护下,加热至45 ℃反应5 h.此反应混合液先旋干,再用饱和碳酸氢钠溶液洗涤,最后用二氯甲烷(30 mL×3)萃取,分液.收集有机层,有机层用无水硫酸镁干燥,减压旋蒸除去二氯甲烷得到粗产物,再经过硅胶柱层析分离得到单取代产物.
1a: 硅胶柱层析(SiO2;V(石油醚)∶V(二氯甲烷)=2∶1),紫色固体,产率为40%.FTIR (KBr),υ(cm-1):2 924, 2 854 (CH3), 2 201, 2 156 (C≡C), 1 609, 1 588, 1 410, 862 (Ar).1H NMR (500 MHz, CDCl3)δ(ppm): 7.53 (d, 2H,J= 8.0 Hz), 7.40 (d, 2H), 7.34 (d, 2H,J= 7.9 Hz), 7.26 (d, 2H), 6.87 (d, 1H,J= 4.1 Hz), 6.81 (d, 1H,J= 4.2 Hz), 6.70 (d, 1H), 6.52 (d, 1H), 2.46 (s, 3H, Ar-CH3), 0.26 (s, 9H, Si(CH3)3).
1b: 硅胶柱层析(SiO2;V(石油醚)∶V(二氯甲烷)=1∶2),橙红色固体,产率为52%.FTIR (KBr),υ(cm-1):2 926, 2 858 (CH3), 2 206, 2 148 (C≡C), 1 739 (C=O), 1 609, 1 588, 1 410, 1 227, 1 152 (C-O-C), 858 (Ar).1H NMR (500 MHz, CDCl3) δ(ppm): 7.97 (d, 2H,J= 7.8 Hz), 7.65 (d, 2H), 7.34 (d, 2H,J= 7.0 Hz), 7.25 (d, 2H), 6.83 (d, 1H,J= 4.6 Hz), 6.80 (d, 1H), 6.66 (d, 1H,J= 4.6 Hz), 6.37 (d, 1H), 3.86 (3H, s, OCH3), 2.39 (s, 3H, Ar-CH3).
1c: 硅胶柱层析(SiO2;V(石油醚)∶V(乙酸乙酯)=2∶1),紫红色固体,产率为31%.FTIR (KBr),υ(cm-1):2 933, 2 846 (CH3), 2 202, 2 152 (C≡C), 1 692 (C=O), 1 609, 1 574, 1 408, 1 227, 852 (Ar).1H NMR (500 MHz, CDCl3)δ(ppm): 10.03 (s, 1H, CHO), 7.89 (d, 2H,J= 8.0 Hz), 7.78 (d, 2H), 7. 44 (d, 2H,J= 7.4 Hz), 7.38 (d, 2H), 6.87 (d, 1H,J= 4.6 Hz), 6.81 (d, 1H), 6.72 (d, 1H,J= 4.6 Hz), 6.47 (d, 1H), 2.39 (s, 3H, Ar-CH3).
2结果与讨论
2.1Sonogashira偶联反应条件的优化
末端芳炔与卤代芳烃Sonogashira交叉偶联反应是一种重要构建碳碳键的有机合成方法.由于此反应的催化效率高、底物适用性广以及选择性好等特性,已被广泛地应用于取代炔烃以及大共轭炔烃的合成中,从而在有机化学、精细化学、材料化学和生物化学等领域起到至关重要作用[18-19].本文以3,5-二溴-8-(4-甲苯基)BODIPY为底物,与不同的芳基末端炔进行Sonogashira偶联反应合成一系列单取代的BODIPY衍生物.
为了得到最佳反应条件,以3,5-二溴-8-(4-甲苯基)BODIPY与对三甲基硅烷乙炔基苯乙炔的 Sonogashira偶联反应为例,考察了反应温度、反应时间、催化剂种类和用量、底物结构等对得到单取代产物的影响,具体结果如表1所示.
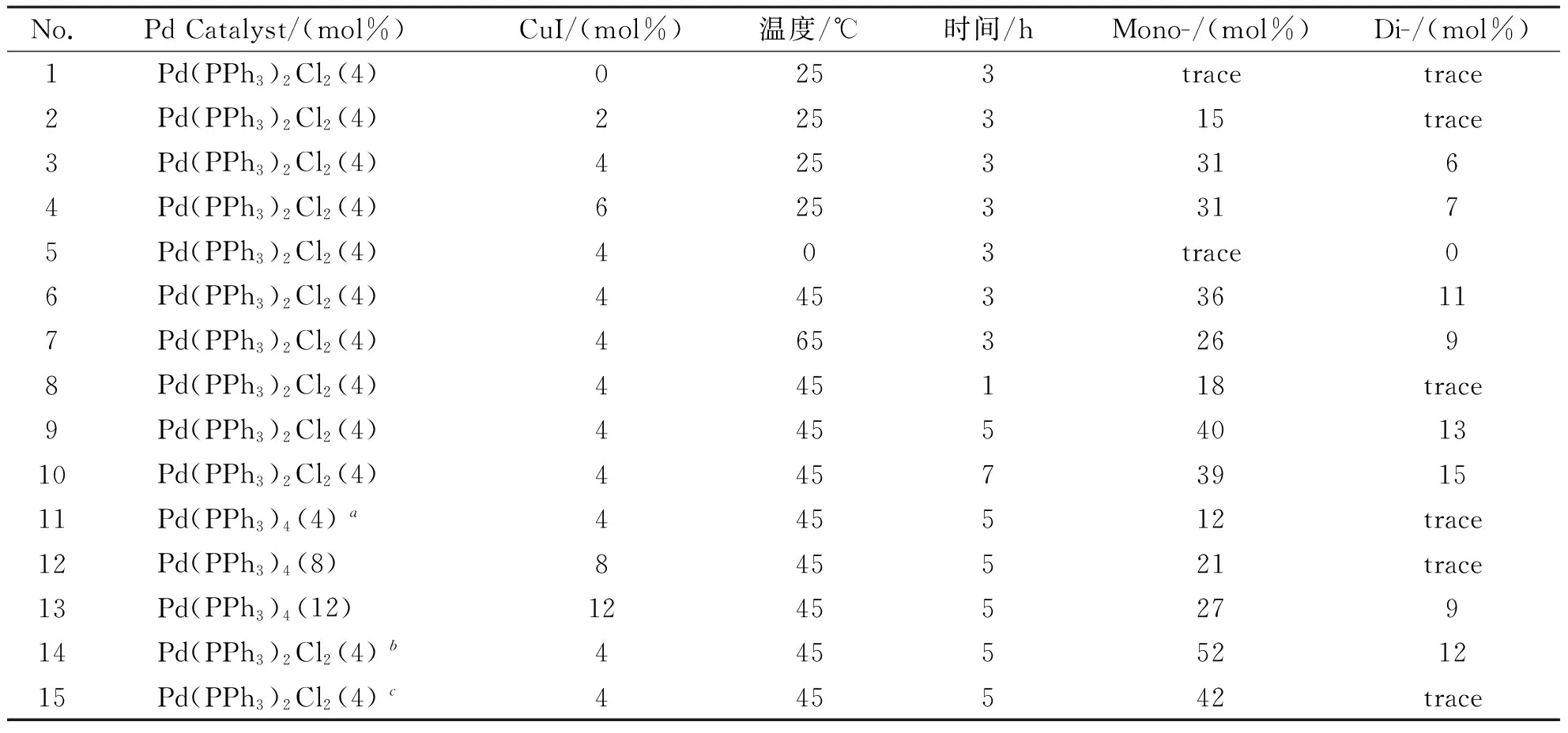
表1 Sonogashira偶联反应条件优化
an(Pd)∶n(CuI) = 1∶1.b3,5-二溴-8-(4-甲苯基)BODIPY与对炔苯甲酸甲酯的Sonogashira偶联反应.c3,5-二溴-8-(4-甲苯基)BODIPY与对炔苯甲醛的Sonogashira偶联反应.
助催化剂碘化亚铜用量探究实验(No.1—4)表明,若不添加碘化亚铜催化剂时,反应几乎不能发生(No.1);随着碘化亚铜用量的增加,单取代产物的产率有明显提高,4 mol%助催化剂用量(钯催化剂与助催化剂用量1∶1时)是该反应的最佳用量.Sonogashira 等认为,该催化反应包含3个催化环,碘化亚铜的加入使炔类化合物反应生成d-π共轭的炔铜化合物,更易于加成到 Pd(Ⅱ)上,提高催化效率.
碘化亚铜的加入虽然提高了反应产率,但此时单取代产物产率仅为 31% (No.4).改变反应温度,我们发现随着温度的上升,单取代产物的产率有明显提高.升高至45 ℃时,产率可以提高至36%;进一步升高温度,反而导致产率有所下降(No.5,3,6,7).这可能是由于升高温度芳炔更易发生自偶联副反应,导致产率下降.因此,该Sonogashira偶联反应的最佳温度为45 ℃(No.6).
我们进一步研究了时间对该Sonogashira反应的影响.实验结果(No.8,6,9,10)表明,当反应温度为45 ℃,延长反应时间有利于提高单取代产物的产率,但反应时间5 h 后,单取代产物的产率不但没有提高反而下降.这可能是由于BODIPY长时间处于碱性条件会发生部分分解.
我们也考察了不同催化剂对该Sonogashira偶联反应的影响.实验结果(No.9,11,12,13)表明,在相同的条件下,以Pd(PPh3)4代替Pd(PPh3)2Cl2作催化剂,得到单取代产物的产率仅为12%.虽然增加Pd(PPh3)4的用量,可以提高反应的产率,但是当Pd(PPh3)4的用量达到12 mol%时,反应产率也仅提高至27%.这可能是Pd(PPh3)4要比Pd(PPh3)2Cl2更活泼,在反应过程中对水或氧气更加敏感,容易造成催化剂失效.
因此,3,5-二溴-8-(4-甲苯基)BODIPY与对(三甲基硅烷乙炔基)苯乙炔进行Sonogashira偶联反应得到单取代产物的反应最佳条件为Pd(PPh3)2Cl2和CuI用量比1∶1做为催化剂,用量为4 mol%,反应温度为45 ℃,反应时间为5 h.
2.2炔烃原料对Sonogashira偶联反应的影响
在上述最佳条件下,我们进一步考察了不同炔烃原料对这类Sonogashira偶联反应的影响.实验结果表明,3,5-二溴-8-(4-甲苯基)BODIPY与苯乙炔进行 Sonogashira偶联反应的产率最高,可达到67%.苯乙炔苯环上含有三甲基硅烷基、酯基或醛基都会导致这类Sonogashira偶联反应的产率降低(No.9,14,15).3,5-二溴-8-(4-甲苯基)BODIPY与对(三甲基硅烷乙炔基)苯乙炔进行Sonogashira偶联反应产率相对较低的原因可能是,一方面由于三甲基硅烷基团在碱性条件下易发生脱去反应,另一方面三甲基硅烷取代基大的空间位阻效应.脱去反应和空间位阻共同影响导致产率大大地降低.通常含吸电子基团有利于芳溴与乙炔类衍生物进行Sonogashira偶联反应.然而,吸电子效应却会导致这类含BODIPY基团的Sonogashira偶联反应产率降低.
2.3炔烃原料用量对单、双取代的影响
表2炔烃原料用量对产物组成的影响
Tab. 2The influence of dosage of alkyne to the composition of products

No.BODIPY/molAlkyne/molMono-/(mol%)Di-/(mol%)110.5a19trace211.0a4013311.5a3719412.0a3024512.5a2232613.0a1837714.0a1737813.0b2142913.0c3437
an(Pd)∶n(CuI) = 1∶1.b3,5-二溴-8-(4-甲苯基)BODIPY与对炔苯甲酸甲酯的Sonogashira偶联反应.c3,5-二溴-8-(4-甲苯基)BODIPY与对炔苯甲醛的Sonogashira偶联反应.
在上述最佳条件下,进一步考察3,5-二溴-8-(4-甲苯基)BODIPY与不同用量的炔烃反应对产物组成的影响,具体结果如表2所示.
炔烃原料用量探究实验表明,当BODIPY与炔烃用量为1∶0.5时,单取代产物只有19%,此时仍有大量BODIPY原料未参与反应;当BODIPY与炔烃用量为1∶1时,单取代产物达到最大值40%,同时有13%的双取代产物;进一步增加炔烃原料的用量,单取代产物的量减少,双取代产物的量增加;当BODIPY与炔烃用量为1∶3时,双取代产物达到最大值37%,同时有18%的单取代产物;继续增加炔烃原料用量,产物组成没有太明显变化.
3结论
利用3,5-二溴-8-(4-甲苯基)BODIPY与不同末端芳炔的Sonogashira偶联反应合成了一系列BODIPY荧光染料衍生物.通过实验探索发现,当催化剂Pd(PPh3)2Cl2和助催化CuI用量为1∶1,反应温度为45 ℃,时间为5 h时,3,5-二溴-8-(4-甲苯基)BODIPY与末端芳炔反应得到的单取代产物最高;不同炔烃原料对Sonogashira偶联反应的影响也不同,对(三甲基硅烷乙炔基)苯乙炔由于脱去反应和空间位阻共同影响导致产率降低,而对炔苯甲酸甲酯,对炔苯甲醛由于吸电子效应导致产率降低;当3,5-二溴-8-(4-甲苯基)BODIPY与末端芳炔用量为1∶1时,单取代产物达到最大值,当3,5-二溴-8-(4-甲苯基)BODIPY与末端芳炔用量为1∶3时,双取代产物达到最大值.该研究为制备长波长的BODIPY荧光染料衍生物提供了新的原料.
参考文献:
[1] LOUDET A, BURGESS K. BODIPY dyes and their derivatives: Syntheses and spectroscopic properties[J]. Chemical Reviews,2007,107(11):4891-4932.
[2] HUANG J L, MA X W, LIU B, et al. A colorimetric and ratiometric turn-on BODIPY-based fluorescent probe for double-channel detection of Cu2+and Hg2+[J]. Journal of Luminescence,2013,141:130-136.
[3] BURA T, LECLERC N, FALL S, et al. High-performance solution-processed solar cells and ambipolar behavior in organic field-effect transistors with thienyl-BODIPY scaffoldings[J]. Journal of the American Chemical Society,2012,134(42):17404-17407.
[4] SUI B L, YUE X L, KIM B, et al. Near-IR Two-Photon fluorescent sensor for K(+) imaging in live cells[J]. ACS Applied Materials & Interfaces,2015,7(32):17565-17568.
[5] MIN J, AMERI T, GRESSER R, et al. Two similar near-infrared (IR) absorbing benzannulated aza-BODIPY dyes as near-IR sensitizers for ternary solar cells[J]. ACS Applied Materials & Interfaces,2013,5(12):5609-5616.
[6] WANG L, FANG G, CAO D. Highly selective and sensitive detection of F-, and CN-, ions simultaneously by a reaction-based BODIPY-containing conjugated polymer[J]. Sensors & Actuators B Chemical,2015,221(1):63-74.
[7] FAN J, MU H Y, ZHU H, et al. Recognition of HClO in live cells with separate signals using a ratiometric fluorescent sensor with fast response[J]. Industrial & Engineering Chemistry Research,2015,54(36):8842-8846.
[8] KONG M Y, WANG L, CHEN Q Y, et al. Study on the interaction of Fe(III) complex of BODIPY appended di(picolyl)amine with water and HeLa cells[J]. Spectrochimica Acta Part A, Molecular and Biomolecular Spectroscopy,2015,151:790-795.
[9] BESSETTE A, HANAN G S. Design, synthesis and photophysical studies of dipyrromethene-based materials: insights into their applications in organic photovoltaic devices[J]. Chemical Society Reviews,2014,43(10):3342-3405.
[10] LEE J S, KANG N Y, KIM Y K, et al. Synthesis of a BODIPY library and its application to the development of live cell glucagon imaging probe[J]. Journal of the American Chemical Society,2009,131(29):10077-10082.
[11] VENDRELL M, ZHAI D T, ER J C, et al. Combinatorial strategies in fluorescent probe development[J]. Chemical Reviews,2012,112(8):4391-4420.
[12] MADHU S, GONNADE R, RAVIKANTH M. Synthesis of 3,5-bis(acrylaldehyde) boron-dipyrromethene and application in detection of cysteine and homocysteine in living cells[J]. The Journal of Organic Chemistry,2013,78(10):5056-5060.
[13] ULRICH G, ZIESSEL R, HARRIMAN A. The chemistry of fluorescent bodipy dyes: versatility unsurpassed[J]. Angewandte Chemie (International ed. in English),2008,47(7):1184-1201.
[14] BOENS N, LEEN V, DEHAEN W. Fluorescent indicators based on BODIPY[J]. Chemical Society Reviews,2012,41(3):1130-1172.
[15] YIN S C, LEEN V, VAN SNICK S, et al. A highly sensitive, selective, colorimetric and near-infrared fluorescent turn-on chemosensor for Cu2+based on BODIPY[J]. Chemical Communications (Cambridge, England),2010,46(34):6329-6331.
[16] AUSTIN W B,BILOW N,KELLEGHAN W J, et al. Facile synthesis of ethynylated benzoic acid derivatives and aromatic compounds via ethynyl-trimethylsilanet[J].J Org Chem,1981,46:2280-2286.
[17] RAJADURAI C, IVANOVA A, ENKELMANN V, et al. Study on the heteroatom influence in pyridine-based nitronyl nitroxide biradicals with phenylethynyl spacers on the molecular ground state[J]. The Journal of Organic Chemistry,2003,68(26):9907-9915.
[18] TANG B Z, KONG X X, WAN X H, et al. Synthesis and properties of polyacetylenes containing cyano groups, poly[[4-[[[n-[(4‘-cyano-4-biphenyl) alkyl] oxy] carbonyl] phenyl] acetylenes] [J]. Macromolecules,1997,30:5620-5628.
[19] GARCIA O, GARRIDO L, SASTRE R, et al. Synthetic strategies for hybrid materials to improve properties for optoelectronic applications[J]. Advanced Functional Materials,2008,18(14):2017-2025.
收稿日期:2015-12-25
基金项目:国家自然科学基金项目(21574034);浙江省自然科学基金项目(LY16B040006);国家大学生创新计划项目(201510346015);浙江省新苗计划项目(2015R423026,2015R423029).
通信作者:尹守春(1976—),男,教授,主要从事超分子聚合物、光电功能高分子和荧光探针研究.E-mail:yinsc@hznu.edu.cn
doi:10.3969/j.issn.1674-232X.2016.04.006
中图分类号:O626.32
文献标志码:A
文章编号:1674-232X(2016)04-0363-05
Study on Sonogashira Coupling Reaction of 3,5-dibromo BODIPY with Terminal Aryl Acetylene
HE Tian, YANG Anle, WANG Tao, CHEN Jia, WEI Bin, LIU Yuanyuan,MA Yifan, YIN Shouchun
(College of Material, Chemistry and Chemical Engineering, Hangzhou Normal University, Hangzhou 310036, China)
Abstract:Three BODIPY fluorescence dyes were synthesized by the reaction of 3-5-dibromo-BODIPY with three aryl alkynes in the Sonogashira coupling condition. Their chemical structures were confirmed by IR, 1 H NMR,13C NMR and MS. The effects of temperature, time, catalyst, dosage and different starting materials on the yield of Sonogashira coupling reaction were investigated. The highest yield of mono-substitued product was 40% in the condition of 4 mol% Pd(PPh3)2Cl2and CuI (1∶1) as the catalyst, 45 ℃ and 5 h. Sonogashira coupling reaction was very efficient for the functionalization of BODIPY because not only the reaction was simple, mild and high yield, but also the conjugate degree of BODIPY could be effectively controlled, which could expand BODIPY’s application.
Key words:BODIPY; coupling reaction; arylacetylene
