上调miR-206对婴幼儿血管瘤内皮细胞生长状态和侵袭能力的影响
2016-08-10徐建国戴海英孙肇晟
徐建国,杨 超,邢 新,戴海英,方 硕,孙肇晟
实验研究
上调miR-206对婴幼儿血管瘤内皮细胞生长状态和侵袭能力的影响
徐建国,杨 超,邢 新,戴海英,方 硕,孙肇晟
目的 研究上调婴幼儿血管瘤内皮细胞miR-206水平对细胞增殖、凋亡和侵袭能力的影响。方法 通过CD31磁珠提取婴幼儿血管瘤内皮细胞,经转染miR-206模拟物提高HemECs细胞内miR-206水平,研究miR-206对该细胞功能的影响。以cck-8法检测细胞增殖能力的改变,AV-PI凋亡试剂盒经流式细胞仪检测凋亡水平变化,并经Transwell侵袭实验检测侵袭能力变化。结果 转染miR-206模拟物进入HemECs细胞内48 h后,能够明显抑制细胞增殖,抑制率为(34.2±6.8)%;转染48 h后相比于对照组(1.7±1.6)%的凋亡细胞比率,miR-206模拟物组细胞凋亡比率提高到(23.9±5.1)%,差异具有统计学意义;转染后24 h侵袭实验显示,细胞穿透Transwell小室至下室面细胞数在对照组为30.3±2.4,在miR-206模拟物组细胞数减少至14.3±3.0。结论 上调HemECs细胞内miR-206水平可明显抑制细胞增殖,增加细胞凋亡水平,减少细胞侵袭能力。提示miR-206可能通过调节瘤体细胞生物活性,对婴幼儿血管瘤疾病进程起到重要的调控作用。
婴幼儿血管瘤; miR-206; 内皮细胞; 细胞凋亡; 细胞侵袭
婴幼儿血管瘤(Infantile hemangioma,IH)是儿童最常见的良性肿瘤,高加索人种新生儿发病率在4%~10%[1],女婴更易发病,男女比例约为1.0∶2.3[2],亚裔人群发病率相对偏低,但尚未见准确流行病学调查数据。婴幼儿血管瘤发病机制不明,一般认为具有增生期、消退期和消退完成期3个时期的独特病程发展过程,具有自发消退特性是其独特的病程特征。婴幼儿血管瘤增生期快速增生的分子机制,可能是由于主体细胞婴幼儿血管瘤内皮细胞(infantile hemangioma endothelial cells,HemECs)内C482R和TEM8基因突变,导致VEGFR2/TEM8/β1整合素复合物异常,引发VEGFR2信号通路活性增强和VEGFR1信号通路活性减弱,从而刺激HemECs大量快速增生[3]。而婴幼儿血管瘤内皮细胞的凋亡和瘤体细胞的分化转化,可能是瘤体转向消退的重要原因[4]。自2012年1月至2013年12月,笔者研究了miR-206在婴幼儿血管瘤内皮细胞中的作用,以了解婴幼儿血管瘤病程的发展机制。
1 对象与方法
1.1 内皮细胞分离培养和分组 共收集经病理确诊的婴幼儿血管瘤增生期标本7例,标本来源于第二军医大学长海医院整形外科。均获患者家属知情同意,并通过长海医院伦理委员会审核。借鉴马刚等的技术方法[5],自7例增生期标本中获取HemECs细胞,获取方法大致如下:标本组织切至约1 mm×1 mm×1 mm后,采用0.2%胶原酶Ⅰ(美国SIGMA公司)于37℃消化40 min后,细胞过滤,形成的单细胞悬液采用CD31磁珠试剂盒(德国MILTENYI公司)进行阳选细胞磁珠分选得婴幼儿血管瘤内皮细胞(hemangioma endothelial cells, HemECs);分选后细胞接种于500 ng/ml纤维黏连蛋白铺底的培养皿中,以EGM-2MV培养基(瑞士LONZA公司,包含VEGF、bFGF、EGF、IGF、肝素、VitC、氢化可的松等),37℃,5%CO2培养箱内静置培养。细胞获取后通过形态、摄取Dil-Ac-LDL能力、表面CD31标记物、vWF标记物检测以及成管实验鉴定。细胞传代2、3代并处于对数生长期后,平铺于6孔板,各标本实验细胞分空白组、阴性对照组、miR-206模拟物转染组。按Lipofectamine®RNAiMAX Reagent (美国lIFE TECHNOLOGIES公司)说明书对miR-206模拟物转染组HemECs细胞进行miR-206 mimics转染,阴性对照组以常用参照物miR-67进行转染,miR-206 mimics正义链序列(5'-3'):UGGAAUGUAAGGAAGUGUGUGG;反义链序列(5'-3'):CCACACACUUCCUUACAUUCCA(上海拓然生物有限公司)。
1.2 实时定量PCR检测转染后miR-206的表达 各组细胞6孔板培养,转染miRNAs 48 h后采用mirVana PARIS Kit(美国lIFE TECHNOLOGIES公司)提取各细胞总RNA,依据产品说明书进行逆转录和实时定量PCR检测。采用TaqMan探针引物,由llIFE TECHNOLOGIES公司设计合成,引物编号(Assay ID:000510)。以U6 snRNA(Assay ID :001973)为内参,细胞以阴性对照组为对照,计算各组对应的2-△△Ct值。△△Ct计算公式如下:
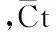
1.3 细胞增殖实验 以3例标本中分离培养的HemECs细胞为实验对象,每例标本细胞分空白组、阴性对照组、miR-206模拟物转染组。细胞培养于96孔板内,每例标本细胞各组设技术重复3孔,测定值取平均值,并设转染后24 h和48 h两板,加入cck-8试剂(同仁化学研究所,日本)10 μl,37℃孵育2 h后,以ELX800UV酶标仪(美国BIOTEK公司)检测细胞活性。细胞增殖抑制率计算方法如下:

1.4 细胞凋亡检测 以3例标本中分离培养的HemECs细胞为实验对象,每例标本细胞均分为空白组、阴性对照组、miR-206模拟物转染组。每例标本细胞各组设技术重复3孔,细胞培养于6孔板内,转染后24 h通过ANNEXIN V-FITC/PI凋亡检测试剂盒(凯基生物技术公司)和流式细胞仪检测细胞凋亡水平。
1.5 细胞侵袭实验 以3例标本中分离培养的HemECs细胞为实验对象,实验分空白组、阴性对照组、miR-206模拟物转染组。每例标本细胞于6孔板内培养后进行转染,转染12 h后消化接种于铺有matrigel胶的Transwell小室内,内室以EGM-2无血清培养基培养细胞,外室以10%FBS的EGM-2MV培养基作为趋化培养基。培养12 h后,以0.1%结晶紫染色法进行Transwell小室下室面细胞染色检测。采用细胞计数方法在高倍镜下匀称选取中间及上下左右共5个视野进行细胞计数。
2 结果
2.1 HemECs分离培养及鉴定 经CD31偶联磁珠分选后培养细胞呈梭形,细胞4 h左右贴壁生长。因原代生长较慢,故传代后具有快速增殖能力,细胞接触抑制较其他细胞不明显。生长过旺,细胞间积压后呈长梭形。分离细胞进行形态、摄取Dil-Ac-LDL能力、表面CD31标记物、vWF标记物检测以及成管能力检测鉴定。培养细胞及鉴定见图1。
2.2 实时定量PCR检测miR-206的表达 miR-206模拟物转染后8 h,miR-206模拟物转染组miR-206相对量水平(8.01±1.30)明显高于阴性对照组(1.05±0.36),差异具有统计学意义。见图2。
2.3 HemECs细胞内miR-206水平对细胞增殖活力的影响 通过cck-8试剂对培养细胞进行增殖能力检测,与对照组比较可见,转染24 h后,细胞增殖能力无明显改变,转染miR-206 模拟物组细胞在转染48 h后,细胞数量明显偏低,差异具有统计学意义。细胞增殖抑制率为(34.2±6.8)%,见图3。实验结果提示,miR-206水平的提高,对HemECs细胞的增殖能力有明显的抑制作用。
2.4 HemECs细胞内miR-206水平对细胞凋亡水平的影响 HemECs细胞在转染后48 h进行细胞收集。通过ANNEXIN V-FITC/PI凋亡检测试剂盒,对转染后细胞进行凋亡水平的流式细胞仪检测。转染miR-206模拟物后,HemECs细胞凋亡水平明显增高。阴性对照组细胞凋亡比率为(1.7±1.6)%,miR-206模拟物组细胞凋亡比率为(23.9±5.1)%,与对照组相比,差异具有统计学意义。
2.5 HemECs细胞内miR-206水平对细胞侵袭能力的影响 与空白对照组相比,阴性对照组细胞无明显差异,说明转染试剂对细胞侵袭力改变无明显影响。细胞计数方法为高倍镜下,匀称选取中间及上下左右共5个视野进行细胞计数。与阴性对照组下室面细胞数30.3±2.4相比,转染miR-206模拟物组细胞在转染后24 h,穿透matrigel胶进入Transwell小室下室面细胞明显减少为14.3±3.0,侵袭能力明显减弱,差异具有统计学意义。
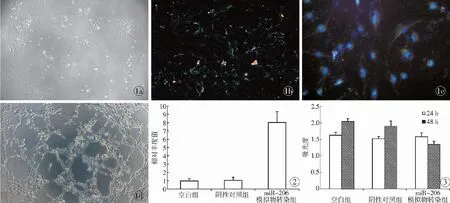
图1 婴幼儿血管瘤CD31磁珠阳选细胞鉴定 a. 细胞种板后24 h细胞明显开始分裂生长,呈铺路石样改变 b. 分离细胞与Dil-Ac-LDL共培养4 h后,荧光显微镜下可见明显Dil的红色荧光颗粒,提示细胞具有内皮细胞的吞脂功能 c. DAPI染核CD31和vWF共标记后细胞显影,提示分离细胞具有内皮细胞的CD31和vWF双表达 d. 分离细胞成管实验阳性,在Matrigel胶铺底培养皿分离细胞在培养后3 h出现内皮细胞独有的管样结构 图2 HemECs细胞转染miR-206 mimics 8 h后各组细胞内miR-206相对丰度变化 图3 HemECs细胞转染miR-206模拟物后细胞增殖力变化
Fig 1 Identification of the cells positively selected by CD31 coupled magnetic beads from infantile hemangioma. a. slabstone-like cells start to divide and grow after cultured for 24 hours. b. phagocytic fat function of endothelial cells (red) after isolated cells were cultured withDil-Ac-LDL for 4 hours under fluorescence microscope. c. double expression of CD31 and vWF of cultured cells. d. positive of tubules formed incubation of cultured cells on Matrigel for 3 hours. Fig 2 Changes of miR-206 relative abundance in each group at 8 hours after the miR-206 mimics transfected into HemECs. Fig 3 Changes of proliferation detected after miR-206 mimics transfected into HemECs.
3 讨论
miR-206被认为是一种肿瘤抑制因子,在胃癌[6]、子宫内膜癌和乳腺癌的研究中都发现有miR-206下调现象[7 ],这种细胞内miR-206下调状态在肺动脉高压等[8]其他血管性疾病中也有发现。婴幼儿血管瘤既有肿瘤的性质,同时又和血管密切相关,因此,miR-206可能在IH增生期的下调机制和肿瘤及血管性疾病中类似。提高HeLa细胞中的miR-206水平,可影响Notch3的表达,从而增加细胞凋亡[9]。在Samuel 等的研究中还发现,减少小鼠肺动脉平滑肌细胞内miR-206的水平,可引起细胞增殖能力的提高和凋亡的减少,以及增加细胞分化表型a-SMA和calponin的表达,这种作用可以被提高细胞内miR-206的水平所逆转,说明miR-206在细胞增殖改变、凋亡以及细胞分化中具有重要的调节作用[10],在我们的研究中发现,提高细胞内miR-206水平能够明显抑制细胞增殖,抑制率为(34.2±6.8)%。提高细胞内miR-206水平后,细胞凋亡比率从对照组的(1.7±1.6)%提高到(23.9±5.1)%,说明miR-206水平变化对HemECs细胞的凋亡和增殖都有显著影响,同时miR-206对HemECs细胞增殖的抑制作用明显,部分可能是凋亡在其中发挥一定的作用,但从凋亡比例改变上看,凋亡细胞的影响只占据了一部分。在胃癌和乳腺癌的研究中发现,miR-206对细胞增殖能力有影响,这种作用是通过CyclinD2来影响细胞周期实现的[11]。结合这些研究结果,miR-206可能通过对HemECs增殖周期蛋白的影响,调节了细胞的增殖能力改变。在肌肉损伤的修复[12]以及肌细胞的研究中发现,miR-206通过靶向于OTX2,调节细胞增殖和凋亡的作用[13]。在成肌细胞C2C12的研究中,TGFβ能够通过HDAC4影响miR-206的表达,从而调控了细胞的增殖和分化[14],且miR-206能够通过VEGF-A负向调控血管生成作用[15]。这些多靶点的作用,提示miR-206可能通过多个作用途径改变HemECs细胞的功能活性,从而在婴幼儿血管瘤病程发展中起到了关键调控作用。
我们的研究确定了miR-206在婴幼儿血管瘤内皮细胞增殖能力改变、凋亡改变以及侵袭能力改变的调节中发挥了重要作用。miR-206作为一种和血管疾病相关的肿瘤抑制因子,在血管瘤病程演化中可能发挥了重要的调节作用,这种作用是通过对婴幼儿血管瘤内皮细胞功能的调控引起的,其具体调节机制以及对婴幼儿血管瘤内皮细胞的这种调控作用,有待进一步地研究。
[1] Roach EE, Chakrabarti R, Park NI, et al. Intrinsic regulation of hemangioma involution by platelet-derived growth factor[J]. Cell Death Dis, 2012,21(3):e328.
[2] Pandey A, Gangopadhyay AN, Gopal SC, et al. Twenty years′experience of steroids in infantile hemangioma-a developing country′s perspective[J]. J Pediatr Surg, 2009,44(4):688-694.
[3] Jennin M, Medici D, Park L, et al. Suppressed NFAT-dependent VEGFR1 expression and constitutive VEGFR2 signaling in infatile hemangioma[J]. Nat Med, 2008,14(11):1236-1246.
[4] Boscolo E, Mulliken JB, Bischoff J. Pericytes from infantile hemangioma display proangiogenic properties and dysregulated angiopoietin-1[J]. Arterioscler Thromb Vasc Biol, 2013,33(3):501-509.
[5] 马 刚, 林晓曦, 金云波, 等. 婴幼儿血管瘤内皮细胞的分离、培养及鉴定[J]. 中华整形外科杂志, 2008,24(2):144-147.
[6] Zhang L, Liu X, Jin H, et al. MiR-206 inhibits gastric cancer proliferation in part by repressing CyclinD2[J]. Cancer Lett, 2013,332(1):94-101.
[7] Chen X, Yan Q, Li S, et al. Expression of the tumor suppressor miR-206 is associated with cellular proliferative inhibition and impairs invasion in ERalpha-positive endometrioid adenocarcino-ma[J]. Cancer Lett, 2012,314(1):41-53.
[8] Li X, Zhang X, Leathers R, et al. Notch3 signaling promotes the development of pulmonary arterial hypertension[J]. Nat Med, 2009,15(11):1289-1297.
[9] Song G, Zhang Y, Wang L. MicroRNA-206 targets notch3, activates apoptosis, and inhibits tumor cell migration and focus formation[J]. J Biol Chem, 2009,284(46):31921-31927.
[10] Jalali S, Ramanathan GK, Parthasarathy PT, et al. Mir-206 regulates pulmonary artery smooth muscle cell proliferation and differentiation[J]. PLoS One, 2012,7(10):e46808.
[11] Zhou J, Tian Y, Li J, et al. miR-206 is down-regulated in breast cancer and inhibits cell proliferation through the up-regulation of cyclinD2[J]. Biochem Biophys Res Commun, 2013,433(2):207.
[12] Liu N, Williams AH, Maxeiner JM, et al. microRNA-206 promotes skeletal muscle regeneration and delays progression of Duchenne muscular dystrophy in mice[J]. J Clin Invest, 2012,122(6):2054-2065.
[13] Wang R, Hu Y, Song G, et al. MiR-206 regulates neural cells proliferation and apoptosis via Otx2[J]. Cell Physiol Biochem, 2012,29(3-4):381-390.
[14] Winbanks CE, Wang B, Beyer C, et al. TGF-beta regulates miR-206 and miR-29 to control myogenic differentiation through regulation of HDAC4[J]. J Biol Chem, 2011,286(16):13805. [15] Stahlhut C, Suárez Y, Lu J, et al. miR-1 and miR-206 regulate angiogenesis by modulating VegfA expression in zebrafish[J]. Development, 2012,139(23):4356-4364.
Effect of miR-206 up-regulation on proliferation, apoptosis and invasion ability of infantile hemangioma endothelial cells
XUJian-guo,YANGChao,XINGXin,DAIHai-ying,FANGShuo,SUNZhao-sheng.
(DepartmentofPlasticSurgery,FirstAffiliatedHospitalofSecondMilitaryMedicalUniversity,Shanghai200433,China)
XINGXin,Email:xingxin57@163.com
Objective To investigate the effect of miR-206 up-regulation on cell proliferation, apoptosis and invasion ability of infantile hemangioma endothelial cells (HemECs). Methods HemECs was isolated from infantile hemangioma digestion tissue by CD31 magnetic bead, then the miR-206 was up-regulated by miR-206 mimics transfection. The apoptosis of HemECs was examined using Annexin V-FITC/PI by flow cytometry and cell proliferation was detected by cck-8 assay method. Invasion ability was determined by Transwell invasion assay. Results The proliferation of HemECs was significantly inhibited after miR-206 mimics transfected into HemECs at 48h, the inhibit rate was (34.2±6.8)%. Concerning transfection within the group of miR-206 mimics compared with the control group, the apoptosis level elevated from (1.7±1.6)% to (23.9±5.1)% after miR-206 mimics transfected into HemECs at 48 h. Matrigel invasion assay demonstrates that, within the group of miR-206 mimics transfection compared with the control group, the number of cells at the opposite surface of Transwell bottom decreased from 30.3±2.4 to 14.3±3.0. Conclusion The miR-206 level in up-regulated HemECs could obviously inhibit cell proliferation ability, elevate the apoptosis level and decrease invasive ability. MiR-206 may have important regulation effect on pathogenesis of infantile hemangioma through adjusting HemECs′ biological activation.
Infantile hemangioma; MiR-206; Endothelial cells; Apoptosis; Cellular invasion
国家自然科学基金(81272119)
200433 上海,第二军医大学附属长海医院 整形外科
徐建国(1982-),男,浙江龙游人,博士.
邢 新,200433,第二军医大学附属长海医院 整形外科,电子信箱:xingxin57@163.com
10.3969/j.issn.1673-7040.2016.04.016
R732.2
A
1673-7040(2016)04-0238-04
2015-12-24)
