改变碳输入对亚热带人工林土壤微生物生物量和群落组成的影响
2016-08-09万晓华黄志群何宗明余再鹏王民煌刘瑞强郑璐嘉
万晓华,黄志群,*,何宗明,余再鹏,王民煌,刘瑞强,郑璐嘉
1 福建师范大学地理科学学院, 福州 350007 2 湿润亚热带山地生态国家重点实验室培育基地, 福州 350007 3 福建农林大学林学院, 福州 350002
改变碳输入对亚热带人工林土壤微生物生物量和群落组成的影响
万晓华1,2,黄志群1,2,*,何宗明3,余再鹏1,2,王民煌1,2,刘瑞强1,2,郑璐嘉1,2
1 福建师范大学地理科学学院, 福州350007 2 湿润亚热带山地生态国家重点实验室培育基地, 福州350007 3 福建农林大学林学院, 福州350002
摘要:通过在亚热带杉木(Cunninghamia lanceolata)和米老排(Mytilaria laosensis)人工林中设置互换凋落物、去除凋落物、去除凋落物+去除根系和对照处理来分析改变地上、地下碳输入对人工林土壤微生物生物量和群落组成的影响。结果显示,改变地上、地下碳输入对土壤微生物生物量碳、氮的影响因树种而异。在米老排林中,土壤微生物生物量不受碳源的限制。而在杉木林中,加入米老排凋落物、去除凋落物和去除凋落物+去除根系3种处理中土壤微生物生物量碳、氮具有明显增加的趋势。磷脂脂肪酸分析结果显示,杉木林中,添加高质量的米老排凋落物后,革兰氏阳性细菌、阴性细菌、丛枝菌根真菌、放线菌和真菌群落生物量分别显著增加了24%、24%、53%、25%、28%,革兰氏阴性细菌和丛枝菌根真菌的相对丰度均有显著增加。与对照相比,杉木林中去除凋落物后革兰氏阳性细菌、阴性细菌、丛枝菌根真菌、放线菌和真菌群落生物量分别显著增加了22%、29%、44%、25%、52%,真菌与细菌比值显著增加了21%。但是,去除凋落物+去除根系处理对两个树种人工林土壤微生物群落组成均无显著影响。米老排和杉木林土壤微生物生物量碳、氮的季节变化格局不同,土壤养分有效性可能是驱动土壤微生物生物量季节变化的主要因子。未来研究需要关注凋落物和根系在不同树种人工林中对土壤微生物群落的相对贡献。
关键词:去除凋落物;去除根系;土壤微生物生物量;微生物群落组成;树种;亚热带人工林
土壤微生物作为分解者,在陆地生态系统养分循环中扮演着重要的角色。微生物生物量及其群落组成是影响土壤物理、化学和生物过程的重要因子[1]。许多研究表明,树种影响土壤微生物群落组成,不同树种下会形成独特的微生物群落[2],尤其是针叶树种和阔叶树种之间土壤微生物群落差别较大[3- 4]。树种主要通过郁闭度、根系深度、地上地下凋落物数量和质量以及改变土壤温度和pH值等[5- 6]影响土壤微生物群落。凋落物作为土壤有机质地上部分的主要来源,其输入的数量和质量变化也可能改变土壤碳的积累或流失状况[7]。例如,Leff等[8]在一个热带雨林中通过设置不同凋落物输入方式研究发现,添加双倍凋落物后土壤表层的有机碳含量增加了31%,而去除凋落物使得土壤有机碳降低了26%;不同凋落物输入方式引起的土壤有机碳量的变化与可溶性有机质、细根生物量和土壤微生物过程等有关。Garcia-Oliva等[9]研究发现,新鲜凋落物的淋滤物质及其分解产物中含有大量的易变性有机碳,能够为土壤微生物活动提供大量碳源。Feng等[10]在我国亚热带季雨林中的实验研究发现,去除地上部分凋落物2年后降低了19.0%的土壤微生物生物量碳。根系分泌物和根系周转也会影响土壤中微生物的生物量和活性。Kramer等[11]通过14C同位素示踪法研究发现,在温带森林中来源于根系输入的碳是微生物主要的碳源(占60%以上)。Li等[12]在热带松树人工林中的研究发现,去除根系处理7年后土壤微生物生物量下降了45.4%。也有研究发现,去除根系处理只是减少了森林有机层中的真菌生物量和细菌群落结构,而对矿质层中的微生物却无显著影响[13- 14]。然而,目前关于树种是如何通过凋落物、根系特性来影响土壤微生物生物量和群落组成的研究仍较少。
植物残体的添加和去除实验(DetritusInputandRemovalTreatment,DIRT)是通过改变地上、地下碳输入来研究植物和土壤微生物群落之间反馈作用的有效方法[15]。例如,Wang等[16]通过DIRT实验研究了我国亚热带地区针叶树种人工林(主要树种为杉木和马尾松)改变地上、地下碳输入对土壤呼吸和微生物群落组成的影响。本研究以杉木林采伐迹地上营造的19年生米老排(Mytilaria laosensis)和杉木(Cunninghamia lanceolata)人工林为研究对象,通过设置互换凋落物、去除凋落物和去除凋落物+去除根系处理来分析碳输入方式的改变对不同树种人工林土壤微生物生物量和群落组成的影响,旨在为森林管理中如何提高人工林土壤肥力提供参考。
1材料与方法
试验地位于福建省南平市峡阳林场(26°48′N,117°59′E),地处武夷山脉东南侧、闽江上游,海拔高度为229—246m。该区属中亚热带季风气候,年均温20.0 ℃,年均降水量1644mm,年均蒸发量1370mm,年均相对湿度75.2%。土壤为石英黑云母片岩发育的山地红壤。本试验地包括19年生米老排和杉木两个树种人工林,均为1993年春在杉木人工林采伐迹地上营造[17],初植密度均为2500 株/hm2。其中米老排为金缕梅科米老排属的常绿大乔木,是分布在南亚热带地区的主要乡土珍贵阔叶树种之一[18]。2011年7月样地本底调查时,米老排平均树高15.4m,平均胸径14.7cm;杉木平均树高13.8m,平均胸径15.9cm。两个树种人工林凋落物和土壤基本理化性质见表1。其中,年凋落物量根据凋落物框收集法估算得出,将收集的凋落物样品在60 ℃下烘干至恒量,粉碎后过0.15mm筛,用元素分析仪(ElementalAnalyzerVarioELIII,德国)测定其碳、氮含量;土壤样品采集深度为0—5cm[17],全碳、全氮含量用元素分析仪(ElementalELMAXCNSanalyzer,德国)测定;土壤pH值采用土水比为1∶2.5测定。
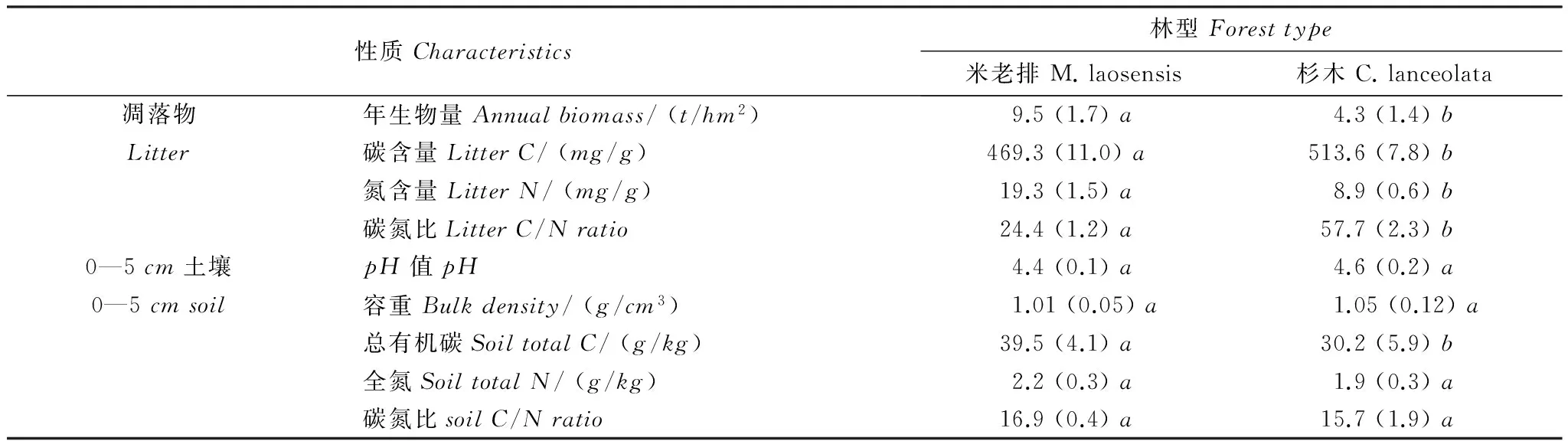
表1 米老排和杉木林的基本概况
括号中数据为标准差(n=4),同一行不同小写字母表示两个树种之间差异显著(P<0.05)
2012年1月,在米老排和杉木人工林采用完全随机区组设计方法分别设置16个2m×2m的小区,在小区内做如下4种处理:(1)去除地上凋落物,在小区上方1m处放置孔径为1mm的尼龙网,防止凋落物进入,同时把地表的凋落物全部去除;(2)凋落物互换,即将米老排和杉木林去除凋落物处理小区内尼龙网上截留的凋落物进行互换,原凋落物去除,每月定期交换一次;(3)去除凋落物+去除根系,去除凋落物并且挖壕沟排除小区内根系,壕沟深度为1m;(4)对照,保留原来状态。
1.2土壤样品采集与测定
从2012年1月开始至12月,每月定期在各小区内沿对角线等距离钻取3个点,采集0—5cm土壤层样品,去除砂石、可见根系后,在室内过2mm筛储存于4 ℃冰箱中,用氯仿-熏蒸浸提法测定土壤微生物生物量碳(MBC)和氮(MBN)[19]。采集土壤样品的同时,用数字式瞬时温度计(AM- 11T,Avalon公司,美国)测定地下5cm处的土壤温度(℃),采用时域反射仪(TDR)(ModelTDR300,Spectrum公司,美国)测定地下5cm处的土壤含水量(%)。
土壤微生物群落组成采用磷脂脂肪酸(PLFA)分析法,仅对2012年6月采集的土壤样品进行了测定。磷脂脂肪酸的提取参考White等[20]方法,简单操作步骤:称取相当于8g干土重的鲜土,依次加入5mL磷酸缓冲液、6mL三氯甲烷、12mL甲醇,振荡2h后离心(1000r/min,10min),转移上层清液到分液漏斗中,向剩余土壤中再加入12mL三氯甲烷和12mL磷酸缓冲液,振荡离心,转移上层清液,合并两次上清液,黑暗环境下静置一夜;收集下层氯仿相,在氮气下吹干,通过硅胶柱分离出磷脂,加甲醇∶甲苯(1∶1)和0.2mol/L氢氧化钾溶液进行皂化和甲基化形成脂肪酸甲酯。每一个脂肪酸甲酯通过气象色谱仪(Agilent6890N, 美国),根据它们的停留时间结合MIDI微生物识别系统(MIDIInc.,Newark,DE)来进行鉴定。顺式异构和反式异构支链脂肪酸表征革兰氏阳性细菌[21- 22];单一不饱和和环丙烷脂肪酸表征革兰氏阴性细菌[23- 24];18∶1ω9c和18∶2ω6,9c脂肪酸表征真菌,16∶1ω5c表征丛枝菌根真菌[24];10Me16∶0、10Me17∶0、10Me18∶0表征放线菌(表2)。

表2 检验土壤微生物种群的脂肪酸标志物
1.3数据处理
所有数据处理和统计分析均基于Excel2003和SPSS17.0软件进行。采用单因素方差分析(ANOVA)来确定处理对土壤微生物生物量和群落结构的影响,显著水平设为α=0.05。采用重复测量的方差分析方法来确定树种、取样时间和处理对土壤微生物生物量月动态的影响。通过相关分析来确定土壤温度、湿度与微生物生物量的相关性。
2结果与分析
2.1土壤微生物生物量碳氮及季节动态变化
2015年8月,程瀚还将150万元交予王某某理财,约定期限为2015年9月1日至2017年9月1日,年利率24%。后来程瀚取走15万元的利息。
通过方差分析发现,树种和取样时间对土壤MBC、MBN和MBC/MBN具有显著影响,而处理对微生物生物量的影响未达到显著水平(表3)。从年平均值来看,米老排林中,与对照相比,各处理小区土壤MBC、MBN无明显变化。在杉木林中,虽然加入米老排凋落物、去除凋落物和去除凋落物+去除根系处理土壤MBC、MBN与对照之间的差异均未达到统计上的显著水平(P>0.05),但3种处理中土壤MBC(17%、21%和20%)、MBN(17%、10%和17%)均有明显增加的趋势。
表3树种、处理和取样时间及其交互作用对土壤微生物生物量碳、氮及其比值影响的方差分析表
Table3Statisticalsummaryoftreespecies,treatments,samplingmonthandtheirinteractioneffectsonsoilmicrobialbiomassC(MBC)andN(MBN)andC/Nratios(MBC/MBN)

因子Factors自由度dfDegreeoffreedom土壤微生物生物量碳SoilmicrobialbiomassC(MBC)FP土壤微生物生物量氮SoilmicrobialbiomassN(MBN)FP土壤微生物生物量碳氮比MBC/MBNFP树种Treespecies126.869<0.00160.469<0.0014.0550.055处理Treatment30.702NS0.989NS1.178NS月份Month1120.992<0.00139.610<0.00144.494<0.001树种×处理Treespecies×Treatment30.886NS1.215NS0.072NS树种×月份Treespecies×Month112.414<0.0014.341<0.00110.330<0.001处理×月份Treatment×Month331.292NS0.737NS1.054NS树种×处理×月份Treespecies×Treatment×Month331.350NS0.727NS0.919NS
NS:notsignificant
从月动态来看,米老排林小区内土壤MBC变化范围为394—990mg/kg,一年之内无明显峰值,最低值出现在10月(图1);土壤MBN从1—4月呈缓慢增加的趋势,5—9月出现下降-上升-下降的趋势,在11月出现一个峰值116mg/kg(图1)。杉木林小区内,土壤MBC、MBN月动态变化基本一致,均呈现“M”型格局∶从1月开始,土壤微生物生物量呈现增加的趋势,在4—9月出现下降-上升-下降的趋势;9月之后,土壤微生物生物量又出现上升的趋势,在11月达到1个峰值(图1)。通过方差分析发现,树种对土壤温度和湿度具有显著影响(P=0.00),而各处理之间土壤温度和湿度无显著差异(P>0.05)。相关分析显示,米老排林各处理小区的土壤温度、湿度与MBC、MBN之间均无显著相关性;杉木林小区内,仅对照和去除凋落物+去除根系处理小区土壤温度与MBN之间呈显著负相关(P<0.05)。
2.2土壤微生物群落组成
从微生物群落的生物量来看,米老排林中,与对照相比,各处理中细菌、真菌和放线菌生物量均无显著变化(表4)。而杉木林中,与对照相比,加入米老排凋落物处理中革兰氏阳性细菌、阴性细菌、丛枝菌根真菌、放线菌和真菌生物量分别显著增加了24%、24%、53%、25%、28%,而革兰氏阳性细菌与阴性细菌比值、真菌与细菌比值均无显著变化;去除凋落物处理中革兰氏阳性细菌、阴性细菌、丛枝菌根真菌、放线菌和真菌生物量分别显著增加了22%、29%、44%、25%、52%,革兰氏阳性细菌与阴性细菌比值无显著变化,而真菌与细菌比值显著增加了21%;去除凋落物+去除根系处理中土壤各微生物种群生物量无显著变化。
从微生物群落结构来看,米老排林中,与对照相比,加入杉木凋落物、去除凋落物、去除凋落物+去除根系处理对土壤微生物群落组成均无显著影响。而在杉木林中,与对照相比,加入米老排凋落物处理中表征革兰氏阴性细菌的cy17∶0、18∶1ω7c、18∶1ω5c脂肪酸以及表征丛枝菌根真菌的16∶1ω5c的相对丰度均有显著增加(P<0.05),而去除凋落物、去除凋落物+去除根系处理对土壤微生物群落组成无显著影响。
3讨论
3.1不同树种的凋落物和根系对土壤微生物生物量的影响
本研究结果显示,杉木林中,加入高质量(低C/N)的米老排凋落物后土壤微生物生物量碳、氮均有明显增加的趋势,土壤中真菌、细菌和放线菌的生物量也显著高于对照样地。这与胡亚林等[25]、陈法霖等[26- 27]研究结果一致。一般来说,针叶树种的凋落物中含有较多难以分解、疏水性芳香族化合物,而阔叶树种的凋落物中含有较多易变、亲水性低分子量化合物[28- 29]。因此,与针叶凋落物相比,阔叶凋落物的淋滤物质中含有较多的易变性有机碳(如可溶性有机碳等)组分,这些物质是土壤微生物的重要碳源[30- 31]。因此,在杉木林中,加入高质量的米老排凋落物后,为土壤微生物提供了更为有效的底物碳源。凋落物质量影响土壤微生物生物量和活性,而土壤微生物群落反过来也会影响凋落物分解速率。高质量的凋落物含有较多易被微生物降解的化学物质,而低质量的凋落物往往含有高抗性或有毒成分,不易被微生物所降解[32]。例如,Cleveland等[33]将生长在相同气候条件下不同树种的凋落物,在室内进行凋落物互换分解实验研究发现,不同质量凋落物下细菌群落的差异影响凋落物分解。本研究结果表明,杉木林中添加高质量的米老排凋落物后,不仅增加了土壤微生物生物量,而且土壤微生物群落组成的改变,一定程度上也促进了凋落物的分解。
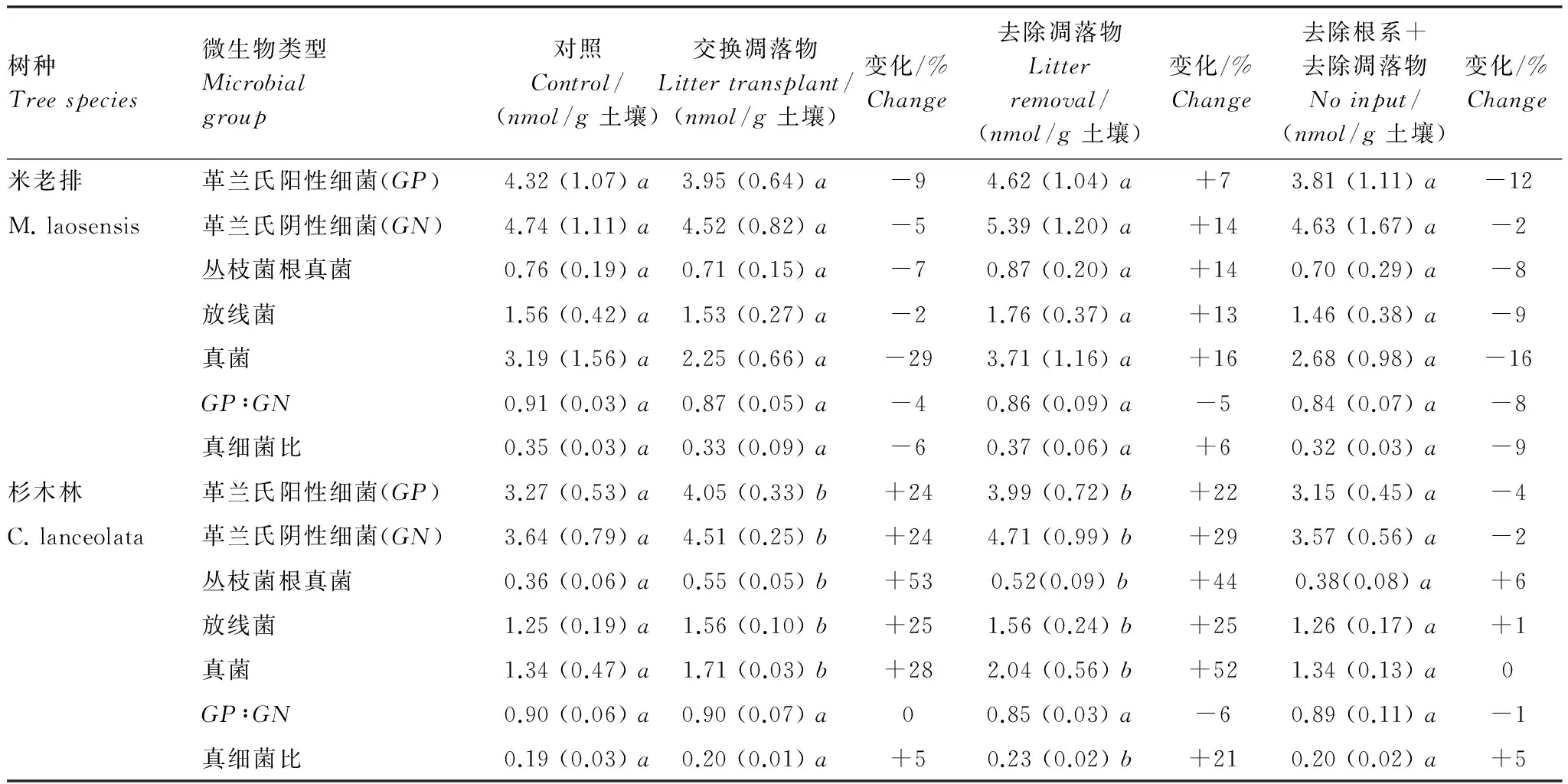
表4 米老排和杉木林中改变碳输入方式对0—5 cm土壤层微生物群落生物量的影响
括号中数据为标准差(n=4),对于一个给定的PLFA,同一行小写字母不同表示处理与对照之间具有显著差异
研究发现,杉木林中,去除凋落物和去除凋落物+去除根系小区内的土壤微生物生物量与对照相比均有明显增加的趋势,这可能与杉木的针叶凋落物和根系性质有关。许多研究表明,杉木连栽导致土壤中化感物质(如酚醛物质等)增加,从而产生自毒作用[34- 35]。例如,陈龙池等[36]研究发现,杉木根系和凋落物分泌的香草醛等酚类化合物能够抑制杉木生长、降低生产力。黄志群等[37]报道了,杉木根桩分解过程中释放的酚类物质影响下一代杉木的生长。植物化感物质除了影响植物生长之外,还会影响土壤微生物生物量、群落结构和活性[38]。例如,Souto等[39]在欧洲云杉林(Picea abies (L.)Karst.)中研究发现,植物产生的酚类物质抑制土壤微生物的活性。王延平等[40]报道了杨树(Populus euramericana)人工林中,酚酸浓度的增加,土壤中有效态氮的提取量显著下降,脲酶和碱性磷酸酶活性显著降低。因此,在杉木林小区内去除凋落物和根系后,土壤微生物生物量增加,可能与减少了杉木针叶分解过程中抑制微生物生长的毒性物质有关。而米老排林中,与对照相比,去除凋落物和去除凋落物+去除根系小区内土壤微生物生物量无明显变化,这可能与矿质土壤中原有有机质含量有关。有研究表明,来源于地上部分的碳源减少后,土壤微生物会转而利用土壤有机质中的易变性有机碳来维持自身生长[41]。在本实验地的先前研究中发现,米老排林地土壤可溶性有机碳含量显著高于杉木林(未发表数据)。因此,在一定时期内,米老排人工林中土壤微生物生物量不受地上、地下碳源的限制。本研究结果表明,不同树种之间凋落物质量的差异,是影响土壤微生物生物量的主要因素。
3.2凋落物和根系对土壤微生物群落组成的影响
微生物可利用的碳源主要来自于地上凋落物及其淋滤物质、根系分泌物和土壤有机质[11, 42]。改变地上和地下碳输入会影响土壤微生物群落组成[10, 16, 42]。例如,Brant等[43]通过长期的野外凋落物的添加和去除转移实验发现,温带森林中根系的碳输入对土壤微生物群落的影响要远大于地上部分凋落物的碳输入。Wang等[16]在我国亚热带地区的研究也发现,杉木人工林中去除凋落物仅降低了细菌与真菌的生物量比值,去除根系则同时降低了革兰氏阴性细菌与阳性细菌比值以及细菌与真菌比值。张伟东等[44]通过模拟实验发现,与地上凋落物相比,杉木根系在土壤生态学过程中发挥着重要作用。与以上研究结果不同,本研究结果却发现,来源于地上凋落物的碳输入对土壤微生物群落的影响要显著于地下根系。在本研究的杉木林小区内,添加高质量的米老排凋落物后,激发了土壤中革兰氏阴性细菌和丛枝菌根真菌的生长。这个结果与Bastian等[45]和Potthast等[46]在实验室的培养结果一致,即在农业土壤中添加高质量(低C/N)的凋落物会激发土壤中富含养分微生物群落的生长,例如革兰氏阴性细菌。这是因为不同微生物群落种群对碳源的利用具有选择性。在农业土壤中,革兰氏阴性细菌会优先利用新鲜输入的植物残体作为碳源,而革兰氏阳性细菌则主要利用土壤有机质中的碳源[47]。也有许多人提出假设,森林生态系统中地上部分凋落物的化学质量决定了土壤微生物的群落组成[48],因此,本研究结果在一定程度上验证了这个假设。但是到底是哪些凋落物质量指标对土壤微生物群落有显著影响;随着处理时间的增加,来源于凋落物和根系的碳输入对土壤微生物群落组成的影响是否会发生变化,这些问题还需要进一步通过长期的野外实验数据来证明。
3.3不同树种人工林土壤微生物生物量季节变化的调控因子
本研究中,米老排和杉木人工林不同处理样地土壤微生物生物量碳、氮均具有明显的季节变化模式,即在植物生长期间,土壤微生物生物量出现先上升后下降的趋势,而在冬季,土壤微生物生物量仍回归到一个较高的水平。这个结果与温带森林[49]、北亚热带湿润森林[50]地区的研究结果一致。影响土壤微生物生物量季节变化的因子,主要有土壤温度和湿度,有机质输入的数量和质量以及土壤碳、氮动态等[10, 51- 52]。例如,Feng等[10]在亚热带季雨林中的研究发现,在有机层中,土壤微生物生物量碳的季节变化受土壤温度或土壤湿度影响不显著;而在矿质层中,则主要受土壤温度和湿度的驱动。他们得出结论,来源于植物冠层的碳在土壤中的再分配以及原有的土壤有机质是决定矿质土壤中微生物生物量的季节变化的主要因子。本研究中,米老排和杉木林各处理小区内土壤微生物生物量碳、氮与土壤温度和湿度之间无显著相关性,各处理对土壤微生物生物量碳、氮无显著影响。因此,土壤温度和湿度以及新鲜输入有机质的数量和质量不是调控人工林土壤微生物生物量季节变化的主要因子。土壤微生物生物量在很大程度上取决于土壤有机质的养分有效性。土壤微生物生物量减少,会引起土壤中养分的矿化;反之,则导致养分的固定[53]。例如,Chu等[54]在北极苔原景观中研究发现,不同植被类型土壤的全碳、全氮,微生物生物量碳,可溶性有机碳、氮,矿质氮以及氮矿化潜力不同,氮矿化潜力与土壤中的有效态碳、氮呈正相关,与土壤C/N比值呈负相关。在本实验地的先前研究中,也发现米老排和杉木林土壤的氮矿化速率和矿质氮含量与易变性有机碳、土壤C/N比值和微生物群落组成有关[19]。因此,我们推测本研究中不同树种人工林之间土壤原有有机质的养分有效性是驱动土壤微生物生物量季节动态主要因子。
4结论
(1)凋落物和根系处理对土壤微生物生物量碳、氮的影响因树种而异。杉木林中添加高质量的米老排凋落物、去除凋落物、去除凋落物+去除根系后土壤微生物生物量碳、氮具有明显增加的趋势,而米老排林土壤微生物生物量不受碳源的限制。
(2)杉木林中添加高质量的米老排凋落物后,土壤中细菌、真菌和放线菌生物量有显著增加,且革兰氏阴性细菌和丛枝菌根真菌的种群丰度也有显著提高;地上部分凋落物输入的碳对土壤微生物群落组成的影响较为显著。
(3)米老排和杉木林土壤微生物生物量呈现明显的季节变化格局,土壤中原有有机质的养分有效性可能是驱动土壤微生物生物量季节变化的主要因子。
致谢: 感谢福建省南平市峡阳国有林场对野外试验样地的维护以及对野外实验开展的支持。
参考文献(References):
[1]FraterrigoJM,BalserTC,TurnerMG.Microbialcommunityvariationanditsrelationshipwithnitrogenmineralizationinhistoricallyalteredforests.Ecology, 2006, 87(3): 570- 579.
[2]LejonDP,ChaussodR,RangerJ,RanjardL.Microbialcommunitystructureanddensityunderdifferenttreespeciesinanacidforestsoil(Morvan,France).MicrobialEcology, 2005, 50(4): 614- 625.
[3]UshioM,WagaiR,BalserTC,KitayamaK.Variationsinthesoilmicrobialcommunitycompositionofatropicalmontaneforestecosystem:doestreespeciesmatter?SoilBiologyandBiochemistry, 2008, 40(10): 2699- 2702.
[4]WeandMP,ArthurMA,LovettGM,McCulleyRL,WeathersKC.EffectsoftreespeciesandNadditionsonforestfloormicrobialcommunitiesandextracellularenzymeactivities.SoilBiologyandBiochemistry, 2010, 42(12): 2161- 2173.
[5]IovienoP,AlfaniA,BååthE.SoilmicrobialcommunitystructureandbiomassasaffectedbyPinus pineaplantationintwoMediterraneanareas.AppliedSoilEcology, 2010, 45(1): 56- 63.
[6]LynchHB,EppsKY,FukamiT,VitousekPM.Introducedcanopytreespecieseffectonthesoilmicrobialcommunityinamontanetropicalforest.PacificScience, 2012, 66(2): 141- 150.
[7]BooneRD,NadelhofferKJ,CanaryJD,KayeJP.Rootsexertastronginfluenceonthetemperaturesensitivityofsoilrespiration.Nature, 1998, 396(6711): 570- 572.
[8]LeffJW,WiederWR,TaylorPG,TownsendAR,NemergutDR,GrandyAS,ClevelandCC.Experimentallitterfallmanipulationdriveslargeandrapidchangesinsoilcarboncyclinginawettropicalforest.GlobalChangeBiology, 2012, 18(9): 2969- 2979.
[9]Garca-OlivaF,SveshtarovaB,OlivaM.SeasonaleffectsonsoilorganiccarbondynamicsinatropicaldeciduousforestecosysteminwesternMexico.JournalofTropicalEcology, 2003, 19(2): 179- 188.
[10]FengWT,ZouXM,SchaeferD.Above-andbelowgroundcarboninputsaffectseasonalvariationsofsoilmicrobialbiomassinasubtropicalmonsoonforestofsouthwestChina.SoilBiologyandBiochemistry, 2009, 41(5): 978- 983.
[11]KramerC,TrumboreS,FröbergM,CisnerosDozalLM,ZhangD,XuX,SantosGM,HansonPJ.Recent(< 4yearold)leaflitterisnotamajorsourceofmicrobialcarboninatemperateforestmineralsoil.SoilBiologyandBiochemistry, 2010, 42(7): 1028- 1037.
[12]LiYQ,XuM,SunOJ,CuiWC.EffectsofrootandlitterexclusiononsoilCO2effluxandmicrobialbiomassinwettropicalforests.SoilBiologyandBiochemistry, 2004, 36(12): 2111- 2114.
[13]SubkeJA,HahnV,BattipagliaG,LinderS,BuchmannN,CotrufoMF.Feedbackinteractionsbetweenneedlelitterdecompositionandrhizosphereactivity.Oecologia, 2004, 139(4): 551- 559.
[14]Siira-PietikäinenA,HaimiJ,FritzeH.Organisms,decomposition,andgrowthofpineseedlingsinborealforestsoilaffectedbysodcuttingandtrenching.BiologyandFertilityofSoils, 2003, 37(3): 163- 174.
[15]CrowSE,LajthaK,FilleyTR,SwanstonCW,BowdenRD,CaldwellBA.Sourcesofplant-derivedcarbonandstabilityoforganicmatterinsoil:implicationsforglobalchange.GlobalChangeBiology, 2009, 15(8): 2003- 2019.
[16]WangQK,HeTX,WangSL,LiuL.Carboninputmanipulationaffectssoilrespirationandmicrobialcommunitycompositioninasubtropicalconiferousforest.AgriculturalandForestMeteorology, 2013, 178- 179: 152- 160.
[17]万晓华, 黄志群, 何宗明, 胡振宏, 杨靖宇, 余再鹏, 王民煌. 阔叶和杉木人工林对土壤碳氮库的影响比较. 应用生态学报, 2013, 24(2): 345- 350.
[18]明安刚, 贾宏炎, 陶怡, 卢立华, 苏建苗, 史作民. 桂西南 28 年生米老排人工林生物量及其分配特征. 生态学杂志, 2011, 31(5): 1050- 1056.
[19]HuangZQ,WanXH,HeZM,YuZP,WangMW,HuZH,YangYS.Soilmicrobialbiomass,communitycompositionandsoilnitrogencyclinginrelationtotreespeciesinsubtropicalChina.SoilBiologyandBiochemistry, 2013, 62: 68- 75.
[20]WhiteD,DavisW,NickelsJ,KingJ,BobbieR.Determinationofthesedimentarymicrobialbiomassbyextractiblelipidphosphate.Oecologia, 1979, 40(1): 51- 62.
[21]DenefK,RoobroeckD,ManimelWaduMC,LootensP,BoeckxP.Microbialcommunitycompositionandrhizodeposit-carbonassimilationindifferentlymanagedtemperategrasslandsoils.SoilBiologyandBiochemistry, 2009, 41(1): 144- 153.
[22]LandesmanWJ,DightonJ.Responseofsoilmicrobialcommunitiesandtheproductionofplant-availablenitrogentoatwo-yearrainfallmanipulationintheNewJerseyPinelands.SoilBiologyandBiochemistry, 2010, 42(10): 1751- 1758.
[23]FrostegårdÅ,TunlidA,BååthE.UseandmisuseofPLFAmeasurementsinsoils.SoilBiologyandBiochemistry, 2011, 43(8): 1621- 1625.
[24]SwallowM,QuideauS,MacKenzieM,KishchukB.Microbialcommunitystructureandfunction:theeffectofsilviculturalburningandtopographicvariabilityinnorthernAlberta.SoilBiologyandBiochemistry, 2009, 41(4): 770- 777.
[25]胡亚林, 汪思龙, 黄宇, 于小军. 凋落物化学组成对土壤微生物学性状及土壤酶活性的影响. 生态学报, 2005, 25(10): 2662- 2668.
[26]陈法霖, 郑华, 阳柏苏, 欧阳志云, 张凯, 肖燚, 屠乃美. 中亚热带几种针、阔叶树种凋落物混合分解对土壤微生物群落碳代谢多样性的影响. 生态学报, 2011, 31(11): 3027- 3035.
[27]陈法霖, 郑华, 欧阳志云, 张凯, 屠乃美. 土壤微生物群落结构对凋落物组成变化的响应. 土壤学报, 2011, 48(3): 603- 611.
[28]KalbitzK,SchwesigD,SchmerwitzJ,KaiserK,HaumaierL,GlaserB,EllerbrockR,LeinweberP.Changesinpropertiesofsoil-deriveddissolvedorganicmatterinducedbybiodegradation.SoilBiologyandBiochemistry, 2003, 35(8): 1129- 1142.
[29]KaiserK,GuggenbergerG,HaumaierL,ZechW.Thecompositionofdissolvedorganicmatterinforestsoilsolutions:changesinducedbyseasonsandpassagethroughthemineralsoil.OrganicGeochemistry, 2002, 33(3): 307- 318.
[30]SmolanderA,KitunenV.SoilmicrobialactivitiesandcharacteristicsofdissolvedorganicCandNinrelationtotreespecies.SoilBiologyandBiochemistry, 2002, 34(5): 651- 660.
[31]NeffJC,AsnerGP.Dissolvedorganiccarboninterrestrialecosystems:synthesisandamodel.Ecosystems, 2001, 4(1): 29- 48.
[32]査同刚, 张志强, 孙阁, 王高敏, 贠小琴, 王伊琨, 刘艳. 凋落物分解主场效应及其土壤生物驱动. 生态学报, 2013, 32(24): 7991- 8000.
[33]ClevelandCC,ReedSC,KellerAB,NemergutDR,O’NeillSP,OstertagR,VitousekPM.Litterqualityversussoilmicrobialcommunitycontrolsoverdecomposition:Aquantitativeanalysis.Oecologia, 2014, 174(1): 283- 294.
[34]HuangZQ,LiaoLP,WangSL,CaoGQ.Allelopathyofphenolicsfromdecomposingstump-rootsinreplantChinesefirwoodland.JournalofChemicalEcology, 2000, 26(9): 2211- 2219.
[35]马祥庆, 刘爱琴, 黄宝龙. 杉木人工林自毒作用研究. 南京林业大学学报: 自然科学版, 2000, 24(1): 12- 16., 2000.
[36]陈龙池, 汪思龙. 杉木根系分泌物化感作用研究. 生态学报, 2003, 23(2): 393- 398.
[37]黄志群, 廖利平, 汪思龙, 刘应迪. 杉木根桩和周围土壤酚含量的变化及其化感效应. 应用生态学报, 2000, 11(2): 190- 192.
[38]李秋玲,肖辉林. 土壤性质及生物化学因素与植物化感作用的相互影响. 生态环境学报, 2012, 21(12): 2031- 2036.
[39]SoutoXC,ChiapusioG,PellissierF.Relationshipsbetweenphenolicsandsoilmicroorganismsinspruceforests:significancefornaturalregeneration.JournalofChemicalEcology, 2000, 26(9): 2025- 2034.
[40]王延平, 王华田, 许坛, 倪桂萍, 姜岳忠. 酚酸对杨树人工林土壤养分有效性及酶活性的影响. 应用生态学报, 2013, 24(3): 667- 674.
[41]FengWT,SchaeferDA,ZouXM,ZhangM.ShiftingsourcesofsoillabileorganiccarbonafterterminationofplantcarboninputsinasubtropicalmoistforestofsouthwestChina.EcologicalResearch, 2011, 26(2): 437- 444.
[42]BrantJB,MyroldDD,SulzmanEW.Rootcontrolsonsoilmicrobialcommunitystructureinforestsoils.Oecologia, 2006, 148(4): 650- 659.
[43]BrantJB,SulzmanEW,MyroldDD.Microbialcommunityutilizationofaddedcarbonsubstratesinresponsetolong-termcarboninputmanipulation.SoilBiologyandBiochemistry, 2006, 38(8): 2219- 2232.
[44]张伟东, 汪思龙, 颜绍馗, 杨会侠, 徐广标. 杉木根系和凋落物对土壤微生物学性质的影响. 应用生态学报, 2009, 20(10): 2345- 2350.
[45]BastianF,BouziriL,NicolardotB,RanjardL.Impactofwheatstrawdecompositiononsuccessionalpatternsofsoilmicrobialcommunitystructure.SoilBiologyandBiochemistry, 2009, 41(2): 262- 275.
[46]PotthastK,HamerU,MakeschinF.ImpactoflitterqualityonmineralizationprocessesinmanagedandabandonedpasturesoilsinSouthernEcuador.SoilBiologyandBiochemistry, 2010, 42(1): 56- 64.
[47]KramerC,GleixnerG.Variableuseofplant-andsoil-derivedcarbonbymicroorganismsinagriculturalsoils.SoilBiologyandBiochemistry, 2006, 38(11): 3267- 3278.
[48]LeckieSE.Methodsofmicrobialcommunityprofilingandtheirapplicationtoforestsoils.ForestEcologyandManagement, 2005, 220(1/3): 88- 106.
[49]YangK,ZhuJJ,ZhangM,YanQL,SunOJ.SoilmicrobialbiomasscarbonandnitrogeninforestecosystemsofNortheastChina:acomparisonbetweennaturalsecondaryforestandlarchplantation.JournalofPlantEcology, 2010, 3(3): 175- 182.
[50]王国兵, 阮宏华, 唐燕飞, 栾以玲, 陈月琴, 陶忠芳. 北亚热带次生栎林与火炬松人工林土壤微生物生物量碳的季节动态. 应用生态学报, 2008, 19(1): 37- 42.
[51]XuZH,WardS,ChenCR,BlumfieldT,PrasolovaN,LiuJX.Soilcarbonandnutrientpools,microbialpropertiesandgrossnitrogentransformationsinadjacentnaturalforestandhooppineplantationsofsubtropicalAustralia.JournalofSoilsandSediments, 2008, 8(2): 99- 105.
[52]ChenTH,ChiuCY,TianG.Seasonaldynamicsofsoilmicrobialbiomassincoastalsandduneforest.Pedobiologia, 2005, 49(6): 645- 653.
[53]McGillW,CannonK,RobertsonJ,CookF.Dynamicsofsoilmicrobialbiomassandwater-solubleorganicCinBretonLafter50yearsofcroppingtotworotations.CanadianJournalofSoilScience, 1986, 66(1): 1- 19.
[54]ChuHY,GroganP.Soilmicrobialbiomass,nutrientavailabilityandnitrogenmineralizationpotentialamongvegetation-typesinalowarctictundralandscape.PlantandSoil, 2010, 329(1/2): 411- 420.
基金项目:国家自然科学基金项目(41371269); 教育部新世纪优秀人才支持计划(DB-168); 福建省杰出青年科学基金项目(2060203)
收稿日期:2013- 10- 14; 网络出版日期:2015- 10- 10
*通讯作者
Corresponding author.E-mail: zhiqunhuang@hotmail.com
DOI:10.5846/stxb201310142473
Changesofabove-andbelowgroundcarboninputaffectedsoilmicrobialbiomassandcommunitycompositionintwotreespeciesplantationsinsubtropicalChina
WANXiaohua1,2,HUANGZhiqun1,2,*,HEZongming3,YUZaipeng1,2,WANGMinhuang1,2,LIURuiqiang1,2,ZHENGLujia1,2
1 College of Geographical Science, Fujian Normal University, Fuzhou 350007, China 2 Cultivation Base of State Key Laboratory of Humid Subtropical Mountain Ecology, Fuzhou 350007, China 3 College of Forestry, Fujian Agriculture and Forestry University, Fuzhou 350002, China
Abstract:We employed Detritus Input and Removal Experiment (DIRT) to examine the effects of carbon (C) input on soil microbial biomass and community composition in 19-year-old Chinese fir (Cunninghamia lanceolata (Lamb.) Hook) and Mytilaria laosensis forests in subtropical China. The treatments included: (1) reciprocal litter transplant; (2) litter removal; (3) no inputs (litter removal+ root trenching); and (4) control. Each treatment had four 2 m×2 m plots. From January to December 2012, we collected the top 5 cm soil layer samples monthly from C. lanceolata and M. laosensis plots. Chloroform fumigation-extraction was used to determine the soil microbial biomass C and nitrogen (N) contents. Phospholipid fatty acid (PLFA) analysis was used to characterize the microbial community composition in soil samples collected in June 2012. Results suggested that the C input manipulations induced differences in soil microbial biomass and community composition were dependent on tree species. C input manipulations had no significant effects on soil microbial biomass C and N under M. laosensis. However, the concentrations of microbial biomass C and N seemed to increase under C. lanceolata. PLFA analysis showed that M. laosensis litter significantly increased the contents of bacterial PLFAs, fungal PLFAs and actinomycetes, and significantly enhanced the percent abundance of gram-negative bacteria and arbuscular mycorrhizal fungi under C. lanceolata. Litter removal significantly increased the contents of gram-positive bacteria, gram-negative bacteria, arbuscular mycorrhizal fungi, actinomycetes and fungi by 22%, 29%, 44%, 25% and 52%, respectively, and also increased the fungi to bacteria ratio by 21% compared with the control in C. lanceolata soil. However, litter removal and root trenching did not change soil microbial community composition in C. lanceolata and M. laosensis soils. Seasonal patterns of microbial biomass C and N were different between C. lanceolata and M. laosensis plantations. Nutrient availability rather than soil temperature, moisture or fresh litter input, may determine seasonal fluctuation of soil microbial biomass in this study. Our results suggested that further studies are required to confirm the relative contribution of above- and belowground C inputs in different tree species plantations in subtropical China.
Key Words:litter removal; root trenching; soil microbial biomass; microbial community composition; tree species; subtropical plantation
万晓华,黄志群,何宗明,余再鹏,王民煌,刘瑞强,郑璐嘉.改变碳输入对亚热带人工林土壤微生物生物量和群落组成的影响.生态学报,2016,36(12):3582- 3590.
WanXH,HuangZQ,HeZM,YuZP,WangMH,LiuRQ,ZhengLJ.Changesofabove-andbelowgroundcarboninputaffectedsoilmicrobialbiomassandcommunitycompositionintwotreespeciesplantationsinsubtropicalChina.ActaEcologicaSinica,2016,36(12):3582- 3590.
