肝细胞癌组织中Shh、Gli1、Snail、E-cadherin表达的临床研究
2016-08-09倪卓然赵红川朱立新耿小平
倪卓然,谢 坤,赵红川,朱立新,耿小平
◇临床医学研究◇
肝细胞癌组织中Shh、Gli1、Snail、E-cadherin表达的临床研究
倪卓然1,谢 坤1,赵红川1,朱立新2,耿小平1
目的 探讨Shh、Gli1、Snail及E-cadherin在肝细胞癌组织中的表达及意义。方法 应用免疫组化法检测91例肝癌组织、癌旁组织及30例正常肝组织中Shh、Gli1、Snail及E-cadherin的表达情况,结合临床资料,分析其对预后的影响。结果 Shh、Gli1、Snail及E-cadherin在肝癌组织和癌旁组织及正常肝组织中的表达程度差异均有统计学意义(P<0.05),肝癌组织中前3者表达高于癌旁组织及正常肝组织,E-cadherin在正常肝组织中的表达高于癌旁组织(P<0.05);4种蛋白的表达均与肝癌直径、分化程度、有无脉管癌栓相关(P<0.05);4种蛋白的表达与年龄、性别、术前血清甲胎蛋白水平、乙肝表面抗原阳性、肿瘤单发或多发、肝硬化与否均无相关性;Shh、Gli1和Snail两两之间在肝癌组织中的表达呈正相关性(P<0.05),而这3个蛋白表达均与E-cadherin呈负相关性(P<0.05)。Shh、Gli1及E-cadherin在肝癌组织阳性表达程度与预后相关,而Snail在肝癌组织和癌旁组织同时表达则提示预后不良。结论 Hedgehog信号通路与上皮间质转换过程在肝癌组织中均异常活跃,提示异常激活的Hedgehog信号通路可能通过引起转录因子的异常表达而调控上皮间质转化发生,从而影响肝细胞癌的发生发展。
肝细胞癌;Hedgehog信号通路;上皮间质转换
网络出版时间:2016-3-8 8:29:01 网络出版地址:http://www.cnki.net/kcms/detail/34.1065.R.20160308.0829.034.htm l
上皮间质转化(epithelial-mesenchymal transtion,EMT)是一种基础的生理病理现象,目前被认为是肿瘤转移的重要机制之一,与肝细胞癌(hepatocelluar carcinoma,HCC)的侵袭转移更密切相关[1]。Hedgehog信号通路是胚胎发育过程中重要的调控信号,研究[2]表明Hedgehog信号通路分子在HCC等多种肿瘤上存在异常表达,可能参与了HCC的发生发展。有关Hedgehog通路和EMT在HCC侵袭转移中的相互作用及其作用机制尚不明确。该研究选用Hedgehog信号通路中Shh和Gli1两个关键转录因子,以及EMT中Snail及E-钙黏蛋白(E-cadherin)两个标志的转录因子,分析其表达与HCC临床病理特点、预后及相互之间的关系。
1 材料与方法
1.1 病例资料 随机选取2007年6月~2012年6月安徽医科大学第一附属医院肝胆外科手术根治切除或活检组织的91例肝癌组织、癌旁组织及30例正常者肝组织,患者术前均未行放化疗,每例标本皆经病理确诊。HCC组:男85例,女6例;年龄21~78岁,中位年龄52岁;肿瘤平均直径为1.4~15.0 cm,中位直径为5.9 cm;分化类型:低分化20例,中高分化52例,高分化19例;重度肝硬化16例,中重度肝硬化35例,轻度肝硬化35例,无肝硬化5例;乙肝表面抗原(HBsAg)阳性表达84例,HBsAg阴性表达7例;血清甲胎蛋白升高(>25 ng/ml)53例,血清甲胎蛋白正常(≤25 ng/ml)38例;有脉管癌栓24例,无脉管癌栓67例;肿瘤单发24例,多发67例。收集所有病例肝癌组织及癌旁组织标本(距离癌组织边缘2 cm以上),收集同时期活检病理证明为正常肝脏组织标本30例。所有患者通过电话或传真长期随访,相关资料录入肝胆外科康宁随访系统中。
1.2 主要试剂 兔来源Shh抗体、Gli1抗体、Snail抗体、E-cadherin抗体(北京博奥森生物技术有限公司);非生物素超敏二步法免疫组织化学检测试剂盒(PV6000)、3,3-二氨基联苯胺(3,3-diaminobenzidine,DAB)(北京中杉金桥生物技术有限公司)。
1.3 免疫组化染色 石蜡切片脱蜡至水,PBS冲洗3次,每次3 min,柠檬酸缓冲液微波热修复抗原,3%H2O2灭活内源性过氧化物酶10 min,PBS冲洗3次,每次3 min,除去PBS后,滴加50μl一抗4℃过夜。Shh蛋白稀释度为1∶50,Gli1蛋白为1∶150,Snail蛋白为1∶100,E-cadherin蛋白为1∶150,用武汉博士德公司提供的已知人乳腺癌切片作阳性对照,以PBS代替一抗作阴性对照,PBS冲洗3次,每次3 min,除去PBS液,滴加50μl生物素标记的二抗,室温下孵育30 min,PBS冲洗3次,每次3 min,除去PBS液,DAB显色1 min,自来水冲洗3 min终止反应,苏木精对比复染、脱水、透明、封片。
1.4 结果判断 普通光学显微镜下每张切片随机选取5个高倍镜视野观察细胞,细胞内出现棕黄或棕褐颗粒为阳性细胞,根据阳性细胞染色强以及阳性细胞在总细胞中所占比例判定实验结果。无着色为0分;淡黄色为1分;黄色为2分;棕褐色为3分。阳性细胞率计分标准:阳性细胞<5%为0分;5%~25%为1分;>25%~50%为2分;>50%~75% 为3分;>75%为4分。总评分值(阳性细胞率评分乘以着色强度评分)≤3分为阴性,>3分为阳性。疾病特异性总生存期(overall survial,OS)定义为从手术日到肝癌至死亡或末次随访的时间。无瘤生存期(disease free survial,DFS)定义为是从手术日到影像学证实肿瘤复发时。
1.5 统计学处理 应用SPSS 19.0软件进行分析,数据采用χ2检验及Fisher确切概率法。相关性分析采用Spearman相关分析。生存数据进行Kaplan-Meier分析,并绘制生存曲线,应用Log-rank检验差异性。
2 结果
2.1 Shh、G li1、Snail及E-cadherin表达情况 Shh
主要表达于胞质,胞膜也见表达(图1A),肝癌组织显著高于癌旁组织及正常肝组织(χ2=19.976、7.329,P=0.001、0.007),正常肝组织与癌旁组织差异无统计学意义;Gli1主要在胞质、胞核表达(图1B),肝癌组织显著高于癌旁组织和正常肝组织(χ2=19.07、10.32,P=0.001、0.001),正常肝组织与癌旁组织差异无统计学意义;Snail主要表达于胞质、胞核亦见少量表达(图1C),肝癌组织高于癌旁组织及正常肝组织(χ2=22.10、14.59,P=0.001、0.001),正常肝组织与癌旁组织差异无统计学意义;E-cadherin主要在胞膜、胞质表达(图1D),肝癌组织显著低于癌旁组织及正常肝组织(χ2=43.62, P<0.001),而癌旁组织显著低于正常肝组织,差异有统计学意义(χ2=9.143,P=0.002)。见表1。
2.2 Shh、Gli1、Snail及E-cadherin的表达与肝癌临床病理特征的关系 Shh、Gli1及Snail在HCC中的阳性表达与肿瘤直径、脉管癌栓和分化程度存在相关性,表现为随着肿瘤直径增大、存在脉管癌栓时和(或)肿瘤分化程度较差时Shh、Gli1和Snail阳性表达增加,差异有统计学意义(P<0.05)。E-cadherin在HCC中的阳性表达同样与肿瘤直径、脉管癌栓和分化程度存在相关性,随着直径增加、脉管癌栓时和(或)肿瘤分化程度较差,E-cadherin阳性表达减少,差异有统计学意义(P<0.05)。此外,E-cadherin的表达在肝脏是否硬化上差异有统计学意义(P=0.020)。4种蛋白在肝癌组织中的表达与患者性别、年龄、甲胎蛋白水平、肿瘤单发或多发、肝硬化与否无明显关系,见表2。

图1 肝癌组织中蛋白表达情况 SP×400A:Shh阳性表达;B:Gli1阳性表达;C:Sanil阳性表达;D:E-cadherin阴性表达

表1不同组织中 Shh、G li1、Snail、E-cadherin阳性表达率[n(%)]
2.3 肝癌组织中Shh、G li1、Snail及E-cadherin表达的相互关系Shh、Gli1、Snail、E-cadherin在HCC中的表达同样经配对资料Spearman相关分析显示Shh与Gli1和Snail的表达呈正相关性(r=0.369、0.333,P<0.01),Shh与E-cadherin的表达呈负相关性(r=-0.358,P<0.01),E-cadherin与Gli1和Snail的表达呈负相关性(r=-0.227、-0.260,P<0.05),Gli1与Snail的表达呈正相关性(r=0.246,P <0.05)。表2 Shh、Gli1、Snail及E-cadherin的表达与肝癌临床病理特征的关系(n)

临床病理特征 n Shh阳性 P值Gli1阳性 P值Snail阳性 P值E-cadherin阳性 P值0.691 0.079 0.761 0.876 >52 44 28 21 22 9 ≤52 47 28 31 25 9性别 0.789 0.223 0.076 0.389 男85 52 50 46 16 女6 4 2 1 2术前甲胎蛋白(ng/ml) 0.659 0.244 0.313 0.185 >25 53 36 33 25 8 ≤25 38 20 19 22 10血清HBsAg 0.290 0.210 0.203 0.111 (-)7 3 2 2 3 (+) 84 53 50 45 15硬化 0.942 0.894 0.592 0.020 无5 3 3 2 3 有86 53 49 45 15肿瘤数目 0.547 0.410 0.774 0.655 1 24 16 12 13 4 >1 67 40 40 34 14肿瘤直径(cm) 0.009 0.029 0.016 0.024 >3 47 35 32 30 6 ≤3 44 21 20 17 12分化程度 <0.001 0.001 0.007 <0.001 高20 5 5 5 16中、低 71 51 47 42 2脉管癌栓 0.039 0.003 0.028 0.025 有24 19 20 17 1无年龄(岁)67 37 32 30 17

2.4 Shh、Gli1、Snail及E-cadherin表达与预后的关系 本组HCC患者经电话或短信长期随访,随访率94.5%。本组患者癌组织中Shh、Gli1、Snail及E-cadherin阳性表达分别是56、52、47、18例。当Shh、Gli1阴性表达时,患者DFS的中位数分别是阳性表达患者的1.31倍(34个月/26个月)、2.21倍(42个月/19个月),而OS的中位数分别是阳性表达患者的1.72倍(50个月/29个月)、1.81倍(47个月/ 26个月),3年生存率(70.6%、66.7%)也显著高于阳性表达患者(49.1%、44.2%),见图2。Shh和Gli1的阳性表达率与患者的生存状态呈正相关性,差异有统计学意义(P<0.05),提示预后不良。E-cadherin阳性表达时,患者的DFS的中位数(34个月)及OS的中位数(47个月)、3年生存率(83.3%)显著优于阴性表达患者的DFS中位数(26个月)、OS中位数(37个月)、3年生存率(50.7%),提示E-cadherin阳性表达可能是较好预后的影响因素之一。Snail在肝癌组织中表达与预后无明显相关性,但当Snail在肝癌组织和癌旁组织同时表达阳性时(19/91,20.88%),Snial的表达与DFS及OS均有相关性(P<0.05),见图3。

图2 肝癌组织中Shh与 G li1表达与否的生存曲线A:DFS;B:OS
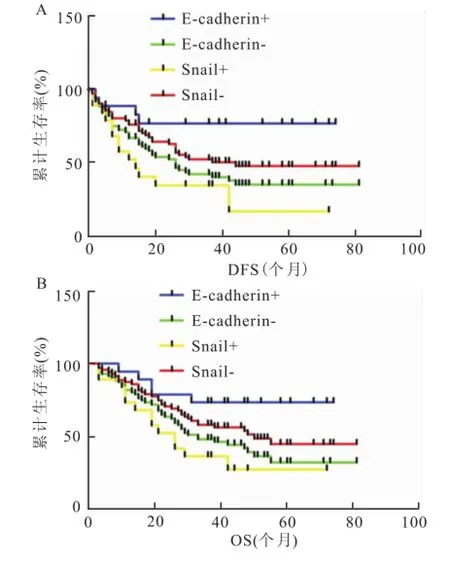

图3 肝癌组织中 E-cadherin与肝癌、癌旁组织中Snail中同时表达与否的生存曲线A:DFS;B:OS
3 讨论
原发性肝癌在2014年成为世界范围内第五大最常见的恶性肿瘤,也是第二大最常见致死性恶性肿瘤,严重危害人类健康。我国是HCC的高发区域,每年发病患者数达30多万,占世界肝癌患者的60%[3]。目前仍然缺乏高敏感性的早期诊断方法,而且HCC早期极易发生肝内外转移,多数患者就诊时已为中晚期,即使行根治性切除或肝移植仍易早期复发,预后极差。
近年来,人们在包括肝癌的多种肿瘤模型中均发现了EMT现象。EMT是指在特定的生理和病理情况下上皮细胞向间质细胞转化的现象,是胚胎发育中形态发生过程的重要部分,在成人体内,EMT参与多种疾病发展,包括组织器官的纤维化和肿瘤的发生和发展,目前被认为是肿瘤转移的重要机制之一,其与HCC的发生发展密切相关[1]。锌指转录因子Snail首先在果蝇中被发现,是参与EMT调控的重要转录因子,Snail通过抑制E-cadherin转录表达,诱导EMT发生[4]。E-cadherin广泛存在于各种上皮细胞中,介导同型细胞连接的钙依赖性黏附分子,是主要的抑制上皮肿瘤转移基因,而E-cadherin表达的下调是EMT的最重要标志之一[5]。Hedgehog通路由Hedgehog配体、2个跨膜蛋白受体Ptch和Smo以及下游转录因子Gli蛋白等组成,而Shh 和Gli1基因和蛋白的表达水平是反映Hedgehog信号通路活性的可靠指标[6]。既往研究[7]表明,当肝脏发育成熟后Hedgehog信号通路转入静息状态,但Hedgehog信号通路分子在多种肿瘤上异常表达,例如基底细胞癌、胰腺癌和胆管癌等,因此,认为Hedgehog信号通路与肿瘤的发生、发展、侵袭及转移密切相关[8-9]。
本研究结果显示,Snail在肝癌组织表达明显高于癌旁组织和正常肝组织,与肝癌的肿瘤直径、脉管癌栓、分化程度呈现相关性。当肿瘤直径越大、分化程度越差和(或)有脉管癌栓时,Snail表达增高;E-cadherin的表达则正好相反。当肿瘤伴有微血管侵犯时,E-cadherin表达低于无血管侵犯。此外,E-cadherin阳性表达率不仅在肝癌组织与癌旁组织存在显著性差异,且癌旁组织与正常肝脏组织也存在显著性差异。本研究显示Snail与E-cadherin呈明显负相关性,Snail在肝癌组织及癌旁组织同时阳性表达组的DFS及OS显著低于阴性组,E-cadherin在肝癌组织阳性表达组的DFS及OS显著高于阴性组,提示肝组织中Snail的表达可能直接调控肝癌组织及癌旁组织E-cadherin的表达,通过降低肝癌组织及癌旁组织E-cadherin的表达,破坏细胞间的紧密连接,致使细胞间黏附力减弱或丧失,导致EMT发生,进而促进肝癌的复发和转移。在动物模型及肝癌标本研究[10-11]中也得出相似的结论。
本研究结果显示,Shh和Gli1表达呈正相关性。Shh在肝癌组织的表达明显高于癌旁组织和正常肝组织。且随着肿瘤分化程度的增高而减少,低分化组阳性率显著高于中、高分化组。此外,Shh在肝癌伴脉管癌栓组中表达显著高于无脉管癌栓组。Gli1的表达水平与Shh得出相似的结论。本实验结果提示Hedgehog信号通路的异常活化可能参与了肝癌的发生发展,并且与肿瘤的直径、分化程度及微血管侵犯有着密切的关系,直接影响肝癌的生物学行为,并显著影响患者手术切除预后。
在HCC的研究中,Hedgehog通路异常活化与癌细胞EMT及侵袭力相关,表现为在 Hedgehog通路活化的肝癌细胞中,用阻滞剂环巴胺阻断该通路后,肿瘤的EMT现象及肿瘤细胞迁移受限[12]。在本研究中,Shh、Gli1、Snail及E-cadherin蛋白在肝组织中的阳性表达,直接影响患者预后。而Shh、Gli1 和Snail3者之间在肝癌中的表达呈正相关性,而这3个蛋白的表达与E-cadherin呈负相关性,提示异常激活的Hedgehog通路可能参与了调控Snail、E-cadherin的表达,通过调控EMT的发生,促进肝癌的发生发展。而随着研究的进展,肝癌中Hedgehog通路调节EMT过程的机制愈发明晰,靶向干涉或阻断Hedgehog通路,或将为肝癌的临床治疗提供一个更为广阔的应用前景。
[1] Whittaker S,Marais R,Zhu A X,et al.The role of signaling pathways in the development and treatment of hepatocellular carcinoma[J].Oncogene,2010,29(36):4989-5005.
[2] Bailey JM,Singh P K,Hollingsworth M A,et al.Cancermetastasis facilitated by developmental pathways:Sonic hedgehog,Notch,and bone morphogenic proteins[J].J Cell Biochem,2007,102 (4):829-39.
[3] Bruix J,Gores G J,Mazzaferro V,et al.Hepatocellular carcinoma:clinical frontiers and perspectives[J].Gut,2014,63(5):844 -55.
[4] Martinez-Estrada O M,Lettice L A,Essafi A,et al.Wt1 is required for cardiovascular progenitor cell formation through transcriptional control of Snail and E-cadherin[J].Nat Genet,2010,42(1):89-93.
[5] Gheldof A,Berx G.Cadherins and epithelial-to-mesenchymal transition[J].Prog Mol Biol Transl Sci,2013,116:317-36.
[6] Pasca di Magliano M,Hebrok M.Hedgehog signalling in cancer formationandmaintenance[J].Nat Rev Cancer,2003,3(12):903 -11.
[7] Yoo Y A,Kang M H,Kim JS,et al.Sonic hedgehog signaling promotesmotility and invasiveness of gastric cancer cells through TGF-beta-mediated activation of the ALK5-Smad 3 pathway[J]. Carcinogenesis,2008,29(3):480-90.
[8] Zuo M,Rashid A,ChuriC V.Novel therapeutic strategy targeting the Hedgehog signalling andmTOR pathways in biliary tract cancer [J].Br JCancer,2015,112(6):1042-51.
[9] Kumar V,Mondal G,Slavi K P,et al.Codelivery of smallmolecule hedgehog inhibitor and miRNA for treating pancreatic cancer [J].Mol Pharm,2015,12(4):1289-98.
[10]Song R,Song H,Liang Y,et al.Reciprocal activation between ATPase inhibitory factor 1 and NF-κB drives hepatocellular carcinoma angiogenesis andmetastasis[J].Hepatology,2014,60(5):1659-73.
[11]Qian M,Zhang SQ,Zhu J.The expression of Snail in hepatocarcinoma and inhibitory effects of anti-Snail on invasion and migration of hepatocarcinoma cells[J].Chin JSurg Onco,2010,2(3):152 -5.
[12]Sicklick JK,Li Y X,Jayaraman A.Dysregulation of the Hedgehog pathway in human hepatocarcinogenesis[J].Carcinogenesis,2006,27(4):748-57.
Conclusion Hedgehog signaling pathway and epithelial-mesenchymal transition(EMT)process in liver cancer tissues are hyperactive,prompting the abnormal activation of the Hedgehog signaling pathwaymay lead to the abnormal expression of EMT by regulating the expression of transcription factors,thus affect the incidence and development of HCC.
Clinical research of Shh,G li1,Snail,E-cadherin expression in hepatocellular carcinoma tissues
Ni Zhuoran,Xie Kun,Zhao Hongchuan,et al
(Deptof General Surgery,The First Affiliated Hospital of AnhuiMedical University,Hefei 230022)
Objective To appraise the expression of Shh,Gli1,Snail and E-cadherin in hepatocellular carcinoma (HCC)tissue and its significance.Methods The expression of Shh,Gli1,Snail and E-cadherin proteins in 91 cases of HCC tissues,pericarcinous tissues and 30 cases of normal human liver tissueswere detected by using immunohistochemical technology,then to analyze its influence on prognosis combined with clinical data.Results Shh,Gli1,Snail and E-cadherin were expressed statistically significant among HCC tissues,pericarcinous tissues and normal tissues(P<0.05),While Shh,Glil,Snail expressionswere higher in HCC group than in pericarcinous tissues group and normal tissues group.By contrast,E-cadherin expression was higher in pericarcinous tissues than in normal tissues,but lower than in HCC tissues(P<0.05).All proteins expression was correlated with tumor differentiation,tumor size,and vascular tumor emboli(P<0.05),and was not correlated with age,gender,preoperative serum AFP level,positive serum HBsAg,single ormultiple tumors,liver cirrhosis.Shh,Gli1 and Snail expressed in HCC was positively correlated with each other(P<0.05),butwas negatively correlated with E-cadherin(P<0.05).The prognosis and overall survivalwere correlated with the expression of Shh,Gli1,E-cadherin protein,it indicated poor prognosis when Snail expressed positive both in carcinoma and pericarcinous tissues.
hepatocelluar carcinoma;hedgehog signaling pathway;epithelial-mesenchymal transition
R 657.3
A
1000-1492(2016)04-0536-06
2015-12-21接收
安徽省卫生厅医学科研重点项目(编号:2010A009)
安徽医科大学第一附属医院1普外科、2中心实验室,合肥230022
倪卓然,男,硕士研究生;
耿小平,男,主任医师,教授,博士生导师,责任作者,E-mail:xp_geng@163.net
