P[14]型轮状病毒VP8*蛋白特异结合A型组织血型抗原
2016-08-09孙晓曼郭妮君徐子乾李丹地段招军
孙晓曼 郭妮君 徐子乾 李丹地 段招军
·技术方法·
P[14]型轮状病毒VP8*蛋白特异结合A型组织血型抗原
孙晓曼郭妮君徐子乾李丹地段招军
102206 北京,中国疾病预防控制中心病毒病预防控制所(孙晓曼、李丹地、徐子乾、段招军); 410005 长沙, 湖南师范大学第一附属医院湖南省人民医院检验科(郭妮君)
【摘要】目的研究轮状病毒与组织血型抗原之间的关系。方法以直接从人粪便标本中检测到的比较少见的G8P[14]型轮状病毒为研究对象,表达纯化得到P[14] VP8*蛋白,通过寡糖结合和唾液结合实验,研究其与组织血型抗原的结合。结果P[14] VP8*蛋白可以与A型寡糖和A型唾液特异结合,而没有检测到与其他型别的组织血型抗原结合。 结论A型组织血型抗原可能是P[14]型轮状病毒的潜在受体,这为进一步研究其他型别轮状病毒受体结合特征及轮状病毒监测提供了一定的基础和依据。
【主题词】P[14]型轮状病毒;VP8*蛋白;组织血型抗原
Fund programs: National Natural Science Foundation of China (81472003;31500139)
轮状病毒(rotaviruses,RVs)是引起婴幼儿及动物病毒性胃肠炎的重要病原体,每年引起大约50万例婴幼儿死亡[1]。轮状病毒属于呼肠孤病毒科轮状病毒属,是分节段的双链RNA病毒,基因组包含11个双链RNA片段,编码12种蛋白,包括6个结构蛋白和6个非结构蛋白[2]。轮状病毒颗粒包含有三个壳层,分别由不同的结构蛋白构成,其中最外层由VP4 和VP7蛋白构成。VP7 是一种糖蛋白,大量存在于感染细胞的内质网中,与病毒装配有关;VP4 蛋白形成主要的刺突蛋白,介导病毒吸附和进入宿主细胞。病毒感染宿主过程中,VP4 蛋白经蛋白酶作用可裂解为VP5*和VP8*蛋白[3]。VP8*主要参与受体识别,介导病毒吸附于宿主细胞;VP5*主要参与膜融合,帮助病毒颗粒进入细胞质。根据VP7 和VP4 蛋白,可以将轮状病毒分为不同的G 型和P 型[4],目前鉴定到的有27 个G型和35 个P型,其中流行较多的毒株的G型为G1~G4,P 型为P[4]和P[8]。
有些动物轮状病毒对唾液酸酶(sialidase,SA)敏感,可能结合宿主细胞表面含有末端唾液酸的受体,如GD1a。进一步研究发现大多数动物轮状病毒和人轮状病毒对唾液酸酶都不敏感[5],对于这些唾液酸不敏感的轮状病毒受体结合特征还不是很明确,有研究表明它们可能结合具有支链唾液酸的神经节苷脂(ganglioside)[6],如GM1。近来研究发现组织血型抗原(histo-blood group antigens,HBGAs)可以与VP8*蛋白相互作用,可能是轮状病毒的潜在受体[7-10]。HBGAs具有丰富的多态性,包含ABO、分泌型及Lewis抗原[11]。研究表明,不同P型的轮状病毒与HBGAs的结合具有型别特异性[7, 12],人群中主要流行的P[4]和P[8]型轮状病毒结合H1和Leb,而P[6]只与H1结合。此外,不同人群对各种轮状病毒易感性也存在差异[13],轮状病毒疫苗(P[8]型轮状病毒)在非洲地区的保护效力相对较低,研究发现可能是因为人群中Lewis抗原阴性和非分泌型个体比例较高,而这些个体对P[8]轮状病毒不易感[14]。因而,研究轮状病毒与HBGAs的相互作用对于阐明轮状病毒的感染机制以及对轮状病毒疫苗的研究具有重要意义。
本课题组在我国轮状病毒监测中发现了一株比较少见的G8P[14] 轮状病毒。P[14]型轮状病毒虽然没有P[4]和P[8]型轮状病毒那样流行广泛,但近来P[14]感染人的报导也越来越多。P[14]型轮状病毒也被认为可以跨种传播,从动物传播到人[15]。本研究表达和纯化了P[14] 轮状病毒 VP8*蛋白,并对其与HBGAs的结合特征进行了研究,结果发现P[14] 轮状病毒 VP8*蛋白与A型HBGA特异结合,对深入研究轮状病毒的跨种传播提供了依据。
1材料与方法
1.1VP8*蛋白表达和纯化利用Geneaid试剂盒从粪便标本中提取病毒RNA,RT-PCR扩增得到VP8*片段。将VP8*全长基因克隆到表达载体pGEX4T-1,转化大肠埃希菌BL21(DE3)感受态细胞(天根生物公司),挑单克隆37 ℃培养至OD600值0.6~1.0之间,加入异丙基-β-d-硫代半乳糖苷(IPTG)(终浓度为0.4 mmol/L),20 ℃诱导表达过夜。
离心收集菌体经PBS重悬,冰水浴超声破碎(超声2s,间隔2s),高速离心(15 000 rpm,1 h)收集上清并用0.22 mm滤膜过滤,结合谷胱甘肽琼脂糖磁珠(Glutathione Sepharose 4B),先用50~100 ml PBS洗去非特异结合蛋白,用30~50 ml洗脱液(50 mM Tris-HCl,pH 8.0,10 mmol/L还原性谷胱甘肽)洗脱,得到VP8*-GST融合蛋白,通过SDS-PAGE电泳检测纯化后的蛋白。
1.2寡糖结合试验将纯化得到的VP8*-GST融合蛋白用PBS稀释成20 μg/ml的浓度,包被到96孔酶标板中,每孔100 μl,4 ℃过夜。用5%的脱脂奶粉封闭,每孔200 μl,37 ℃ 封闭1 h。用2%脱脂奶粉将人工合成的生物素标记的寡糖Lea、Lex、Leb、Ley、H1、H2、H3、A、B、SiaLex、N-acetylneuraminicacid(Neu5Ac)、N-glycolylneuraminicacid(Neu5Gc)及type I前体(preI)和type II前体(preII)(GlycoTech)稀释成2 mg/ml,每孔加100 μl,4 ℃过夜。用2%脱脂奶粉将辣根过氧化酶(horseradish peroxidase, HRP)标记的streptavidin(Abcam)以1∶1 500稀释后每孔加入100 μl,37 ℃温育1 h。此实验过程中每一步反应之后均以PBST洗液洗板5次、拍干。每孔加入100 μl四甲基联苯氨(3, 3′, 5, 5′-tetramethylbenzidine, TMB)底物缓冲液(BD Biosciences),避光显色10 min;加入100 μl 1 M磷酸终止反应,酶标仪检测OD450吸收值。
1.3唾液结合试验使用中国疾病预防控制中心病毒病预防控制所腹泻室保存的已经测定表型的唾液样本,将A、AB、B和O各种表型的唾液样本用PBS以1∶1 000稀释,每孔100 μl包被96孔酶标板,4 ℃过夜。用5%脱脂奶粉37 ℃封闭1 h。每孔加入100 μl浓度为20 μg/ml的VP8*-GST融合蛋白,37 ℃孵育1 h。然后加入100 μl鼠抗GST标签抗体(TransGen,1∶1 000稀释),37 ℃孵育1 h;最后加入100 μl HRP-羊抗鼠IgG(Abgent,1∶1500),37 ℃孵育1 h。实验过程中每一步反应之后均以PBST洗液洗板5次后拍干。同上用TMB底物缓冲液显色,检测OD450吸收值。
2结果
2.1P[14] VP8*-GST融合蛋白表达和纯化通过大肠埃希菌表达系统,得到可溶形式的P[14] VP8*-GST融合蛋白,利用亲和层析纯化得到较纯的目的蛋白,十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)结果显示有大约50 kDa条带和大约26 kDa蛋白(图1)。经质谱鉴定26 kDa条带为单独表达的GST蛋白,50 kDa条带为GST-VP8*融合蛋白,与目的蛋白预期的相对分子质量也相符合。

M:蛋白分子量标准;1:纯化后蛋白图1 P[14] VP8*-GST融合蛋白SDS-PAGE M, Protein ladder; 1, Purified proteinFig.1 SDS-PAGE of purified VP8*-GST protein
2.2P[14] VP8*-GST融合蛋白结合A型HBGA通过寡糖结合实验,研究P[14] VP8*-GST融合蛋白与各种组织血型抗原之间的结合特征,结果显示,与Lewis型寡糖(Lea、Lex、Leb和Ley)、H型寡糖(H1、H2、H3)、唾液酸(Neu5Ac、Neu5Gc)以及唾液酸化的Lewis寡糖(SiaLex)都没有检测到明显的结合,与B型HBGA也未检测到结合,而与A型HBGA有较明显的结合(图2)。为了排除单独GST蛋白的影响,单独的GST蛋白与各寡糖也进行了结合实验,结果显示单独的GST与各寡糖都没有检测到结合,表明GST对VP8*蛋白结合活性没有影响。
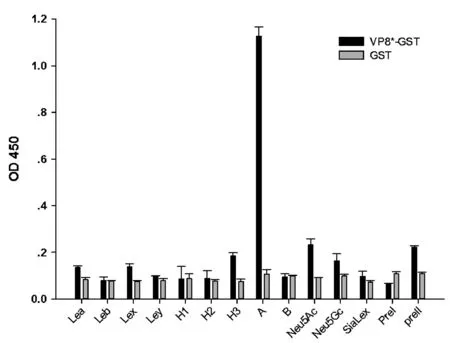
注:结果为三次平行实验的均值图2 P[14] VP8*-GST融合蛋白与各寡糖的结合Note:The result shows the average of three parallel experimentsFig.2 Oligosaccharides binding assay of P[14] VP8*-GST fusion protein and free GST protein
2.3P[14] VP8*-GST融合蛋白结合A型唾液样本利用本实验室保存的ABO表型明确的94份唾液样本,进行了P[14] VP8*-GST蛋白唾液样本的结合实验,结果显示其与A型和AB型唾液样本具有较明显的结合,与B型和O型唾液样本没有结合(图3)。
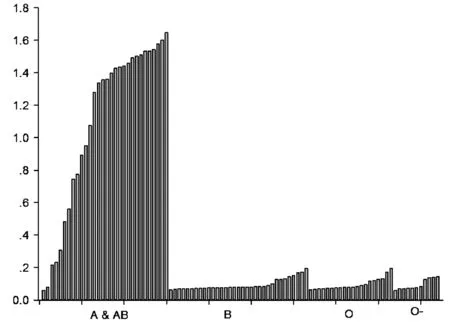
注:O-指非分泌型个体图3 P[14] VP8*-GST融合蛋白与A、B、O型唾液样本的结合Note: O- represents the non-secretorsFig.3 Binding of P[14] VP8*-GST fusion protein to the A, B and O saliva samples.
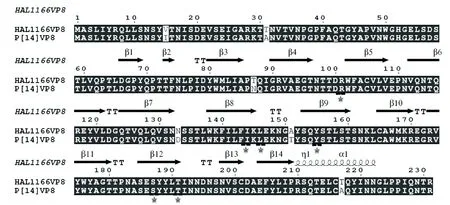
注:受体结合的关键位点以星状标记图4 P[14] VP8*氨基酸序列比对Note:The key amino acids are labeled with stars Fig.4 The amino acids alignment of P[14] and HAL1166 VP8*
3讨论
识别宿主受体并与受体结合是大多数病原引起感染至关重要的一步。关于轮状病毒受体的研究也较多,但其受体及潜在受体结合机制尚不明确。近期的研究发现,组织血型抗原有可能是轮状病毒的受体[7]。本研究以轮状病毒监测中发现的P[14]型轮状病毒为对象,研究其与HBGAs之间的相互关系。以pGEX4T-1为载体,表达纯化了VP8*-GST融合蛋白,通过唾液结合和寡糖结合实验,发现P[14]型轮状病毒特异性地与A型HBGA结合。已有研究通过糖点阵实验和细胞结合实验,发现HAL1166株P[14] VP8*蛋白与A型HBGA结合[16]。氨基酸序列比对发现本实验中的P[14] VP8*蛋白与HAL1166 VP8*蛋白相似度为97%,其中预期的关键结合位点氨基酸(101Arg, 144Ile, 146Leu, l55Tyr和187-191 SerTyrTyrLeuThr)也相对保守(图4),这也与它们都结合A型HBGA的结果相一致。
本研究中VP8*-GST融合蛋白表达的同时也有一些单独GST蛋白的表达,但通过实验发现GST蛋白与寡糖和唾液都是没有结合的,表明是P[14] VP8*蛋白特异性与A型寡糖和唾液结合。P[14]型轮状病毒可以感染偶蹄类动物,进而跨种传播到人[15],而A型HBGA不仅在人中存在,在某些动物中也存在,P[14] VP8*蛋白特异性与A型HBGA结合也从一方面揭示了其跨种传播的潜在机制。
综上所述,通过寡糖结合和唾液结合研究表明轮状病毒P[14] VP8*蛋白与A型寡糖有较明显的结合,为其他型别轮状病毒与HBGAs的结合研究做了基础,也为轮状病毒跨种传播和防控提供了一定的理论依据。
4参考文献
[1]Tate JE, Burton AH, Boschi-Pinto C, et al. 2008 estimate of worldwide rotavirus-associated mortality in children younger than 5 years before the introduction of universal rotavirus vaccination programmes: a systematic review and meta-analysis[J]. Lancet Infect Dis, 2012,12(2):136-141. doi: 10.1016/S1473-3099(11)70253-5.
[2]Settembre EC, Chen JZ, Dormitzer PR, et al. Atomic model of an infectious rotavirus particle[J]. EMBO J, 2011,30(2):408-416. doi: 10.1038/emboj.2010.322.
[3]Padilla-Noriega L, Dunn SJ, López S, et al. Identification of two independent neutralization domains on the VP4 trypsin cleavage products VP5* and VP8*of human rotavirus ST3[J]. Virology, 1995,206(1):148-154.
[4]Matthijnssens J, Ciarlet M, McDonald SM, et al. Uniformity of rotavirus strain nomenclature proposed by the Rotavirus Classification Working Group (RCWG)[J]. Arch Virol, 2011,156(8):1397-1413. doi: 10.1007/s00705-011-1006-z.
[5]Ciarlet M, Estes MK. Human and most animal rotavirus strains do not require the presence of sialic acid on the cell surface for efficient infectivity[J]. J Gen Virol, 1999,80 ( Pt 4):943-948. doi: 10.1099/0022-1317-80-4-943.
[6]Haselhorst T, Fleming FE, Dyason JC, et al. Sialic acid dependence in rotavirus host cell invasion[J]. Nat Chem Biol, 2009,5(2):91-93. doi: 10.1038/nchembio.134.
[7]Huang P, Xia M, Tan M, et al. Spike protein VP8*of human rotavirus recognizes histo-blood group antigens in a type-specific manner[J]. J Virol, 2012,86(9):4833-4843. doi: 10.1128/JVI.05507-11.
[8]郭妮君,孙晓曼,曹友德,等. 组织血型抗原: 轮状病毒可能的潜在受体[J]. 中国科学: 生命科学, 2015, 45, 6: 1-6, 10.1360/N052015-00039.
[9]李丹地,孙晓曼,段招军. 轮状病毒与其受体人类组织血型抗原相关性的研究进展[J]. 病毒学报, 2015, 04: 463-467, 1000-8721(2015)04-0463-05.
[10]Ma X, Li DD, Sun XM, et al. Binding Patterns of Rotavirus Genotypes P[4], P[6], and P[8] in China with Histo-Blood Group Antigens[J]. PLoS One, 2015,10(8):e0134584. doi: 10.1371/journal.pone.0134584.
[11]Marionneau S, Cailleau-Thomas A, Rocher J, et al. ABH and Lewis histo-blood group antigens, a model for the meaning of oligosaccharide diversity in the face of a changing world[J]. Biochimie, 2001,83(7):565-573.
[12]Yaddanapudi K, De Miranda J, Hornig M, et al. Toll-like receptor 3 regulates neural stem cell proliferation by modulating the Sonic Hedgehog pathway[J]. PLoS One, 2011,6(10):e26766. doi: 10.1371/journal.pone.0026766.
[13]Van Trang N, Vu HT, Le NT, et al. Association between norovirus and rotavirus infection and histo-blood group antigen types in Vietnamese children[J]. J Clin Microbiol, 2014,52(5):1366-1374. doi: 10.1128/JCM.02927-13.
[14]Nordgren J, Sharma S, Bucardo F, et al. Both Lewis and secretor status mediate susceptibility to rotavirus infections in a rotavirus genotype-dependent manner[J]. Clin Infect Dis, 2014,59(11):1567-1573. doi: 10.1093/cid/ciu633.
[15]Matthijnssens J, Potgieter CA, Ciarlet M, et al. Are human P[14] rotavirus strains the result of interspecies transmissions from sheep or other ungulates that belong to the mammalian order Artiodactyla?[J]. J Virol, 2009,83(7):2917-2929. doi: 10.1128/JVI.02246-08.
[16]Hu L, Crawford SE, Czako R, et al. Cell attachment protein vp8* of a human rotavirus specifically interacts with a-type histo-blood group antigen [J]. Nature, 2012, 485(7397): 256-259.doi:10.1038/nature10996
通信作者:李丹地, Email:dandili@163.com;段招军,Email: zhaojund@126.com
DOI:10.3760/cma.j.issn.1003-9279.2016.03.015
基金项目:国家自然科学基金(81472003;31500139)
(收稿日期:2015-12-10)
P[14] Rotavirus VP8*protein specifically binds to a type histo-blood group antigen
SunXiaoman,GuoNijun,XuZiqian,LiDandi,DuanZhaojun
NationalInstituteforViralDiseaseControlandPrevention,ChineseCenterforDiseaseControlandPrevention,Beijing102206,China(SunXM,LiDD,XuZQ,DuanZJ);ClinicalLaboratoryofHunanProvincialPeople’sHospital,ThefirstAffiliatedHospitalofHunanNormalUniversity,Changsha410005,China(GuoNJ)Correspondingauthor:LiDandi,Email:dandili@163.com;DuanZhaojun,Email:zhaojund@126.com
【Abstract】ObjectiveTo explore the binding specificity of the P[14] RV detected directly from the stool samples. MethodsThe P[14] VP8* protein was expressed and purified and then the binding pattern to synthetic oligosaccharides and saliva samples was carried out. ResultsThe P[14] VP8* protein showed significant binding to A type HBGA while almost no binding was detected to other HBGAs. ConclusionsA-HBGA may be the attachment factor for the P[14] rotavirus. Therefore, the research of the interaction between P[14] RV and HBGAs provides the basis for further characterization of binding patterns of other RV genotypes and the RV surveillance.
【Key words】P[14] rotavirus;VP8* protein;Histo-blood group antigens
