干扰素诱导的跨膜蛋白IFITM1/2/3对SFTS病毒感染的影响
2016-08-09万佳张硕李阿茜曲靖李川李德新梁米芳
万佳 张硕 李阿茜 曲靖 李川 李德新 梁米芳
·论著·
干扰素诱导的跨膜蛋白IFITM1/2/3对SFTS病毒感染的影响
万佳张硕李阿茜曲靖李川李德新梁米芳
102206 北京,中国疾病预防控制中心病毒病预防控制所
【摘要】目的在细胞水平初步探索IFITM1/2/3对SFTS病毒感染的影响。方法分别构建IFITM1/2/3真核表达载体并验证其在细胞内的表达。在过表达IFITM l/2/3的Vero和THP-1细胞中,利用实时荧光定量PCR检测不同时间点SFTS病毒的复制情况。结果间接免疫荧光及Western Blot检测显示重组IFITM l/2/3表达质粒在Vero细胞及THP-1细胞内可表达。实时荧光定量PCR结果显示,IFITM1/2/3对SFTS病毒在细胞内的感染均具有显著的抑制作用,尤其是在细胞感染早期,过表达的IFITM1/2/3对低剂量SFTS病毒感染的抑制作用更为明显。结论IFITM l/2/3可在细胞水平抑制病毒复制。
【主题词】IFITM1/2/3;SFTS病毒;抗病毒作用
干扰素诱导的跨膜蛋白(Interferon induced transmembrane proteins, IFITMs) 是一组由干扰素刺激基因(Interferon-stimulated genes, ISGs)编码表达的抗病毒蛋白[1]。在干扰素(Interferon, IFN)刺激下, IFITMs的表达水平显著提高。作为细胞内参与天然免疫的限制因子,IFITM家族中序列高度同源的IFITM l、IFITM2和IFITM3表现出广谱的抗病毒活性[2-5],对立夫特谷热病毒(Rift Valley fever virus, RVFV)、拉克罗斯病毒(La Crosse virus, LCV)及汉滩病毒(Hantaan virus)等布尼亚病毒均有明显的抑制作用[6,7]。
SFTS病毒(Sever fever with thrombocytopenia syndrome virus, SFTSV) 主要经蜱传播,可引起发热伴血小板减少综合征,病死率较高,无特异性治疗手段及有效的疫苗[8]。IFN诱导的抗病毒蛋白IFITM l、IFITM2和IFITM3主要通过影响病毒入侵过程发挥作用[2-7,9]。研究这些IFITMs蛋白对SFTS病毒感染与复制的影响,或可加强对SFTS病毒侵入与感染细胞的机制的了解。目前国内外尚未有IFITM l、IFITM2和IFITM3对SFTS病毒相关作用的研究报道。
1材料与方法
1.1材料HEK293T细胞、THP-1细胞、VERO细胞均购自ATCC;SFTS病毒HB29毒株及pCAGEN载体由本室保存;DH5α感受态菌株购自全式金公司。胎牛血清(Fetal Bovine Serum, FBS)、DMEM及1640培养基、青链霉素(Penicillin Streptomycin, PS)、Ampicillin购自德国Gibco公司;IFN-α、PMA(Phorbol-12-myristate-13-acetate)、HRP标记羊抗兔IgG抗体、HRP标记羊抗鼠IgG抗体、FITC标记羊抗兔IgG抗体、鼠源β-Actin抗体购自Sigma公司;兔源IFITM1/2/3多克隆抗体购自Santa Cruz公司;ECL免疫印迹化学发光溶液购自PerkinElmer公司;RNA提取试剂盒、PCR产物胶回收试剂盒购自Qiagen公司;反转录试剂盒、细胞转染试剂盒购自美国Roche公司;内切酶XhoI、NotI购自美国NEB公司。T4 DNA连接酶、PCR扩增试剂盒购自日本TaKaRa公司;荧光定量PCR试剂盒购自Ambion公司;荧光定量PCR相关引物和探针交(上海)生工公司定制。
1.2IFITM1/2/3表达载体的构建用含有10%FBS、1%PS的DMEM培养基将IFN-α稀释至mg/ml,在5%CO2、37 ℃条件下刺激293T细胞24 h后收集并提取细胞总RNA,反转录为cDNA,PCR分别扩增IFITM1/2/3相应基因,所用引物如下:
IFITM1-F: ccgCTCGAGATGCACAAGGAGGAACATGAGG
IFITM1-R: tgtgGCGGCCGCCTAGTAACCCCGTTTTTCCTG
IFITM2-F: ccgCTCGAGATGAACCACATTGTGCAAACC
IFITM2-R: tgtgGCGGCCGCCTATCGCTGGGCCTGGACGACC
IFITM3-F: ccgCTCGAGATGAATCACACTGTCCAAACC
IFITM3-R: tgtgGCGGCCGCCTATCCATAGGCCTGGAAGATC
1.3重组载体转染细胞将重组质粒pCAGEN-IFITM1、pCAGEN-IFITM2、pCAGEN-IFITM3分别转染至Vero细胞和THP-1细胞(操作步骤参考 X-tremeGENE HP DNA Transfection Reagent说明书)。其中THP-1细胞在转染前,用含有2%FBS、1%PS的1640培养基将PMA稀释至mg/ml,在5%CO2、37 ℃条件下诱导分化48 h[10]。同时设空载体pCAGEN及空细胞对照。
1.4间接免疫荧光(Immunofluorescence, IFA)检测IFITM1/2/3的表达利用过表达IFITM l/2/3的Vero细胞及THP-1细胞制作抗原片,同时设空载体pCAGEN对照。加兔源IFITM1/2/3多克隆抗体(一抗,PBS 1∶100稀释)37 ℃孵育30 min。蒸馏水轻柔吹洗,加FITC标记羊抗兔IgG抗体(二抗,伊文斯蓝1∶200稀释)37 ℃孵育30 min。蒸馏水轻柔吹洗,置于荧光显微镜下观察结果。
1.5蛋白免疫印迹(Western Blot)检测IFITM1/2/3的表达重组质粒转染细胞48 h后,将细胞蛋白变性,上样进行SDS-PAGE凝胶电泳。分离的蛋白电转移至PVDF膜,5%脱脂奶封闭2 h,加兔源IFITM1/2/3多克隆抗体(一抗,5%脱脂奶1∶1000稀释)4 ℃过夜孵育。置于摇床用PBST洗30 min,加HRP标记羊抗兔IgG抗体(二抗,5%脱脂奶1∶5000稀释)孵育1 h。置于摇床用PBST洗30 min,化学发光ECL法显迹检测IFITM1/2/3表达。同时设空载体pCAGEN及空细胞对照,以β-Actin作为内参照。
1.6IFITM1/2/3对SFTS病毒感染的影响IFITM1/2/3表达载体分别转染Vero细胞及THP-1细胞48 h后,将SFTS病毒HB29毒株按0.1 MOI和1.0 MOI分别感染上述细胞。同时设置阴性对照(pCAGEN)及空白细胞对照。分别在感染病毒后12 h、24 h、48 h、72 h收集细胞并提取细胞总RNA(操作步骤参考 RNeasy Mini Kit说明书),利用real-time RT-PCR方法测定不同细胞、不同染毒量在不同时间点的病毒载量。以Human GAPDH作为内参照。
1.7统计学方法通过Dunnett-t检验比较实验组与对照组之间的差别,通过SNK-q检验比较各实验组之间的差别。当P<0.05时,认为差异有统计学意义。以上统计分析利用IBM SPSS statistics 20.0软件完成。
2结果
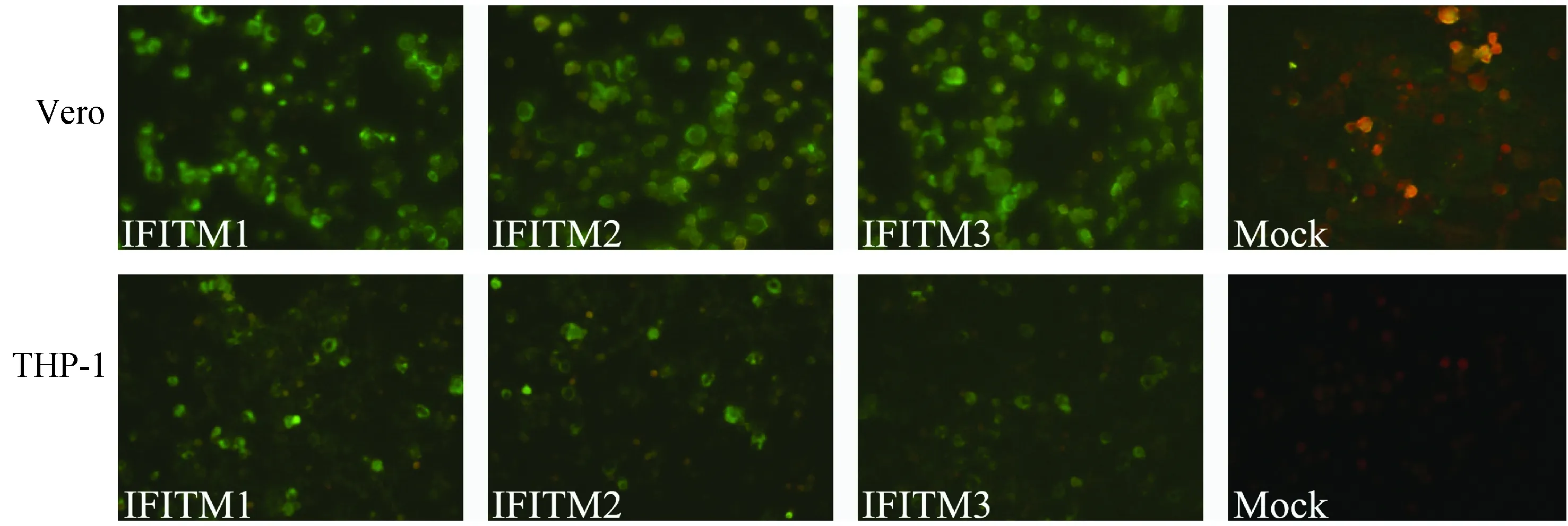
图1 间接免疫荧光检测IFITM1/2/3在细胞内的表达Fig.1 IFA test for intracellular expression of IFITM1/2/3
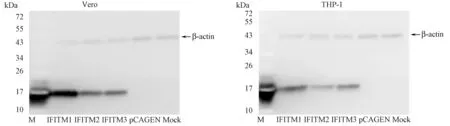
图2 Western Blot检测IFITM1/2/3在细胞内的表达Fig.2 Western blot detection for intracellular expression of IFITM1/2/3
2.1IFITM1/2/3的表达与鉴定IFN-α刺激293T细胞24 h后收集并提取细胞总RNA进行反转录及PCR扩增,琼脂糖凝胶电泳可见三段400 bp左右的条带,大小与预期相符;重组载体经双酶切鉴定显示片段已成功构建入表达载体pCAGEN;测序结果经DNA Star软件与GenBank中IFITM1/2/3基因序列比对,无突变。
重组质粒转染Vero细胞和THP-1细胞48 h后,分别对两种细胞进行IFA及Western Bolt检测。
IFA结果显示Vero和THP-1细胞均可见特异性绿色荧光(图1)。说明IFITM1/2/3在Vero和THP-1细胞中能够有效表达,且广泛分布在胞膜和胞浆内。据此结果并结合相关文献资料[2-7,9],可推断IFITM1/2/3不仅在细胞膜上发挥各种功能,还可能参与细胞内的各种活动。
Western Bolt检测结果可见三条16kDa左右的条带(图2),大小与预期相符,说明IFITM1/2/3在Vero和THP-1细胞中能够有效表达,且具有良好的抗体结合活性;空载体pCAGEN及空细胞对照未见目的条带表达。
2.2IFITM1/2/3抑制SFTS病毒的感染利用real-time RT-PCR测定不同细胞、不同染毒量在不同时间点的Ct值,并转换为TCID50值,分析IFITM1/2/3对SFTS病毒感染的抑制作用(图3)。Vero细胞各孔内参Human-GAPDHCt值的均值为19.72±0.35,变异系数CV=1.77%;THP-1细胞各孔内参Human-GAPDHCt值的均值为17.64±0.41,变异系数CV=2.32%;未见过大或过小的离群值,说明PCR数据未受到各孔内核酸浓度的影响,实验结果真实可信。Vero和THP-1细胞中过表达IFITM1、IFITM2和IFITM3的实验组TCID50值低于对照组(Dunnett-t检验,P<0.05,差异有统计学意义),实验组各组之间TCID50值没有明显差异(SNK-q检验,P>0.05,差异无统计学意义),即IFITM1、IFITM2和IFITM3对SFTS病毒在细胞内的感染及复制均有抑制作用,且作用大小没有显著区别。同时,分析数据可知:SFTSV感染细胞12 h~24 h时,0.1 MOI染毒剂量组内实验组与对照组的差异显著高于1.0 MOI染毒剂量组内的差异,但这种差异随感染时间的延长而减小。这说明在细胞感染早期,过表达的IFITM1/2/3对低剂量SFTS病毒感染有更为明显的抑制作用。
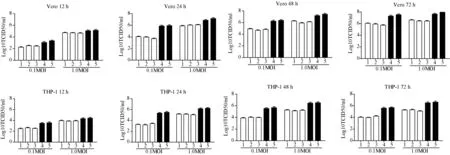
注:1、2、3分别表示转染IFITM1/2/3并染毒的细胞;4表示转染pCAGEN载体并染毒的细胞;5表示只染毒的细胞图3 IFITM1/2/3抑制SFTS病毒感染Note:1、2 and 3 represent cells transfected with IFITM1/2/3 and infected by SFTS virus; 4 represents cells transfected with pCAGEN vector and infected by SFTS virus; 5 represents cells infected by SFTS virusFig.3 IFITM1/2/3 inhibit SFTS virus infection
3讨论
作为人体天然免疫机制的重要组成部分,IFN对入侵人体的病毒并不直接发挥其抗病毒作用,而是通过诱导宿主细胞表达多种抗病毒蛋白(Antiviral protein, AVP)间接达到抗病毒效果。编码这些抗病毒蛋白的基因称干扰素刺激基因(IFN-stimulated genes, ISG),而IFITM蛋白家族就是ISG的一组表达产物[13]。人体内的IFITM蛋白家族成员有IFITM1、IFITM2、IFITM3和IFITM5。其中IFITM1、IFITM2和IFITM3与人体免疫相关,具有广谱的抗病毒活性,在体内多种组织和细胞中均有表达。
IFITM1/2/3的抗病毒活性具有一定选择性,且它们对同一种病毒的抑制作用亦有差别。对于形态相似,且包膜上均有相似糖蛋白的布尼亚病毒,IFITM1/2/3的抑制作用亦是如此:没有IFITMs能够抑制克里米亚一刚果出血热病毒(Crimean-Congo hemorrhagic fever virus, CCHFV),仅IFITM 2和IFITM3能够分别抑制RVFV[8]。作为我国新发现的布尼亚病毒,SFTS病毒是否受到IFITMs的抑制作用尚未明晰。鉴于此,本实验通过克隆并表达IFITM1/2/3,在细胞水平初步探索其对SFTS病毒感染的抑制作用。结果显示,IFITM1、IFITM2和IFITM3对SFTS病毒在细胞内的感染均有明显抑制作用,且作用大小没有显著区别。实验数据同时提示,在细胞感染早期,过表达的IFITM1/2/3对低剂量SFTS病毒感染有更为明显的抑制作用。这可能与IFITM1/2/3主要在细胞感染的早期阶段阻碍SFTS病毒与细胞受体结合或抑制SFTS病毒早期膜融合有关,具体机制还需进一步探索。
总之,本研究验证了IFITM1/2/3在细胞水平对SFTS病毒感染的抑制作用,为进一步探寻IFITM蛋白家族抑制病毒的机理、SFTS病毒感染细胞的机制及后续抗病毒药物的研发提供了基础。
4参考文献
[1]Duggal NK, Emerman M. Evolutionary conflicts between viruses and restriction factors shape immunity[J]. Nat Rev lmmunol, 2012, 12: 687-695. doi: 10.1038/nri3295. Epub 2012 Sep 14.
[2]Diamond MS, Farzan M. The broad-spectrum antiviral functions of IFIT and IFITM proteins[J]. Nat Rev Immunol, 2012, 13(1): 46-57. doi: 10.1038/nri3344. Epub 2012 Dec 14.
[3]Huang I C, Bailey CC, Weyer JL et al. Distinct patterns of IFITM-mediated restriction of filoviruses,SARS coronavirus, and influenza A virus[J]. PLoS Pathog, 2011, 7(1): e1001258. doi: 10.1371/journal.ppat.1001258.
[4]Wilkins C, Woodward J, Lau DT, et al. IFITM1 is a tight junction protein that inhibits hepatitis C virus entry[J]. Hepatology, 2013, 57:46l-469. doi: 10.1002/hep.26066. Epub 2012 Dec 12.
[5]Lu J, Pan Q, Rong L et al. The IFITM proteins inhibit HIV-1 infection[J]. J Virol, 201l, 85(5): 2126-2137. doi: 10.1128/JVI.01531-10. Epub 2010 Dec 22.
[6]Abraham L Brass, Huang IC, Benita Y, et al. The IFITM proteins mediate cellular resistance to influenza A Hl N1 virus, West Nile virus, and dengue virus[J]. Cell, 2009, 139(7): 1243-1254. doi: 10.1016/j.cell.2009.12.017.
[7]Mudhasani R, Tran JP, Retterer C, et al. IFITM2 and IFITM3 but not IFITM1 restrict Rift Valley fever virus[J]. J Virol, 2013,87(15): 845l-8464. doi: 10.1128/JVI.03382-12.
[8]李德新,发热伴血小板减少综合征布尼亚病毒概述[J].中华实验和临床病毒学杂志,2011,25(2):81-84. doi: 10.3760/cma.j.issn.1003-9279.2011.02.001.
[9]Li K, Markosyan RM, Zheng YM, et al. IFITM proteins restrict viral membrane hemifusion[J]. PLoS Pathog, 2013, 9: el003124. doi: 10.1371/journal.ppat.1003124. Epub 2013 Jan 24.
[10]Metz P, Dazert E, Ruggieri A, et al. Identification of type I and type II interferon-induced effectors controlling hepatitis C virus replication[J]. Hepatology, 2012, 56(6), 2082-2093. doi: 10.1002/hep.25908. Epub 2012 Oct 14.
通信作者:梁米芳,Email:mifangl@vip.sina.com
DOI:10.3760/cma.j.issn.1003-9279.2016.03.006
(收稿日期:2016-03-18)
Impact of interferon induced transmembrane proteins IFITM1/2/3 on SFTS virus infection
WanJia,ZhangShuo,LiAqian,QuJing,LiChuan,LiDexin,LiangMifang
NationalInstituteforViralDiseaseControlandPrevention,ChineseCenterforDiseaseControlandPrevention,Beijing102206,China.Correspondingauthor:LiangMifang,Email:mifangl@vip.sina.com
【Abstract】ObjectiveTo investigate the effect of IFITM1/2/3 on SFTS virus infection. Methods IFITM1/2/3 expression vectors were constructed by inserting corresponding genes into pCAGEN vector respectively and the expression of IFITM1/2/3 were detected by immunofluorescence assay (IFA) and Western Blot analysis. SFTS virus load at different time post infection on Vero and THP-1 cells that overexpressing IFITM1/2/3 were determined by quantitative real-time RT- PCR. ResultsHigh intracellular antibody binding activities of IFITM l/2/3 were observed by IFA and Western Blot assay. The results of real-time RT-PCR indicated that IFITM1/2/3 could significantly inhibit the infection of SFTS virus on the above two cell lines. Furthermore, at early stage of virus infection, the inhibition effects were more obvious for low dose infection. ConclusionsIFITM1/2/3 could effectively inhibit intracellular SFTS virus infection.
【Key words】IFITM1/2/3; SFTS virus; antiviral effect
