单增李斯特菌WaX12及其sigB缺失突变株在不同pH下生长动力学的比较
2016-08-08孙晓红潘迎捷
王 旭,孙晓红,潘迎捷,赵 勇*
(1.上海海洋大学 食品学院,上海201306;2.上海水产品加工及贮藏工程技术研究中心,上海201306;3.农业部水产品贮藏保鲜质量安全风险评估实验室(上海),上海 201306)
单增李斯特菌WaX12及其sigB缺失突变株在不同pH下生长动力学的比较
王旭1,2,3,孙晓红1,2,3,潘迎捷1,2,3,赵勇1,2,3*
(1.上海海洋大学 食品学院,上海201306;2.上海水产品加工及贮藏工程技术研究中心,上海201306;3.农业部水产品贮藏保鲜质量安全风险评估实验室(上海),上海 201306)
为了探究σB因子对单增李斯特菌(LM)的生长影响,比较了LM-WaX12及其sigma B缺失突变株在不同pH值下生长动力学的差异。作者运用重叠延伸PCR(SOE-PCR)和同源重组的方法构建缺失SigB基因的LM突变株WaX12-ΔsigB;利用sigB外围引物扩增其两侧片段鉴定突变株,并且通过修正的Logistic模型拟合两个菌株在不同酸碱度下(pH 5~9)的生长曲线,分析各生长参数之间的差异性。结果表明,单增李斯特菌sigB缺失突变株构建成功;WaX12-ΔsigB 和WaX12在pH 5的环境下最大比生长速率μmax、延滞期λ与最大菌浓MPD-OD均存在显著性差异(P<0.05),而在中性和碱性环境下二者无明显差异。
单增李斯特菌;σB因子;酸性环境;生长动力学参数
单增李斯特菌(Listeria monocytogenes)是一种人畜共患病食源性致病菌[1],在食品安全中处于 II型,属于严重危害级别,能引起人和动物的脑膜炎、败血症、流产等症状,是WHO公布的四大食源性致病菌之一[2],为典型的革兰氏阳性细菌,广泛存在于土壤、污水、动物性食品及饲草等环境中,主要通过消化道引起人和动物感染[3]。单增李斯特菌之所以能适应多种的生存环境,与其内部环境调节因子σ家族有密切关系[4]。
σ因子是sigma基因的编码产物,σ因子可结合在RNA核心酶上形成RNA聚合酶全酶,是RNA聚合酶的一个亚基。σ家族通过感受外界环境对自身控制的基因起到调节作用,主要是通过调控各基因的启动子来完成[5],其中σ家族中的σB因子是最重要的环境调控因子:σB由sigB基因编码,可使单增李斯特菌在多种逆境下生存,并且较快的适应外界环境[6]。根据不同的血清型,单增李斯特菌能在1~50℃,10%的盐溶液,pH值4.4~9.6[7]的范围内都可以生长,而且在一定的抗生素、光照、重金属等逆境中都可以生存[8-9]。Becker L等人验证了σB在稳定期对单增李斯特菌有明显的调控作用[10],而利用转录组学对σB操纵子进行研究,发现已经有105个σB正调控的基因和111个负调控的基因[11],而其中的有些基因分别调节单增李斯特菌在不同环境下的生长以及衰亡。
因此,作者利用本实验室从猪肉中分离的单增李斯特菌LM-WaX12菌株构建其SigB基因缺失菌株WaX12-ΔsigB,利用修正的Logistic模型拟合原始菌株与突变株的生长情况,探究σB因子在不同pH值下对单增李斯特菌的生长影响,为σB因子对单增李斯特菌在酸性环境中的调控作用奠定了分子基础。
1材料与方法
1.1菌株、仪器与试剂
WaX12:上海市芦潮港菜市场购买的生猪肉中分离的野生致病菌,血清型为4b,经过形态学分析、生化特性以及分子生物学鉴定,由上海海洋大学农业部水产品贮藏保鲜质量安全风险评估实验室保藏;Premix Taq酶、pMD-18T载体、限制性内切酶、PrimeScriptTMRT reagent反转录试剂盒:购自Takara;荧光定量SYBR Green Master:购自罗氏生物;脑心浸液培养基(BHI):购自北京陆桥;穿梭质粒pKSV7:由美国康奈尔大学Martin Wiedmann教授和浙江大学方维焕教授馈赠;Bioscreen C全自动微生物生长曲线分析仪:购自芬兰 Oy Growth Curves Ab公司;其他试剂均为进口分析纯。
1.2引物设计
根据 NCBI中已经公布的 L.monocytogenes ATCC 19117(NC_018584)全基因组序列,设计sigB基因的上游和下游序列的特异性引物,见表1,所有引物均由上海生工合成。

表1 引物名称和序列Table 1 Primers and sequences
1.3WaX12-ΔsigB缺失菌株的构建
1.3.1SigmaB基因的缺失提取LM-WaX12野生株的基因组,用psigB-1F和psigB-2R扩增包含了sigB基因ORF的整个上下游臂的片段 (sigB1F-2R);再用sigB-1F、sigB-1R和sigB-2F、sigB-2R分别扩增上下游同源臂sigB1F-1R和 sigB2F-2R(sigB1F-1R长440 bp,sigB2F-2R长427 bp);然后以sigB1F-1R和sigB2F-2R为模版,PrimeSTAR® HS(Premix)高保真酶对上下游臂再次扩增。利用SOE-PCR技术重叠融合上下游臂,扩增无sigB的片段 ΔsigB1F-2R,见图 1。随后构建重组质粒pMD18T-ΔsigB1F-2R,经过酶切验证结果正确。
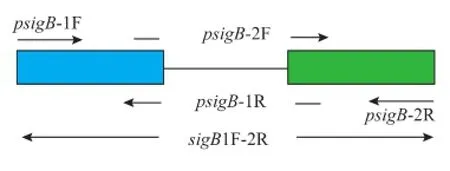
图1 单增李斯特菌sigB基因ORF的去除Fig.1 Cleavage of sigB gene open reading frame in L.monocytogenes
1.3.2穿梭载体的构建以及电转化pMD18TΔsigB1F-2R和pKSV7经过EcoRI、SalI双酶切,二者用T4连接酶连接,转入DH5α感受态细胞,构建重组质粒pKSV7-ΔsigB1F-2R。用HEPES缓冲液配置单增李斯特菌的感受态细胞,在其中加入重组穿梭质粒,电击后涂布在BHI琼脂培养基上,于30℃培养。挑取单菌落,进行菌液PCR鉴定后得到带有重组质粒的阳性菌。
1.3.3WaX12-△sigB缺失株的筛选与鉴定将带有重组质粒的阳性菌接种于含Cm(10 μg/mL)的液体BHI中,41℃传代6次,涂布于固体培养基上,培养出单菌落后挑取至30℃培养10 h,涂布于BHI+ Cm上,挑取单菌落分别接种于BHI和BHI+Cm固体培养基上过夜培养。为了去除穿梭质粒的干扰,以 sigB基因的外围序列设计引物 psigB-knockCHKf,psigB-knockCHKR,挑取可疑的单菌落进行菌液 PCR验证,获得缺失sigB的突变株WaX12-ΔsigB。
1.4WaX12和WaX12-ΔsigB不同pH值下生长情况将WaX12和WaX12-ΔsigB挑取单菌落至5 mL BHI液体培养基,37℃培养12 h至OD600约0.6(9lgCFU/mL),菌液进行10倍梯度稀释至104CFU/mL。在全自动微生物生长曲线分析仪配套的100微孔板中进行梯度稀释,分别吸取20 μL接种至180 μL不同浓度的BHI(用HCl和NaOH分别调至pH 4,pH 5,pH 6,pH 7,pH 8和pH 9)中,保证每孔中的菌落数为103CFU/mL。用将全自动微生物生长曲线分析仪设置为每30分钟读取OD600值一次,测定37℃下两株菌的生长曲线,每个菌株做3个孔平行。
1.5生物动力学参数的计算方法
应用微生物模型修正Logistic方程[12]拟合37℃下的生长曲线,并且计算出两株菌在不同pH值下的λ(λ为单增李斯特菌菌液的 OD600)达到Bioscreen C全自动微生物生长曲线分析仪可检测水平(107CFU/mL)时的时间(h);μmax为单增李斯特菌最大比生长速率(OD/h);MPD-OD为单增李斯特菌达到最大菌液浓度时候的OD600值。
修正Logistic方程:lgNt=A+C/(1+exp(-B(t-M)))
其中logNt是t时间(h)时的菌数OD值,A是初始菌数OD值,C是初始菌数和最大菌数之间OD值,M是达到相对最大生长速率的时间 (h),B是最大生长速率μmax,把修正 Logistic方程的A、C、B和M参数赋予微生物学意义,即λ为M-(2/B),MPDOD(最大菌浓)为A+C。
1.6数据处理
实验结果为3次重复的平均值,采用SAS 8.2进行实验数据的统计与分析,运用LSD法(P<0.5)比较生长动力学参数。
2结果与讨论
2.1SigmaB突变株的构建
2.1.1sigB-1F-2R全长的扩增以野生菌株WaX12的基因组为模版,以psigB-1F和psigB-2R为引物扩增得到与预期大小一致的1 647 bp的片段 (sigB基因上游臂440 bp,sigB基因下游臂427 bp和 sigB基因 780 bp),连接 pMD-18T,构建pMD18T-sigB-1F-2R,酶切验证见图2。结果表明含有sigB开放阅读框和上下游臂的这段DNA序列正确插入到pMD-18T中,表明pMD18T-sigB-1F-2R载体构建成功。
2.1.2pKSV7-△sigB穿梭载体的构建将sigB基因上游臂sigB-1F-1R(440 bp)和下游臂sigB-2F-2R片段(427 bp)分别连接 pMD-18T,获得pMD18T-sigB-1F-1R和pMD18T-sigB-2F-2R载体;再以两个载体为模版,用高保真酶分别扩增sigB-1F-1R和sigB-2F-2R片段。将两个片段经过重叠PCR得到缺失sigB的片段ΔsigB-1F-2R,见图3,结果大小与预测相符,为867 bp。
将ΔsigB-1F-2R与pKSV7连接,构建穿梭载体pKSV7-ΔsigB-1F-2R,酶切验证见图4。表明含有sigB上下游臂的DNA序列正确插入到穿梭载体pKSV7,pKSV7-ΔsigB构建成功,见图5。

图2pMD18T-sigB-1F-2R的酶切验证Fig.2 pMD18T-sigB-1F-2Rdigested by restriction endonuclease

图3 高保真酶扩增ΔsigB-1F-2R片段Fig.3 Amplification of ΔsigB-1F-2R
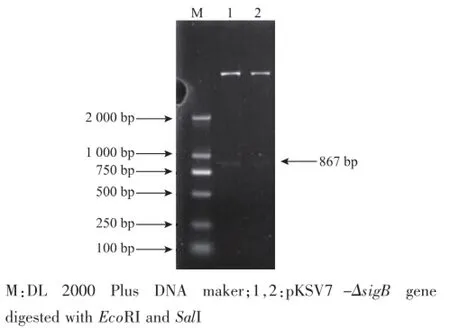
图4pKSV7-ΔsigB的酶切验证Fig.4 pKSV7-ΔsigB digested by restriction endonuclease
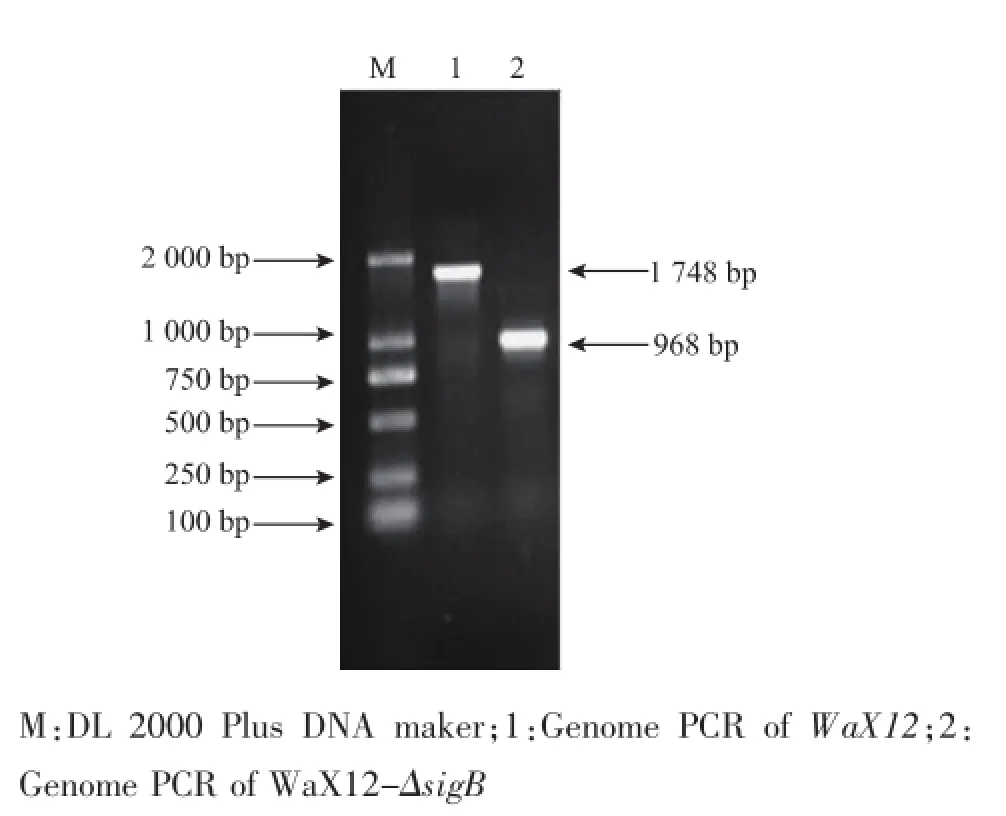
图5 重组菌的突变株鉴定Fig.5 Identification of recombinantmutation
2.1.3SigB缺失突变株的筛选与鉴定挑取电转化的单转化子并且过夜培养,用psigB-1F和psigB-2R为引物进行菌液PCR鉴定。挑取以上阳性转化子进行同源重组,筛选缺失菌株,见图6。提取疑似缺失单菌落 (在BHI+Cm上不生长但在BHI上生长,图中红框标出)的基因组DNA。以sigB基因的外围引物psigB-knockCHKf,psigB-knockCHKR为引物鉴定,筛选出缺失菌株命名为WaX12-ΔsigB。基因组PCR结果与预期值相符,用WaX12基因组扩增的结果为1 748 bp,而以缺失株WaX12-ΔsigB基因组扩增的结果为968 bp,鉴定了阳性菌为稳定传代,即同源重组成功,获得了WaX12-ΔsigB基因敲除突变株。
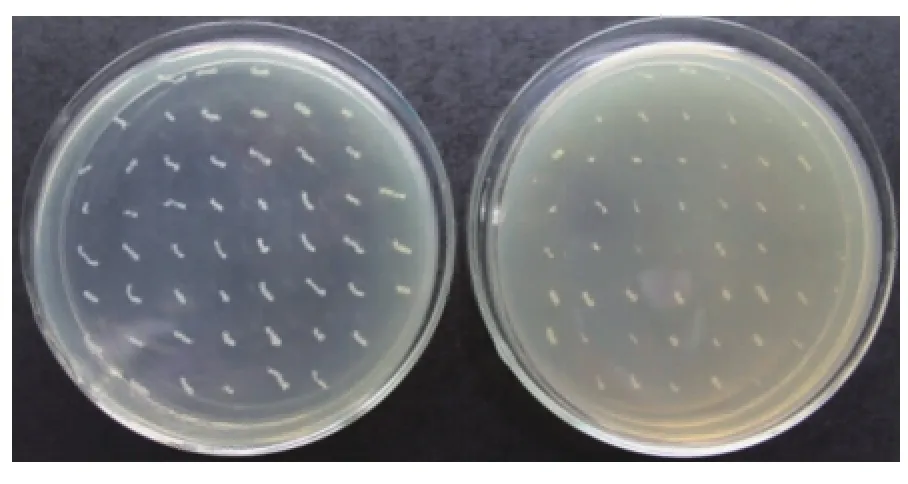
图6 疑似阳性sigB缺失突变株的筛选Fig.6 Screen of suspected sigB gene-knock mutant
2.2WaX12和WaX12-ΔsigB生长动力学比较
通过修正的Logistic生长模型拟合WaX12和WaX12-Δ sigB在不同pH值下(pH 5~9)的生长曲线,并根据拟合的生长曲线计算生长动力学参数最大比生长速率μmax、延滞期λ(h)和最大细菌浓度MPD-OD。结果表明,两株菌在pH 4的情况下均不能生长,而在pH 5~9的环境生长并能够用修正的
Logistic生长模型较好的拟合(R2>0.99)。
原始菌株与突变株在不同pH条件下的生长曲线与修正Logistic模型拟合的生长动力学参数见图7及表2。结果表明,pH 5条件下,两株菌的生长存在明显差异。通过模型拟合得到的λ(WaX12-ΔsigB)为20.543 h,而λ(WaX12)为17.934 h,表明突变株(WaX12-ΔsigB)的延滞期显著大于原始菌株(P<0.05)。此外,μmax(WaX12-ΔsigB)为0.065 OD/h,μmax(WaX12)为0.077 OD/h,表明突变株的最大比生长速率显著低于原始菌株(P<0.05)。同时,比较原始菌株与突变株的MPD-OD发现,MPD-OD(WaX12-ΔsigB)为 0.411,MPD-OD(WaX12)为 0.492,表明SigB的缺失显著降低了菌株的最大细菌浓度 (P<0.05)。上述结果进一步说明,细菌在低酸性条件(pH 5)下,σB因子对其生长具有重要的调控作用。而在pH 8和pH 9的条件下,原始菌株与突变株的生长不存在显著差异。

图7WaX12-ΔsigB与WaX12在不同pH值下的生长曲线Fig.7 Growth curve of WaX12-ΔsigB and WaX12 at different pH values

表2 WaX12-ΔsigB与WaX12在不同pH值下的3种生长动力学参数Table 2 Three different parameters of WaX12-ΔsigB and WaX12 at different pH values
单增李斯特菌SigmaB基因做为单增李斯特菌中应激环境变化的因子,在外界变化中存在调控作用,提高细菌适应外界环境变化的能力。修正的Logistic预测模型能够较好地拟合 WaX12以及WaX12-ΔsigB缺失突变株在不同pH值下的生长情况,两株菌的从pH 5到pH 7的生长速率都变快,延滞期变短,最大菌浓也上升,而从pH 7到pH 9的生长速率变慢,延滞期变长,最大菌浓下降,表明pH 7最适合两株菌的生长。但是在酸性情况下,WaX12-ΔsigB各参数之间与WaX12存在显著性差异,表明σB因子在pH 5下对生长最敏感,这与O'Driscoll等[13]人研究的单增李斯特菌亚致死有关,亚致死是生存与死亡的临界状态,相对于原始菌株有一定的细胞损伤,而在同样细胞受损的sigB基因缺失突变株,其适应环境的能力明显下降;FERREIRAA.[14]等人做了在pH 2.5的情况下,原始菌株比缺失sigB的突变株的耐酸能力有提高,并且在2 h之内原始菌株的衰亡率没有降低,而原始菌株和ΔsigB经过亚致死情况的驯化后,其适应环境的能力都有轻微提高,这为σB因子对LM亚致死机制的研究奠定了一定的分子基础。
同时,ATR(Acid Tolerance Response)是LM在受到酸刺激情况下所表现出的耐受因子,它可以增加LM的抗酸性,并且σB因子可以调控ATR的活性[15]。σB因子促使LM耐受酸性条件的作用机理可能是σB因子能调控一些与耐受酸性环境相关基因的表达,比如ATR、GAD等[16]。单增李斯特菌的GAD系统(谷氨酸脱羧酶,glutamate-decarboxylase)对细菌在胃液(pH 2.5)中的存活至关重要,而单增李斯特菌的σB因子亦与细菌在胃液(pH 2.5)中的存活相关[17],即σB因子可能参与调控GAD系统。这个系统除了GAD还有Glu/γ-氨基丁酸 (γ-aminobutyric acid,GABA)反向转运子,反向转运子起到了维持体内pH的恒定。LM中GAD由gadA,gadB和gadD基因编码,反向转运子由gadC和gadE基因编码,在基因gadCB和gadD启动子上游分别具有σB的结合位点[18-19]。从而使σB因子在酸性应激条件下,开始调控GAD系统基因的表达[20]。其中gadD基因中分为gadD1,gadD2和gadD3等,其中GadD2在单增李斯特菌受低酸中对其生长能力起到了主要作用[21]。σB因子则是在酸性环境中可以正调控gadD2和gadD3,缺失了σB因子的单增李斯特菌对酸性环境的适应能力有所降低。Wemekamp等人[22]将sigB缺失菌株与原始菌株同时在pH 4.5的酸中暴露1 h后,通过荧光定量的方法发现gadA的表达量几乎没有变化,而其余的gad家族的基因表达则减少,揭示了σB因子可能通过直接或间接的方式转录调控除gadA外的gad家族的表达来介导LM对酸性环境的耐受。由此机理看出,在低酸的情况下,sigB缺失株比原始菌株耐受环境的能力有所降低。而在高pH值下的结果表明,sigB缺失株对高pH值下的应激能力稍低于野生菌株,但是LM耐受碱的机制尚不明确[23]。
作者通过修正Logistic预测模型,更加直观的获得了WaX12-△sigB与WaX12在不同pH值下的生长动力学差异,但是本实验的不足之处在于没有将不同pH值与不同温度相互结合起来进行研究σB因子的敏感性,后续实验会对pH值和温度正交实验并逐步分析。
3结语
作者构建了敲除了SigmaB基因开放阅读框(ORF)的突变株WaX12-ΔsigB,通过修正的Logistic模型揭示了σB因子对LM应对环境反应过程中起到了重要的作用,得出在 pH 5的盐酸环境下,WaX12-ΔsigB和WaX12的最大比生长速率μmax、延滞期λ与最大细菌浓度MPD-OD均存在显著性差异,为下一步研究σB对LM在酸性环境下对毒力基因以及生长情况的调控作用提供了重要的分子理论依据。
[1]孟庆玲,乔军,才学鹏,等.单核细胞增多性李氏杆菌缺失株InlB的分子特性及及其表达和纯化研究 [J].微生物学报,2007,47(6):1098-1101. MENG Qinlin,QIAO Jun,CAI Xuepeng,et al.Molecular characteristics of InlB protein of Listeria monocytogenes wild strain and it's expression and purification[J]. Acta Microbiologica Sinica,2007,47(6):1098-1101.(in Chinese)
[2]Rocourt J,Benembarek P,Toyofuku H,et al.Quantitative risk assessment of Listeria monocytogenes in ready-to-eat foods:the FAO/WHO approach[J].Fems Immunology and Medical Microbiology,2003,35(3):263-267.
[3]罗勤,张晓莉,李兵,等.单核细胞增生李斯特菌PrfA蛋白转录调控毒力基因表达的分子机制[J].微生物学通报,2008,35 (2):275-280. LUO Qin,ZHANG Xiaoli,LI Bing,et al.Regulation of PrfA-dependent virulence genes expression in Listeria monocytogenes[J]. Microbiology China,2008,35(2):275-280.(in Chinese)
[4]Okada Y,Okada N,Makino S,et al.The sigma factor RpoN(σ54)is involved in osmotolerance in Listeria monocytogenes[J].Fems Microbiology Letters,2006,263:54-60.
[5]Van Schaik W,Abee T.The role of σBin the stress response of Gram-positive bacteria-targets for food preservation and safety[J]. Current Opinion in Biotechnology,2005,16(2):218-224.
[6]WiedmannM,Arvik T,Hurley R.et al.General stress transcription factor sigmaB and its role in acid tolerance and virulence of Listeria monocytogenes[J]. Journal of Bacteriology,1998,180(14):3650-3656.
[7]McClure P J,Roberts T A,Otto Oguru P.Comparison of the effects of sodium chloride,pH and temperature on the growth of Listeria monocytogenes on gradient plates and in liquid medium[J]. Letters in Applied Microbiology,1989,9:95-99.
[8]Ondrusch N,J Kreft.Blue and red light modulates SigB-Dependent gene transcription,swimming motility and invasiveness in Listeria monocytogenes[J].Plos One,2011,6(1):15-21.
[9]Palmer M,Wiedmann M,Boor K,et al.Sigma(B)and sigma(L)contribute to Listeria monocytogenes 10403S response to the antimicrobial peptides SdpC and Nisin[J].Foodborne Pathogens and Disease,2009,6(9):1057-1065.
[10]Becker L,Cetin M,Hutkins R,et al.Identification of the gene encoding the alternative sigma factor sigmaB from Listeria monocytogenes and its role in osmotolerance[J].Journal of Bacteriology,1998,180(17):4547-4554.
[11]Schaik V,Abee T.The role of σBin the stress response of Gram-positive bacteria-targets for food preservation and safety[J]. Current Opinion in Biotechnology,2005,16(2):218-224.
[12]Zwietering M H,Jongenburger L,Rombouts F M,et al.Modeling of the bacterial growth curve[J]. Applied and Environmental Microbiology,1990,56(6):1875-1881.
[13]O'driscoll B,GAHAN C G M,Hill C.Adaptive acid tolerance response in Listeria monocytogenes:isolation of an acid-tolerant mutant which demonstrates increased virulence[J].Applied and Environmental Microbiology,1996,62(5):1693-1698.
[14]Ferreira A,Sue D,O'Byrne,CP,et al.Role of Listeria monocytogenes sigmaB in survival of lethal acid conditions and in the acquired acid tolerance response[J]. Applied and Environmental Microbiology,2003,69(5):2692-2698.
[15]Werbrouck,H,Vermeulen A,Van Coillie E,et al.Influence of acid stress on survival,expression of virulence genes and invasion capacity into Caco-2 cells of Listeria monocytogenes strains of different origins[J].International Journal of Food Microbiology,2009,134(1):140-146.
[16]Neuhaus K,Satorhelyi P,Schauer K,et al.Acid shock of Listeria monocytogenes at low environmental temperatures induces PrfA,epithelial cell invasion,and lethality towards Caenorhabditiselegans[J].BMC Genomics,2013,14:285.
[17]Smith J L,Liu Y H,Paoli G C.How does Listeria monocytogenes combat acid conditions[J]. Canadian Journal of Microbiology.2013,59(3):141-152.
[18]Chaturongakul S,Kathryn J Boor.σBActivation under environmental and energy stress conditions in Listeria monocytogenes[J]. Applied and Environmental Microbiology,2006,72(8):5197-5203.
[19]Chaturongakul S,Raengpradub S,Wiedmann M,et al.Modulation of stress and virulence in Listeria monocytogenes[J].Trends in Microbiology,2008,16(8):388-396.
[20]Ferreira A,O'byrneC,Boor K J,et al.Role of σBin heat,ethanol,acid,and oxidative stressresistance and during carbon starvation in Listeria monocytogenes[J]. Applied and Environmental Microbiology,2001,67(10):4454-4457.
[21]Paul D C,Sheila R,Cormac G M G,et al.Presence of GadD1 glutamate decarboxylase in selected Listeria monocytogenes strains is associated with an ability to grow at low pH[J].Applied and Environmental Microbiology,2005,71(6):2832-2839.
[22]Wemekamp-kamphuis H H,Wouters J A,de Leeum P P L A,et al.Identification of sigma factor sigma(B)-controlled genes and their impact on acid stress,high hydrostatic pressure,and freeze survival in Listeria monocytogenes EGD-e[J]. Applied and Environmental Microbiology,2004,70(6):3457-3466.
[23]Singh v k,Schmidt J L,Jayaswal R K,et al.Impact of sigB mutation on Staphylococcus aureusoxacillin and vancomycin resistance varies with parental background and method of assessment[J]. International Journal of Food Microbiology,2003,21(3):256-261.
Comparison of Growth Kinetics of Listeria monocytogenes WaX12 and Dull sigB Mutant at Different pH Values
WANG Xu1,2,3,SUN Xiaohong1,2,3,PAN Yingjie1,2,3,ZHAO Yong1,2,3*
(1.College of Food Science and Technology,Shanghai Ocean University,Shanghai 201306,China;2.Shanghai EngineeringResearchCenterofAquatic-ProductProcessing&Preservation,Shanghai201306,China;3. Laboratory of Quality Safety Risk Assessment for Aquatic Products on Storage and Preservation(Shanghai),Shanghai 201306,China)
To explore the effect of σBin the growth of Listeria monocytogenes(LM),we compared the growth kinetics of LM-WaX12 and its dull sigB mutant at different pH values.We used splicing by overlap extension PCR(SOE-PCR)and homologous recombination to construct the sigmaB gene deleted mutant;The mutant was identified by the fragments that amplified by two sides primer of sigB.The growth curve of WaX12 and WaX12-sigB were fitted by modified Logistic model from pH 5 to pH 9,as well as both growth kinetic parameters were analyzed.The results showed the ΔsigB mutant was constructed correctly.The maximum exponential growth rate(μmax),lag phase duration(λ)and maximum population density(MPD-OD)of WaX12-ΔsigB and WaX12 had all significant difference(p<0.05)at pH 5,but had no different significant at neutral and alkali. Keywords:Listeria monocytgenes,σBfactor,acid stress stimulate,growth kinetic parameters
Q 78
A
1673—1689(2016)05—0477—08
2014-11-20
国家自然科学基金项目(31271870);上海市科委计划项目(14DZ1205100,14320502100,12391901300);上海市科技兴农重点攻关项目(沪农科攻字2014第3-5号)。
王 旭(1984—),男,安徽芜湖人,食品微生物博士研究生。E-mail:shouwainwang@126.com
赵勇(1975—),男,湖北英山人,理学博士,教授,硕士研究生导师,主要从事食品安全与食品生物技术方面的研究。E-mail:yzhao@shou.edu.cn
