IL-10基因修饰的未成熟树突状细胞在大鼠角膜移植排斥反应中的作用
2016-08-08孙建华
李 佳,李 雪,孙建华,李 兵
IL-10基因修饰的未成熟树突状细胞在大鼠角膜移植排斥反应中的作用
李佳1*,李雪1,2*,孙建华3,李兵1
注:*李佳和李雪对本文贡献一致。
1Department of Ophthalmology, the First Affiliated Hospital of Jinzhou Medical University, Jinzhou 121000,Liaoning Province,China;2Shenyang Aier Eye Hospital, Shenyang 110000, Liaoning Province, China;3Department of Otorhinolaryngology Head and Neck Surgery, Jinzhou Central Hospital, Jinzhou 121000, Liaoning Province, China
*Co-first authors:Jia Li and Xue Li.
Correspondence to:Bing Li. Department of Ophthalmology, the First Affiliated Hospital of Jinzhou Medical University, Jinzhou 121000, Liaoning Province, China. jzslibingv@163.com
Received:2016-03-02Accepted:2016-07-14
•AIM:Through the establishment of penetrating keratoplasty model of rats, to detect the role and its mechanism of immature dendritic cells with IL-10 gene modified.
•METHODS:Allogeneic penetrating corneal transplantation in rat model was performed. SD rats were randomly divided into positive control group, GFP-DC group, 8-DC and IL-10-GFP-DC group. At 3d before keratoplasty, the rats were given tail intravenous injection with the same amount of PBS, bone marrow 8-DC (DC had cultured for 8d) from donor Wistar rats, GFP-DC after 48h transfection and IL-10-GFP-DC. Rats were observed under slit-lamp for corneal graft cases every day, and recorded rejection index and corneal graft survival time. At 14d after keratoplasty, pathologic and immunohistochemical examinations were performed.
•RESULTS:Compared with GFP-DC group and 8-DC group, corneal graft survival time of IL-10-GFP-DC group was significantly longer (P<0.01); at 14d after keratoplasty, corneal opacity, edema, neovascularization and rejection index of IL-10-GFP-DC group were significantly lower (P<0.01). Pathological examination showed that in the three experimental groups corneal inflammation was lighter than the positive control group without significant central graft neovascularization. Immunohistochemistry showed: compared to the positive control group, GFP-DC group and 8-DC group, CD4+, CD8+, CD25+, IL-2+, NK+and NF-κB+positive cells in IL-10-GFP-DC group were lower(P<0.01).
•CONCLUSION: After donor-derived immature dendritic cells pretreated, corneal graft survival was significantly prolonged, successfully induced corneal transplantation tolerance. CD4+, CD8+, CD25+, IL-2+, NK+and NF-κB+positive cells are involved in corneal allograft rejection regulation, IL-10-GFP-DC may reduce CD4+, CD8+, CD25+, IL-2+, NK+and NF-κB+positive cell infiltration, inhibit corneal transplant rejection.
Citation:Li J, Li X, Sun JH,etal. Role and its mechanism of immature dendritic cells with IL-10 gene modified in rats after keratoplasty.GuojiYankeZazhi(IntEyeSci) 2016;16(8):1439-1443
摘要
目的:通过建立大鼠角膜穿透性移植模型,探讨IL-10基因修饰的未成熟树突状细胞在大鼠角膜移植排斥反应中的作用及其作用机制。
方法:建立大鼠同种异体穿透性角膜移植模型,将受体SD大鼠随机分为:阳性对照组、GFP-DC组、8-DC组及IL-10-GFP-DC组,分别于角膜移植术前3d尾静脉注射等量的PBS、供体Wistar大鼠骨髓源8-DC(培养8d的DC)、转染48h的GFP-DC及IL-10-GFP-DC。术后每天在裂隙灯下观察角膜植片情况,记录排斥反应指数及角膜植片存活时间,在移植术后第14d行各组角膜组织的病理学检查及免疫组织化学检查。
结果:IL-10-GFP-DC组角膜植片存活时间较GFP-DC组、8-DC组比较显著延长(P<0.01)。术后第14d时IL-10-GFP-DC组角膜植片的混浊、水肿、新生血管及排斥指数均显著降低(P<0.01)。病理组织学检查结果显示各实验组角膜植片的炎症反应较阳性对照组轻,植片中央未见明显新生血管。免疫组织化学结果显示:IL-10-GFP-DC组的CD4+、CD8+、CD25+、IL-2+、NK+及NF-κB+阳性细胞数量较阳性对照组、GFP-DC组、8-DC组减少,差异均具有显著统计学意义(P<0.01)。
结论:经过供体来源未成熟树突状细胞预处理的受体,角膜植片的存活时间显著延长,成功诱导角膜移植免疫耐受。CD4+、CD8+、CD25+、IL-2+、NK+及NF-κB+阳性细胞参与了同种异体角膜移植排斥反应的调控,IL-10-GFP-DC可降低CD4+、CD8+、CD25+、IL-2+、NK+及NF-κB+阳性细胞的浸润,抑制角膜移植排斥反应的发生。
关键词:IL-10;树突状细胞;穿透性角膜移植;移植排斥
引用:李佳,李雪,孙建华,等.IL-10基因修饰的未成熟树突状细胞在大鼠角膜移植排斥反应中的作用.国际眼科杂志2016;16(8):1439-1443
0引言
在我国,每年因角膜病致盲的患者约有400万,角膜病是我国目前主要致盲病因之一,已成为第二致盲眼病,角膜移植术是治疗顽固性角膜病的最终手段,但角膜移植术后的排斥反应仍然是角膜移植失败的主要因素,如何抑制排斥反应的发生已经成为角膜移植研究中亟待解决的关键问题[1]。目前研究表明诱导受体对供体器官产生免疫耐受是抑制移植排斥反应的最佳方法[2]。树突状细胞(dendritic cell,DC)是现在所知唯一的机体内专职的、功能强大的、诱导初始T细胞活化的抗原递呈细胞(antigen processing cell,APC),是适应性T细胞免疫应答的始动者[3]。未成熟的树突状细胞(immature dendritic cell,imDC)能够调节T细胞的反应能力,诱导其发生免疫耐受[4]。IL-10(Interleukin 10,IL-10)又叫细胞因子合成抑制因子,是由Th2淋巴细胞和单核细胞合成分泌的,在抗炎和抑制多种细胞因子合成方面发挥着重要的作用。据研究表明,IL-10能够抑制DC成熟,并且imDC又能够进一步分泌IL-10,从而放大imDC在诱导免疫耐受中的作用,形成反馈效应,从而延长移植物的存活时间[5-6]。本实验通过建立同种异体大鼠穿透性角膜移植模型,经过供体大鼠骨髓源树突状细胞对受体大鼠预处理的方法,观察移植术后各组角膜植片的存活情况及病理组织学变化,观察CD4+、CD8+、CD25+、IL-2+、NK+及NF-κB+的表达,从而探讨IL-10基因修饰的未成熟树突状细胞在大鼠角膜移植排斥反应中的作用。
1材料和方法
1.1材料健康SD大鼠52只,购自辽宁医学院实验动物中心;健康Wistar大鼠26只,购自中国医科大学实验动物中心,这两种大鼠重量均为200~250g,鼠龄6~8wk,雌雄不限。IL-10-GFP-Adenovirus(上海吉凯基因化学技术有限公司),CD4免疫组化试剂盒、CD8免疫组化试剂盒、CD25免疫组化试剂盒、IL-2免疫组化试剂盒、NK免疫组化试剂盒、NF-κB免疫组化试剂盒(北京博奥森生物技术有限公司),本实验的DC细胞的来源和培养主要通过利用大鼠淋巴细胞分离液及细胞因子诱生方法,提取大鼠骨髓源树突状细胞的前体细胞并进行培养[7]。
表1移植术后角膜植片各参数评分标准

角膜植片的临床观察情况评分角膜植片混浊0~4 植片完全透明0 植片透明度轻度丢失1 植片透明度中度丢失,虹膜血管可见2 虹膜血管窥视不清,但瞳孔可见3 瞳孔轮廓窥不清4角膜植片水肿0~2 无水肿0 中度水肿1 伴有植片增厚的显著水肿2角膜植片新生血管0~4 无新生血管0 新生血管在任何象限伸入达到植片半径的25%1 新生血管达到植片半径的50%2 新生血管达到植片半径的75%3 新生血管达到植片的中央4总积分10
1.2方法
1.2.1实验分组将培养第6d的DC分为3组:第1组继续原条件培养48h后(共培养8d),即为8-DC,收集细胞,PBS洗涤2次,调整细胞悬液浓度为2×106个/mL;另两组分别经GFP-Adenovirus、IL-10-GFP-Adenovirus转染48h后,收集细胞,PBS洗涤2次,调整细胞悬液浓度为2×106个/mL。以SD大鼠为受体,Wistar大鼠为供体,将受体SD大鼠随机分为4组,每组13例13眼。阳性对照组:术前3d受体鼠尾静脉注射PBS 1mL;GFP-DC组:术前3d受体鼠尾静脉注射GFP-DC细胞悬液1mL;8-DC组:术前3d受体鼠尾静脉注射8-DC细胞悬液1mL;IL-10-GFP-DC组:术前3d受体鼠尾静脉注射IL-10-GFP-DC细胞悬液1mL。
1.2.2建立角膜移植动物模型[8]术前15min术眼滴复方托吡卡胺滴眼液充分散瞳,腹腔注射10%水合氯醛进行全身麻醉,常规消毒。在手术显微镜下,用植片直径3.5mm的环钻在供体大鼠(术眼为双眼)角膜中央轻压形成压痕,用尖刀在压痕处刺入前房,使用显微角膜剪沿压痕环形剪下角膜,作为备用植片,放入0.9%氯化钠注射液中保存(保存时间不超过20min);使用植床直径3.0mm的环钻,按上述相同方法剪除受体大鼠(术眼为右眼)中央角膜,制作植床。将植片置于植床上,用10-0爱惜良尼龙线间断缝合8针,建立前房。术毕红霉素眼膏涂结膜囊内,缝合眼睑。术后第1d拆除眼睑缝线,术后每天用复方托吡卡胺滴眼液和氯霉素滴眼液滴眼3次至术后第10d。
1.2.3裂隙灯显微镜观察自术后第1d起每日在裂隙灯显微镜下对受体鼠术眼进行观察,以水肿、混浊和新生血管3项指标进行评分,参照Larkin等[9]评分标准(表1),3项评分之和为当日排斥反应指数(rejection index,RI),当RI≥5时,或者植片混浊一项达到3时视为排斥反应发生,记录角膜植片存活时间。
1.2.4组织病理学检查角膜移植术后第14d,各组随机抽取6只大鼠,术眼(右眼)全眼球摘除,正常SD大鼠3只,6眼为阴性对照,4%多聚甲醛固定,常规石蜡包埋,5μm切片,HE染色,镜检。

图1显微镜下观察移植术后第14d各组角膜植片的情况A:阳性对照组:角膜植片混浊、水肿,瞳孔窥不见,新生血管角膜长入植片中央,角膜植片发生排斥;B:GFP-DC组:角膜植片轻度混浊、水肿,新生血管长入植片边缘;C:8-DC组:角膜植片轻度混浊、水肿,新生血管长入植片边缘;D:IL-10-GFP-DC组:角膜植片透明,未见混浊、水肿,新生血管长入植片边缘。
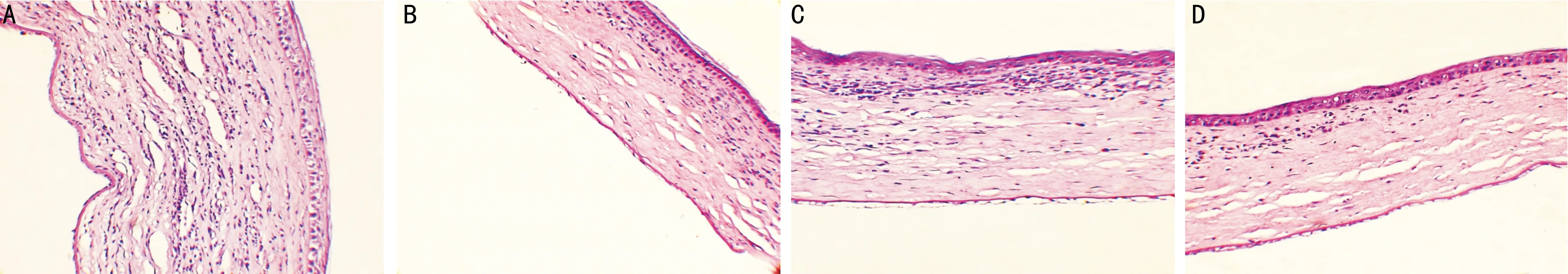
图2术后第14d各组角膜病理组织学HE染色(×200)A:阳性对照组:角膜植片明显水肿、增厚,植片可见大量炎细胞浸润并可见新生血管,基质层排列紊乱;B:GFP-DC组;C:8-DC组;D:IL-10-GFP-DC组。
1.2.5免疫组织化学检测石蜡切片常规脱蜡,微波修复抗原,灭活内源性过氧化物酶。滴加5% BSA封闭液,室温10~30min。滴加1∶200浓度稀释的一抗,4℃孵育过夜,PBS洗涤3次。滴加1∶200浓度稀释的二抗,37℃孵育30min。滴加试剂SP,DAB显色。苏木素复染、脱水、封片,光学显微镜下观察。设立阴性对照:以PBS代替一抗。进行图像分析:以×400图像输入。每张切片随机取5个视野,每个视野面积为0.2mm×0.2mm。阳性结果为细胞胞膜、胞浆或胞核呈棕黄色,计数单位视野内阳性细胞数。

2结果
2.1角膜植片存活时间各组角膜植片的存活时间GFP-DC组、8-DC组、IL-10-GFP-DC组与阳性对照组比较,植片存活时间明显延长,差异具有显著统计学意义(P<0.01);IL-10-GFP-DC组角膜植片存活时间显著长于GFP-DC组、8-DC组,有显著统计学意义(P<0.01);GFP-DC组与8-DC组比较,差异无统计学意义(P>0.05,表2,图1)。
2.2各组角膜植片参数结果术后第14d,GFP-DC组、8-DC组、IL-10-GFP-DC组与阳性对照组比较,角膜植片的混浊、水肿、新生血管及排斥指数均降低,差异具有显著统计学意义(P<0.01);IL-10-GFP-DC组与GFP-DC组、8-DC组比较角膜植片的混浊、水肿、新生血管及排斥指数均降低,差异具有显著统计学意义(P<0.01);GFP-DC组与8-DC组比较,差异无统计学意义(P>0.05,表3)。
2.3组织病理学检查结果术后第14d,阳性对照组角膜植片明显水肿、增厚,植片可见大量炎细胞浸润,并可见新生血管,基质层排列紊乱;GFP-DC组、8-DC组及IL-10-GFP-DC组角膜植片无明显水肿及增厚,且炎性细胞浸润较少,角膜结构基本正常,其中IL-10-GFP-DC组角膜植片改善最明显,炎性细胞最少(图2)。

表2 各组角膜植片存活时间 ±s,d)
注:aP<0.01vs阳性对照组;bP<0.01vsGFP-DC组;cP<0.01vs8-DC组。
2.4免疫组织化学检测结果应用细胞图像分析系统进行图像分析,以×400图像输入。每只眼随机取出1张切片,每张切片随机取5个视野,每个视野面积为0.2mm×0.2mm。阳性结果为细胞胞膜、胞浆或胞核呈棕黄色,计数单位视野内阳性细胞数。阳性对照组中、GFP-DC组、8-DC组及IL-10-GFP-DC组角膜植片中均存在CD4+、CD8+、CD25+、IL-2+、NK+及NF-κB+阳性细胞的表达,但其余三组阳性细胞数量明显较阳性对照组减少。IL-10-GFP-DC组CD4+、CD8+、CD25+、IL-2+、NK+及NF-κB+阳性细胞的数量最少,阳性对照组CD4+、CD8+、CD25+、IL-2+、NK+及NF-κB+阳性细胞的数量最多;GFP-DC组与8-DC组比较,结果无统计学意义(P>0.05);IL-10-GFP-DC组与GFP-DC组、8-DC组及阳性对照组比较,差异具有统计学意义(P<0.01,表4)。
3讨论
目前,角膜病已成为第2位致盲眼病,角膜移植仍然是目前治疗各种严重角膜疾病的最终途径,而免疫排斥反应是造成植片衰竭导致移植失败的主要原因[10]。如何避免排斥反应的发生是角膜移植研究中需要解决的关键问题,近来众多学者认为诱导受体对供体器官产生免疫耐受才是解决异体移植排斥反应的关键所在[11-13]。
DC是目前所知的机体内唯一的、专职的、功能强大的、诱导初始T细胞活化的APC,是适应性T细胞免疫应答的始动者[14-15]。IL-10主要是由Th2淋巴细胞和单核细胞合成分泌的,在抗炎和抑制多种细胞因子合成等方面发挥着重要的作用。大量的实验证明,IL-10修饰的DC可以明显降低心脏、肝、肾等移植术后的排斥反应,延长移植物的存活时间,诱导免疫耐受的发生[16-18]。
有研究表明,同种异体的角膜移植排斥反应是由T淋巴细胞为主所介导的迟发型超敏反应(delayed type hypersensitivity,DTH)[19],根据其表型的不同可分为:CD4+T细胞和CD8+T细胞。有研究学者在对大鼠角膜移植术后的排斥反应的病理组织学中发现,在移植排斥反应中,植片内有很多CD4+T细胞和CD8+T细胞的浸润[20-21]。CD4+Th主要负责介导细胞免疫应答,在器官移植排斥反应、抗感染及自身免疫性等疾病的诱导中起着重要的作用。CD25是效应性T细胞的重要标志[22],作为非特异性免疫系统重要组成部分之一的NK细胞与T淋巴细胞同属共同的祖细胞,与T细胞不同的是,NK细胞表面没有特异性抗原识别受体的表达。有实验表明,术前受体内NK细胞的清除可以明显延长动物异体心脏移植的存活时间[23]。1986年,Sen和Blaldwin最初在B细胞核的抽取物中发现了一种核蛋白因子,取名为NF-κB[24],在许多参与免疫和炎症反应物质的基因中,NF-κB均对其有诱导调控的作用[25],调控T淋巴细胞、B淋巴细胞和树突状细胞的生长、增殖及分化,在体液和细胞免疫中扮演着重要的角色[26],在器官移植排斥反应中也可能发挥着中心调控者的作用。


组别眼数混浊水肿新生血管排斥指数阳性对照组72.29±0.492.14±0.382.29±0.496.71±0.49GFP-DC组71.29±0.49b1.14±0.38b1.29±0.49b3.71±0.49b8-DC组71.57±0.54b1.14±0.38b1.14±0.70b3.86±0.38bIL-10-GFP-DC组70.71±0.49b,d,f0.57±0.54b,d,f0.43±0.54b,d,f1.71±0.49b,d,f
注:bP<0.01vs对照组;dP<0.01vsGFP-DC组;fP<0.01vs8-DC组。


组别眼数CD4+CD8+CD25+IL-2+NK+NF-κB+阳性对照组641.20±5.0738.00±2.9235.40±2.7038.60±2.3034.60±4.4569.80±5.22GFP-DC组629.40±2.07b23.60±2.19b20.80±3.35b23.60±2.41b23.20±3.90b43.00±5.48b8-DC组632.00±2.65b24.00±2.35b22.00±2.74b25.20±0.84b24.60±2.60b44.60±1.95bIL-10-GFP-DC组619.60±2.07b,d,f17.60±3.05b,d,f15.00±1.58b,d,f17.40±2.07b,d,f11.60±3.56b,d,f24.80±3.63b,d,f
注:bP<0.01vs对照组;dP<0.01vsGFP-DC组;fP<0.01vs8-DC组。
本实验室前期的研究通过细胞因子诱生法成功培养出大鼠骨髓源树突状细胞,已证实IL-10-GFP-Adenovirus转染可以抑制树突状细胞的成熟,GFP-Adenovirus对DC无影响。在本实验研究中,术后第14d我们对角膜植片行病理组织学检查及免疫组织化学检测,研究角膜移植术后角膜植片的病理学变化及植片中CD4+、CD8+、CD25+、IL-2+、NK+及NF-κB+阳性细胞数量的表达变化。病理组织学检查结果显示:GFP-DC组、8-DC组、IL-10-GFP-DC组与阳性对照组比较,植片存活时间明显延长(P<0.01),IL-10-GFP-DC组角膜植片存活时间显著长于GFP-DC组、8-DC组(P<0.01)。阳性对照组角膜植片明显水肿、增厚,植片可见大量的炎细胞浸润及新生血管,基质层排列紊乱,GFP-DC组、8-DC组、IL-10-GFP-DC组角膜植片无明显水肿及增厚,且炎性细胞浸润较少,角膜结构基本正常,其中IL-10-GFP-DC组角膜植片改善最明显,炎性细胞最少。免疫组织化学检测结果为:阳性对照组角膜植片中CD4+、CD8+、CD25+、IL-2+、NK+及NF-κB+阳性细胞的数量最多,说明诱导了排斥反应的发生,IL-10-GFP-DC组的阳性细胞数量较阳性对照组、GFP-DC组、8-DC组减少,差异均具有统计学意义(P<0.01)。在各实验组中可能由于imDC低表达MHCⅠ/Ⅱ类分子,并且缺乏免疫应答中所必需的CD40、B7(CD80、CD86)等共刺激分子和黏附分子,缺少激活T细胞免疫应答所必需的第二信号,不能有效激活T细胞,抑制了上述细胞的浸润,从而抑制排斥反应,可见imDC在诱导移植免疫耐受过程中具有重要作用。IL-10-GFP-DC组中,CD4+、CD8+、CD25+、IL-2+、NK+及NF-κB+的细胞数量最少、炎症反应最轻,并且角膜植片存活时间最长。由此可见,IL-10-GFP-DC在诱导角膜移植免疫耐受中更加具有优势。
本实验通过受体大鼠术前尾静脉注射经供体来源的imDC、GFP-Adenovirus、IL-10-GFP-Adenovirus转染的供体来源imDC能够延长角膜植片存活时间,能诱导角膜移植免疫耐受,结果显示IL-10-GFP-DC组诱导耐受效果最佳。CD4+、CD8+、CD25+、IL-2+、NK+及NF-κB+细胞参与了角膜移植排斥反应的调控,IL-10-GFP-DC可降低CD4+、CD8+、CD25+、IL-2+、NK+及NF-κB+阳性细胞的浸润,抑制角膜移植排斥反应的发生。本文探讨了IL-10基因修饰的树突状细胞在大鼠角膜移植中的作用,为诱导角膜移植免疫耐受提供实验依据。
参考文献
1苏海英,刁玉梅,李兵.L-10修饰的树突状细胞在大鼠角膜移植中的作用.国际眼科杂志 2011;11(4):588-590
2 Yashiro T, Kubo M, Ogawa H,etal. PU.1 suppresses Th2 cytokine expression via silencing of GATA3 transcription in dendritic cells.PloSOne2015;10(9):e0137699
3 Nakano T, Lai CY, Goto S,etal. Immunological and Regenerative Aspects of Hepatic Mast Cells in Liver Allograft Rejection and Tolerance.PLoSOne2012;7(5): e37202
4 Shen H, Heuzey E, Mori D,etal. Haptoglobin Enhances Cardiac Transplant Rejection.CircRes2015;116(10):1670-1679
5 Cherukuri A, Rothstein DM, Clark B,etal. Immunologic human renal allograft injury associates with an altered IL-10/TNF-α expression ratio in regulatory B cells.JAmSocNephrol2014;25(7):1575-1585
6姚向超,王延东,梁光江.环抱霉素A在眼科应用中的研究分析.当代医学 2011;27(17):151-152
7李雪,李兵. IL-10基因修饰的树突状细胞在大鼠角膜移植中的作用.辽宁医学院硕士学位论文2012
8 Kitamura N, Yokoyama H, Yashiro T,etal. Role of PU.1 in MHC class Ⅱ expression through transcriptional regulation of class Ⅱ transactivator pI in dendritic cells.JAllergyClinImmunol2012;129(3):814-824
9 Larkin DF,Calder VL,Lightman SL.Identification and characterization of cells infiltrating the graft and aqueous humour in rat corneal allograft rejection.ClinExpImmunol1997;107(2):381-391
10 Kusumesh R,Vanathi M.Graft rejection in pediatric penetrating keratoplasty: Clinical features and outcomes.OmanJOphthalmol2015;8(1):33-37
11 Yu T, Rajendran V, Griffith M,etal. High-risk corneal allografts: A therapeutic challenge.WorldJTransplant2016;6(1):10-27
12 Shaharuddin B, Ahmad S, Meeson A,etal. Concise Review: Immunological Properties of Ocular Surface and Importance of Limbal Stem Cells for Transplantation.StemCellsTranslMed2013;2(8):614-624
13 Stepp MA, Zieske JD, Trinkaus-Randall V,etal.Wounding the Cornea to Learn How it Heals.ExpEyeRes2014;121:178-193
14 Pindjakova J,Vitova A,Krulova M.Corneal rat-to-mouse xenotransplantation and the effects of anti-CD4 or anti-CD8 treatment on cytokine and nitric oxide production.TransplInt2005;18(7):854-862
15 Eom TY, Stanco A, Guo J,etal.Differential regulation of microtubule severing by APC underlies distinct patterns of projection neuron and interneuron migration.DevCell2014;31(6):677-689
16 Keubler LM, Buettner M, Häger C,etal. A Multihit Model: Colitis Lessons from the Interleukin-10-deficient Mouse.InflammBowelDis2015;21(8):1967-1975
17 Trifunovic J, Miller L, Debeljak Z,etal. Pathologic patterns of interleukin 10 expression -A review.BiochemMed(Zagreb) 2015;25(1):36-48
18 Holan V, Zajicova A, Javorkova E,etal.Distinct cytokines balance the development of regulatory T cells and interleukin-10-producing regulatory B cells.Immunology2014;141(4):577-586
19 Koorella C,Nair JR, Murray ME,etal.Novel Regulation of CD80/CD86-indu -ced Phosphatidylinositol 3-Kinase Signaling by NOTCH1 Protein in Interleukin-6 and Indoleamine 2,3-Dioxygenase Production by Dendritic Cells.JBiolChem2014;289(11):7747-7762
20 Xu XW, Ding BW, Zhu CR,etal. PU.1-silenced dendritic cells prolong allograft survival in rats receiving intestinal transplantation.WorldJGastroenterol2013;19:7766-7771
21 Bretscher PA. On the Mechanism Determining the Th1/Th2 Phenotype of an Immune Response, and its Pertinence to Strategies for the Prevention, and Treatment, of Certain Infectious Diseases.ScandJImmunol2014;79(6):361-376
22 Duggal NA, Upton J, Phillips AC,etal. An age-related numerical and functional deficit in CD19+CD24hiCD38hiB cells is associated with an increase in systemic autoimmunity.AgingCell2013;12(5):873-881
23 Weber M, Stein P, Prüfer S,etal. Donor and host B cell-derived IL-10 contributes to suppression of graft-versus-host disease.EurJImmunol2014;44(6):1857-1865
24 Alhabbab R, Blair P, Elgueta R,etal. Diversity of gut microflora is required for the generation of B cell with regulatory properties in a skin graft model.SciRep2015;5:115-119
25 Haas M, Sis B, Racusen LC,etal. Banff 2013 Meeting Report: Inclusion of C4d-Negative Antibody-Mediated Rejection and Antibody-Associated Arterial Lesions.AmJTransplant2014;14(2):272-283
26 Lee KM, Kim JI, Stott R,etal. Anti-CD45RB/Anti-TIM-1-Induced Tolerance Requires Regulatory B Cells.AmJTransplant2012;12(8):2072-2078
基金项目:辽宁省自然科学基金计划项目(No.2013022001)
作者单位:1(121000)中国辽宁省锦州市,锦州医科大学附属第一医院眼科;2(110000)中国辽宁省沈阳市,沈阳爱尔眼科医院眼科;3(121000)中国辽宁省锦州市中心医院耳鼻咽喉头颈外科
作者简介:李佳,博士,主治医师,研究方向:角膜及眼表疾病;李雪,硕士,医师,研究方向:角膜病。
通讯作者:李兵,博士,主任医师,教授,硕士研究生导师,研究方向:角膜移植、角膜及眼表疾病.jzslibingv@163.com
收稿日期:2016-03-02 修回日期: 2016-07-14
Foundation item:Project of Natural Science Foundation of Liaoning Province(No:2013022001)
DOI:10.3980/j.issn.1672-5123.2016.8.09
•KEYWORDS:Interleukin-10; dendritic cells; penetrating keratoplasty; transplant rejection
Role and its mechanism of immature dendritic cells with IL-10 gene modified in rats after keratoplasty
Jia Li1*, Xue Li1,2*, Jian-Hua Sun3, Bing Li1
Abstract
