不同测定时间SPAD值对估测叶绿素面积质量的影响1)
2016-08-08李改艳陈康康孙慧珍
李改艳 陈康康 孙慧珍
(东北林业大学,哈尔滨,150040)
不同测定时间SPAD值对估测叶绿素面积质量的影响1)
李改艳陈康康孙慧珍
(东北林业大学,哈尔滨,150040)
摘要以东北东部山区蒙古栎(Quercus mongolica)、五角槭(Acer mono)、春榆(Ulmus japonica)、水曲柳(Fraxinus mandshurica)、胡桃楸(Juglans mandshurica)、黄波椤(Phellodendron amurense)、白桦(Betula platyphylla)和紫椴(Tilia amurensis)8个阔叶树种为研究对象,通过SPAD-502叶绿素仪分析以上树种SPAD日变化特征,计算不同测定时间SPAD值估测叶绿素面积质量误差。结果表明:SPAD值日变化最大值75%出现在12:00—18:00,最小值近90%出现在04:00—06:00,变化率在2%~17%;SPAD最小值低估叶绿素面积质量误差达10%~20%,其他时间段误差在±9%内(除了蒙古栎春季)。叶片SPAD与光量子通量密度、叶绿素面积质量、叶面积质量、含水率相关性因树种和测定时期而异。建议该地区SPAD值测定时间最好在08:00—18:00。
关键词SPAD日变化;叶绿素面积质量;估计误差
叶绿素面积质量是森林生态学研究中极其基础,也是至关重要的生理参数。该指标不仅决定着树木吸收太阳辐射量,直接限制其光合潜力乃至其初级生产量[1],而且可敏感地指示树木体内营养状况[2-3]、生物[4]及环境胁迫[5-6]程度。因此,实时准确、快捷地获取叶绿素面积质量及其变化信息,不仅是提供树木与环境之间关系的重要信息需要,而且对森林生态系统结构功能动态管理及保护等具有重要现实意义。
叶绿素面积质量常采用分光光度法测定,该方法不仅费时费力无法进行连续观测,而且在样品运输、制备过程中因色素损失导致测定结果变异性较高[7]。近30a以来,随着手持式叶绿素仪问世,叶绿素测定技术有了进一步的发展,叶绿素仪通过记录叶绿素强烈吸收的650nm附近波长及940nm参考波长吸收率之差,得到无量纲数值代表叶绿素相对量。通过建立叶绿素面积质量与无量纲数值模型确定叶绿素绝对量。该方法具有使用简便、实时、无损等优势,尤其处理大量样品时,得到广泛应用[8-9]。
目前叶绿素仪型号主要有SPAD-502(Soil-PlantAnalysesDevelopment,MinoltaCameraCo.Ltd.,Japan)、CCM200(Opti-Sciences,Tyngsboro,MA,USA)、CL01(Hansatech,King’sLynn,Norfolk,England)和atLEAF(FTGreenLLC,Wilmington,DE),不同仪器吸收波长略有差异,但参考波长均为940nm,来弥补因叶片特性如叶绿素面积质量、叶厚及含水率等因素影响[10]。但事实上叶绿素仪读数因测定时间不同呈现早晚高、中午低,也有随着时间推移而升高的趋势,变化率在9%~23%之间[6,11-13],有的甚至高达35%[14]。而客观存在的叶绿素仪读数日变化对估测叶绿素绝对值的准确性还知之甚少。因此本文以东北东部山区8个阔叶树种为研究对象,以SPAD-502叶绿素仪为例,分析不同树种SPAD日变化特征,计算不同测定时间SPAD值估测叶绿素面积质量误差,为该地区合理使用SPAD-502叶绿素仪提供科学依据和实践指导。
1研究地概况
研究地设在东北林业大学帽儿山森林生态系统定位研究站。平均海拔400m,坡度10°~15°,地带性土壤为暗棕色森林土。气候属大陆性季风气候,夏季短促湿热,冬季寒冷干燥。年均降水量629mm,主要集中在6—8月,年均蒸发量约864mm,年均气温3.1 ℃,1、7月平均气温分别为-18.5、22.0 ℃;无霜期为120~140d[15]。试验树种为蒙古栎(Quercus mongolicaFisch.exTurcz.)、五角槭(Acer monoMaxim)、春榆(Ulmus japonica (Rehd.)Sarg.)、水曲柳(Fraxinus mandshuricaRupr.)、胡桃楸(Juglans mandshuricaMaxim.)、黄波椤(Phellodendron amurenseRupr.)、白桦(Betula platyphyllaSuk.)和紫椴(Tilia amurensisRupr)。
2材料与方法
2.1SPAD值及叶绿素面积质量测定
每个树种选取处于林缘或全光照下长势一致、生长状况良好的3株样树,分别于春季、夏季和秋季晴天标记各样树树冠中部南向外缘生长健康的5枚叶片,从04:00—18:00每2h采用SPAD-502叶绿素仪(MinoltaCameraCo.Ltd.,Osaka,Japan),避开叶脉,在叶片不同位置均匀测定8个SPAD值,取其均值代表该叶片数值。
完成SPAD测定的叶片,采用DMSO法测定叶绿素面积质量[16]。首先使用直径0.8cm打孔器在测定SPAD值的大致位置上,打取4~6枚圆片放入试管。然后加入10mL二甲基亚砜,在暗处65 ℃水浴30~60min,至叶片无绿色。取上清液在722N可见光分光光度计(上海精密科学仪器有限公司,中国)测定649、665nm吸光值。叶绿素面积质量按照Wellburnetal.[17]公式计算。
2.2叶面积质量、含水率测定及校正公式建立
每株样树摘取与测定SPAD大约同一位置的5枚叶片,装入有湿润滤纸的编号塑封袋内,带回实验室立即测定SPAD值及鲜质量(MF)后,利用T210扫描仪扫描(方正科技集团股份有限公司,中国),使用ImageJ软件分析叶面积(AL),最后将样品置于烘箱中65 ℃烘48h至恒质量,称干质量(MD)。叶面积质量(MA,mg·cm-2)和含水率(MC,%)分别依据下列公式计算:MA=MD/AL;MC=((MF-MD)/MF)×100%。
同时,在春、夏、秋季,各树种分别选取林下、林缘、开阔地不同生境共10株,于晴天上午08:00摘取样树树冠中部南向5枚叶片并编号。通过以上方法测得SPAD及叶绿素面积质量建立模型。
测定SPAD日变化当天的光量子通量密度数据来自生态站自动气象站每15min平均数据。
2.3数据分析
为了便于不同文献对比,SPAD变化率均采用((最大值-最小值)/最小值)×100%计算。通过单因素方差分析检验同一树种不同测定时间SPAD值、不同树种不同季节叶绿素面积质量、叶面积质量、含水率差异,通过方差齐性检验数据,采用LSD进行多重比较;未通过者,采用Tamhane’sT2方法检验。通过曲线拟合分别建立3个时期各树种叶绿素面积质量与SPAD最优方程,并计算不同时间叶绿素面积质量估测误差。误差=((估测值-实测值)/实测值)×100%。通过Pearson双变量对叶片SPAD值、单株SPAD值变化率与相应的光量子通量密度、叶绿素面积质量、叶面积质量和含水率进行相关分析。数据分析由SPSS19.0完成,图表绘制由SigmaPlot10.0实现。
3结果与分析
3.1不同树种SPAD值日变化特征
SPAD最大值出现时间因树种、季节而异(表1)。紫椴春季、蒙古栎夏季、胡桃楸、水曲柳、白桦和紫椴秋季最大值出现在08:00—10:00时,占25%,其余最大值出现在12:00—18:00,占75%。但最小值近90%在04:00—06:00出现,偶尔出现在08:00,且与04:00—06:00数值无差异。8个树种3个季节不同测定时间SPAD值约70%差异显著(P<0.05),变化率在9%~17%;水曲柳和紫椴春季、蒙古栎和五角槭夏季、胡桃楸秋季及黄波椤3个季节各时间点SPAD值差异不显著(P>0.05),变化率2%~7%。
3.2不同测定时间SPAD值对估测叶绿素面积质量影响
SPAD值日变化差异不显著的树种估测误差在-9%~9%之间(图1)。SPAD值日变化差异显著,变化率在9%~16%之间的五角槭和紫椴秋季、春榆和白桦春秋季、胡桃楸春季,误差在-8%~9%。其余季节各树种估测误差随树种和季节而异,但最大误差均出现在04:00—06:00,低估叶绿素面积质量达10%~20%,蒙古栎秋季、胡桃楸和紫椴夏季最大误差低估叶绿素面积质量11%~12%;春榆和水曲柳、白桦夏季最大误差低估叶绿素面积质量15%~18%;蒙古栎春季SPAD变化率最高(17%),其误差低估叶绿素面积质量达20%;其他时间点误差绝对值小于9%(除蒙古栎春季08:00)。

表1 8个阔叶树种不同季节SPAD值日变化特征
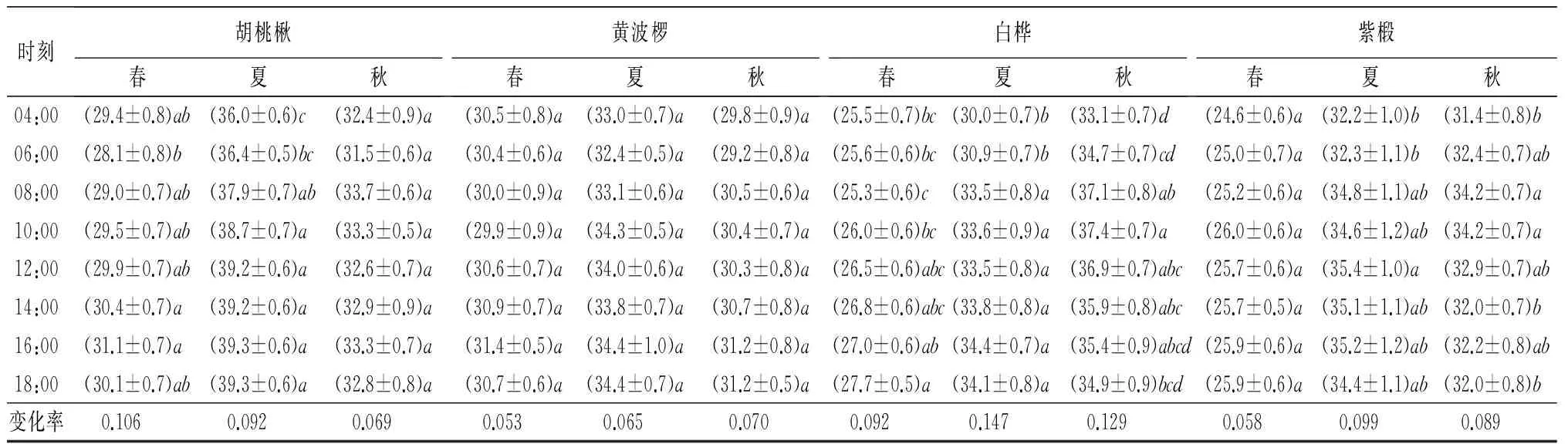
时刻胡桃楸春夏秋黄波椤春夏秋白桦春夏秋紫椴春夏秋04:00(29.4±0.8)ab(36.0±0.6)c(32.4±0.9)a(30.5±0.8)a(33.0±0.7)a(29.8±0.9)a(25.5±0.7)bc(30.0±0.7)b(33.1±0.7)d (24.6±0.6)a(32.2±1.0)b(31.4±0.8)b06:00(28.1±0.8)b(36.4±0.5)bc(31.5±0.6)a(30.4±0.6)a(32.4±0.5)a(29.2±0.8)a(25.6±0.6)bc(30.9±0.7)b(34.7±0.7)cd(25.0±0.7)a(32.3±1.1)b(32.4±0.7)ab08:00(29.0±0.7)ab(37.9±0.7)ab(33.7±0.6)a(30.0±0.9)a(33.1±0.6)a(30.5±0.6)a(25.3±0.6)c(33.5±0.8)a(37.1±0.8)ab(25.2±0.6)a(34.8±1.1)ab(34.2±0.7)a10:00(29.5±0.7)ab(38.7±0.7)a(33.3±0.5)a(29.9±0.9)a(34.3±0.5)a(30.4±0.7)a(26.0±0.6)bc(33.6±0.9)a(37.4±0.7)a(26.0±0.6)a(34.6±1.2)ab(34.2±0.7)a12:00(29.9±0.7)ab(39.2±0.6)a(32.6±0.7)a(30.6±0.7)a(34.0±0.6)a(30.3±0.8)a(26.5±0.6)abc(33.5±0.8)a(36.9±0.7)abc(25.7±0.6)a(35.4±1.0)a(32.9±0.7)ab14:00(30.4±0.7)a(39.2±0.6)a(32.9±0.9)a(30.9±0.7)a(33.8±0.7)a(30.7±0.8)a(26.8±0.6)abc(33.8±0.8)a(35.9±0.8)abc(25.7±0.5)a(35.1±1.1)ab(32.0±0.7)b16:00(31.1±0.7)a(39.3±0.6)a(33.3±0.7)a(31.4±0.5)a(34.4±1.0)a(31.2±0.8)a(27.0±0.6)ab(34.4±0.7)a(35.4±0.9)abcd(25.9±0.6)a(35.2±1.2)ab(32.2±0.8)ab18:00(30.1±0.7)ab(39.3±0.6)a(32.8±0.8)a(30.7±0.6)a(34.4±0.7)a(31.2±0.5)a(27.7±0.5)a(34.1±0.8)a(34.9±0.9)bcd(25.9±0.6)a(34.4±1.1)ab(32.0±0.8)b变化率0.1060.0920.0690.0530.0650.0700.0920.1470.1290.0580.0990.089
注:表中括号内数据为平均数±标准误;同列不同小写字母代表同一树种同一季节内不同测定时刻SPAD值的差异(P<0.05)。

图1 8个阔叶树种不同季节不同测定时间SPAD值估测叶绿素面积质量误差
3.3不同树种叶片指标及其与SPAD值、SPAD变化率相关性
8个树种叶绿素面积质量、叶面积质量夏季最高,含水率春季最高(表2)。除蒙古栎夏秋叶绿素面积质量高达57μg·cm-2,春榆、胡桃楸和五角槭夏季在40.0~41.3μg·cm-2,其他在16.1~37.4μg·cm-2。8个树种夏季水曲柳叶面积质量最高、其次为白桦,五角槭最低。8个树种春夏秋季叶片含水率分别在71%~78%、61%~68%、58%~69%。
不同时期8个树种叶片SPAD值与叶绿素面积质量呈显著正相关的占近70%(表3);与光量子通量密度、叶面积质量、含水率分别呈显著正相关、正相关、负相关,依次占50%、30%和20%。各树种3个季节合并数据与光量子通量密度相关不显著,与叶绿素面积质量呈显著正相关;除水曲柳,其余树种SPAD值与叶面积质量呈显著正相关、与含水率呈显著负相关。SPAD变化率与光量子通量密度、叶绿素面积质量、叶面积质量和叶片含水率相关性均不显著。

表2 不同树种叶片叶绿素面积质量、叶面积质量及含水率特征
注:表中数据为平均数±标准误;同行不同小写字母表示同一树种不同季节该指标的差异(P<0.05),同列不同大写字母表示同一季节不同树种该指标的差异(P<0.05)。

表3 SPAD值及单株SPAD变化率与光量子通量密度、叶绿素面积质量、叶面积质量、含水率相关系数
注:各季节各树种叶片SPAD值与光量子通量密度样本数均为8株;叶绿素面积质量、叶面积质量和含水率样本数均为15株;各季节各树种单株SPAD变化率与以上4个指标样本数均为24;** 、*分别代表0.01和0.05水平差异显著。
4结论与讨论
多项研究表明,SPAD值具有明显的日变化现象,其主要因素是太阳辐射及叶片特性,但研究结果却不尽相同。
首先使用叶绿素仪时,应考虑光照辐射这一重要因素。如温室冬小麦(Triticum aestivum)、白花酢浆草(Oxalis acetosella)和烟草(Nicotiana tabacumcv. Samsun)SPAD值随着光量子通量密度增强而下降,变化率分别为9%、18%、16%[11,13]。而温室烟草(光量子通量密度最大值70μmol·m-2·s-1,8h黑暗/16h光照)SPAD值随辐射增强而升高,变化率达14%[13],然而温室油菜canola(Brassica napus)、冬小麦(Triticum aestivum)、大麦(Hordeum vulgare)、马铃薯(Solanum tuberosum)和玉米(Zea mays)SPAD值并不受辐射的影响[18]。本文SPAD日变化与光量子通量密度具显著正相关的占近一半,这与Naušetal[13]研究结果一致。但除各测定时间SPAD值无显著差异的树种与光量子通量密度相关性不显著外,SPAD值差异显著、变化率9%~16%的春榆、胡桃楸和白桦(春季),白桦(夏季)、水曲柳和紫椴(秋季)也与光量子通量密度相关性不显著,即该树种该季节SPAD日变化对辐射并无响应,应考虑其他因素。
叶片特性包括叶绿素面积质量、叶面积质量和含水率。有研究表明辐射对SPAD值影响与叶片叶绿素面积质量有关。叶绿素面积质量高时,叶绿体随着辐射强度而移动其位置导致叶绿素分布不均匀,进而强烈影响SPAD值;而低叶绿素无此现象发生[8,11]。热带树种无隔囊木棉(Matisia cordata)和秘鲁橡胶树(Hevea guianensis)叶绿素分别为652、500mg·m-2,SPAD值随辐射增强而下降,变化率达11%~23%;而叶绿素低于357mg·m-2的拟龙血巴豆(Croton draconoides)和孪叶豆(Hymenaea courbaril)SPAD值并未随光强而发生变化[14]。但Martínezetal[12]发现温室及田间玉米叶绿素分别为16.1~17.5、20~21μg·cm-2,SPAD值随辐射增强而升高,变化率达8%、13%[12]。本文测定叶片8个不同位置读数的平均值代表叶片值[19-21],基本上消除了由于叶绿素分布不均匀对SPAD的影响。蒙古栎夏秋季叶绿素面积质量最高(57.7、57.1μg·cm-2),但SPAD变化率只有2%、9%;春榆、胡桃楸和五角槭夏季质量浓度在40.0~41.3μg·cm-2之间,SPAD变化率在5%~12%。而叶绿素面积质量最低的五角槭春季、水曲柳秋季变化率高于叶绿素高树种。
叶片含水率及叶片厚度影响光线透过叶片透射系数,进而影响叶绿素仪读数[22]。叶绿素仪已通过远红外940nm参考波长消除叶片含水率及叶厚的影响,但研究结果仍具有不确定性。已有研究表明SPAD值与叶片含水率正相关[23-24]、负相关[12,25-26],甚至两者间根本无关[14,27-28]。与叶面积质量也有正相关[24-25,29-33]、负相关[34]和无关[20,35-37]。本文中8个树种各季节SPAD值与叶面积质量、含水率相关性显著的仅占1/3、1/5。但总体数据除了水曲柳,其余树种SPAD值与含水率显著负相关,与叶面积质量显著正相关。即04:00—06:00间SPAD值较低可能与含水率有关。但单株SPAD变化率与以上4个因素均无明显关系。
对于SPAD日变化,尽管其影响因素较难区分,但基于研究对象、生境等因素的不同,有研究建议其测定时间应在06:00[25]、08:00—10:00[12]、10:00和12:00[13,38]、10:00—16:00[19],或黑暗环境[5]以获得准确稳定测定结果。而本文结果是尽管不同树种叶片特性在不同生长时期具有一定差异,但8个阔叶树种SPAD最小值多出现在04:00—06:00,导致误差低估叶绿素面积质量达10%~20%,其他时间段误差在±9%内(除了蒙古栎春季)。因此对于东北东部阔叶树种SPAD值适当的测定时间是08:00—18:00。
参考文献
[1]RICHARDSONAD,DUIGANSP,BERLYNGP.Anevaluationofnoninvasivemethodstoestimatefoliarchlorophyllcontent[J].NewPhytologist,2002,153(1):185-194.
[2]BERGAK,PERKINSTD.Evaluationofaportablechlorophyllmetertoestimatechlorophyllandnitrogencontentinsugarmaple(Acer saccharumMarsh)leaves[J].ForestEcologyandManagement,2004,200(1/2/3):113-117.
[3]CHANGSX,ROBISONDJ.NondestructiveandrapidestimationofhardwoodfoliarnitrogenstatususingtheSPAD-502chlorophyllmeter[J].ForestEcologyandManagement,2003,181(3):331-338.
[4]KAAKEHW,PFEIFFERDG,MARINIRP.Combinedeffectsofspireaaphid(Homoptera:Aphididae)andnitrogenfertilizationonnetphotosynthesis,totalchlorophyllcontent,andgreennessofappleleaves[J].JournalofEconomicEntomology,1992,85(3):939-946.
[5]ROSSINIM,PANIGADACMERONIM,etal.Assessmentofoakforestconditionbasedonleafbiochemicalvariablesandchlorophyllfluorescence[J].TreePhysiology,2006,26(11):1487-1496.
[6]SAMSONEI,ANDERSONEU,VIKMANEM,etal.Nondestructivemethodsinplantbiology:anaccuratemeasurementofchlorophyllcontentbyachlorophyllmeter[J].ActaUniversitatisLatviensis,2007,723:145-154.
[7]TORRESNETTOA,CAMPOSTRINIE,GONCJ,etal.Photosyntheticpigments,nitrogen,chlorophyllafluorescenceandSPAD-502readingsincoffeeleaves[J].ScientiaHorticulturae,2005,104(2):199-209.
[8]MARKWELLJ,OSTERMANJC,MITCHELLJI.CalibrationoftheMinoltaSPAD-502leafchlorophyllmeter[J].PhotosynthesisResearch,1995,46(3):467-472.
[9]PARRYC,BLONQUISTJ,BUGBEEB.Insitumeasurementofleafchlorophyllconcentration:analysisoftheoptical/absoluterelationship[J].PlantCellandEnvironment,2014,37(11):2508-2520.
[10]HAWKINSJA,SAWYERJE,BARKERDW,etal.UsingrelativechlorophyllmetervaluestodeterminenitrogenapplicationratesforCorn[J].AgronomyJournal,2007,99(4):1034-1040.
[11]HOELBO,SOLHAUGKA.EffectofirradianceonchlorophyllestimationwiththeMinoltaSPAD-502leafchlorophyllmeter[J].AnnalsofBotany,1998,82(3):389-392.
[12]MARTNEZDE,GUIAMETJJ.DistortionoftheSPAD502chlorophyllmeterreadingsbychangesinirradianceandleafwaterstatus[J].Agronomie,2004,24(1):41-46.
[13]NAUJ,PROKOPOVJ,EBEKJ,etal.SPADchlorophyllmeterreadingcanbepronouncedlyaffectedbychloroplastmovement[J].PhotosynthRes,2010,105(3):265-271.
[14]NASCIMENTOHCS,MARENCORA.SPAD-502readingsinresponsetophotonfluenceinleaveswithdifferentchlorophyllcontent[J].RevistaCeres,2010,57(5):614-620.
[15]WANGCK,HANY,CHENJQ,etal.SeasonalityofsoilCO2effluxinatemperateforest:Biophysicaleffectsofsnowpackandspringfreeze-thawcycles[J].AgriculturalandForestMeteorology,2013,177(15):83-92.
[16]HISCOXJD,ISRAELSTAMGF.Amethodfortheextractionofchlorophyllfromleaftissuewithoutmaceration[J].CanadianJournalofBotany,1979,57:1332-1334.
[17]WELLBURNA.Thespectraldeterminationofchlorophyllsaandb,aswellastotalcarotenoidsusingvarioussolventswithspectrophotometersofdifferentresolution[J].JournalofPlantPhysiology,1994,144(3):307-313.
[18]ZHUJJ,TREMBLAYN,LIANGYL.ComparingSPADandatLEAFvaluesforchlorophyllassessmentincropspecies[J].CanadianJournalofSoilScience,2012,92(4):645-648.
[19]UDDLINGJ,GELANG-ALLREDSSONJ,PIIKKIK,etal.EvaluatingtherelationshipbetweenleafchlorophyllconcentrationandSPAD-502chlorophyllmeterreadings[J].PhotosynthesisResearch,2007,91(1):37-46.
[20]WANGQB,CHENJJ,STAMPSRH,etal.CorrelationofvisualqualitygradingandSPADreadingofgreen-leavedfoliagePlants[J].JournalofPlantNutrition,2005,28(7):1215-1225.
[21]TORRESNETTOA,CAMPOSTRINIE,YAMANISHIOK,etal.Portablechlorophyllmeterforthequantificationofphotosyntheticpigments,nitrogenandthepossibleuseforassessmentofthephotochemicalprocessinCaricapapaya[J].BrazilianJournalofPlantPhysiology,2002,14(3):203-210.
[22]KNAPPAK,CARTERGA.Variabilityinleafopticalpropertiesamong26speciesfromabroadrangeofhabitats[J].AmericanJournalofBotany,1998,85(7):940-946.
[23]NIUG,RODRIGUEZDS,RODRIGUEZL,etal.Effectofwaterstressongrowthandfloweryieldofbigbendbluebonnet[J].Horttechnology,2007,17(4):557-560.
[24]HUNTER,DAUGHTRYCST.Chlorophyllmetercalibrationsforchlorophyllcontentusingmeasuredandsimulatedleaftransmittances[J].AgronomyJournal,2014,106(3):931-939.
[25]MARENCORA,ANTEZANA-VERAS,NASCIMENTOHCS.Relationshipbetweenspecificleafarea,leafthickness,leafwatercontentandSPAD-502readingsinsixAmazoniantreespecies[J].Photosynthetica,2009(2),47:184-190.
[26]FANIZZAG,RICCIARDIL,BAGNULOC.Leafgreennessmeasurementstoevaluatewaterstressedgenotypesinvitisvinifera[J].Euphytica,1991,55(1):27-31.
[27]LIYC,ALVAAK,CALVERTDV,etal.Arapidnondestructivetechniquetopredictleafnitrogenstatusofgrapefruittreewithvariousnitrogenfertilizationpractices[J].Horttechnology,1998,8(1):81-86.
[28]MIELKEMS,SCHAFFERB,LIC.UseofaSPADmetertoestimatechlorophyllcontentinEugenia unifloraL.leavesasaffectedbycontrastinglightenvironmentsandsoilflooding[J].Photosynthetica,2010,48(3):332-338.
[29]JIFONJL,SYVERTSENJP,WHALEYE.GrowthenvironmentandleafanatomyaffectnondestructiveestimatesofchlorophyllandnitrogeninCitrussp.Leaves[J].JournaloftheAmericanSocietyforHorticultural,2005,130(2):152-158.
[30]THOMPSONJA,SCHWEITZERLE,NELSONRL.Associationofspecificleafweight,anestimateofchlorophyll,andchlorophyllconcentrationwithapparentphotosynthesisinsoybean[J].PhotosynthesisResearch,1996,49(1):1-10.
[31]TSIALTASJT,MASLARISN.Leafphysiologicaltraitsanditsrelationwithsugarbeetcultivarsuccessintwocontrastingenvironments[J].InternationalJournalofPlantProduction,2012,6(1):15-36.
[32]GIUNTAF,MOTZOR,DEIDDAM.SPADreadingsandassociatedleaftraitsindurumwheat,barleyandtriticalecultivars[J].Euphytica,2002,125(2):197-205.
[33]YAMAMOTOA,NAKAMURAT,ADU-GYAMFIJJ,etal.Relationshipbetweenchlorophyllcontentinleavesofsorghumandpigeonpeadeterminedbyextractionmethodandbychlorophyllmeter(SPAD-502)[J].JournalofPlantNutrition,2002,25(10):2295-2301.
[34]DEMOTES-MAINARDS,BOUMAZAR,MEYERS,etal.Indicatorsofnitrogenstatusforornamentalwoodyplantsbasedonopticalmeasurementsofleafepidermalpolyphenolandchlorophyllcontents[J].ScientiaHorticulturae,2008,115(4):377-385.
[35]FANIZZAG,GATTAC,BAGNULOC.Anon-destructivedeterminationofleafchlorophyllinVitis vinifera[J].AnnalsofAppliedBiology,1991,119(1):203-205.
[36]COSTES,BARALOTOC,LEROYC,etal.AssessingfoliarchlorophyllcontentswiththeSPAD-502chlorophyllmeter:acalibrationtestwiththirteentreespeciesoftropicalrainforestinFrenchGuiana[J].AnnalsofForestScience,2010,67(6):6071-6075.
[37]FUXY,ZHOULY,HUANGJB,etal.Relatingphotosyntheticperformancetoleafgreennessinlitchi:Acomparisonamonggenotypes[J].ScientiaHorticulturae,2013,152(2):16-25.
[38]MIZUSAKID,UMEKIK,HONJOT.Developmentofmodelsforestimatingleafchlorophyllandnitrogencontentsintreespecieswithrespecttoseasonalchanges[J].Photosynthetica,2013,51(4):531-540.
第一作者简介:李改艳,女,1989年12月生,东北林业大学林学院,硕士研究生。E-mail:1106131938@qq.com。 通信作者:孙慧珍,东北林业大学林学院,副教授。E-mail:sunhz-cf@nefu.edu.cn。
收稿日期:2016年1月6日。
分类号Q945.79
EffectofSPADMeasurementTimeonEstimatingChlorophyllContentandItsRelatedFactors//
LiGaiyan,ChenKangkang,SunHuizhen
(NortheastForestryUniversity,Harbin150040,P.R.China)//JournalofNortheastForestryUniversity,2016,44(8):44-48,60.
WestudiedthediurnalcharacteristicsofSPADvalues,andcalculatedtheestimationerrorsfromdifferentmeasurementtimeofSPADusingtheportablenondestructiveopticalchlorophyllmetersSPAD-502forQuercus mongolica, Acer mono, Ulmus japonica, Fraxinus mandshurica, Juglans mandshurica, Phellodendron amurense, Betula platyphylla,andTilia amurensisinnortheastChina.ThediurnalmaximumSPADvaluesmostlyoccurredbetween12:00to18:00,andminimumvaluesin04:00-06:00,withthevariationin2%-17%incleardaysduringthegrowingseason.Minimumestimationerrorwere10%-20%foreighttreespecies,occurringin04:00-06:00,whileerrorwaswithin±9%duringtheothermeasurementtimeperiodexceptfortheSpringofQ. mongolica.ThecorrelationbetweenleafSPADandPPFD(photosyntheticphotonfluxdensity),chlorophyllcontent,LMA(leafmassarea),andLWC(leafwatercontent)wasnotconsistentwithtreespeciesandmeasurementperiod.TheSPADmeasurementtimewasbetterin08:00-18:00innortheastChina.
KeywordsDiurnal characteristics of SPAD; Chlorophyll content; Estimation error
1)国家自然科学基金项目(31300507);国家“十二五”科技支撑项目(2011BAD37B01)资助。
责任编辑:潘华。
