香樟CcCBFs基因的克隆及表达模式1)
2016-08-08李勇鹏张力维张佳佳陈慧茹曹玥华杜丽
李勇鹏 张力维 张佳佳 陈慧茹 曹玥华 杜丽
(南阳师范学院,南阳,47300)
香樟CcCBFs基因的克隆及表达模式1)
李勇鹏张力维张佳佳陈慧茹曹玥华杜丽
(南阳师范学院,南阳,47300)
摘要CBF转录因子又称为DREB1,在增强植物抵御非生物胁迫(低温、干旱和盐胁迫)方面具有重要的作用。利用同源克隆的方法结合RACE PCR技术,从香樟中获得2个CBF类似基因的cDNA全长序列,命名为CcCBFa和CcCBFb,其cDNA序列全长分别为909和941 bp,分别包含一个714和729 bp的开放阅读框,编码237和242个氨基酸;gNDA序列分析结果显示,CcCBFa和CcCBFb基因均不含有内含子。一系列生物信息学分析表明,CcCBFa和CcCBFb基因属于DREB家族的CBF/DREB1亚家族,将所获得香樟CBF基因cDNA全长序列提交到NCBI(登录号:KJ958932和KJ958933)。此外,实时定量PCR结果表明,CcCBFa和CcCBFb基因在香樟不同器官中的表达量存在一定差异,并且均能被低温、干旱、盐以及ABA强烈诱导。这些结果表明,CcCBFa和CcCBFb可能在香樟应对低温、干旱和盐等非生物胁迫时发挥重要作用,并且可能与ABA信号通路有关。
关键词香樟;CcCBF基因;非生物胁迫;RACE PCR;基因表达
植物由于不能像动物一样自由移动,它们不得不应对来自生长环境一系列不利因素的伤害,这些不利因素包括生物胁迫和非生物胁迫。非生物胁迫,主要包括低温、干旱和高盐胁迫,是影响植物生长、发育和产量的重要因素,并且决定了植物的地理分布,其中低温对植物的限制性影响最为深远[1-2]。为了应对各种各样的胁迫,植物经过漫长的进化,在形态、生理、生化和分子等方面做出了一系列适应性改变,使自身得以生存和繁殖[3]。植物在经过一段低温非冷冻处理后,抗寒性会显著增强,这就是植物的冷驯化(coldacclimation),植物的冷驯化是一个多基因参与的复杂过程。研究表明,当植物处于逆境时植物会激活或抑制大量具有不同功能的基因的表达,这些基因被分为两类,第一类基因主要是功能蛋白基因,表达一些可以减少逆境对植物伤害的保护蛋白,如胚胎晚期发育丰富蛋白、抗冻蛋白、分子伴侣,水通道蛋白膜转运蛋白以及合成有机渗透调节剂如脯氨酸、糖、糖醇和甜菜碱等的关键酶等;另一类基因主要是调节基因,通过调节多个下游基因的表达来抵御不良环境,如转录因子、蛋白激酶和光合作用相关的酶类[3-4]。
CBF(C-repeatBindingFactor)又称为DREB1(DehydrationResponsiveElementBindingFactor1)作为一种与冷驯化相关的转录因子,成为近年来植物抗寒研究的热点。CBF/DREB1蛋白可以特异地结合在COR(coldregulated)基因启动子的CRT/DRE(c-repeat/dehydration-responsiveelement)区域,从而调控多个低温相关基因的表达[5-8]。在拟南芥中DREB亚家族的蛋白又被分为6个小组,命名为A-1至A-6,A-1和A-2构成DREB亚家族中最大的两个组,其中CBF基因属于DREBA-1(DREB1)组主要与植物应对低温胁迫相关[9-10]。自从Stockingeretal[6]从拟南芥(Arabidopsis thaliana)中分离并鉴定了AtCBF1,研究者们已经从许多植物中克隆到了CBF/DREB1基因,包括大豆(Glycine max)、香瓜(Cucumis melo)、河北杨(Populus hopeiensis)、短柄草(Brachypodium distachyon),莴苣(Lactuca sativa)、杨树(Populus trichocarpa)、巨桉(Eucalyptus grandis)和盐地碱蓬(Suaeda salsa)等[11-18]。与CBF/DREB基因相关的大量研究表明,CBF/DREB1可能与一种逆境相关,也可能同时与多种逆境相关,并且当组成型表达该家族基因时,可以增强转基因植物对一种或多种胁迫的抵御能力[19-20]。可见,通过转化CBF/DREB1调节下游抗寒相关基因的表达,从而增强作物的抗寒性是可行的,这一发现为利用基因工程手段改良植物抗寒性提供了一条新思路。
香樟(Cinnamomum camphora)是亚热带常绿阔叶树种,因其树形优美,冠大荫浓经常作为行道树、庭荫树、孤植树等应用于城市的园林绿化中。成功地往北方地区引种香樟,不但可以丰富当地园林常绿树种种类,还可以改善北方城市的冬季园林景观。但是,香樟抗寒性差这一不良性状,使其地理分布和在园林绿化中的应用受到严重限制[21]。而通过选育或基因工程手段获得抗寒性增强的香樟新品种是解决这一问题的关键。本研究通过对香樟CBF基因进行克隆和表达模式分析,将有助于了解香樟抵御低温胁迫的分子机制,为进一步研究其功能和作为候选基因应用于香樟的遗传改良奠定基础,至今香樟CBF基因的相关研究尚未见报道。
1材料与方法
1.1试验材料
用于胁迫处理的试验材料为6月龄的生长在自然条件下的香樟实生幼苗,约30cm高,种植于直径约19cm的花盆中。进行胁迫处理试验前,先将幼苗置于培养箱适应1周,其培养条件为温度(25±1)℃,光照强度3 000lx,光照时间16h/d,相对湿度75%。干旱、盐和ABA处理前,幼苗置于培养箱中利用液体培养1周。根、茎和叶取材于本实验室温保存的香樟无性系组培苗,培养温度为(25±1)℃,光照强度2 500lx,光照时间16h/d。
1.2香樟CcCBF基因的克隆
采用EASYspinPlus植物RNA快速提取试剂盒提取香樟叶片(4 ℃处理4h)总RNA,并用DNaseI(ThermoFisherScientific,USA)去除样品可能污染的基因组DNA(gDNA)。RNA样品的浓度和质量通过琼脂凝胶电泳和NanoDrop2000(ThermoFisherScientific,USA)检测,合格的样品取2μg使用PrimeScriptII1ststrandcDNASynthesisKit(TaKaRa,大连,中国)试剂盒进行cDNA第一链的合成,作为PCR反应的模板。根据已公布的CBF基因核苷酸序列的保守区域设计一对简并引物CcCBF-F和CcCBF-R(表1),利用该对引物以上述cDNA为模板进行PCR扩增,PCR产物经纯化回收连接到pMD19-T上,转化大肠杆菌感受态细胞,将阳性克隆送往上海生工测序。
根据所获得中间片段设计两对引物5′CBFGSP1、5′CBFGSP2和3′CBFGSP1、5′CBFGSP,2(表1)按照RACE试剂盒SMARTTMRACEcDNAAmplificationKit说明书分进行基因的5′/3′区域的扩增。第一轮PCR的反应条件为:94 ℃预变性4min;94 ℃变性30s,62 ℃退火30s;72 ℃延伸1min30s,5个循环;94 ℃变性30s,65 ℃退火30s;72 ℃延伸1min30s,30个循环;72 ℃总延伸10min。扩增产物用去离子水1∶50稀释用于下一步nestedPCR的反应模板。反应条件为:94 ℃预变性4min;94 ℃变性30s,65 ℃退火30s;72 ℃延伸1min,32个循环;72 ℃总延伸10min。嵌套式PCR产物经检测和回收连接到克隆载体上并测序。
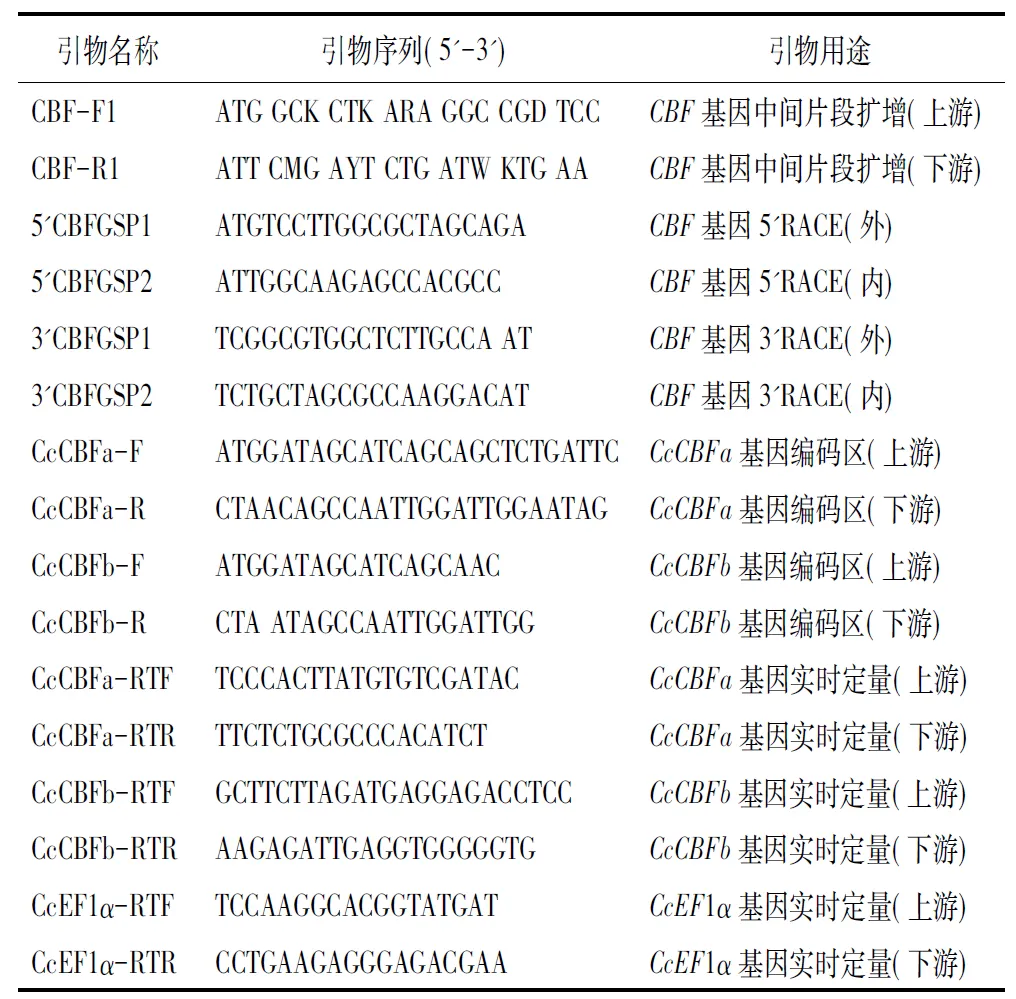
表1 实验中所用引物
注:简并碱基K(GT),Y(CT),M(AC),R(AG),D(GAT),B(GTC),H(ATC)。
1.3香樟CcCBF基因核苷酸序列、编码蛋白的氨基酸序列分析及系统进化树的构建
将测序获得的香樟CBF基因的核苷酸序列以及推导的相应氨基酸序列在NCBI网站利用BLAST在线分析工具(http://blast.ncbi.nlm.nih.gov/Blast.cgi)进行同源性分析,下载其他物种的CBF/DREB1氨基酸序列与所获得基因氨基酸序列进行多序列比对,利用Clustax2.0和MEGA5.0进行系统进化树的构建。
1.4低温胁迫处理
在人工气候箱25 ℃条件适应1周的香樟幼苗,置于同样规格的培养箱内4 ℃(除温度外其他条件保持一致)进行低温处理,分别于0、0.5、1、2、4、6、12、24、48和72h取叶片。
1.5干旱、盐和ABA处理
利用20%的PEG(polyethyleneglycol)6000溶液和250mmol/LNaCl溶液分别模拟干旱和盐胁迫环境,ABA是一种跟逆境相关的植物激素,处理浓度为100μmol/L,将在蒸馏水培养一周的幼苗分别置于相应溶液中进行处理,于0、0.5、1、2、4、6、12和24h取叶片。每个处理3株幼苗,每株幼苗,每个时间点取3个叶片用于试验重复,所有材料收获后立即用液氮速冻,并于冰箱-80 ℃保存用于RNA提取和qPCR分析。
1.6定量实时PCR(qPCR)分析及数据处理
cDNA样品用去离子水稀释后用于qPCR反应的模板,qPCR采用FastStartUniversalSYBRGreenMaster(Roche,Germany)荧光定量试剂盒在CFX96TM103实时PCR检测系统上(Bio-Rad,USA)进行,反应程序为:94 ℃预变性5min;94 ℃变性15s,60 ℃退火30s,72 ℃延伸1min,共40次循环;溶解曲线在65~95 ℃,每0.05s升高0.5 ℃。试验所用内参基因为香樟延伸因子基因CcEF1α[22],利用CFX96自带的Bio-RadCFXmanager2.0软件计算基因的相对表达量,每个样品重复3次。qPCR所用引物(表1)在用于定量PCR分析试验之前均将其扩增产物进行测序确保引物特异性。
1.7香樟CcCBF基因在不同器官中的表达差异
采用半定量RT-PCR技术,以根、茎和叶的cDNA样品为模板检测香樟CcCBF基因在不同器官中的差异性表达,香樟延伸因子基因CcEF1α作为内参。
2结果与分析
2.1香樟CcCBF基因的克隆和序列分析
简并引物CcCBF-F和CcCBF-R的扩增产物经测序获得一个147bp的基因片段,通过NCBI的BLAST工具分析该片段与DREB家族的基因有较高的同源性。将该片段与RACE所获得的5’/3’cDNA片段进行拼接,获得2个核苷酸序列高度相似的cDNA序列全长,分别为909和941bp,命名为CcCBFa和CcCBFb,并将2个香樟CBF基因cDNA序列全长提交到NCBI,登录号分别为KJ958932和KJ958933。为确保序列片段的拼接结果来自同一基因并验证基因内部是否含有内含子,研究设计了两对特异引物(表1),分别以cDNA和gDNA为模板利用PCR技术进行2基因开放阅读框ORF(openreadframes)区域的扩增(图1)。将扩增产物进行测序,CcCBFa和CcCBFb基因的ORF区域为714和729bp,分别编码237和242个氨基酸,由此可知,实验获得的2个序列确实来自不同的基因,并且均不含有内含子。在线分析软件Expasy(http://web.expasy.org/compute_pi/)预测其所编码蛋白的分子量为26.2和26.5ku,等电点为5.01和5.11。
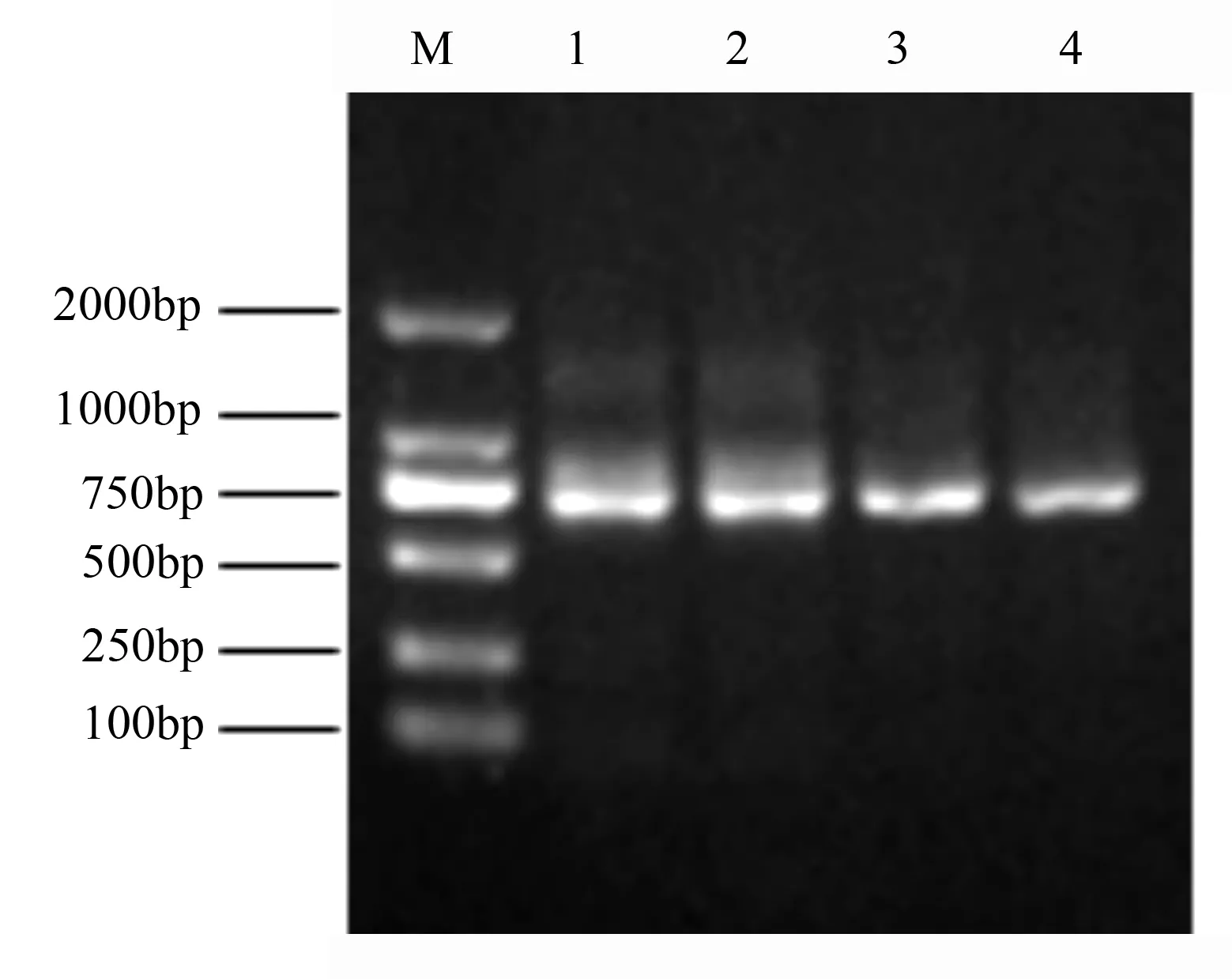
M.DNAmarker(DL2000);1、2.CcCBFa编码区扩增产物;3、4.CcCBFb编码区扩增产物;1、3以cDNA为模板,2、4以gDNA为模板。
图1CcCBFa和CcCBFb基因编码区PCR扩增电泳图谱
2.2香樟CcCBF与其他物种CBF/DREB1蛋白的同源性分析和系统进化树的构建
利用DNAMAN软件对香樟CcCBF基因推导的氨基酸序列和其他物种的DREB蛋白进行多序列比对(图2),结果表明,CcCBF与其他DREB蛋白有较高的同源性,CcCBFa和CcCBFb均含有1个AP2结构域,并且它们的AP2结构域只有一个氨基酸的差异。在其AP2结构域的两端含有CBF家族的典型的保守氨基酸序列:PKK/RPAGRxKFxETRHP和DSAW,并且CcCBF蛋白的AP2结构域中含有两个保守的分别位于第14位的缬氨酸残基V14和位于第19位谷氨酸残基E19。利用PredictProtein(https://www.predictprotein.org/)对他们的AP2结构域的二级结构进行预测,结果显示,其AP2结构域中含有3个β折叠和一个α螺旋。本研究所克隆的香樟CcCBFa和CcCBFb基因与拟南芥4个DREB1基因中的AtDREB1D(CBF4)基因的AP2结构域氨基酸序列最为相似,有3个氨基酸位点的差异,其中2个在AP2结构域的α螺旋位点,氨基酸位点的差异不影响其二级结构的形成。
为了进一步了解所克隆香樟CBF基因与其他物种CBF/DREB基因的进化关系,从NCBI下载了20个来自不同单子叶和双子叶植物的DREB1和DREB2蛋白的氨基酸序列,利用ClustalX2.0软件进行多序列比对,比对结果利用MEGA5.0软件建立系统进化树(图3),结果显示,DREB1和DREB2家族分为两支,并且同一家族中单子叶植物和双子叶植物也明显地各聚为一支,香樟CBF与DREB1与来自双子叶植物的DREB1基因亲缘关系较近,说明本研究所克隆的2个基因可能属于CBF/DREB1家族,可能跟其他DREB1基因有相似的功能,在香樟抵御胁迫的过程发挥一定的作用。

拟南芥AtDREB1A(NP_567720.1),AtDREB1B(NP_567721.1),AtDREB1C(NP_567719.1)和AtDREB1D(NP_200012.1);月季RhDREB1B(ACI42860.1);大麦HvCBF2(AAM13419.1);木薯MeCBF1(AAY43213.1);水稻OsDREB1B(AAN02488.1)。AP2结构域用黑色实线表示,黑色方框内为CBF蛋白标志性序列PKK/RPAGRxKFxETRHP和DSAWR,箭头指出的是DREB家族的两个保守氨基酸残基V14和E19,星状代表β折叠,三角状代表α螺旋。
图2香樟CBF蛋白与来自其他物种DREB蛋白的氨基酸序列比对
2.3香樟CcCBF基因在低温胁迫处理下的表达模式
利用qPCR技术研究了香樟CcCBF基因在低温胁迫下的表达模式,表达分析结果(表2)表明,低温(4 ℃)处理下,CcCBFa和CcCBFb的表达量均显著增加,并且2个基因具有相似的表达模式:在低温处理30min后,2个基因的表达即被诱导,表达量分别是对照(25 ℃)的7.9倍和3.1倍,随着低温处理时间的延长,2个基因的表达量呈逐渐增高的趋势,并且在低温处理6h的时候表达量达到最大值,表达量分别是对照的3808倍和1688倍,之后表达量开始降低,但在低温处理72h,2个基因的表达量仍为对照的17.2倍和9.8倍。表达分析结果表明,CcCBFa基因相对于CcCBFb基因,对低温诱导的响应更加显著,由此可知,CcCBFa基因在香樟抵御低温胁迫中可能发挥更重要的功能。
2.4香樟CcCBF基因在干旱、盐和ABA处理下的表达模式
干旱对CcCBFa和CcCBFb表达的诱导速度较为迅速(表3),在20%PEG溶液处理香樟幼苗30min时,这2个基因的表达量就有显著的提高,分别为对照(蒸馏水)的119倍和113倍,并且在胁迫进行1h即达到峰值,表达量分别为对照的152倍和150倍,而后随胁迫时间延长表达量开始下降,但在胁迫进行24h时,两基因的表达量有一个回升。CcCBFa和CcCBFb对盐胁迫的响应更为迅速,其表达量在胁迫处理30min就达到最大值,分别为对照(蒸馏水)的458倍和264倍,之后表达量开始下降(表4)。CcCBFa和CcCBFb对ABA的响应模式与干旱类似(表5),其表达量在处理1h达到峰值分别为对照的914倍和1183倍。以上结果表明,干旱、盐和ABA均可以诱导CcCBFa和CcCBFb基因的表达,并且这2个基因对ABA的反应较干旱和盐胁迫显著,上述研究结果意味着这2个基因可能与多种胁迫密切相关,参与到香樟抵御各种胁迫的过程中,并且可能与ABA介导的信号通路有关。
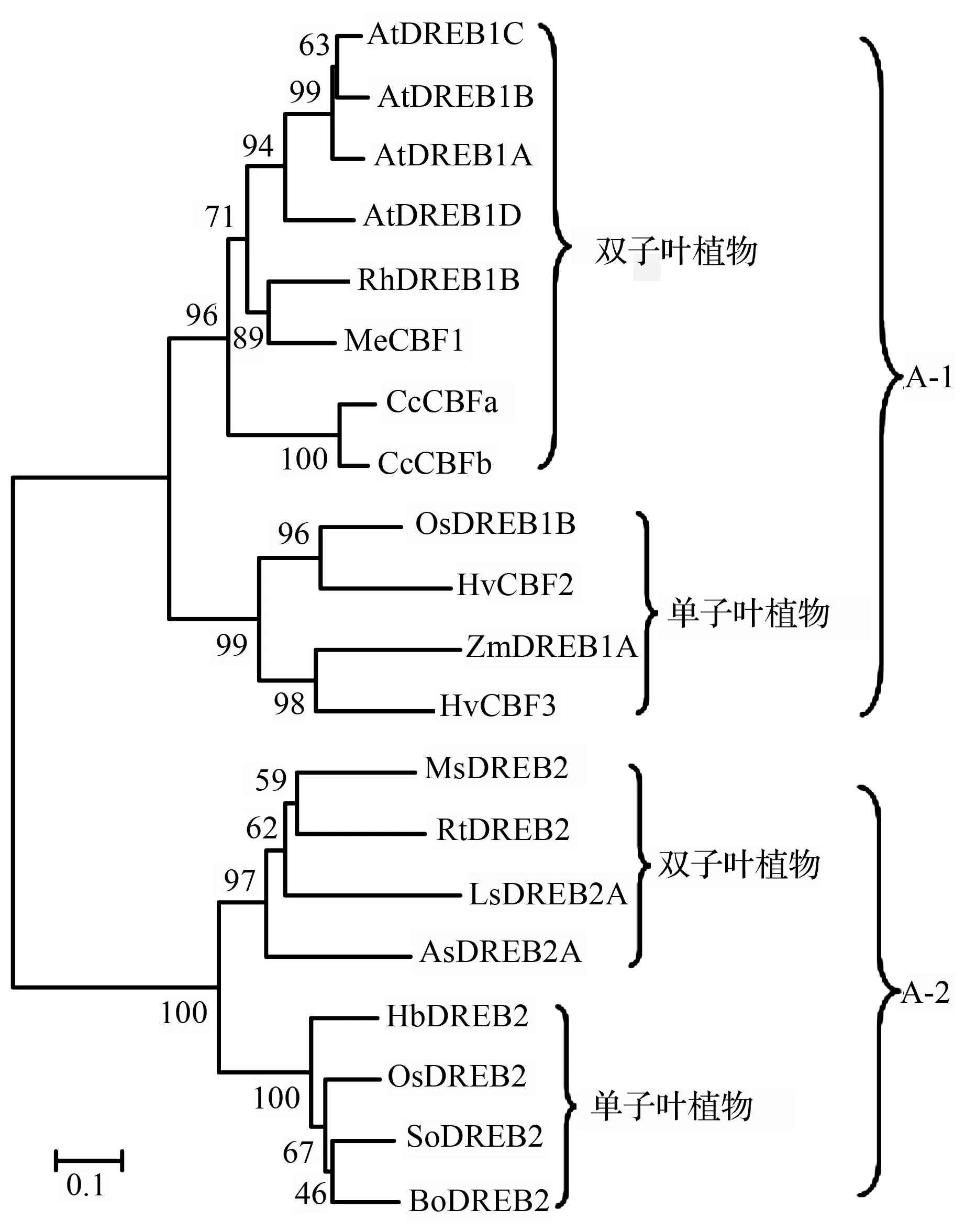
拟南芥AtDREB1A(NP_567720.1),AtDREB1B(NP_567721.1),AtDREB1C(NP_567719.1),AtDREB1D(NP_200012.1)和AtDREB2A(NP_001031837.1);月季RhDREB1B(ACI42860.1);木薯MeCBF1(AAY43213.1);水稻OsDREB1B(AAN02488.1)和OsDREB2(A2WL19.2);大麦HvCBF2(AAM13419.1)和HvCBF3(ABE02630.1);玉米ZmDREB1A(NP_001105651.1)和ZmDREB2A(BAE96012);新疆野苹果MsDREB2(AFS60111.1);大叶杨PtDREB2(ABO48361);莴苣LsDREB2A(BAO00821.1);甘蔗SoDREB2(AFV52020.1);野牛草BdDREB2(ABP52086.1)。
图3部分来自双子叶和单子叶植物的DREB1和DREB2蛋白的系统进化树
2.5香樟CcCBF基因的器官特异性表达分析
半定量RT-PCR分析结果(图4)表明,正常温度条件下,香樟CcCBFa和CcCBFb基因在根、茎和叶中均有一定程度的表达,但其在茎中的表达量相对较高。
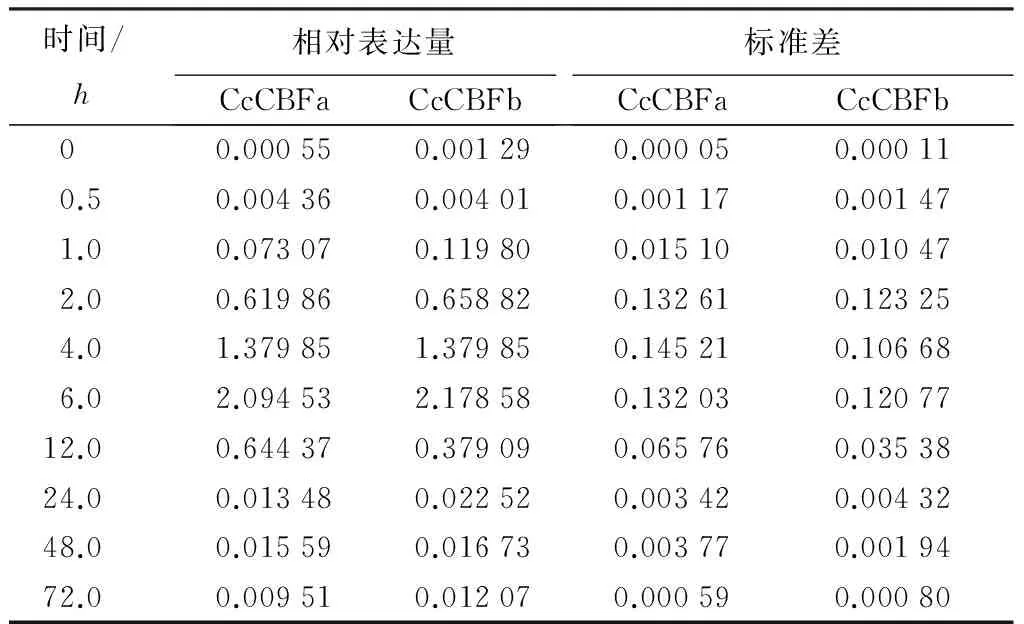
表2 CcCBFa和CcCBFb基因在低温处理下相对表达量
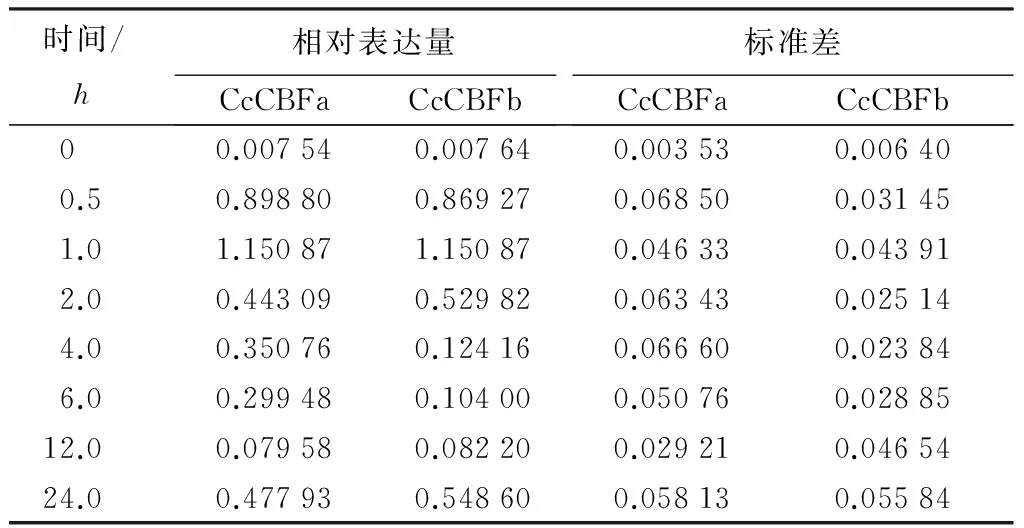
表3 CcCBFa和CcCBFb基因在干旱处理下相对表达量
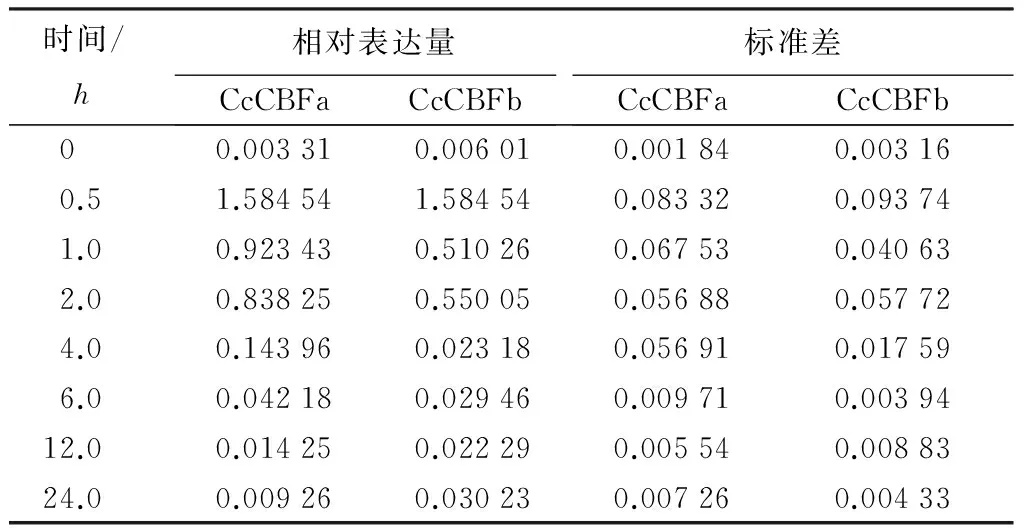
表4 CcCBFa和CcCBFb基因在盐处理下相对表达量
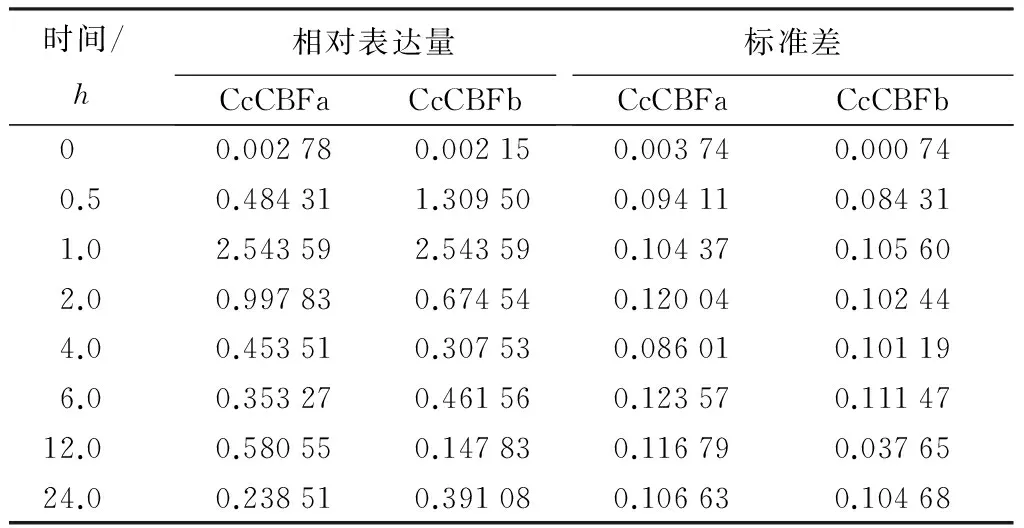
表5 CcCBFa和CcCBFb基因在ABA处理下相对表达量
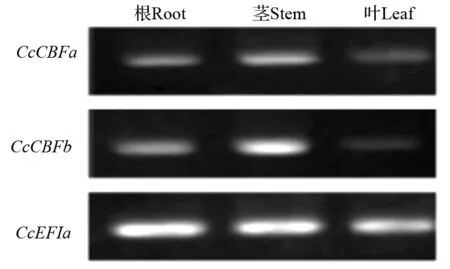
图4 CcCBFa和CcCBFb基因在香樟根、茎、叶中的表达
3结论与讨论
DREB转录因子在植物应对非生物胁迫时发挥重要的作用,本研究成功克隆了2个香樟CBF基因,CcCBFa和CcCBFb;氨基酸序列分析表明,2个香樟CBF基因1个AP2结构域,并且在AP2结构域的上下游含有CBF蛋白标志性序列PKK/RPAGRxKFxETRHP和DSAW,该序列被认为是CBF蛋白的特征序列[23]。而PKK/RPAGRxKFxETRHP被认为是CBF蛋白的核定位信号序列(NLS)[2,24],预示着香樟CBF基因可能作为一种转录因子在细胞核中发挥作用。另外,其AP2结构域中包含的V14和E19氨基酸残基在其识别和调节下游逆境相关基因的表达过程中起关键作用[9,25]。序列比对分析表明,CcCBFa和CcCBFb基因核苷酸序列与其编码蛋白的氨基酸序列相似度分别为84.49%和86.64%,说明了CBF基因家族的高度保守性,这也是为什么我们用同样的引物获得了2个不同的基因。
早先的研究曾指出,DREB1基因的表达主要被低温诱导,而不被干旱和盐胁迫诱导,而DREB2基因主要被干旱和盐胁迫诱导而不被低温诱导[10]。如来自黑麦草(Lolium perenne)的DREB1基因LpCBF3的表达只被低温诱导,而不被干旱、盐和ABA诱导[26];来自莴苣(L. sativa)的DREB2家族基因LsDREB2A可以被干旱和盐诱导,却不被低温、高温和ABA诱导[15]。近年来,随着科研工作者们对DREB家族基因研究的深入进行,发现DREB基因在不同植物中抵御胁迫时可能发挥不同的作用,如来自葡萄(Vitis amurensis)的DREB1家族基因VaCBF1基因不仅被低温诱导,而且可以被干旱和盐诱导[27];来自西红柿(Solanum lycopersicum)的DREB2基因LeDREB2不仅可以被干旱诱导,还可以被低温诱导[28]。ABA是一种与植物抵御逆境相关的植物激素,大量研究报道了ABA可以诱导DREB基因的表达[27,29]。因此,本研究探讨了所获得的2个CcCBF基因与ABA和多个胁迫因子包括低温、干旱和盐胁迫的相关性,结果表明该2个基因均能被上述4个影响因子所诱导,同样的结果可以在葡萄、巨桉等研究中发现[17,27]。并且2个基因的表达模式较为相似,从表达分析数据来看,CcCBFa在各个胁迫下的表达量与对照相比增加更为显著,可能在香樟应对胁迫过程中发挥更重要的作用。并且,正常条件下,2个基因在香樟根、茎和叶片中均有一定量的表达,并且茎中的表达量相对较高。以上结果表明,尽管CBF家族的基因在序列和结构上有较高的保守性,他们在不同物种应对胁迫时可能具有不同的信号转导途径。
本研究从香樟中成功分离到2个CBF基因,CcCBFa和CcCBFb,这2个基因均属于DREB家族的DREB1组,基于qPCR的表达分析显示,CcCBFa和CcCBFb基因均有响应低温胁迫的特征,并且与干旱、盐胁迫和ABA相关。此外,CcCBFa和CcCBFb基因在香樟不同器官中的表达量存在一定差异。研究结果有助于揭示香樟在冷驯化过程中的分子机制,并且为进一步创制抗寒性增强的香樟新种质提供一定的研究基础。香樟CBF基因下游基因的鉴定以及其在转基因水平上的应用将成为下一步研究的重点。
参考文献
[1]AKHTARM,JAISWALA,JAISWALJP,etal.Cloningandcharacterizationofcold,saltanddroughtinducibleC-repeatbindingfactorgenefromahighlycoldadaptedecotypeofLepidium latifoliumL[J].PhysiolMolBiolPlants,2013,19(2):221-230.
[2]AKHTARM,JAISWALA,TAJG,etal. DREB1/CBFtranscriptionfactors:theirstructure,functionandroleinabioticstresstoleranceinplants[J].JournalofGenetics,2012,91(3):385-395.
[3]GUOC,ZHANGJQ,PENGT,etal.StructuralandexpressionanalysesofthreePmCBFsfromPrunus mume[J].BiologiaPlantarum,2014,58(2):247-255.
[4]SANCHITA,DHAWANSS,SHARMAA.Analysisofdifferentiallyexpressedgenesinabioticstressresponseandtheirroleinsignaltransductionpathways[J].Protoplasma,2014,251(1):81-91.
[5]BAKERSS,WILHELMKS,THOMASHOWMF.The5′-regionofArabidopsisthalianacor15ahascis-actingelementsthatconfercold-,drought-,andABA-regulatedgeneexpression[J].PlantMolecularBiology,1994,24(5):701-713.
[6]STOCKINGEREJ,GILMOURSJ,THOMASHOWMF. Arabidopsis CBF1encodesanAP2domain-containingtranscriptionactivatorthatbindstotheC-repeat/DRE,acis-actingDNAregulatoryelementthatstimulatestranscriptioninresponsetolowtemperatureandwaterdeficit[J].ProceedingsoftheNationalAcademyofSciences,1997,94(3):1035-1040.
[7]THOMASHOWMF.MolecularBasisofPlantColdAcclimation:InsightsGainedfromStudyingtheCBFColdResponsePathway[J].PlantPhysiology,2010,154(2):571-577.
[8]YANGW,LIUXD,CHIXJ,etal.DwarfappleMbDREB1enhancesplanttolerancetolowtemperature,drought,andsaltstressviabothABA-dependentandABA-independentpathways[J].Planta,2011,233(2):219-229.
[9]SAKUMAY,LIUQ,DUBOUZETJG,etal.DNA-BindingspecificityoftheERF/AP2domainofArabidopsisDREBs,transcriptionfactorsinvolvedindehydration-andcold-induciblegeneexpression[J].BiochemicalandBiophysicalResearchCommunications,2002,290(3):998-1009.
[10]LIUQ,KASUGAM,SAKUMAY,etal.Twotranscriptionfactors, DREB1andDREB2,withanEREBP/AP2DNAbindingdomainseparatetwocellularsignaltransductionpathwaysindrought-andlowtemperature-responsivegeneexpression,respectively,inArabidopsis[J].PlantCell,1998,10(8):1391-1406.
[11]LIXP,TIANAG,LUOGZ,etal.SoybeanDRE-bindingtranscriptionfactorsthatareresponsivetoabioticstresses[J].TheorApplGenet,2005,110(8):1355-1362.
[12]MIZUNOS,HIRASAWAAY,SONODAAM,etal.IsolationandcharacterizationofthreeDREB/ERF-typetranscriptionfactorsfrommelon(Cucumis melo)[J].PlantScience,2006,170(6):1156-1163.
[13]王泽亮,秦鹏飞,郭洪英,等.河北杨CBF类基因的克隆及其进化[J].东北林业大学学报,2013,41(10):75-81.
[14]RYUJY,HONGSY,JOSH,etal.Molecularandfunctionalcharacterizationofcold-responsiveC-repeatbindingfactorsfromBrachypodium distachyon[J].BMCPlantBiology,2014,14(1):1-15.
[15]KUDOK,OIT,UNOY.FunctionalcharacterizationandexpressionprofilingofaDREB2-typegenefromlettuce(Lactuca sativaL.)[J].PlantCellTissOrganCult,2014,116(1):97-109.
[16]赵金玲,姚文静,王升级,等.杨树AP2/ERF转录因子家族生物信息学分析[J].东北林业大学学报,2015,43(10):21-29.
[17]魏晓玲,程龙军,窦锦青,等.巨桉EgrDREB2A基因结构及表达特性分析[J].林业科学,2015,51(2):80-89.
[18]SUNXB,MAHX,JIAXP,etal.MolecularcloningandcharacterizationoftwonovelDREBgenesencodingdehydration-responsiveelementbindingproteinsinhalophyteSuaeda salsa[J].Genes&Genomics,2015,37(2):199-212.
[19]TANGMJ,LIUXF,DENGHP,etal.Over-expressionofJcDREB,aputativeAP2/EREBPdomain-containingtranscriptionfactorgeneinwoodybiodieselplantJatropha curcas,enhancessaltandfreezingtoleranceintransgenicArabidopsis thaliana[J].PlantScience,2011,181(6):623-631.
[20]XUEY,WANGYY,PENGRH,etal.TranscriptionfactorMdCBF1geneincreasesfreezingstresstoleranceintransgenicArabidopsis thaliana[J].BiologiaPlantarum,2014,58(3):499-506.
[21]DUL,LIYP,YAOY,etal.Anefficientprotocolforplantletregenerationviadirectorganogenesisbyusingnodalsegmentsfromembryo-culturedseedlingsofCinnamomum camphoraL.[J].PLoSONE,2015,10(5):e0127215.
[22]张力维,李勇鹏,姚瑶,等.香樟延伸因子EF1α基因片段的克隆和表达分析[J].中南林业科技大学学报,2015,35(5):122-128.
[23]CarlosFC,RaquelR,IreneR,etal.UnravelingtherolesofCBF1,CBF4anddehydrin1genesintheresponseoftablegrapestohighCO2levelsandlowtemperature[J].JPlantPhyisiol,2013,169(7):744-748.
[24]PENGXJ,MAXY,FANWH,etal.ImproveddroughtandsalttoleranceofArabidopsis thalianabytransgenicexpressionofanovelDREBgenefromLeymus chinensis[J].PlantCellRep,2011,30(8):1493-1502.
[25]GUTTERSONN,REUBERTL.RegulationofdiseaseresistancepathwaysbyAP2/ERFtranscriptionfactors[J].CurrOpinPlantBiol,2004,7(4):465-471.
[26]XIONGYW,FEISZ.FunctionalandphylogeneticanalysisofaDREB/CBF-likegeneinperennialryegrass(Lolium perenneL.)[J].Planta,2006,224:878-888.
[27]DONGC,ZHANGZ,QINY,etal. VaCBF1fromVitis amurensisassociatedwithcoldacclimationandcoldtolerance[J].ActaPhysiolPlant,2013,35(10):2975-2984.
[28]GUOJ,WANGMH.ExpressionprofilingoftheDREB2typegenefromtomato(Solanum lycopersicumL.)undervariousabioticstresses[J].HorticultureEnvironmentandBiotechnology,2011,52(1):105-111.
[29]LIULQ,ZHUK,YANGYF,etal.Molecularcloning,expressionprofilingandtrans-activationpropertystudiesofaDREB2-likegenefromchrysanthemum(Dendranthema vestitum)[J].JPlantRes,2008,121(2):215-226.
第一作者简介:李勇鹏,男,1991年11月生,南阳师范学院生命科学与技术学院,硕士研究生。E-mail:daniel_lee1217@yeah.net。 通信作者:杜丽,南阳师范学院生命科学与技术学院,教授。E-mail:dldldlucky@163.com。
收稿日期:2015年12月22日。
分类号S943.2
CloningandExpressionProfilingofCcCBFGenesinCinnamomum camphora//
LiYongpeng,ZhangLiwei,ZhangJiajia,ChenHuiru,CaoYuehua,DuLi
(NangyangNormalUniversity,Nanyang473000,P.R.China)//JournalofNortheastForestryUniversity,2016,44(8):34-40.
Asanimportanttranscriptionfactor,C-repeatbindingfactor(CBF),alsocalleddehydration-responsiveelementbindingfactor1(DREB1),playsakeyroleinenhancingplanttolerancetoaboticenvironmentalstressessuchaslowtemperature,droughtandsalinity.TwonovelCBF-likegenesdesignatedasCcCBFaandCcCBFbweresuccessfullyisolatedfromCinnamomum camphora,andthefulllengthcDNAsequenceswere909and941bp,respectively.Theiropenreadingframes(ORF)were714and729bp,respectively,encoding237and242aminoacids.Therewasnointroninthecodingregionsofthetwogenes.Byanarrayofbioinformaticsanalysis,twogeneswereclassifiedintotheCBF/DREB1subfamily,andtheirfull-lengthcDNAsequencesweresubmittedtotheNCBIwithaccessionnumbersofKJ958932andKJ958933.ByqPCR, CcCBFaandCcCBFbcouldbedramaticallyinducedbylowtemperature,droughtandsalinity,aswellasABA,andtheexpressionlevelofthetwogeneshadspecificexpressiondifferencesindifferentorgansofC. camphora.Therefore, CcCBFaandCcCBFbwereinvolvedinresponsetocold,drought,salinity,andABA-responsivesignalingpathway.
KeywordsCinnamomum camphora; CcCBF; Abiotic stress; RACE; Gene expression
1)国家自然科学基金项目(31100511)。
责任编辑:潘华。
