多倍体萱草的离体快繁技术1)
2016-08-08尹立辉武术杰刘亚亮温娜王丽兰王雪松
尹立辉 武术杰 刘亚亮 温娜 王丽兰 王雪松
(长春大学,长春,130012) (吉林省技秾种业有限公司) (中邦园林股份有限公司)
多倍体萱草的离体快繁技术1)
尹立辉武术杰刘亚亮温娜王丽兰王雪松
(长春大学,长春,130012)(吉林省技秾种业有限公司)(中邦园林股份有限公司)
摘要以多倍体萱草的嫩叶、生长点、腋芽、花蕾、花瓣和花茎作外植体进行离体快繁技术研究。结果表明:以幼嫩的花蕾和花瓣为外植体最为适宜;以MS+6-BA 0.5 mg/L+NAA 0.2 mg/L+2,4-D 0.7 mg/L为最适诱导培养基,诱导分化率可达74%以上;以MS+6-BA 2.0 mg/L+NAA 0.2 mg/L为最适继代增殖培养基,增殖系数可达5.8;以MS+6-BA 1.0 mg/L+NAA 0.2 mg/L+IBA 0.02 mg/L+马铃薯20 g/L为壮苗培养基。培养1~2周后转入MS+NAA 0.04 mg/L的生根培养基中,其平均根长、根长势等最为理想,生根率达100%,且移栽后成活率高,生长健壮。
关键词多倍体萱草;花蕾;花瓣;离体快繁
多倍体萱草,百合科萱草属。花色鲜艳,园林中多用于花境或路旁栽植,是优良的园林地被植物。但其自然分蘖繁殖的速度慢,远不能满足商品化生产的需要。而利用组培快繁技术,可以极大地提高萱草的繁殖数量,加快繁殖速度,实现规模化生产。目前已有一些关于萱草组培快繁的研究,张洁茹、毕晓颖、兰丽婷[1-4]等对诱导培养、增殖培养、生根培养、移栽等过程进行了研究,但由于萱草品种间差异性大、特异性强,因此结果不尽相同。不同学者研究的不同萱草品种、不同外植体的培养方法和培养基配方都存在较大差异[5-7],因此,开展多倍体萱草组培快繁研究具有重要价值。笔者对多倍体萱草从外植体选取部位至炼苗移栽进行了系统的研究,为其规模化生产提供了依据。
1材料与方法
于长春公园选取成年、健壮、无病菌的植株移栽于长春大学温室过渡培养备用。各阶段培养以MS为基础培养基,附加不同质量浓度的6-BA、IBA、NAA、2,4-D、蔗糖(30g/L),琼脂(9g/L)等,pH=5.8。所有培养条件均为温度(25±2)℃、光照强度1 500~2 000lx、光照时间12h/d。
外植体的建立:取多倍体萱草的嫩叶、生长点、腋芽、花蕾、花瓣、花茎为外植体,洗衣粉液泡洗后,用自来水冲洗1~2h;然后在75%酒精中浸泡10s后,用无菌水冲洗;再转入0.1%的升汞(加1~2滴吐温)液中浸泡12min后,用无菌水冲洗,以备接种。
诱导培养:将外植体接种于诱导培养基上,每种外植体接种40瓶,每瓶4株,培养期间观察萌芽及生长状况。出愈率=出现愈伤组织外植体数量÷接种外植体数量×100%;诱导分化率=已分化的外植体数量÷接种外植体数量×100%;污染率=污染的外植体数量÷接种外植体数量×100%;褐变率=褐变外植体数量÷接种外植体数量×100%;增殖倍数=继代后芽苗数量÷继代前芽苗数量;生根率=生根的组培苗数量÷接种组培苗数量×100%。
继代培养:将诱导培养基上萌发的生长良好、健壮的嫩芽切下转接到继代培养基中培养。
壮苗培养:将瓶内苗木转至壮苗培养基中培养,观察生长状况。生根培养:将瓶内苗高剪至2~3cm,转至生根培养基中,观察生根状况及苗木生长状况。
2结果与分析
2.1多倍体萱草诱导培养
从表1可见,将不同外植体接于同一培养基上,以花蕾和花瓣为外植体出愈率和诱导率最高,大约在1周左右开始膨大变绿,并且有淡黄绿色的愈伤组织颗粒产生(见图1)。在培养10d时观察,均无不定芽产生;在培养15d左右发现,以花瓣和花蕾为外植体在Y3培养基上和Y4基上有不定芽产生(见图2);且20d时在Y4培养基上,以花蕾和花瓣为外植体的诱导率均达74%以上。以花瓣为外植体的诱导率最高,达78%,不定芽浓绿健壮。各培养基中以嫩叶为外植体接种后其愈伤组织出现晚,且不宜诱导分化,褐化率最高。
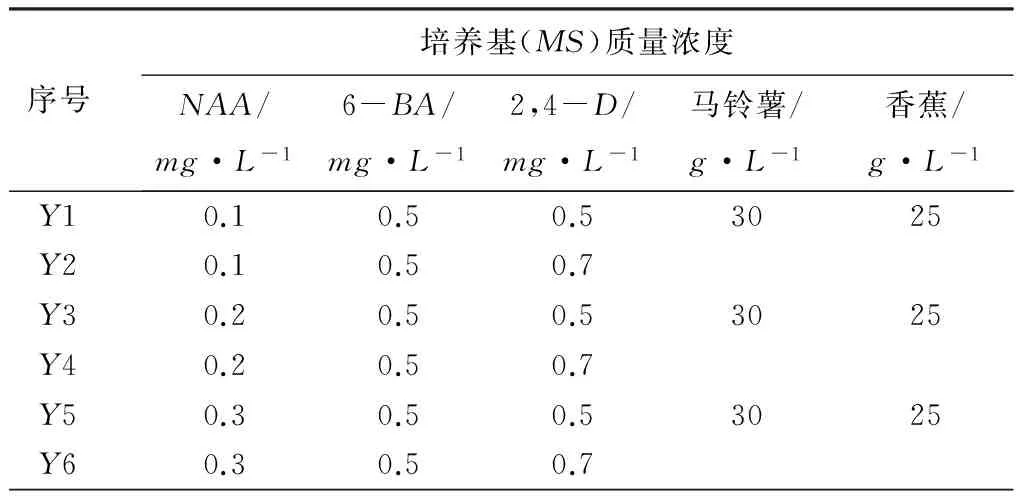
表1 外植体诱导分化
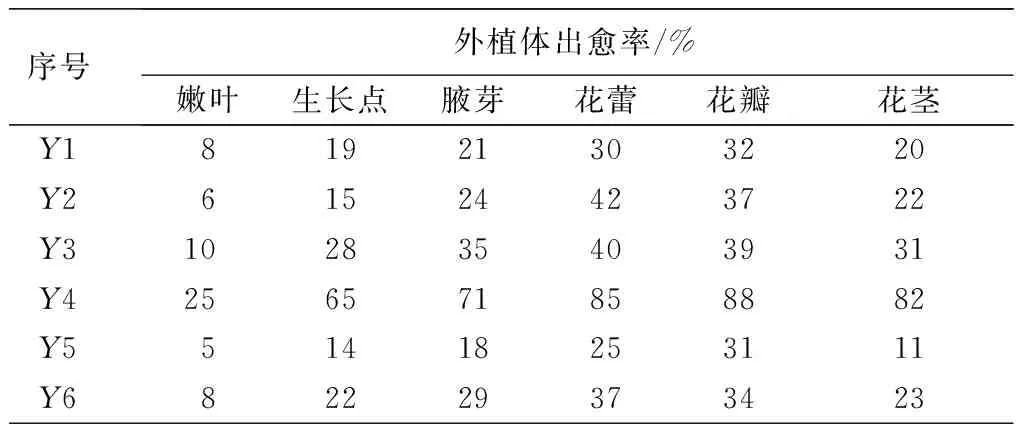
序号外植体出愈率/%嫩叶生长点腋芽花蕾花瓣花茎Y181921303220Y261524423722Y3102835403931Y4256571858882Y551418253111Y682229373423
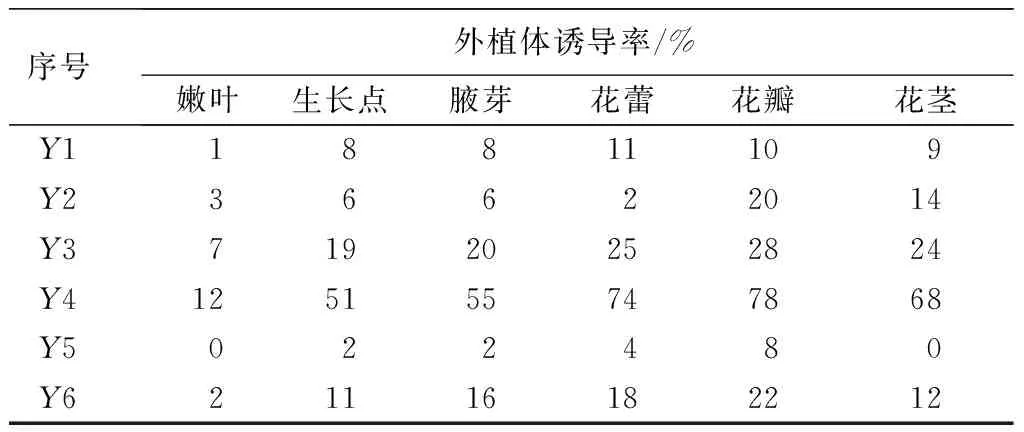
序号外植体诱导率/%嫩叶生长点腋芽花蕾花瓣花茎Y118811109Y236622014Y371920252824Y4125155747868Y5022480Y621116182212
2.2多倍体萱草继代培养
将诱导芽剪取转接到继代培养基上,25d左右继代一次。继代增殖培养结果见表2。可见,NAA质量浓度为0.1mg/L时,随着6-BA质量浓度的增加,增殖倍数增加;6-BA质量浓度达2.0mg/L时,增殖倍数最大,达3.8倍。NAA质量浓度为0.2mg/L时,随着6-BA质量浓度的增加,增殖倍数增加;6-BA质量浓度达2.0mg/L时,增殖倍数最大,达5.8倍,且该增殖培养基中苗木生长速率快,叶较宽、浓绿,苗木健壮(见图3)。

图1 多倍体萱草的愈伤组织诱导

图2 多倍体萱草的愈伤组织分化
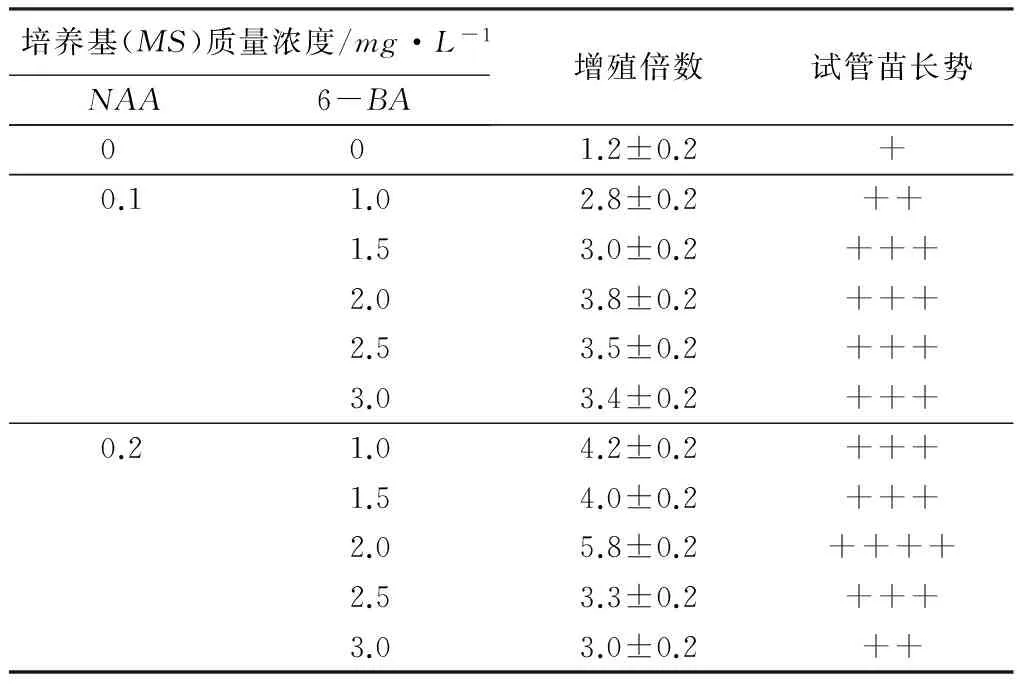
培养基(MS)质量浓度/mg·L-1NAA6-BA增殖倍数试管苗长势0 0 1.2±0.2+0.11.02.8±0.2++1.53.0±0.2+++2.03.8±0.2+++2.53.5±0.2+++3.03.4±0.2+++0.21.04.2±0.2+++1.54.0±0.2+++2.05.8±0.2++++2.53.3±0.2+++3.03.0±0.2++
注:表中数值为平均值±标准差;供试样品均为40瓶,每瓶4株;+为发育不良(根少、细),++为发育较好(根较少、细长),+++为发育良好(根较多、粗长),++++为发育很好(根多、粗长);试验过程中出现少量褐化现象,分别在褐化的培养基中加入0.25%活性炭,褐化效果消除不明显。
2.3多倍体萱草壮苗培养
经过增殖培养,试管苗整体长势较弱,且有玻璃化现象,影响移栽后的成活率,因此生根前将试管苗转入MS+6-BA1.0mg/L+NAA0.2mg/L+IBA0.02mg/L+马铃薯20g/L培养基中进行壮苗培养(见图4),以提高瓶苗质量。

图3 多倍体萱草的继代增殖培养基

图4 多倍体萱草的壮苗培养基
2.4多倍体萱草生根培养
将生长健壮,高2~3cm的无根幼苗转入生根培养基中,大约1周左右开始分化出根的生长点,25d后的生根情况见表3。可见,萱草在MS+0.04mg/LNAA培养基中平均根长可达7cm,生根率达100%,且根毛密集、粗长、白润,生长健壮(见图5)。
2.5多倍体萱草炼苗与移栽
将组培苗从培养瓶中取出,洗净根部培养基。将根部置于盛满水的容器中,罩上透明塑料薄膜,保持温度和湿度,3d后清洗根部培养基后移栽。移栽后成活率达98%以上。
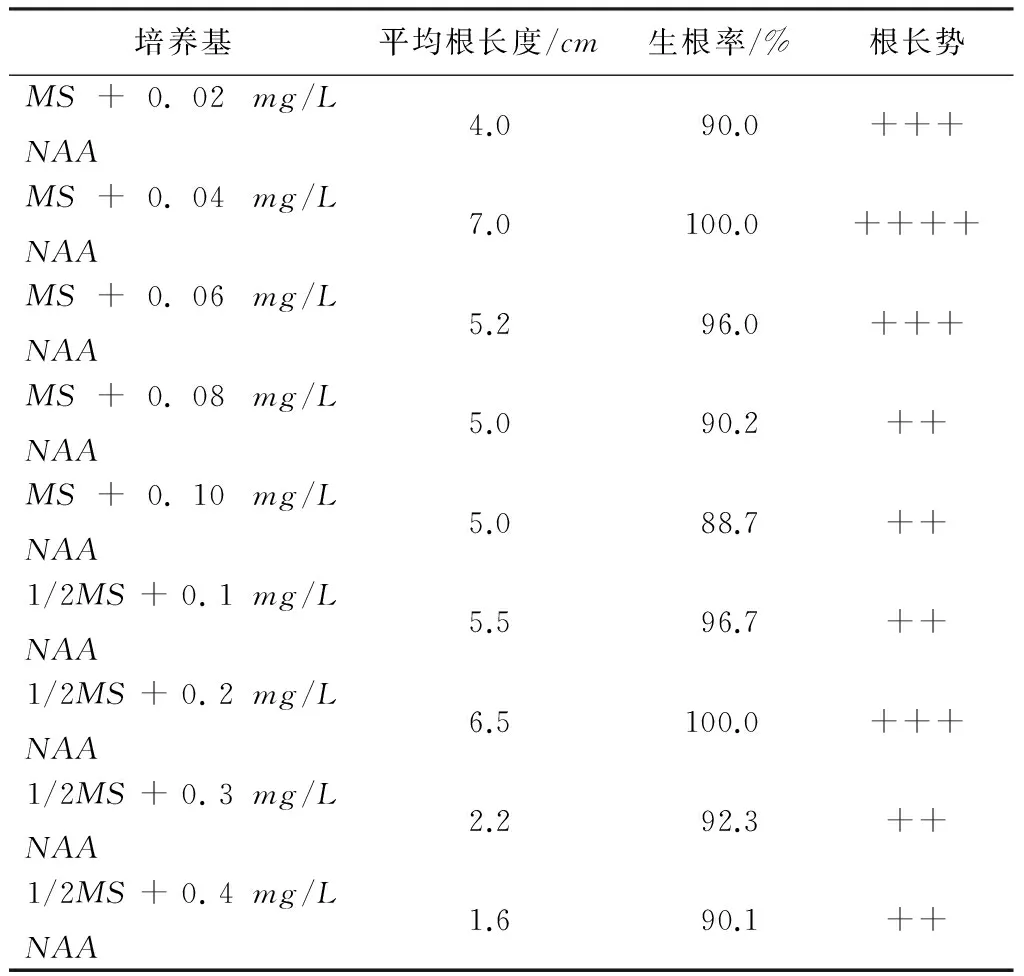
表3 不同生根培养基对萱草生根的影响
注:供试样品均为40瓶,每瓶4株;++为发育较好(根较少、细长),+++为发育良好(根较多、粗长),++++为发育很好(根多、粗长)。

图5 多倍体萱草的生根培养基
3结论与讨论
以幼嫩的花蕾和花瓣为多倍体萱草最佳外植体,培养1周左右愈伤组织开始膨大,15d左右出现不定芽,大大缩短了获得无菌幼苗的时间。最适诱导培养基为MS+NAA0.2mg/L+6-BA0.5mg/L+2,4-D0.7mg/L;最适增殖培养基为MS+NAA0.2mg/L+6-BA2.0mg/L;最适壮苗培养基为MS+6-BA1.0mg/L+NAA0.2mg/L+IBA0.02mg/L+马铃薯20g/L;最适生根培养基为MS+0.04mg/LNAA。炼苗可直接在盛满水的容器中进行,3d后即可移栽,套袋保湿,加强管理,成活率达98%。
此外,试验中发现种植于不同基质中的生根苗其长势各不相同。栽植于草炭土中的植株长势要明显好于园土+草炭的基质,即萱草适宜生长在通气透水性好的草炭土中;但在透气性差的园土+草炭中也能生长,只是长势较弱。试验中出现的褐化问题还是没有更好的办法解决,有待于进一步研究。
参考文献
[1]张洁茹,刘晓嘉,陈丽飞,等.矮壮素对萱草组培苗生根及移栽的影响[J].东北林业大学学报,2014,42(7):95-99.
[2]张洁茹,刘晓嘉,陈丽飞,等.萱草优良单株花茎离体快繁[J].东北林业大学学报,2014,42(2):73-77.
[3]毕晓颖,王宁.萱草花茎离体培养与快速繁殖[J].东北林业大学学报,2012,40(11):56-59,158.
[4]兰丽婷,李冲,任爽英,等.萱草新品种组培再生体系的建立[J].东北林业大学学报,2011,39(4):14-17.
[5]姜凤英,栾绍武,吴志刚,等.多倍体萱草“金娃娃”的离体培养研究[J].辽宁农业科学,2007(1):51-52.
[6]路光,王岩,涂传炜.大花萱草—金娃娃组培苗继代增殖因素的研究[J].北方园艺,2006(6):139-140.
[7]王晓娟,金樑,陈家宽.大花萱草不同外植体诱导愈伤组织的比较研究[J].生命科学研究,2005,9(3):242-246.
第一作者简介:尹立辉,女,1978年11月生,长春大学园林学院,讲师。E-mail:51442591@qq.com。
收稿日期:2015年5月20日。
分类号Q813.1
RapidinVitroPropagationofPolyploidHemerocallis fulva//
YinLihui,WuShujie
(ChangchunUniversity,Changchun130012,P.R.China);LiuYaliang(JilinJinongSeedIndustryLimitedCompany);WenNa,WangLilan,WangXuesong(ZhongbangGardenLimitedCompany)//JournalofNortheastForestryUniversity,2016,44(8):41-43,67.
TheexperimentwasconductedtostudytherapidinvitropropagationofpolyploidyHemerocallis fulvawithtenderleaf,growingpoint,axillarybud,bud,petalandscapeasexplants.Theyoungbudandpetalwerethemostsuitableexplants.MS+6-BA0.5mg/L+NAA0.2mg/L+2,4-D0.7mg/Lwasthemostsuitableinducingmedium,andtheinducingdifferentiationratewas74%.MS+6-BA2.0mg/L+NAA0.2mg/Lwasthemostsuitablesubculturemedium,andproliferationcoefficientwas5.8.MS+6-BA1.0mg/L+NAA0.2mg/L+IBA0.02mg/L+Potato20g/Lwasthestrongseedlingmedium.After1-2weeks,tissuecultureseedlingwastransferredtotherootingmediumofMS+NAA0.04mg/L.Theaveragerootlengthandrootgrowthoftissuecultureseedlingswerethemostidealwiththerootingrateof100%,thesurvivalratewashigh,andthegrowthwasstrong.
KeywordsPolyploid Hemerocallis fulva; Bud; Petal; Rapid in vitro propagation
1)吉林省科学技术开发(委托)项目(2010220001000250)。
责任编辑:戴芳天。
