钒胁迫下枸杞和芥菜叶蛋白含量的变化
2016-08-08赵军平邹盛淼
侯 明,赵军平,熊 玲,邹盛淼
(桂林理工大学 化学与生物工程学院,广西 桂林 541004)
钒胁迫下枸杞和芥菜叶蛋白含量的变化
侯明,赵军平,熊玲,邹盛淼
(桂林理工大学 化学与生物工程学院,广西 桂林541004)
摘要:采用碱法和Tris-HCl提取法,研究了V胁迫对不同蔬菜叶蛋白含量的影响。结果表明,随V胁迫量的增加,枸杞和芥菜叶蛋白含量呈先升后降的变化趋势,当V胁迫量达50 mg·kg-1时,碱法提取枸杞叶和芥菜叶蛋白含量分别达最大值127.07和41.76 mg·g-1,茎中蛋白含量分别为143.51和23.54 mg·g-1。随胁迫时间增加,枸杞叶蛋白含量减少,在V 胁迫量100 mg·kg-1,胁迫时间80 d时,碱法和Tris-HCl提取叶蛋白含量分别为86.68和28.65 mg·g-1;胁迫时间120 d则分别为74.86和23.52 mg·g-1。当V胁迫量>100 mg·kg-1,枸杞叶蛋白含量下降并趋于平稳。可能V胁迫量较低时,枸杞植物诱导产生具有相关解毒机制的蛋白,表现为叶蛋白含量增加;当V胁迫量超过枸杞植物的耐受限度,维持生命活动的蛋白受到V的毒害变性失活,表现为叶蛋白含量下降。
关键词:钒胁迫;枸杞;芥菜;叶蛋白
0引言
随着工业化发展,重金属通过土壤进入生物圈并不断积累,对环境和人体造成伤害,植物吸收的重金属在根、茎、叶及籽实中积累,会影响植物的生长发育[1-2]。重金属对植物的危害主要表现在其对细胞酶活性以及植物新陈代谢产生的影响[3]。植物细胞中可溶性蛋白的含量是衡量植物新陈代谢和生理状态的重要指标之一,它包含各种酶原、酶分子和代谢调节物,能反映细胞内蛋白质变性、合成及降解等有关信息。重金属胁迫会造成活性氧的积累,使植物体产生氧化胁迫,进而引起植物体内蛋白含量的变化[4-5]。因此,关于重金属胁迫对不同植物可溶性蛋白的影响成为研究热点:李朝阳、Ahsan和Hajduch[6-8]等的研究表明,在高浓度Cd胁迫下,植物体内蛋白质代谢功能紊乱,湿地匍灯藓(Plagiomniumacutum)可溶性蛋白与Cd浓度表现出负相关,而水稻中参与抗氧化及胁迫调节活动的可溶性蛋白明显上升,水稻叶受Cu诱导,使参与光合作用的蛋白合成受阻,影响正常的光合作用;杜晓、沙翠芸和熊春晖[9-11]等研究了在Cd或Pb胁迫下, 珊瑚树、 紫叶李等植物和荷叶中可溶性蛋白的变化, 随土壤中Cd、Pb浓度增大蛋白含量呈先升后降的趋势; 柳玲等[12]的研究结果则表明, 芹菜叶内可溶性蛋白与Cr胁迫浓度表现出负相关。 此外, 侯明、 王学和陈茂铨等[13-15]研究也显示, 重金属对一些农作物中可溶性蛋白含量的影响存在“少促多抑”的规律, 但产生这些现象的机制还有待进一步探究。
枸杞嫩茎叶俗称“枸杞头”, 含有丰富的营养成分和活性物质, 具有清肝明目、 降血压等功能[16]。 芥菜中的抗坏血酸是活性很强的还原物质, 能增加大脑中氧含量, 有提神醒脑和解除疲劳的作用。 枸杞嫩叶和芥菜是华南地区人们喜爱食用的蔬菜, 其品质直接影响人体的健康, 开展重金属胁迫对枸杞和芥菜叶茎蛋白含量的影响研究具有重要的意义。 基于本课题组的前期研究成果[13, 17-18], 笔者进一步采用碱溶液提取法和Tris-HCl提取法,深入研究了不同钒胁迫条件下枸杞和芥菜茎叶蛋白含量的变化,以及钒胁迫不同时间对枸杞叶蛋白含量的影响,探讨了植物对钒的解毒和耐性等机理,为培育高抗性、低积累的枸杞植物和芥菜品种提供理论依据,也可为枸杞叶资源的开发和利用提供实验基础。
1材料与方法
1.1供试材料
扦插枸杞(LyciumchinenseMill.)枝条取自桂林市某菜地, 供试芥菜(Brassicajuncea)品种为大坪铺包心芥菜, 盆栽试验选取土质肥力较大的农田土, 所选用的钒(NH4VO3)为分析纯试剂。
1.2试验设计
土壤经风干,除去石块和杂质,过3.2 mm筛,备用。取风干过筛后的土壤,每个塑料盆装土6 kg(以干土计), 每盆加入15 g复合肥(NH4H2PO4、 (NH4)2HPO4、 KH2PO4等)作底肥, 与土壤充分混匀。 试验设置6种处理, 分别加入不同的V量(以NH4VO3形式加入): 0、 25、 50、 100、 150、 200 mg·kg-1, 每种处理6个重复, 充分混匀后陈化一周。 每盆扦插8株已经半木质化的枸杞枝条或播种20粒芥菜种子, 芥菜出苗后定株为10株, 按大田栽培管理要求进行灌水和追肥, 50 d后收获(枸杞茎叶收获时间分别为50、 80、 120 d)。植株分叶、茎收获,先用自来水冲洗,再用去离子水洗净,放入烘箱中95 ℃杀青15 min,60 ℃烘干,用粉碎机粉碎,过0.198 mm筛,分装于密封袋中,低温保存。
1.3试验方法
1.3.1植物叶蛋白的提取称取植物叶干粉0.1 g,按料液比1∶60加入0.2 mol·L-1NaOH提取剂,在45 ℃温水浴中振荡提取1.5 h(或按料液比1∶20加入0.15 mol·L-1Tris-HCl提取剂,在pH值8.5下提取4 h),4 500 r/min条件下离心20 min,上清液用于测定可溶性蛋白质含量。
1.3.2可溶性蛋白含量的测定将上述提取液用考马斯亮蓝法测定可溶性蛋白含量[19]:准确移取一定体积上清液于10 mL比色管中,加入蒸馏水0.95 mL使溶液体积至1.00 mL,加入0.1 g·L-1考马斯亮蓝G-250(使用之前应先抽滤)5 mL,摇匀,放置5 min后以试剂空白为参比溶液,使用Cary 50紫外分光光度计于650 nm处测定吸光度,根据牛血清蛋白标准曲线法求得样品中蛋白含量。试验结果为3次重复试验的平均值。
1.4数据处理
采用DPS数据处理系统和Microsoft Excel 2003对数据进行统计分析,Duncan多重比较法对显著性差异(P<0.05)进行多重比较。
2结果与分析
2.1不同钒胁迫量对蔬菜蛋白含量的影响
按试验方法,用NaOH提取剂对V胁迫50 d的枸杞和芥菜茎叶中可溶性蛋白进行提取分析,结果如图1、2。
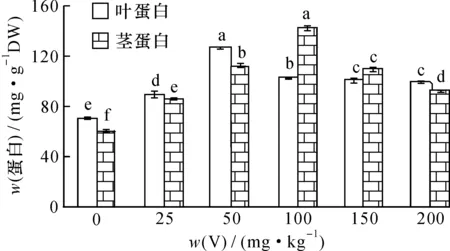
图1 钒胁迫对枸杞茎叶蛋白含量的影响Fig.1 Effect of vanadium (V) stress on the protein content in stem and leaf of Lycium chinense Mill.
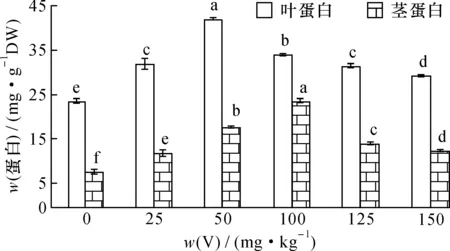
图2 钒胁迫量对芥菜茎叶中蛋白含量的影响Fig.2 Effect of vanadium (V) stress on the protein content in stem and leaf of Brassica juncea
可以看出, 随着土壤V胁迫量的增加,蔬菜茎、 叶蛋白含量均呈现先升后降的趋势, 当V胁迫量达50 mg·kg-1时, 枸杞和芥菜叶蛋白含量达最大, 分别为127.07和41.76 mg·g-1, 与对照相比较差异达显著水平(P< 0.05); 当V胁迫量>50 mg·kg-1,叶片中蛋白含量下降并趋于平稳,枸杞和芥菜叶蛋白最低为99.3和29.3 mg·g-1,但始终高于对照。枸杞和芥菜茎内蛋白含量变化与叶相似,当V胁迫量达100 mg·kg-1时,枸杞和芥菜茎中蛋白含量达最大,分别为143.51和23.54 mg·g-1;当V胁迫量>100 mg·kg-1时,随V浓度增加植物茎中蛋白含量下降;V胁迫量为200 mg·kg-1时,枸杞茎蛋白降低为92.7 mg·g-1;V胁迫量为150 mg·kg-1时,芥菜茎蛋白降低为12.5 mg·g-1,但均高于对照。
在低胁迫量V(≤100 mg·kg-1)作用下, V可与植物蛋白结合形成低分子量植物螯合肽(LMW)转入液泡内, 降低了V的毒性; 同时由于V的刺激作用, 使一些参与缓解氧化胁迫的酶活性上升, 受到活性氧自由基的诱导, 细胞内非酶系统抗氧化物质如抗坏血酸(ASA)活性上升, 有助于保证细胞膜的完整性,使细胞免受伤害, 从而维持细胞的正常代谢[20], 诱导植物叶蛋白含量增加。 当V胁迫量较大(>100 mg·kg-1)时,一方面会使细胞内酶的结构和代谢作用受到影响,植物体内的脯氨酸、丙二醛(MDA)和细胞膜透性(CMP)增加,细胞中可溶性物质外渗,改变了细胞内外渗透压,使重金属更易进入细胞引起毒害[18,21-22];另一方面,V的毒害可损伤与蛋白质合成相关的细胞器,使植物中蛋白合成酶下降,分解酶活性上升,从而抑制新蛋白质的合成,或改变了相关蛋白的基因表达,导致可溶性蛋白下降[23]。当V胁迫量>100 mg·kg-1(茎)或>50 mg·kg-1(叶)时,枸杞和芥菜叶茎蛋白含量逐渐下降,显然,V胁迫对植物叶的影响比茎要大。总的来说,少量的V会刺激植物体内产生解毒作用的蛋白或者诱导产生了V结合蛋白,这些蛋白能够提高植物对重金属的耐受力,维持新的新陈代谢动态平衡,使植物体内生理活动向有利于生长的方向进行,表现为低含量V胁迫时植物蛋白含量始终高于对照的植物蛋白含量;当V胁迫量超过了植物耐受能力,将破坏之前的新陈代谢平衡,表现出蛋白含量下降。而芥菜的叶蛋白含量总是大于茎蛋白含量。
2.2不同提取方法对枸杞叶蛋白含量的影响
按试验方法, 用不同提取剂对V胁迫80和120 d的枸杞植株叶蛋白进行提取。 结果表明: 随着V胁迫量增加, 胁迫不同时间的枸杞叶蛋白含量均呈现缓慢升高后再下降的变化趋势(图3、 4)。

图3 胁迫时间对枸杞叶蛋白含量的影响(NaOH提取)Fig.3 Effect of stress time on the leaf protein content of Lycium chinense Mill. with NaOH as extractor
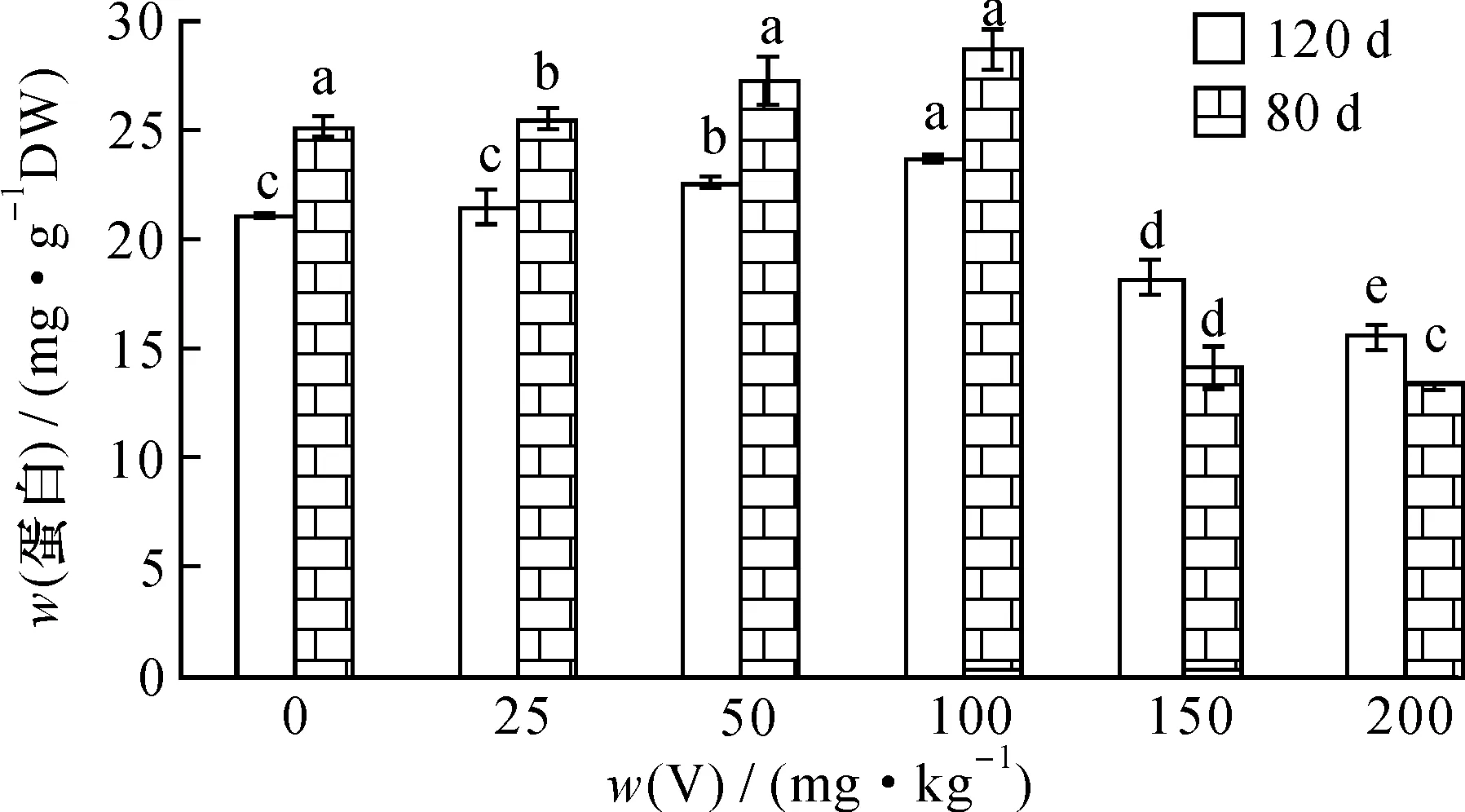
图4 胁迫时间对枸杞叶蛋白的影响(Tris-HCl提取)Fig.4 Effect of stress time on the leaf protein content Lycium chinense Mill. with Tris-HCl as extractor
V胁迫时间不同时,不同提取方法提取的叶蛋白含量均在V胁迫量为100 mg·kg-1时达最大值,NaOH提取的蛋白含量比Tris-HCl提取分别多58.03 mg·g-1(80 d)和51.36 mg·g-1(120 d); 在V胁迫量为200 mg·kg-1时达最低值, NaOH提取蛋白含量比Tris-HCl提取分别多50.16 mg·g-1(80 d)和40.93 mg·g-1(120 d)。使用不同提取剂提取植物蛋白含量的结果表明,不同提取方法对提取效果有较大影响。在pH 4~10范围内,蛋白质的溶解性较差,但能溶于稀酸或稀碱。碱液对蛋白分子的次级键特别是氢键有破坏作用,促使蛋白与淀粉分离,从而对蛋白质分子有增溶作用,因此采用碱提取能更好地溶解出枸杞叶蛋白,而Tris-HCl主要提取酸溶蛋白,小分子量的蛋白很少[24]。两种提取剂与蛋白的亲和力不同,导致提取出来的可溶性蛋白种类各异,而NaOH的提取量要远大于Tris-HCl提取量。因此,可以选择碱溶液作为开发利用枸杞叶蛋白的提取剂。
2.3钒胁迫不同时间对枸杞叶蛋白含量的影响
从图3、4可见,当V胁迫量≤100 mg·kg-1时,两种提取剂提取不同时间的枸杞叶蛋白含量均呈上升趋势;当V胁迫量>100 mg·kg-1,两种提取剂提取不同时间的蛋白含量均下降。随胁迫时间增加,两种提取剂提取的蛋白含量均下降,说明胁迫时间愈长,V 对枸杞叶的伤害愈重。在V胁迫量为100 mg·kg-1的条件下,不同胁迫时间的蛋白含量均达最大值,80 d的蛋白含量分别为28.65 mg·g-1(Tris-HCl)和86.69 mg·g-1(NaOH), 相比于对照分别增加15.8%和13.5%; 120 d的蛋白含量分别为23.5 mg·g-1(Tris-HCl)和74.86 mg·g-1(NaOH), 相比于对照增加5.1%和2%。 当V胁迫量达200 mg·kg-1, 80 d的蛋白含量分别为15.38 mg·g-1(Tris-HCl)和63.34 mg·g-1(NaOH), 相比于对照下降27.8%和17.1%; 120 d的蛋白含量分别为11.18 mg·g-1(Tris-HCl)和56.32 mg·g-1(NaOH), 相比于对照降低33.9%和10.6%, 与对照相比, 差异达显著水平。 不同胁迫量胁迫不同时间, 植物蛋白含量不同。 试验表明: 在低胁迫量(≤100 mg·kg-1)和短时间胁迫下, 植物中少量的V积累有助于其自身合成具有解毒机制的蛋白, 有利于植物生长; 随着胁迫时间的增加, V对枸杞植株的影响超过了植物的耐受程度, 损伤植物体内的抗氧化酶活性, 部分蛋白降解或破裂, 植物的光合作用受阻, 使植物体内新陈代谢减慢, 枸杞叶蛋白含量下降。当V胁迫量>100 mg·kg-1、胁迫时间为120 d时, V对植物的毒害增大, 导致植物叶中参与光合作用和ATP活动的蛋白含量降低, 蛋白质半胱氨酸合成酶(Cysteine synthase, CS)和谷胱甘肽巯基转移酶(GlutathioneS-transferase, GST)合成量降低[25-26], 或者不能进行正常的生理合成, 从而改变植物的正常生理变化和新陈代谢, 对枸杞植株的毒害增强。 所以, 在合适的胁迫时间下, 一定量的V有利于植物叶蛋白的合成, 促进植物的生长。
3结论
(1)随着V胁迫量的增加,枸杞和芥菜中叶和茎蛋白含量呈先上升后下降的变化趋势,说明枸杞和芥菜体内存在有解毒作用的特定蛋白,这些蛋白有助于提高对重金属的耐受力,维持新的新陈代谢动态平衡。当V胁迫量超过了植物耐受能力,将破坏之前的新陈代谢平衡,表现出蛋白含量下降。
(2)NaOH溶液对枸杞叶蛋白的提取量要远大于Tris-HCl溶液提取量,可以选择碱溶液作为开发利用枸杞叶蛋白的提取剂。
(3)在低胁迫量(≤100 mg·kg-1)和短时间胁迫下,植物中少量的V有助于自身合成具有解毒作用的蛋白;随着胁迫时间的增加,V对枸杞植株的影响超过了其耐受程度,将会使植物体内部分蛋白降解或破裂,光合作用受阻,使枸杞叶蛋白含量下降,尤其是在高胁迫量(200 mg·kg-1)和长时间胁迫下,V对植物的毒害增大,使得枸杞叶蛋白含量显著低于对照。
参考文献:
[1]Pillai S, Behra R, Nestler H, et al. Linking toxicity and adaptive responses across the transcriptome, proteome, and phenotype ofChlamydomonasreinhardtiiexposed to silver[J]. Proceedings of the National Academy of Sciences, 2014, 111(9):3490-3495.
[2]Srivastava R K, Pandey P, Rajpoot R, et al. Cadmium and lead interactive effects on oxidative stress and antioxidative responses in rice seedlings[J]. Protoplasma, 2014,251(5): 1047-1065.
[3]Piotrowska-Niczyporuk A, Bajguz A, Zambrzycka E, et al. Phytohormones as regulators of heavy metal biosorption and toxicity in green algaChlorellavulgaris(Chlorophyceae)[J]. Plant Physiology and Biochemistry, 2012, 52:52-65.
[4]Shahnaz G, Shekoofeh E, Kourosh D, et al. Interactive effects of silicon and aluminum on the malondialdehyde (MDA), proline, protein and phenolic compounds inBoragoofficinalisL.[J]. Journal of Medicinal Plants Research, 2011, 5(24):5818-5827.
[5]Aghaleh M, Niknam V, Ebrahimzadeh H, et al. Salt stress effects on growth, pigments, proteins and lipid peroxidation inSalicorniapersicaandS.europaea[J]. Biologia Plantarum, 2009, 53(2):243-248.
[6]李朝阳, 陈玲, 吴昊, 等, 湿地匍灯藓 (Plagiomniumacutum) 的防御机制对镉胁迫的响应[J]. 农业环境科学学报, 2012, 31(9):1665-1671.
[7]Ahsan N, Lee S H, Lee D G, et al. Physiological and protein profiles alternation of germinating rice seedlings exposed to acute cadmium toxicity[J]. Comptes Rendus Biologies, 2007, 330(10):735-746.
[8]Hajduch M, Rakwal R, Agrawal G K, et al. High-resolution two-dimensional electrophoresis separation of proteins from metal-stressed rice (OryzasativaL.) leaves: Drastic reductions/fragmentation of ribulose-1, 5-bisphosphate carboxylase/oxygenase and induction of stress-related proteins[J]. Electrophoresis, 2001, 22(13):2824-2831.
[9]杜晓, 申晓辉. 镉胁迫对珊瑚树和地中海荚蒾生理生化指标的影响[J]. 生态学杂志, 2010,29(5):899-904.
[10]沙翠芸, 孟庆瑞, 王静, 等. 两种彩叶植物对铅胁迫的生理响应[J]. 西北林学院学报, 2011,26(4):36-40.
[11]熊春晖, 许晓光, 卢永恩, 等. 铅镉复合胁迫下莲藕对铅镉的富集及其生理变化[J]. 园艺学报, 2012, 39(12):2385-2394.
[12]柳玲, 吕金印, 张微. 不同浓度Cr6+处理下芹菜的铬累积量及生理特性[J]. 核农学报, 2010, 24(3):639-644.
[13]侯明, 陈国勇, 梁福晓, 等. 钒胁迫对水稻幼苗生理生化和富集特性的影响[J].生态环境学报, 2014, 23(10):1657-1663.
[14]王学, 徐恒戬, 刘涛. 白菜对铈、铅胁迫响应的比较研究[J]. 核农学报, 2010, 24(3):634-638.
[15]陈茂铨,陈兵红,刘术新,等.铅对芫荽种子萌发及幼苗生长的影响[J]. 热带作物学报, 2010, 31(3):393-396.
[16]Dong J Z, Gao W S, Lu D Y, et al. Simultaneous extraction and analysis of four polyphenols from leaves ofLyciumbarbarumL.[J]. Journal of Food Biochemistry, 2011, 35(3):914-931.
[17]侯明, 陈如, 黄艳娇. 枸杞幼苗对钒胁迫的生理响应和积累特性[J]. 桂林理工大学学报, 2013, 33(4):688-693.
[18]侯明,陈国勇,梁福晓,等. 碱法提取枸杞植物叶中的蛋白质[J].桂林理工大学学报,2014,34(3): 515-518.
[19]赵英永, 戴云, 崔秀明,等. 考马斯亮蓝 G-250 染色法测定草乌中可溶性蛋白质含量[J]. 云南民族大学学报:自然科学版, 2006, 15(3):235-237.
[20]Hossain M A, Piyatida P, Teixeirada da Silva J A, et al. Molecular mechanism of heavy metal toxicity and tolerance in plants: Central role of glutathione in detoxification of reactive oxygen species and methylglyoxal and in heavy metal chelation[J]. Journal of Botany, 2012:1-37.doi:10.1155/2012/872875.
[21]王明新, 陈亚慧, 白雪,等. 孔雀草对镉胁迫的响应及其积累与分布特征[J]. 环境化学, 2014, 33(11):1879-1884.
[22]寇士伟, 倪高风, 马岚婷, 等. Cd-Pb-Cu复合污染对芥菜生长及生理特性的影响[J]. 环境科学研究, 2011,24(3):281-286.
[23]Pena L B, Barcia R A, Azpilicueta C E, et al. Oxidative post translational modifications of proteins related to cell cycle are involved in cadmium toxicity in wheat seedlings[J]. Plant Science, 2012, 196:1-7.doi:10.1155/2012/872875.
[24]原雅纬, 郑伟, 李少菁, 等. 塔玛亚历山大藻双向电泳蛋白的三种提取方法比较[J]. 微生物学报, 2011, 51(8):1113-1118.
[25]Hall J L. Cellular mechanisms for heavy metal detoxification and tolerance[J]. Journal of Experimental Botany, 2002, 53(366): 1-11.
[26]Malik J A, Goel S, Kaur N, et al. Selenium antagonises the toxic effects of arsenic on mungbean (PhaseolusaureusRoxb.) plants by restricting its uptake and enhancing the antioxidative and detoxification mechanisms[J]. Environmental and Experimental Botany, 2012, 77:242-248.
文章编号:1674-9057(2016)02-0344-05
doi:10.3969/j.issn.1674-9057.2016.02.026
收稿日期:2014-12-16
基金项目:国家自然科学基金项目(41161076;41561077);广西自然科学基金项目(2011GXNSFA018045)
作者简介:侯明(1957—),女,博士,教授,研究方向:环境分析化学,glhou@glut.edu.cn。
中图分类号:X503.23;X173
文献标志码:A
Protein changes in leaves ofLyciumchinenseMill. andBrassicajunceastressed with vanadium
HOU Ming,ZHAO Jun-ping,XIONG Ling,ZOU Sheng-miao
(College of Chemistry and Bioengineering, Guilin University of Technology,Guilin 541004,China)
Abstract:Effects of vanadium (V) stress on protein content in leaves of Lycium chinense Mill. and Brassica juncea were investigated by alkali extraction and Tris-HCl extraction. Results show that protein contents in leaves of Lycium chinense Mill. and Brassica juncea increased first and then decreased, with V stress increasing. The protein contents in leaves of Lycium and Brassica juncea were extracted by alkaline, and they reached the maximum 127.07 and 41.76 mg·g-1respectively when V concentration was 50 mg·kg-1, while the protein contents in stems were 143.51 and 23.54 mg·g-1respectively. With stress time increasing, protein contents in Lycium barbarum leaves decreased. When V stress concentration was 100 mg·kg-1and V stress time was 80 days, protein contents were 86.68 and 28.65 mg·g-1respectively for the leaves protein extracted by alkaline and Tris-HCl, while they were 74.86 and 23.52 mg·g-1when V stress time was 120 days. The downward trend of leaves protein content was stabilized when V> 100 mg·kg-1. The reason may be that when V stress concentration was low, both plants were induced to produce the associated proteins with detoxification ability, exhibiting increase of the total leaves protein contents. While V stress concentration exceeded the tolerance limits of plants, the life-sustaining proteins were inactivated by V poisoning and degeneration, exhibiting decrease of the total leaves protein contents.
Key words:vanadium stress; Lycium chinense Mill.; Brassica juncea; leaf protein
引文格式:侯明, 赵军平, 熊玲, 等. 钒胁迫下枸杞和芥菜叶蛋白含量的变化[J]. 桂林理工大学学报, 2016, 36(2): 344-348.
