血清鳞状细胞癌抗原、组织蛋白酶D和糖类抗原125检测对宫颈鳞癌诊断及预测转移的应用价值*
2016-08-08王攀蒋智钢郑家深杨昌伟陈大勇王东红
王攀,蒋智钢,郑家深,杨昌伟,陈大勇,王东红
(1.遵义医学院附属医院 核医学科,贵州 遵义 563000;2.遵义医学院 公共卫生学院,贵州 遵义 563003;3.遵义医学院附属医院 妇科,贵州 遵义 563000)
血清鳞状细胞癌抗原、组织蛋白酶D和糖类抗原125检测对宫颈鳞癌诊断及预测转移的应用价值*
王攀1,蒋智钢2,郑家深1,杨昌伟1,陈大勇3,王东红3
(1.遵义医学院附属医院 核医学科,贵州 遵义 563000;2.遵义医学院 公共卫生学院,贵州 遵义 563003;3.遵义医学院附属医院 妇科,贵州 遵义 563000)
目的探讨血清鳞状细胞癌抗原(SC C Ag)、组织蛋白酶D(C at h-D)、糖类抗原125(C A125)联合检测对宫颈鳞癌诊断及预测转移的临床应用价值。方法酶联免疫吸附法(ELISA)检测血清中SC C Ag和C at h-D水平,全自动化学发光免疫分析法检测C A125。收集2009年1月30日-2012年4月1日宫颈鳞癌患者(ⅠA2~ⅡA期)60例为研究组;宫颈上皮内瘤变组(C IN组)60例为对照组1;慢性宫颈炎组60例为对照组2。研究组在术前检测血清SC C Ag、C at h-D、C A125水平,分析血清SC C Ag、C at h-D、C A125水平与宫颈鳞癌、临床病理特征、转移及复发之间的相关性。结果宫颈鳞癌组手术前的SC C Ag、C at h-D和C A125水平分别为(1.41± 0.26)ng/m l、(19.14±1.52)ng/L和(17.42±0.90)u/m l,明显高于C IN组和慢性宫颈炎组,差异有统计学意义(P= 0.003、0.005、0.000、0.000、0.000和0.000);SC C Ag、C at h-D水平与宫颈鳞癌临床分期、肿瘤体积、分化程度、间质浸润深度、脉管癌栓、宫旁转移、盆腔淋巴结转移有不同程度相关,差异有统计学意义(P<0.05),C A125水平变化与宫颈癌间质浸润深度密切相关,差异有统计学意义(P=0.007)。应用工作特征曲线(R O C)分析SC C Ag、C at h-D和C A125诊断宫颈鳞癌的临界值分别为1.03 ng/m l、13.58 ng/L和8.16 u/m l,预测转移临界值分别为3.21 ng/m l、21.20 ng/L和12.45 u/m l,曲线下面积(AU C)分别为0.954、0.905和0.718。结论血清SC C Ag和C at h-D水平对宫颈鳞癌的诊断、临床分期、预判复发具有很高的临床诊断价值;SC C Ag、C at h-D和C A125 3项指标联合使用,可明显提高预测宫颈鳞癌转移的临床价值。
宫颈鳞癌;鳞状细胞癌抗原;组织蛋白酶D;糖类抗原125;诊断;转移
宫颈癌发展迅猛,在全球妇女羅患的恶性肿瘤中排第2位[1],以宫颈鳞癌居多,每年有超过28万患者死亡,在中国每年新增宫颈癌病例约13.5万[2],占全球数量的1/3[3],发病率逐年上升,且趋于年轻化[4]。肿瘤一旦转移常常提示预后不佳[5]。因此,寻找早期诊断宫颈癌的肿瘤标志物,可能为治疗方案的制定提供一定的参考依据。目前联合检测鳞状细胞癌抗原(squam ous cel l carci nom a ant i gen,SCCAg)、组织蛋白酶D(Cat hepsi n-D,Cat h-D)和糖类抗原125 (carbohydrat e ant i gen 125,CA125)以诊断宫颈鳞癌、预测转移及复发的报道较少,本文通过检测宫颈鳞癌患者血清SCCAg、Cat h-D和CA125水平,探讨其在宫颈鳞癌诊疗中的临床价值。
1 材料与方法
1.1标本来源
选取2009年1月30日-2012年4月1日在遵义医学院附院妇科病房住院行手术治疗,并经病理确诊的宫颈鳞癌患者60例为研究组,年龄32~65岁,平均(45.00±3.28)岁。按照2009年国际妇产科联盟(Int ernat i onal Federat i on of Gynecol ogy and Ob st et ri cs,FIGO)分期,其中ⅠA2期10例,ⅠB1期13例,ⅠB2期15例,ⅡA期22例。随机选取同期在本院妇科门诊和/或病房诊治后经病理确诊的宫颈上皮内瘤变(cervi cal i nt ra-epi t hel i al neopl asi a,CIN)60例为对照组1,慢性宫颈炎60例为对照组2。所有入选患者均排除支气管囊肿、妊娠、牛皮癣、肺结核、湿疹及盆腔炎症。各组年龄比较差异无统计学意义(P= 0.215)。
1.2主要试剂与仪器
采用酶联免疫吸附法(enzym e-l i nked i m m unosorbent assay,ELISA)检测SCCAg和Cat h-D水平,试剂由上海信裕生物科技有限公司提供,检测仪器为荷兰W el l scan M K2酶标仪;全自动化学发光免疫分析法检测CA125水平,仪器为Im m ul i t e 2000,试剂由西门子公司提供。所有操作严格按照说明书进行。
1.3结果判断标准
选择体检健康女性60例(均行妇科检查及宫颈刮片检测),检测SCCAg、Cat h-D和CA125水平确定参考值。取95%可信区间(conf i dence i nt erval,CI),SCCAg为 0.1~0.7 ng/m l,≥0.7 ng/ml为阳性;Cath-D为4.3~7.5 ng/L,≥7.5ng/L为阳性;CA125为2.1~8.9 u/m l,≥8.9 u/m l为阳性。
1.4统计学方法
采用SPSS 18.0统计软件进行数据分析,计量资料用均数±标准差(±s)表示,运用单因素方差分析(One-way ANOVA),两两比较用LSD法,检验水准为0.05。检测结果以敏感性为纵轴,以误诊率为横轴,绘制工作特征曲线(recei ver operat i ng charact eri st i c curve,ROC),计算曲线下面积(area under curve,AUC)和标准误,ROC曲线下面积<0.70表示准确性较低,0.70~0.90为中等,>0.90为较高。其中联合检测结果变量即预测概率由Logi st i c回归产生,P<0.05为差异有统计学意义。
2 结果
2.1研究组与对照组的 SC C Ag、C at h-D和C A125水平比较
宫颈鳞癌组SCCAg、Cat h-D和CA125水平升高。方差分析表明,各组间SCCAg、Cat h-D和CA125水平比较,差异有统计学意义。见表1。
进一步两两比较结果表明,宫颈鳞癌组与CIN组和慢性宫颈炎组间差异有统计学意义(①SCCAg:宫颈鳞癌组vsCIN组,t=22.286,P=0.003;慢性宫颈炎组vs宫颈鳞癌组,t=20.333,P=0.005;②Cat h-D:宫颈鳞癌组vs CIN组,t=17.385,P=0.000;慢性宫颈炎组 vs宫颈鳞癌组,t=16.333,P=0.000;③CA125:宫颈鳞癌组vsCIN组t=16.887,P=0.000;慢性宫颈炎组vs宫颈鳞癌组,t=17.815,P=0.000);CIN组SCCAg、Cat h-D、CA125与慢性宫颈炎组比较,差异无统计学意义(t=1.952、1.052和0.927,P= 0.144、0.289和0.493)。
2.2SC C Ag、C at h-D、C A125与不同病理参数的相关性
宫颈鳞癌组血清SCCAg、Cat h-D水平与临床分期、分化程度、间质浸润深度、肿瘤体积、阴道残端浸润、脉管癌栓、盆腔淋巴结转移有不同程度相关,差异有统计学意义(P<0.05),CA125水平变化与宫颈癌间质浸润深度有关,差异有统计学意义(P<0.05)。见表2、3。
2.3宫颈鳞癌诊断、预测转移的敏感性与特异性
应用ROC曲线,依据敏感性与特异性之和最大化原则,计算出血清SCCAg、Cat h-D和CA125诊断宫颈鳞癌的临界值分别为1.03 ng/m l、13.58 ng/L和8.16u/m l,预测转移临界值分别为3.21ng/m l、21.20ng/L 和12.45 u/m l。敏感性:Cat h-D>SCCAg>CA125;特异性:SCCAg>Cat h-D>CA125。3项指标联合检测时敏感性(0.99)和特异性(0.98)均显著提高。见表4。
2.4R O C曲线面积预测宫颈鳞癌转移
计算SCCAg、Cat h-D和CA125的ROC曲线下面积,分别为0.954、0.905和0.718,从单项独立指标分析看出,预测宫颈鳞癌转移的准确性:SCCAg>Cat h-D>CA125;联合检测的ROC曲线下面积增加到0.977,明显提高预测宫颈鳞癌转移的准确性。见表5。
表1 各组血清SC C Ag、C at h-D和C A125检测水平比较(n=60,ng/m l,±s)

表1 各组血清SC C Ag、C at h-D和C A125检测水平比较(n=60,ng/m l,±s)
组别C A 1 2 5/ (u / m l)宫颈鳞癌组 1 . 4 1 ± 0 . 2 6 1 9 . 1 4 ± 1 . 5 2 1 7 . 4 2 ± 0 . 9 0 C I N组 0 . 4 4 ± 0 . 0 8 7 . 6 6 ± 0 . 6 6 9 . 0 3 ± 0 . 5 7慢性宫颈炎组 0 . 5 6 ± 0 . 0 8 8 . 3 5 ± 0 . 7 1 8 . 5 9 ± 0 . 8 4 F值 3 0 7 . 1 9 1 1 9 0 . 7 0 9 2 0 0 . 7 3 8 P值 0 . 0 0 0 0 . 0 0 0 0 . 0 0 0 S C C A g/ (n g / m l )C a t h -D/ (n g / L )
表2 SC C Ag、C A125和C at h-D与病理参数的相关性 (±s)

表2 SC C Ag、C A125和C at h-D与病理参数的相关性 (±s)
病理参数例数S C C A g/ (n g / m l )F 值P 值C A 1 2 5/ (u / m l )F 值P 值C a t h -D/ (n g / L )F 值P值临床分期ⅠA 2 1 0 1 . 0 5 ± 0 . 2 5 1 1 . 2 3 ± 3 . 2 6 1 1 . 8 2 ± 2 . 0 6 ⅠB 1 1 3 1 . 1 3 ± 0 . 2 1 1 6 . 4 9 ± 7 . 9 8 1 2 . 3 0 ± 4 . 9 4 5 . 7 0 8 0 . 0 2 2 1 . 1 6 9 0 . 3 8 0 6 . 7 4 5 0 . 0 1 4 ⅠB 2 1 5 2 . 5 0 ± 1 . 4 6 1 7 . 5 6 ± 7 . 2 8 1 7 . 4 3 ± 4 . 2 4 ⅡA2 2 3 . 4 4 ± 0 . 7 4 2 1 . 3 3 ± 7 . 1 6 2 5 . 5 3 ± 5 . 0 5分化程度低1 3 4 . 1 7 ± 0 . 2 1 2 5 . 6 5 ± 7 . 6 1 1 9 . 4 3 ± 3 . 6 7 中3 7 3 . 7 4 ± 1 . 0 6 5 . 9 1 5 0 . 0 3 8 1 8 . 0 2 ± 6 . 4 6 4 . 1 2 0 . 1 3 2 1 5 . 6 0 ± 2 . 3 1 5 . 3 1 3 0 . 0 4 7 高1 0 2 . 0 6 ± 0 . 8 5 1 3 . 5 4 ± 4 . 1 3 1 2 . 3 1 ± 1 . 6 5间质浸润深度≤5 m m 2 2 1 . 4 2 ± 0 . 4 9 1 4 . 7 1 ± 1 . 4 7 1 2 . 3 0 ± 1 . 8 4 5 ~7 m m 1 8 2 . 7 1 ± 0 . 5 2 1 0 . 1 1 6 0 . 0 1 2 1 6 . 5 0 ± 1 . 4 0 1 2 . 6 5 9 0 . 0 0 7 1 1 . 1 1 ± 1 . 0 7 3 2 . 3 5 4 0 . 0 0 1 >7 m m 2 0 3 . 8 0 ± 0 . 8 7 2 1 . 2 5 ± 2 . 0 0 2 1 . 7 8 ± 2 . 2 4
表3 SC C Ag、C A125和C at h-D与病理参数的相关性 (±s)

表3 SC C Ag、C A125和C at h-D与病理参数的相关性 (±s)
病理参数例数S C C A g/ (n g / m l )t 值P 值C A 1 2 5/ (u / m l )t 值P 值C a t h -D/ (n g / L )t 值P值肿瘤体积≤4 c m 3 5 2 . 3 7 ± 0 . 3 1 1 6 . 7 7 ± 2 . 2 2 1 9 . 2 5 ± 0 . 7 9 >4 c m 2 5 3 . 8 5 ± 0 . 6 1 3 . 7 5 8 0 . 0 2 0 2 0 . 6 9 ± 1 . 4 8 2 . 5 4 6 0 . 0 6 4 1 3 . 7 3 ± 1 . 3 3 6 . 1 8 4 0 . 0 0 3阴道残端浸润阴性5 2 2 . 5 3 ± 0 . 1 6 1 5 . 5 1 ± 0 . 9 3 1 7 . 6 3 ± 0 . 6 6阳性8 5 . 3 1 ± 0 . 5 2 8 . 9 3 3 0 . 0 0 1 1 7 . 8 4 ± 2 . 3 1 1 . 6 2 4 0 . 1 8 0 7 . 9 4 ± 0 . 8 8 1 5 . 3 3 9 0 . 0 0 0脉管癌栓阴性5 1 3 . 2 5 ± 0 . 8 6 1 5 . 9 5 ± 2 . 8 8 1 8 . 2 3 ± 1 . 1 3阳性9 5 . 5 0 ± 0 . 6 8 3 . 5 5 6 0 . 0 2 4 2 0 . 6 7 ± 1 . 5 3 2 . 5 0 0 0 . 0 6 7 2 3 . 0 7 ± 1 . 8 6 3 . 8 6 4 0 . 0 1 8盆腔淋巴结转移阴性4 4 2 . 2 0 ± 0 . 1 8 1 8 . 2 6 ± 1 . 2 3 1 5 . 0 1 ± 0 . 1 1阳性1 6 4 . 4 6 ± 0 . 3 8 9 . 4 4 5 0 . 0 0 1 2 2 . 2 4 ± 2 . 7 2 2 . 3 1 2 0 . 0 8 2 2 1 . 5 3 ± 0 . 7 3 1 5 . 2 7 1 0 . 0 0 0
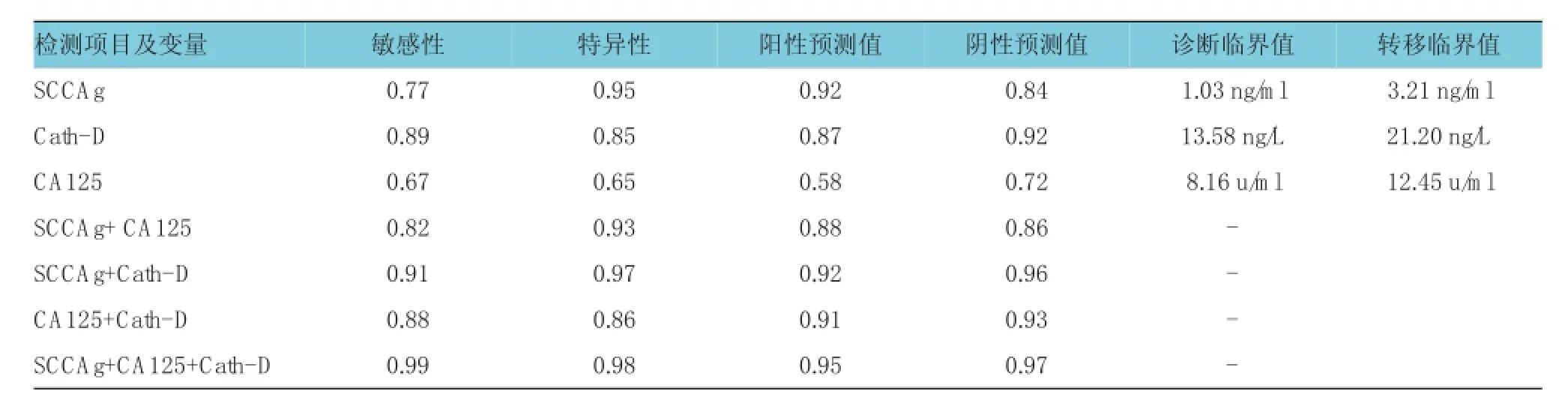
表4 血清SC C Ag、C at h-D和C A125及联合检测对宫颈鳞癌诊断、预测转移的价值

表5 血清 SC C Ag、C at h-D和C A125及联合R O C曲线下面积预测宫颈鳞癌转移价值
3 讨论
宫颈鳞癌的进展是一个从非典型增生到原位癌再到浸润癌的循序渐进过程[6],病因尚不完全明确[7],可能与多基因共同作用有关,系相关致癌因子激活原发基因使细胞增殖和凋亡紊乱所致。目前对宫颈鳞癌的早期诊断及预测转移尚无统一和规范的肿瘤标志物,韦羽梅等[8]研究显示,宫颈癌治疗效果与是否转移密切相关,因此寻找早期诊断和预测转移的指标是提高宫颈鳞癌诊疗效果的关键所在。SCCAg存在于鳞状细胞的胞浆内,是肿瘤相关抗原TA-4的亚单位,作为一种肿瘤标志物与各种器官的鳞状细胞癌相关[9],当鳞状细胞异常增生时,就会被动表达SCCAg并释放到人体外周血中,诱导细胞毒性T细胞的免疫活性,激发机体对肿瘤的免疫应答[10];Cat h-D是一种52kD的含天冬氨酸的糖蛋白,属于木瓜蛋白酶家族,存在于细胞内溶酶体,有分解细胞内蛋白、激活细胞内酶原和激素的作用,当肿瘤组织细胞代谢加强时,随着肿瘤的发展,Cat h-D也会明显升高[11]。有研究显示多种肿瘤患者体内均有Cat h-D高表达[12];CA125属于糖蛋白中的一种,在宫颈癌中的诊断价值曾有报道[13],但其敏感性和特异性均不高。
本文研究血清SCCAg、Cat h-D和CA125及联合检测对宫颈鳞癌诊断及预测转移的价值,结果显示,宫颈鳞癌组SCCAg、Cat h-D和CA125水平显著高于CIN组及慢性宫颈炎组,表明宫颈鳞癌与3项指标密切相关,对宫颈鳞癌的诊断具有非常重要的价值,与赵倩颖[14]报道一致。血清SCCAg和Cat h-D水平与宫颈鳞癌的临床分期、分化程度、瘤体大小、肿瘤浸润深度、脉管癌栓及盆腔淋巴结转移关系密切,可以作为独立预测转移的良好指标,与Gadducci等[15]报道一致。通过CA125诊断宫颈鳞癌浸润有较好的临床意义。
通过研究结果分析 SCCAg、Cat h-D和CA125与宫颈鳞癌发病的原因,机制如下:①宫颈鳞癌侵犯鳞状细胞基底层,SCCAg通过血管、淋巴管进入外周血导致水平升高;②癌细胞通过抑制细胞凋亡途径,使机体相关细胞的自杀机制产生抵抗[16],肿瘤细胞恶性生长,鳞状细胞基因表达和调控失常,受到浸润生长及分化程度的影响,参与凋亡调控的细胞高表达SCCAg;③Cat h-D水平升高,可能是宫颈鳞癌周围组织代谢加强,抑制自噬体的活性,使得Cat h-D的表达随着肿瘤进展而不断增强[17],同时Cat h-D刺激癌细胞的生长,降解基底膜和结缔组织[18],破坏宿主细胞外基质天然屏障,有利于肿瘤细胞侵袭[19];④Cat h-D可诱导uPA介导肿瘤相关蛋白溶解的级联效应,促进肿瘤细胞增殖、局部扩散[20],特别是在肿瘤浸润和转移的过程中蛋白水解酶发挥重要的作用[6];⑤Cat h-D纤溶酶原的水解片段还有抑制血管生成的作用,在缺氧条件下导致环氧化酶2表达,血管密度增加[21],促使肿瘤的形成;⑥CA125与宫颈鳞癌的间质浸润深度有直接关系,可能是因为肿瘤细胞的浸润,破坏正常组织细胞的基底膜,淋巴管侵袭导致CA125水平升高。
应用ROC曲线计算SCCAg、Cat h-D和CA125诊断宫颈鳞癌及预测其转移的临界值、敏感性、特异性和曲线下面积,结果显示SCCAg和Cat h-D在宫颈鳞癌的发生、发展、分化、侵袭、转移等过程中具有相互调控、诱导或信息传递的协同作用,既可单独成为宫颈鳞癌诊断和预测转移的指标,也可以联合使用;SCCAg具有很高的特异性,而Cat h-D有很好的敏感性。如将几项指标联合使用,可明显提高宫颈鳞癌的诊断和预测转移的敏感性和特异性,对宫颈鳞癌早期诊断、预测转移、治疗方案的制定有一定的临床价值。
[1]郭艳芳,刘晋洪,黄宝珍,等.深圳市宝安区2006~2011年恶性肿瘤发病趋势分析[J].中华肿瘤防治杂志,2013,20(9):650-655.
[2]Pan LL,Cheng JY,Zhou M,et al.The SUVm ax(m axi m um st andardi zedupt akeval uef or F-18f l uorodeoxygl ucose)and serumsquam ous cel l carci nom a ant i gen(SCC-Ag)f unct i on as prognost i c bi om arkers i n pat i ent s wi t h pri m ary cervi cal cancer[J]. J Cancer Res Cl i n Oncol,2012,13(8):239-246.
[3]丰有吉,沈铿.妇产科学[M].第2版,北京:人民卫生出版社,2011: 277-326.
[4]Chansaenroj J,Theam boonl ers A,Junyangdi kul P,et al.Pol ym orphi sm s i n TP53(rs1042522),p16(rs11515 and rs3088440)and NQO1(rs1800566)gense i n t hai cervi cal cancer pat i ent s wi t h H PV 16 i nf ect i on[J].Asi an Pac J Cancer Prev,2013,14(1):341-346.
[5]比丽克孜·艾克木,封敏,李秀梅,等.M TA1、M M P-2、M M P-7在宫颈癌中的表达及其意义[J].中国现代医学杂志,2013,23(29):51-54
[6]王文普,张爱丽,刘亮洪,等.P16和Ezri n在宫颈鳞癌中的表达及意义[J].中国现代医学杂志,2012,22(27):23-27.
[7]Tzenov YR,Andrews PG,Voi sey K,et al.H um an papi l l om a vi rus(H PV)E7-m edi at ed at t enuat i on of ret i nobl ast om a(Rb)i nduces hpygopus2 expressi on vi a E1f-1 i n cancer[J].M ol Cancer Res,2013,11(1):19-30.
[8]韦羽梅,姚德生,李菲,等.宫颈癌腹主动脉旁淋巴结转移的高危因素分析[J].中华肿瘤防治杂志,2013,20(14):1110-1112.
[9]王攀,刘毅,杨昌伟,等.应用ROC曲线分析血清SCCAg对宫颈鳞癌诊断及手术疗效的评估价值[J].中国妇幼保健,2012,27(25): 3875-3878.
[10]H om m a S,H arada M,Yano H,et al.Ident i f i cat i on of squam ous cel l carci nom a ant i gen deri ved pept i des havi ng t he capaci t y of i nduci ngcancer react i ve CTLs i n H LA-A24+cancer pat i ent s[J]. Int J Oncol,2006,29(3):577-587.
[11]王晓云,张凡,陈江平,等.自噬活性相关蛋白Cat hepsi n-D及LC3表达与宫颈鳞状细胞癌新辅助化疗耐药关系研究[J].中国妇幼保健,2012,27(4):609-611.
[12]M ebrat uYA,Di ckey BF,Evans C.The BH 3-onl y prot ei n Bi k/Bl k/Nbk i nhi bi t s uncl ear t ransl ocat i on of act i vat ed ERK1/2 t o m edi at e IFN-gam m a-i nduced cel l deat h[J].J Cel l Bi ol,2008,183(3):429-435.
[13]杨辉,郑君.联合检测血清SCCA、CA19-9及CA125对宫颈癌诊断及预后判断的临床意义[J].中国妇幼保健,2013,28(5):772-774.
[14]赵倩颖.鳞状细胞癌抗原在宫颈癌中的临床应用及其研究进展[J].中华妇幼临床医学杂志:电子版,2013,9(3):393-395.
[15]Gadducci A,Tana R,Fanucchi A,et al.Bi ochem i cal prognost i c f act ors and ri sk of rel apses i n pat i ent s wi t h cervi cal cancer[J]. Gynecol Oncol,2007,107(1):23-26.
[16]欧洋华,贾西彪,陈岑.血清鳞状细胞癌抗原检测对宫颈鳞癌的诊断价值[J].实用妇产科杂志,2013,29(5):345-347.
[17]金娜.Cat hepsi n-D、LC3的表达影响宫颈鳞状细胞癌化疗效果分析[J].中国妇幼保健,2014,29(10):1597-1599.
[18]Vasudev NS,Si mS,Cai rns DA,et al.Pre-operat i ve uri nary cat hepsi n Di s associ at ed wi t h survi val i n pat i ent s wi t h renal cel l carci nom a[J].Br J Cancer,2009,101(7):1175-1182.
[19]陈桂,黄德琪.宫颈癌患者血清组织蛋白酶D检测及临床意义[J].国际检验医学杂志,2013,34(23):3239-3240.
[20]戚玮琳,李勇,陆洪芬.红景天对乳腺癌抑制作用的研究[J].中华肿瘤防治杂志,2007,14(17):1292-1295.
[21]M yo K.Predi ct i on of occul t cervi cal l ym ph node m et ast asi s i n pat i ent s wi t h st ageI-Ⅱ squam ous cel l carci nom a of t he oral cavi t y[J].Kokubyo Gakkai Zasshi,2006,73(1):100-106.
(申海菊 编辑)
Value of serum SCCAg,Cath-D and CA125 in diagnosis and metastasis-prediction of cervical squamous carcinoma*
Pan Wang1,Zhi-gang Jiang2,Jia-shen Zheng1,Chang-wei Yang1,Da-yong Chen3,Dong-hong Wang3
(1.Department of Nuclear Medicine,the Affiliated Hospital of Zunyi Medical College,Zunyi,Guizhou 563000,China;2.School of Public Health,Zunyi Medical College,Zunyi,Guizhou 563003,China;3.Department of Gynecology,the Affiliated Hospital of Zunyi Medical College,Zunyi,Guizhou 563000,China)
Objective To evaluate the clinical application value of detecting the serum levels of squamous cell carcinoma antigen(SCCAg),cathepsin-D(Cath-D)and carbohydrate antigen(CA125)in the diagnosis and prediction of the metastasis of squamous carcinoma of the cervix(SCC).Methods Serum levels of SCCAg and Cath-D were tested by ELISA,and CA125 level was detected by chemiluminescent immunoassay.All the cases were collected from Jan.30,2009 to Apr.1,2012.The experiment group consisted of 60 cases withstageⅠA2-ⅡASCC.The control group was divided into two subgroups:cervical intraepithelial neoplasia(CIN)group and chronic cervicitis group with 60 cases in each group.Serum levels of SCCAg,Cath-D and CA125 in the experimental group were detected before operation.Then the relationships of serum SCCAg,Cath-D and CA125 levels with pathological features,metastasis and relapse of SCC were analyzed.Results The preoperative serum levels of SCCAg,Cath-D and CA125 in the experiment group were(1.41±0.26)ng/ml,(19.14±1.52)ng/L and(17.42±0.90)u/ml respectively,which were significantly higher than those in the two control groups(P= 0.003,0.005,0.000,0.000,0.000 and 0.000).The serum levels of SCCAg and Cath-D had different degrees of correlations with clinical stage,gross tumor volume,tumor cell differentiation,depth of interstitial infiltration,vascular tumor embolus,para-uterine metastasis,and pelvic lymph node metastasis of SCC,and the differences were significant(P<0.05).The change of CA125 level was only related to the depth of interstitial invasion of cervical cancer,and the difference was significant(P=0.007).Based on the ROC analysis,the critical values of SCCAg,Cath-D and CA125 for diagnosis of SCC were 1.03 ng/ml,13.58 ng/L and 8.16 u/ml;and the critical values for predicting metastasis were 3.21 ng/ml,21.20 ng/L and 12.45 u/ml;and the area under the ROC curve(AUC)was 0.954,0.905 and 0.718,respectively.Conclusions Detection of SCCAg and Cath-D in serum has high clinical value for diagnosing and staging SCC as well as predicting its recurrence. The combination of SCCAg,Cath-D and C A125 could improve the accuracy of predicting metastasis of SCC.
squamous carcinoma of cervix;squamous cell carcinoma antigen;cathepsin-D;carbohydrate antigen 125;diagnosis;metastasis
R 337.33
A
1005-8982(2016)05-0042-06
10.3969/j.i s s n.1005-8982.2016.05.009
2015-11-19
*
贵州省科技厅基金(No:黔科合2008I219)
王东红,E-m ai l:wangdonghong1970@126.com;Tel:13985645709
