E3泛素连接酶Siah-1与糖尿病血管内皮损伤的关系研究
2016-08-08谷巍张雪坤赵正历孙殿静路玉李耿建林
谷巍,张雪坤,赵正历,孙殿静,路玉李,耿建林
(河北省衡水市哈励逊国际和平医院 内分泌科,河北 衡水 053000)
E3泛素连接酶Siah-1与糖尿病血管内皮损伤的关系研究
谷巍,张雪坤,赵正历,孙殿静,路玉李,耿建林
(河北省衡水市哈励逊国际和平医院 内分泌科,河北 衡水 053000)
目的探讨E3泛素连接酶Si ah-1与糖尿病血管内皮损伤的关系。方法器官浴槽和血管张力系统测定雄性C 57BL/6小鼠,以及雄性db/db糖尿病小鼠的离体胸主动脉血管张力;蛋白质印迹法(W es t ern bl ot)和酶联免疫吸附法(ELISA)测定小鼠Si ah-1和连环蛋白(β-cat eni n)水平。结果糖尿病小鼠离体胸主动脉血管对乙酰胆碱(Ach)引发的舒张反应低于正常小鼠(t=24.270,P=0.000),Si ah-1抑制剂孵育30 m i n的糖尿病小鼠对Ach引发的舒张反应与正常小鼠无明显差异(t=1.991,P=0.327)。各组小鼠对硝普钠(SN P)引发的血管舒张呈现良好的反应,差异无统计学意义(F=0.145,P=0.541)。经Si ah-1抑制剂处理的糖尿病小鼠Si ah-1浓度明显降低(t=5.483,P=0.017),而β-cat eni n浓度明显升高(t=6.670,P=0.023)。在有β-cat eni n抑制剂的情况下,使用Si ah-1抑制剂的糖尿病小鼠血管内皮舒张反应明显低于正常小鼠(t=1.441,P=0.378)。结论E3泛素连接酶Si ah-1参与了糖尿病血管内皮损伤的过程,其机制可能与对β-cat eni n信号通路的影响有关。
E3泛素连接酶Si ah-1;糖尿病;血管内皮损伤
研究表明,血管内皮功能损伤是糖尿病血管并发症的始动因素,也是造成糖尿病患者致残致死的重要原因[1-2]。E3泛素连接酶Si ah-1具有多种生物功能,可与多种不同底物蛋白结合,将其泛素化并通过蛋白酶体途径降解,从而参与细胞周期调控和细胞分化凋亡等过程[3-5]。关于Si ah-1的研究虽然很多,但有关Si ah-1与糖尿病血管内皮细胞功能损伤的研究尚缺乏详细报道。据文献调研,Si ah-1能够介导β-cat eni n蛋白的泛素化和降解,而β-cat eni n能够调控血管内皮细胞的增殖和凋亡,推测Si ah-1可能通过β-cat eni n信号通路引起血管内皮损伤[6]。本研究旨在探讨Si ah-1在糖尿病血管内皮功能损伤中的作用,现报道如下。
1 材料与方法
1.1材料与动物
1.1.1实验材料M yograph血管张力系统620M(丹麦DM T公司),M acLabA/D张力换能器和PowerLab信号系统(澳大利亚PowerLab公司),乙酰胆碱(Acet yl chol i ne,Ach)、去氧肾上腺素(Phenyl ephri ne,Phe)和硝普钠(sodi um ni t roprussi de,SNP)(美国Si gm a公司),Si ah-1抑制剂和β-cat eni n抑制剂(美国St em RD公司),Si ah-1一抗、兔抗鼠Si ah-1二抗和 β-cat eni n酶联免疫吸附法(enzym e-l i nked i m m unosorbent assay,ELISA)试剂盒(美国Sant a Cruz公司)。
1.1.2实验动物雄性C57BL/6小鼠,以及雄性db/ db糖尿病小鼠,均购自上海斯莱克实验动物中心。购回后饲养于本院实验动物中心,维持室温(20±2)℃,相对湿度60%。本实验遵循《实验动物保护条例》,对实验动物进行严格的检验检疫和饲育管理。
1.2方法
1.2.1离体胸主动脉血管环准备小鼠吸入二氧化碳CO2处死,迅速取胸主动脉血管,置于4℃含有5%CO2和95%氧O2混合气体的改良Krebs液(pH= 7.4,氯化钠NaCl=119.0m m ol/L,氯化钾KCl=4.7m m ol/L,碳酸氢钠NaH CO3=25.0m m ol/L,磷酸二氢钾KH2PO4= 1.2 m m ol/L,氯化钙CaCl2·2H2O=2.5 m m ol/L,氯化镁M gCl2·6H2O=1.0 m m ol/L,葡萄糖=11.0 m m ol/L),小心分离主动脉血管周围附着的脂肪和结缔组织,然后剪成2~3 m m长的血管环。通过2根细不锈钢丝将血管环悬挂于预先装有20 m l改良Krebs液的器官浴槽,维持温度37℃,并持续通5%CO2和95%O2混合气体。1根钢丝连接肌张力换能器,另1根钢丝固定于标本架,调节血管环静息张力至2.0 g,平衡90 m i n。在Krebs液中加入6×10-2m ol/L的KCl溶液,引发血管收缩以检测血管收缩功能,然后冲洗、平衡3次。实验前,加入10-6m ol/L Phe引发血管收缩,再加入1×10-6m ol/L的Ach以检测血管内皮舒张功能,选择舒张>80%的胸主动脉血管环用于张力测定。
1.2.2离体血管张力测定①调节血管环静息张力至2.0 g,平衡90 m i n。在Krebs液中加入1×10-6m ol/L 的Phe,待血管收缩稳定后,按1×10-9~1×10-4m ol/L的浓度依次加入Ach(或者依次加入1×10-10~1× 10-5m ol/L SNP),记录每一浓度下主动脉环的张力。②在Krebs液中加入1×10-6m ol/L Si ah-1抑制剂预处理血管30 m i n,再加入1×10-6m ol/L Phe,待血管收缩稳定后,按1×10-9~1×10-3m ol/L浓度依次加入Ach,记录每一浓度下主动脉环的张力。③在Krebs液中加入1×10-6m ol/L的β-cat eni n抑制剂和Si ah-1抑制剂预处理血管30 m i n,再加入1×10-6m ol/L Phe,待血管收缩稳定后,按1×10-9~1×10-3m ol/L浓度依次加入Ach,记录每一浓度下主动脉环的张力。
1.2.3W es t ern bl ot检测SIAH-1水平提取小鼠血管内皮细胞蛋白,考马斯亮蓝法测定蛋白浓度。取50μg等量总蛋白上样,恒压80 V过浓缩胶,恒压120 V过分离胶,电泳分离。恒压80 V转膜2 h至硝酸纤维膜。三羟甲基氨基甲烷缓冲盐溶液(t ri s buf f ered sal i neand t ween 20,TBST)淋洗3×10 m i n,5%脱脂奶粉室温封闭1 h,一抗,4℃孵育过夜。第2天,TBST淋洗3×10 m i n。荧光二抗,37℃下孵育1 h。TBST淋洗3×10 m i n,增强化学发光法(enhanced chem i l um i nescence,ECL)显色。采用图像分析软件,以β-act i n为内参,进行光密度值分析。
1.2.4ELISA检测β-cat eni n水平提取小鼠血管内皮细胞,按照β-cat eni n ELISA试剂盒说明书操作,测定β-cat eni n水平。
1.3统计学方法
采用SPSS 19.0统计软件进行数据分析,计量资料以(±s)表示,多组间均数比较用方差分析,两两比较用t检验,P<0.05为差异有统计学意义。
2 结果
2.1Si ah-1在离体胸主动脉血管内皮舒张中的作用
选择内皮功能完好的胸主动脉血管环进行张力测定。加入Phe预收缩血管,再加入Ach或SNP引发血管舒张,比较各组小鼠对Ach引发的血管舒张反应,差异有统计学意义(F=7.731,P=0.032),其中糖尿病小鼠离体胸主动脉血管对Ach引发的舒张反应明显低于正常小鼠(t=24.270,P=0.000),而经过Si ah-1抑制剂孵育30 m i n的糖尿病小鼠对Ach引发的舒张反应与正常小鼠无明显差异(t=1.991,P=0.327),提示Si ah-1抑制剂可改变糖尿病小鼠对Ach引起的血管舒张反应。
各组小鼠对SNP引发的血管舒张呈现良好的反应,差异无统计学意义(F=0.145,P=0.541),提示糖尿病小鼠出现内皮依赖性血管舒张功能受损。见表1。

表1 小鼠离体胸主动脉血管舒张功能测定
2.2Si ah-1对β-cat eni n信号通路的影响
在前面的实验中,笔者发现Si ah-1抑制剂可改变糖尿病小鼠对Ach引发的血管舒张反应。Si ah-1抑制剂处理糖尿病小鼠后,采用W est ern bl ot和ELISA检测Si ah-1和β-cat eni n的浓度,结果发现经Si ah-1抑制剂处理的糖尿病小鼠Si ah-1浓度降低(t=5.483,P=0.017),而β-cat eni n浓度升高(t= 6.670,P=0.023),提示Si ah-1可能影响糖尿病小鼠β-cat eni n水平(见附图和表2)。为进一步研究Si ah-1对β-cat eni n通路的影响,采用β-cat eni n抑制剂处理糖尿病小鼠,以阻断β-cat eni n信号通路,再采用Si ah-1抑制剂处理该糖尿病小鼠,然后取离体胸主动脉血管测定血管张力,结果发现,在使用β-cat eni n抑制剂的情况下,Si ah-1抑制剂无法改变糖尿病小鼠对Ach引起的血管舒张反应(t= 1.441,P=0.378)(见表3)。以上结果提示,Si ah-1可能通过β-cat eni n信号通路参与糖尿病血管内皮损伤的过程。

附图 W est ern bl ot检测Si ah-1水平
表2 ELI SA检测β-cat eni n水平 (n=10,pg/m l,±s)
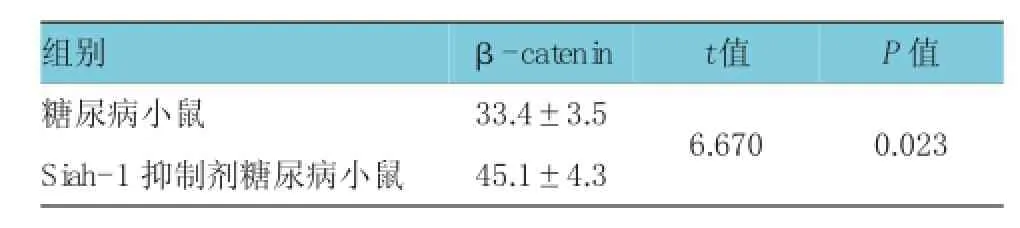
表2 ELI SA检测β-cat eni n水平 (n=10,pg/m l,±s)
组别P值糖尿病小鼠 3 3 . 4 ± 3 . 5 6 . 6 7 0 0 . 0 2 3 S i a h -1抑制剂糖尿病小鼠 4 5 . 1 ± 4 . 3 β -c a t e n i n t 值
表3 Ach引发的小鼠离体胸主动脉血管舒张 (n=10,%,±s)

表3 Ach引发的小鼠离体胸主动脉血管舒张 (n=10,%,±s)
组别P值糖尿病小鼠 1 8 . 7 ± 5 . 3 1 . 4 4 1 0 . 3 7 8 β -c a t e n i n / S i a h -1抑制剂糖尿病小鼠 2 2 . 3 ± 5 . 9最大舒张反应t 值
3 讨论
Si ah家族蛋白是一类由40~80个氨基酸组成的,具有高度保守性的蛋白[7]。其中Si ah-1蛋白含有一个Ri ng-dom ai n结构,该结构具有E3泛素连接酶的功能,可以介导β-cat eni n、腺癌息肉病基因(adenom at ous pol yposi s col i gene,APC)、c-M yb等多种蛋白质经过泛素-蛋白酶体途径降解[8-9]。Si ah-1具有多种生物学功能,有研究发现其具有肿瘤抑制因子的作用,可通过P21W af-1/Ci p-1途径抑制肿瘤细胞的增殖,可通过P53调节细胞凋亡[10-11]。而有关Si ah-1与糖尿病血管内皮细胞功能损伤的研究尚缺乏详细报道。β-cat eni n是由781个氨基酸组成的细胞黏附分子,是W nt信号通路中的重要转录激活因子,对细胞的增殖和分化起着重要的调控作用[12-13]。有研究显示,β-cat eni n可以通过抑制血管内皮细胞凋亡及促进其增生,以改善受损的血管内皮功能[14]。
本研究结果显示,Si ah-1抑制剂可以有效改变糖尿病小鼠对Ach引起的内皮依赖性血管舒张反应。因为Si ah-1可以介导β-cat eni n的泛素化和降解,因此笔者推测Si ah-1对血管内皮功能的作用可能与β-cat eni n有关。如果是的话,那么阻断该通路应该就能影响糖尿病血管内皮功能。为此,研究采用 Si ah-1抑制剂处理糖尿病小鼠,结果β-cat eni n浓度明显升高,进一步证明Si ah-1可以介导β-cat eni n的降解。如果Si ah-1是通过βcat eni n信号通路调控血管内皮功能,那么,在阻断β-cat eni n的情况下,Si ah-1抑制剂将无法改变Ach引起的血管舒张反应。为此,研究中采用β-cat eni n抑制剂处理糖尿病小鼠,以阻断β-cat eni n信号通路,再采用Si ah-1抑制剂处理该糖尿病小鼠,结果发现,在β-cat eni n抑制剂存在的情况下,Si ah-1抑制剂无法改变糖尿病小鼠对Ach引起的血管舒张反应。以上结果提示,Si ah-1可能通过β-cat eni n信号通路参与糖尿病血管内皮损伤的过程。
综上所述,E3泛素连接酶Si ah-1参与糖尿病血管内皮损伤的过程,其机制可能与对β-cat eni n信号通路的影响有关。抑制Si ah-1活性有望成为预防或治疗糖尿病血管内皮功能损伤的新方法,其具体应用有待进一步的研究。
[1]程森华,方朝晖.氧化应激对糖尿病血管内皮的损伤机制及中医药干预研究[J].中医药临床杂志,2012,24(2):163-165.
[2]乐岭,向光大,赵林双,等.糖尿病性肾脏疾病血管内皮功能的变化及其影响因素[J].中国糖尿病杂志,2012,20(2):111-113.
[3]李强,赵延欣,刘学源.SIAH蛋白研究进展[J].中国临床神经科学,2013,21(2):226-231.
[4]Qi J,Ki mH,Scort egagna M,et al.Regul at ors and ef f ect ors of Si ah ubi qui t i n l i gases[J].Cel l Bi ochemBi ophys,2013,67(1): 15-24.
[5]Li Q,W ang P,Ye K,et al.Cent ral rol e of SIAH i nhi bi t i on i n DCC-dependent cardi oprot ect i onprovokedbynet ri n-1/NO[J]. Proc Nat l Acad Sci USA,2015,112(3):899-904.
[6]Jum pert z S,H ennes T,Asare Y,et al.The β-cat eni n E3 ubi qui t i n l i gase SIAH-1 i s regul at ed by CSN5/JAB1 i n CRC cel l s[J]. Cel l Si gnal,2014,26(9):2051-2059.
[7]W ong CS,M öl l er A.Si ah:a prom i si ng ant i cancer t arget[J].Cancer Res,2013,73(8):2400-2406.
[8]W ang D,W ang Y,Kong T.H ypoxi a-i nduced β-cat eni n downregul at i on i nvol ves p53-dependent act i vat i on of Si ah-1[J].Cancer Sci,2011,102(7):1322-1328.
[9]M al z M,Aul m ann A,Sam ari n J,et al.Nucl ear accum ul at i on of seven i n absent i a hom ol ogue-2 support s m ot i l i t y and prol i f erat i on of l i ver cancer cel l s[J].V Int J Cancer,2012,131(9):2016-2026.
[10]Del Ri ncón SV,W i dschwendt er M,Sun D,et al.Cks overexpressi on enhances chem ot herapeut i c ef f i cacy by overri di ng DNA dam age checkpoi nt s[J].Oncogene,2015,34(15):1961-1967.
[11]Gri shi na I,Debus K,García-l i m ones C,et al.SIAH-m edi at ed ubi qui t i nat i on and degradat i on of acet yl-t ransf erases regul at e t he p53 response and prot ei n acet yl at i on[J].Bi ochi m Bi ophys Act a,2012,1823(12):2287-2296.
[12]Zhang YM,Zhang YY,Bul bul A,et al.Bai cal i n prom ot es embryo adhesi on and i m pl ant at i on by upregul at i ng f ucosyl t ransf eraseⅣ(FUT4)vi a W nt/bet a-cat eni n si gnal i ng pat hway[J]. FEBS Let t,2015,DOI:10.1016/j.f ebsl et.2015.04.011.
[13]Baum ül l er S,Lehnen H,Schm i t z,et al.The i m pact of i nsul i n t reat m ent on t he expressi on of vascul ar endot hel i al cadheri n and Bet a-cat eni ni nhum anf et opl acent al vessel s[J].Pedi at r Dev Pat hol,2015,18(1):17-23.
[14]Beard RSJ,H ai nes RJ,W u KY,et al.Non-m uscl e M l ck i s requi red f or β-cat eni n-and FoxO1-dependent downregul at i on of Cl dn5 i n IL-1β-m edi at ed barri er dysf unct i on i n brai n endot hel i al cel l s[J].J Cel l Sci,2014,127(8):1840-1853.
(申海菊编辑)
Relationship between E3 ubiquitin ligase SIAH1 and diabetic vascular endothelial injury
Wei Gu,Xue-kun Zhang,Zheng-li Zhao,Dian-jing Sun,Yu-li Lu,Jian-lin Geng
(Department of Endocrinology,Harrison International Peace Hospital of Hengshui City,Hengshui,Hebei 053000,China)
Objective To investigate the relationship between E3 ubiquitin ligase SIAH1 and diabetic vascular endothelial injury.Methods C57BL/6 rats and db/db rats were used in our study.Tension of isolated thoracic aorta was measured by organ bath and the vascular tension system.The levels of SIAH1 and βcatenin were detected by Western blot and ELISA.Results The vascular endothelial diastolic reaction induced by acetylcholine(Ach)in the db/db rats was significantly lower than that of the normal rats(t=24.270,P= 0.000).There was no significant difference in the vascular endothelial diastolic reaction induced by Ach between the db/db rats using SIANH1 inhibitor and the normal rats(t=1.991,P=0.327).There was no significant difference in the vascular endothelial diastolic reaction induced by sodium nitroprusside(SNP)between the db/db rats and the normal rats(F=0.145,P=0.541).The level of SIAH1 decreased(t=5.483,P= 0.017)and that of β-catenin increased(t=6.670,P=0.023)in the db/db rats using SIAH1 inhibitor.In the presence of β-catenin inhibitor,the vascular endothelial diastolic reaction of the diabetic rats using SIAH1 inhibitor had no significant difference from that of the normal rats(t=1.441,P=0.378).Conclusions E3 ubiquitin ligase SIAH1 is involved in the process of vascular endothelial injury in diabetes,the mechanismmay be related to its effect on β-catenin signal pathway.
E3 ubiquitin ligase SIAH1;diabetes;vascular endothelial injury
R 587.1
A
1005-8982(2016)05-0022-04
10.3969/j.i s s n.1005-8982.2016.05.005
2015-10-26
张雪坤,E-m ai l:3262407372@163.com
