长爪沙鼠原位肝移植模型的建立
2016-08-08卢领群周冰珞郭红刚石巧娟杜江涛萨晓婴
楼 琦,卢领群,周冰珞,郭红刚,李 巍,石巧娟,杜江涛,萨晓婴
(1.浙江省医学科学院实验动物中心,浙江省实验动物与安全性研究重点实验室,杭州 310010;2.浙江大学医学院,杭州 310053)
长爪沙鼠原位肝移植模型的建立
楼琦1,卢领群1,周冰珞2,郭红刚1,李巍1,石巧娟1,杜江涛1,萨晓婴1
(1.浙江省医学科学院实验动物中心,浙江省实验动物与安全性研究重点实验室,杭州310010;2.浙江大学医学院,杭州310053)
目的建立长爪沙鼠原位肝移植模型的方法与技术。方法用改良的双套管法行100 对长爪沙鼠原位肝移植手术,门静脉、肝下下腔静脉行套管吻合,而肝上上腔静脉采用缝合法,胆管内支架法完成胆道重建。结果在手术成熟后,供体手术时间为34.56±5.12 min,修肝及安置套管时间为15.43±2.75 min,受体手术时间为58.37±8.54 min,其中无肝期为23.66±4.47 min。手术成功率为86.67 %(术后存活6 h以上)。结论改良的双套管法成功建立了长爪沙鼠肝移植模型,通过手术技巧训练可提高手术成功率,延长爪沙鼠存活时间。
长爪沙鼠;肝移植;模型,动物
稳定,可靠的肝移植动物模型是临床肝移植和免疫耐受研究的基础。只有成熟稳定的动物模型作为技术平台,器官移植和免疫耐受研究才能有质的飞跃[1]。虽然大鼠肝移植模型是目前较为常用的动物模型,但封闭群大鼠用于该模型的稳定性和重现性有待进一步提高,虽然应用近交系大鼠造模的稳定性有所提高,但由于资源相对匮乏,不易获取,而且较为昂贵[2-4]。因此,进一步寻求稳定、易得的实验动物肝移植模型具有重要价值。
长爪沙鼠又称蒙古沙鼠(Meriones Unguieulataus, Mongolian gerbil),分类学上属于啮齿目、仓鼠科、沙鼠亚科、沙鼠属。近年来,作为重要的实验动物资源,长爪沙鼠在国内的使用越来越多,其应用领域也不断扩大,我国已将长爪沙鼠的标准化及其动物模型开发纳入实验动物领域重点支持范畴[5-6]。目前,国内外尚无有关长爪沙鼠应用于器官移植的报道,本文首次以长爪沙鼠作为供、受体,采用经典的Kamada “双套管法”[7]建立长爪沙鼠原位肝移植模型,探讨长爪沙鼠在器官移植中的应用前景,为长爪沙鼠的进一步开发应用提供依据。
1 材料和方法
1.1实验动物
长爪沙鼠,雄性,体重40~50 g,由浙江省实验动物中心提供【SCXK (浙) 2014-0001】,实验过程在屏障系统实验室中完成(空气洁净度7级,换气次数15~20次/h,温度20~26℃,日温差≤3℃,相对湿度40~70%)。动物使用许可证号【SYXK(浙)2014-0008】。长爪沙鼠饲喂60Co辐射灭菌的营养配合饲料,饮用超滤无菌水,笼器具、垫料等均经121℃高压灭菌。
1.2实验器材
乙醚(杭州市化学试剂厂)、氯胺酮针(100 mg/2 mL,杭州市第一制药厂),肝素注射液(5000 U/2 mL, 杭州市第一制药厂),显微手术器械(上海医药器械厂),缝合线(杭州华威医疗器械有限公司)均购自华东医药股份有限公司。超净工作台(苏州苏洁净化设备有限公司)。
1.3原位肝移植方法与步骤
1.3.1术前准备
供体和受体动物术前均禁食24 h,自由饮水。供体鼠体重接近或略小于受体鼠。供体鼠采用120 mg/kg氯胺酮腹腔注射麻醉,受体采用小剂量氯胺酮(50 mg/kg)腹腔注射加乙醚吸入联合用药麻醉[8]。手术在屏障系统实验室超净工作台内进行无菌操作。
1.3.2血管套管和胆管支架的制备
胆管支架长4.0 mm,外径1.0 mm,由硬膜外导管制成,两端修成斜面。
门静脉、肝下下腔静脉套管由聚乙烯塑料管制成,包含2.0 mm的套管柄和套管体。套管体上刻有横纹,以方便结扎固定。门静脉套管内径为1.5 mm,外径为 2.0 mm。肝下下腔静脉套管内径为1.8 mm,外径为2.0 mm。
1.3.3供肝切取[8-9]
肝脏暴露长爪沙鼠备皮麻醉后仰卧位固定,消毒,腹部行大十字切口。止血钳夹住剑突向头侧牵引固定,充分暴露肝脏,以生理盐水纱布覆盖供肝。切断镰状韧带,以8-0缝合线结扎紧贴着肝上下腔静脉的左膈下静脉。
处理胆管与肝门 将肝脏翻向头侧,用棉签游离胃小弯背腹侧的乳头叶和尾状叶,暴露胆总管,在左右肝管汇合处下1.5 mm 处剪一“V”形切口,插入胆管支架,5-0缝合线结扎固定,远端离断胆总管。
肝周血管的处理将肠管推向左侧,切断后腹膜与右下叶间的联系,从右肾静脉以上水平游离肝下下腔静脉,右肾动脉,以8-0缝合线结扎右肾静脉及右肾上腺静脉。
全血肝素化及肝灌流如图1所示,暴露腹主动脉及其分支,从髂静脉处穿刺,注射含100U 肝素的生理盐水 2 mL,使全血肝素化。以头皮针穿刺肾下端的腹主动脉,并快速剪破左侧膈肌进胸,阻断胸主动脉,同时剪开胸段下腔静脉,让灌流液流出。供体鼠经腹主动脉用0~4℃ 20 mL生理盐水(含25 U/mL 肝素) 灌注,速度为2.5 mL/min,肝脏呈土黄色时即表示灌注良好。钝性分离肝动脉,门静脉及其分支,用8-0缝合线结扎幽门静脉,远端离断,在幽门静脉结扎线以下1.0 mm处切断门静脉,切断左肾静脉水平的肝下下腔静脉、右肾上腺静脉及右肾静脉。紧贴膈肌离断肝上下腔静脉,取出供肝,并置于0~4℃的生理盐水中。
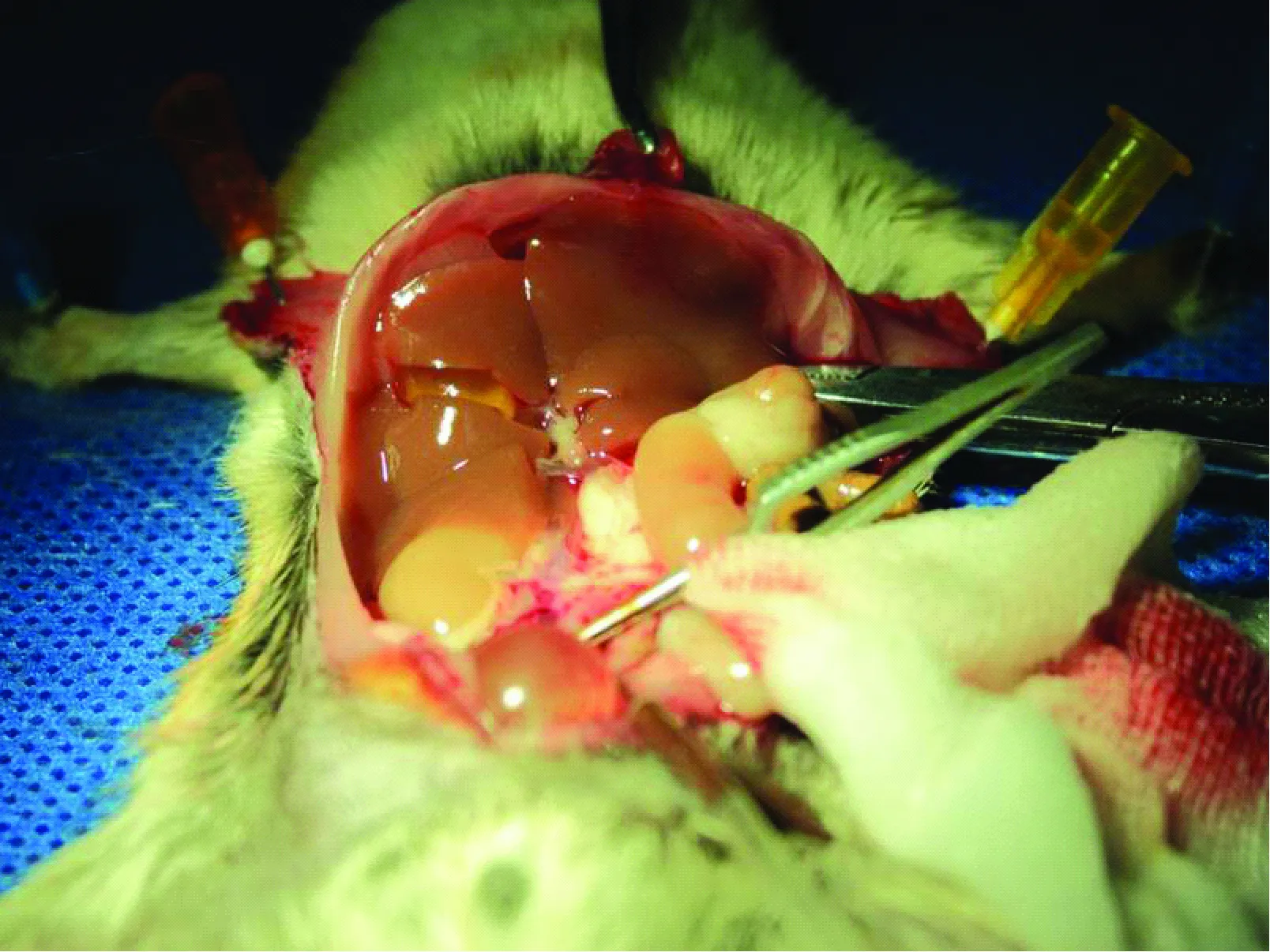
图1 供体肝脏灌注Fig.1 The donor liver perfusion
1.3.4修肝及套管的安置
修肝及套管的安置均在0~4℃的生理盐水冰浴中进行(图2)。去除门静脉及肝下下腔静脉周围的脂肪组织,将自制套管管柄朝下,用显微直镊将肝下下腔静脉从套管中拉出(图3),并将血管壁外翻套于套管上,用5-0的缝合线结扎固定。同法安装门静脉套管。在肝上下腔静脉两角用8-0带针缝合线各吊一针,作为两点式缝合的支持线,完毕后置于4℃冰箱保存。

图2 供体肝脏修整Fig.2 The donor liver adjustment
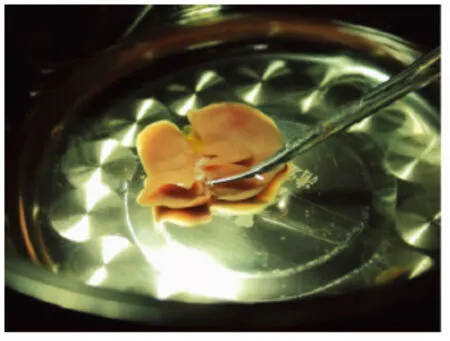
图3 供体肝脏套管插入与固定Fig.3 The placement of cuffs and bile duct stent
1.3.5受体肝切除[8-9]
与供肝同法暴露并游离肝脏,区别在于开腹切口略小,游离肝门内结构时应尽量靠近肝脏,受体内留有足够长度的胆道与血管,分离肝下下腔静脉时则在右肾静脉上缘水平。具体如下:如图4所示,腹部正中切口,用自制拉钩暴露肝脏,向左侧外移肠道并用生理盐水纱布覆盖。离断镰状韧带,缝扎左膈下静脉,游离左三角韧带,结扎离断食管与左肝之间的交通支。同供肝方法暴露胆总管并结扎离断,以8-0缝合线结扎肝动脉。游离右肾静脉平面之上的肝下下腔静脉,远离下腔静脉结扎右肾上腺静脉丛。离断右三角韧带,游离肝上下腔静脉,并在其后方放置一细橡皮条以备牵引。用动脉夹先后阻断右肾静脉水平以上的肝下下腔静脉以及幽门静脉以上的门静脉。于门静脉分叉处注入1 mL生理盐水将肝内血液驱入长爪沙鼠体内。牵引肝上预留的橡皮条,用动脉夹阻断肝上下腔静脉,切断近肝的肝上下腔静脉、门静脉和肝下下腔静脉,移出原肝(图5),密切注意后腹膜有无出血点。
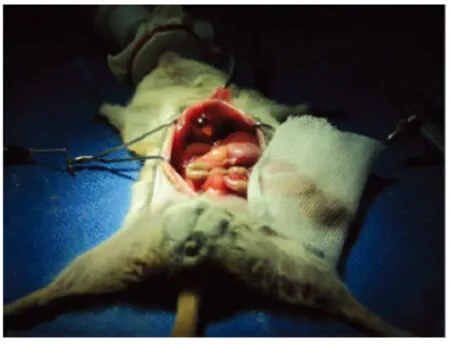
图4 受体肝脏切除Fig.4 The hepatectomy of receptor

图5 受体进入无肝期Fig.5 Receptor in no liver time
1.3.6供肝的植入
从冰水浴中取出供肝,置入上腹部,调整供肝和受体,使肝上下腔静脉处于最佳吻合位置。利用供肝肝上下腔静脉的2根预埋缝合线,从左到右连续缝合血管后壁再到前壁,结束吻合前用生理盐水冲洗管腔以排出气泡。肝上下腔静脉吻合完成后,将肝向头侧翻起,将门静脉动脉夹下移至脾静脉水平处,用生理盐水冲净血管腔内的血块和气泡,夹住供肝门静脉套管柄,将门静脉套管套入受体门静脉内,以5-0缝合线结扎固定。同法连接肝下下腔静脉。开放受体门静脉及肝上上、下腔静脉,结束无肝期(图6)。轻拉受体胆总管,在近结扎处前剪一V形切口,将供肝胆总管支架插入受体胆总管内,5-0缝合线结扎固定。将肠道放回原位,逐层关腹。术后保温,单笼饲养,待恢复正常饮食方可合群。

图6 受体植入供肝Fig.6 The implantation of donor liver
2 结果
预实验期共行长爪沙鼠原位肝移植40例,术后存活10例,存活时间最长13 h,最短45 min,无1例超过24 h。随着操作技术的成熟,在此基础上正式实验,共行长爪沙鼠原位肝移植60例。手术成功52例。供体手术时间为34.56±5.12 min,修肝及安置套管时间为15.43±2.75 min,受体手术时间为58.37±8.54 min,其中无肝期为23.66±4.47 min。术后存活时间6 h~12 h为4例,12 h~24 h 为5例,24 h~2 d 为8例,2 d~ 3 d 为20例,4 d以上为15例,最长存活时间为3个月。
手术中死亡原因主要为术中出血,血管吻合失败,无肝期过长等操作技术原因。术后死亡原因主要是血栓形成,术后出血,移植肝功能不良或失功,胆漏或胆道梗阻,术后感染。
3 讨论
3.1长爪沙鼠原位肝移植模型的意义
长爪沙鼠由于其独特的生理、解剖学和行为学特征,成为一种正在进行开发并具有广阔应用前景的多功能实验动物[5]。本课题组前期研究表明长爪沙鼠脂质代谢与人类相似,连续16周高脂饲料喂养,长爪沙鼠可发生脂肪肝系列病变最终导致肝纤维化的发生,提示长爪沙鼠在肝硬化研究具有潜在价值[10-13],该结果亦得到国内外多篇文献的证实[14-16]。本课题组近期通过外科手术联合高脂饮食的方法,初步建立了符合终末期肝硬化特征(肝硬化,门静脉高压,腹水等)的长爪沙鼠肝硬化模型,而肝移植是临床上治疗终末期肝硬化的根本解决办法,因此,长爪沙鼠原位肝移植模型的建立将为终末期肝硬化疾病的肝移植治疗与观察提供动物模型及技术支持。本课题组前期研究发现长爪沙鼠的天然免疫细胞功能和获得性免疫系统活化程度均显著低于大、小鼠[17],而本文所建立的长爪沙鼠原位肝移植模型将有利于观察长爪沙鼠肝移植后的免疫反应,为长爪沙鼠在器官移植中免疫学研究奠定基础。
3.2长爪沙鼠原位肝移植术式的选择及改进
小动物肝移植模型目前最常用的手术方式有单套管法(即门静脉行套管吻合),双套管法(门静脉、肝下下腔静脉行套管吻合和肝上上腔静脉采用缝合法),三套管法(门静脉、肝下下腔静脉、肝上上腔静脉均用套管吻合法)[2,18-19]。单套管法主要缺点是无肝期及受体总体手术时间相对较长,目前公认这两个时间的长短是术后存活情况的关键,缩短手术期及无肝期可减轻受体血流动力学、生化等方面的病理生理改变,减轻供肝的缺血再灌注损伤。因此,目前已经较少采用该术式。而三套管法虽然能有效减少无肝期(较双套管法平均缩短5~6 min),但在该法中,肝上上腔静脉较容易发生套管扭曲、脱落及血管通而不畅的并发症,上述结论在我课题组针对日常工作中近200例大鼠原位肝移植模型中亦得到证实[8]。本研究在参考Kamada等“双套管”吻合血管的基础上进行了改良,施行长爪沙鼠原位肝移植手术。改进如下:
(1)为减少长爪沙鼠在手术中的死亡率,麻醉深度(尤其是受体)的掌握是关键。常用的乙醚开放麻醉具有简单易操作的优点,但具有诱导期长,动物反抗激烈,不易固定的缺点[20]。本文中受体采用氯胺酮(50 mg/kg,腹腔注射)与乙醚(吸入)联合用药的方法,可有效避免上述缺点。术中偶尔会出现麻醉过深可导致呼吸抑制,或阻断肝上下腔静脉时,钳夹膈肌过多或下拉膈肌过猛,可造成呼吸骤停,此时采用10 mL注射筒联合胸腔按压进行类似人工呼吸的紧急抢救,效果理想。
(2)套管/支架的选择应视动物大小、血管/胆管粗细而异。总体原则是套管/支架在有一定硬度的条件下越薄越好,套管的内径与血管外径接近,过细或过粗都会发生回流不畅,静脉腔张开不全,甚至发生套管扭转、脱落。为方便结扎固定,需要加刻横槽。我们选用硬膜外导管和聚乙烯管分别作为套管和支架的材料,在加热后拉伸出不同的直径。
(3)在血管的吻合/缝合过程中,必须要用生理盐水冲洗管腔,可以防止血管壁粘连引起的血管狭窄,并用以排出气泡,避免由于空气栓塞导致的肝叶坏死,肝脓肿。在吻合胆管时亦应冲洗管腔,可减少术后胆道梗阻的发生。在缝合/吻合过程中,生理盐水的冲洗,还可使术野清晰,提高缝合/吻合的速度与质量。
(4)在肝移植术中,由于感染引起的肾功能、呼吸功能衰竭亦是术后死亡的主要原因。因此我们在术中十分注重无菌操作。首先,手术器械、棉签、纱布、手术衣等均经过高压灭菌。不可高压的物品如套管、胆管支架等均用戊二醛浸泡消毒;冰块亦用无菌手术巾包裹。其次手术在屏障系统实验室的超净工作台中完成。超净工作台按细胞无菌培养的有关规范进行环境控制。整个手术实验室亦定期用万洁进行喷雾消毒并擦拭天花板与墙面,术前用紫外灯照射。以上措施可有效减少感染的发生。
(5)长爪沙鼠的肝脏极为娇嫩,在供肝的获取过程中的任何接触均可造成局部微循环障碍,激活Kuffer 细胞,释放大量的ROS及炎症因子,最终加重肝脏的缺血再灌注损伤[21-22]。因此笔者在手术时动作轻柔,对供肝的保护始终放在重要位置。
总之,本文初步建立了长爪沙鼠原位肝移植模型。长爪沙鼠相对于大鼠要小的多,因而操作更为困难,该模型要求术者具有良好的显微外科操作技术,难度较大,初试者不易成功。本模型虽然术后长期存活问题还需进一步研究,操作方法有待进一步改进,但实验结果表明以长爪沙鼠作为实验动物,建立原位肝移植模型是具有可行性的。
[1]Jacob M, Lewsey JD, Sharpin C,etal. Systematic review and validation of prognostic models in liver transplantation. Liver Transpl[J]. 2005 ,11(7):814-25.
[2]Ishii E, Shimizu A, Takahashi M,etal. Surgical technique of orthotopic liver transplantation in rats: the Kamada technique and a new splint technique for hepatic artery reconstruction[J]. J Nippon Med Sch. 2013;80(1):4-15.
[3]Lu J, Wang S, Wen P,etal. A novel model for orthotopic liver transplantation in rats using hepatic rearterialization and biliary extradrainage system[J]. J Surg Res. 2014 ,187(2):690-8.
[4]周天保,陈规划,杨扬,等. 大鼠原位肝移植急性排斥反应模型的建立[J]. 中国实验动物学报,2009,17(2):120-124
[5]李长龙,杜小燕,陈振文,等. 长爪沙鼠资源开发利用进展[J]. 中国实验动物学报,2014,22(6):106-109,113.
[6]卢领群,宋晓明,戴方伟,等. 长爪沙鼠的生物净化技术[J]. 中国比较医学杂志,2014,24(4):62-66.
[7]Kamada N, Calne RY. Orthotopic liver transplantation in the rat. Technique using cuff for portal vein anastomosis and biliary drainage[J]. Transplantation. 1979,28(1):47-50.
[8]金晓音,楼琦,萨晓婴,等. 大鼠原位肝移植模型建立方法的若干问题探讨[J]. 中国比较医学杂志,2006,16(12):760-762.
[9]陈细桃,马毅,何晓顺,等. 大鼠原位肝移植的围手术期处理[J]. 中国比较医学杂志,2003,13(5):307-309.
[10]李巍,石巧娟,郭红刚,等. 动态分析沙鼠非酒精性脂肪肝病形成及生化影响[J]. 中国比较医学杂志,2011,21(8):44-48,52.
[11]李巍,石巧娟,郭红刚,等. 三种啮齿类动物非酒精性脂肪肝形成及机制探讨[J].中国实验动物学报,2012,22(1):76-80.
[12]Ying HZ, Liu YH, Yu B,etal. Dietary quercetin ameliorates nonalcoholic steatohepatitis induced by a high-fat diet in gerbils[J]. Food Chem Toxicol. 2013,52:53-60.
[13]刘月环,毛栋森,吴旧生,等. 高脂血症长爪沙鼠模型的转录组检测和代谢性炎症通路的初步研究[J].,中国比较医学杂志,2014,24(4):51-56.
[14]钟民涛,黄敏,王钜,等. 长爪沙鼠脂代谢的研究进展[J]. 实验动物科学与管理,2006,23(1):42-46.
[15]俞建顺,严茂祥,王德军,等. 高脂饮食对长爪沙鼠生化及主要脏器组织病理学的影响[J]. 中国比较医学杂志,2015,(4):38-43,47.
[16]钟民涛,黄敏,卢静,等. 长爪沙鼠速发型高脂血症模型的初步建立[J]. 中国实验动物学报,2006,14(3):217-221.
[17]肖丽,戴方伟,宋晓明,等. 长爪沙鼠在病原感染研究中的应用[J]. 中国比较医学杂志,2013,23(7):61-67.
[18]Nagai K, Yagi S, Uemoto S,etal. Surgical procedures for a rat model of partial orthotopic liver transplantation with hepatic arterial reconstruction[J]. J Vis Exp. 2013 ,7;(73):e4376.
[19]康俊升,王霞. 三种大鼠原位肝移植术式的比较研究[J]. 中国实验动物学杂志,2000,10(3):163-166.
[20]陈辉,姜骊,王雁,等. 三种不同麻醉药对SD大鼠肝移植手术麻醉效果的比较和应用[J]. 实验动物科学,2009,26(4):57-59,62.
[21]Liu C, Tsai HL, Chin T,etal. Clamping the supra-celiac aorta can effectively increase the success rate of orthotopic rat liver transplantation by increasing the tolerable time of the anhepatic phase[J]. J Surg Res. 2006,136(1):116-9.
[22]Oldani G, Maestri M, Gaspari A,etal. A novel technique for rat liver transplantation using Quick Linker system: a preliminary result[J]. J Surg Res. 2008 ,149(2):303-9.
Modified orthotopic liver transplantation in gerbils
LOU Qi1, LU Ling-qun1, ZHOU Bing-luo2, GUO Hong-gang1, LI Wei1, SHI Qiao-juan1, DU Jiang-tao1, SA Xiao-ying1
(1.Experimental Animal Center, Zhejiang Academy of Medical Sciences, Zhejiang experimental animal and safety research key laboratory, Hangzhou 310013, China;2.School of Medicine,Zhejiang University,Hangzhou 310058,China)
ObjectiveTo establish the orthotopic liver transplantation model in gebils. Methods Orthotopic liver transplantation was performed in 200 gerbils with modified two-cuff techniques. The suprahepatic vena cave was anastomosed end to end using nylon suture threat, the portal vein and the infrahepatic vena were inosculated by cuff method, respectively. Biliary tract reconstruction was completed in bile duct stent law. ResultAfter paractise, donor surgery time was 34.56±5.12 min, liver repaired time was 15.43±2.75 min, surgery receptor time was 58.37±8.54 min, no liver time was the success rate (survived more than 6 hours after operation)was 23.66±4.47 min. Conclusion Orthotopic liver transplantation with modified two-cuff techniques in gerbils is a certain feasible. Improving operative techniques is of great importance in increasing successful rate and prolonging the survival time of gerbils after surgery.
Gerbils;Liver transplantation ; Models, animal
国家自然科学基金(31301933);浙江省科技计划项目(2013C37012, 2013C37013, 2014C27011)。
楼琦(1982-),男,本科,实验师,专业:实验动物,E-mail:-liuqi@126.com。
萨晓婴,E-mail: saxiaoyin@163.com。
研究报告
R-332
A
1671-7856(2016) 05-0053-05
10.3969.j.issn.1671-7856. 2016.005.008
2016-02-02
