杨梅苷对大鼠离体心脏缺血再灌注损伤的保护作用
2016-08-08陈亚萍刘桂艳林文彬孙桂波孙晓波
陈亚萍,张 彬,刘桂艳,林文彬,王 敏,孙桂波,孙晓波
(1. 北京理工大学生命学院,北京 100081;2. 中国医学科学院北京协和医学院药用植物研究所,北京 100193;3. 哈尔滨商业大学生命科学与环境科学研究中心,哈尔滨 150076)
杨梅苷对大鼠离体心脏缺血再灌注损伤的保护作用
陈亚萍1,张彬2,刘桂艳1,林文彬3,王敏2,孙桂波2,孙晓波2
(1. 北京理工大学生命学院,北京100081;2. 中国医学科学院北京协和医学院药用植物研究所,北京100193;3. 哈尔滨商业大学生命科学与环境科学研究中心,哈尔滨150076)
目的研究杨梅苷对大鼠离体心脏缺血再灌注损伤的保护作用及其机制。 方法60只SD大鼠随机分为6组:正常对照组、模型组、阳性给药组(维拉帕米100 μg/L)和杨梅苷低中高剂量组(2.5, 5, 10 mg/L),每组10只。釆用Langendorff离体心脏灌流技术,停灌30 min,再灌45 min,造成心肌缺血再灌注损伤模型。记录杨梅苷对心脏血流动力学指标的影响,测定冠脉流出液中心肌三酶LDH、CK、AST的水平,心肌组织中抗氧化酶SOD、CAT的活性及脂质过氧化物MDA的含量。HE染色观察心肌组织病理学变化。Western blot检测凋亡相关蛋白的表达。 结果杨梅苷低中高剂量组大鼠心脏血流动力学指标显著改善,冠脉流出液中LDH、CK、AST的释放减少,心肌组织中SOD、CAT的活性增加且MDA的产生减少,不同程度地减轻缺血再灌注造成的心肌损伤。Western blot结果表明杨梅苷能上调Bcl-2的表达,下调Bax和Caspase-3、Caspase-9的表达,同时抑制ERK的磷酸化。 结论杨梅苷对心肌缺血再灌注损伤具有保护作用,可以改善心肌收缩功能、增强抗氧化能力、抑制细胞凋亡等,其机制可能是通过抑制ERK信号转导通路缓解缺血再灌注引起的心肌细胞凋亡。
杨梅苷;心肌缺血再灌注;心脏血流动力学;心肌三酶;细胞凋亡
缺血性心脏病(ischemic heart diseases, IHDs)是临床上最常见的心血管疾病,其发病率和死亡率正逐年上升。传统治疗方法一般采用药物溶栓、冠状动脉搭桥术、经皮腔内冠脉血管成形术等手段恢复心肌血液灌注[1]。但缺血期处于可逆损伤的心肌细胞恢复血液供应后损伤反而加重,并转化为不可逆性,这种损伤被称为缺血再灌注损伤(ischemia/reperfusion, I/R)[2]。I/R损伤造成了心脏血流动力学改变、心肌酶释放和心肌组织超微结构病变等影响,是导致心肌损害的重要因素。研究表明细胞内钙超载、线粒体功能紊乱、氧化应激、炎症反应、细胞凋亡、自噬等诸多因素均可能为缺血再灌注损伤的发生机制[3-4]。
杨梅苷(五羟基黄酮-3-鼠李糖,myricitrin)为天然多酚羟基黄酮苷类化合物,大量存在于杨梅的果实、树皮、树叶及其他多种天然植物中。文献报道杨梅苷具有抗氧化、清除氧自由基、扩张血管、抗炎镇痛、抑菌等多种功效,可改善氧化应激诱导的各种疾病如局部缺血和老年痴呆等[5-7]。本课题组研究表明表杨梅苷对血管内皮细胞的氧化应激损伤具有保护作用,并对其作用机制做了初步研究[8-9]。但是,杨梅苷对心肌缺血再灌注损伤是否具有保护作用目前尚不清楚。
本研究釆用Langendorff离体心脏灌流技术,建立大鼠离体心脏缺血再灌注损伤模型, 观察杨梅苷对缺血再灌注损伤心脏的血流动力学、心肌三酶、抗氧化酶等相关指标的影响,HE染色观察心肌组织病理学变化,Western blot检测凋亡相关蛋白的表达,探讨杨梅苷对心肌缺血再灌注损伤的保护作用及其机制,为开发新的有效的治疗缺血性心脏病的药物提供实验依据。
1 材料和方法
1.1实验动物
健康雄性SD大鼠,体重200~220 g,购于北京维通利华实验动物公司【SCXK(京)2012-0001】。动物分笼饲养于中国医学科学院药用植物研究所SPF 级动物房内【SYXK (京) 2013-0023】(温度22~25℃,湿度50%~70%,昼夜12 h交替),自由饮水及摄食。
1.2主要试剂和仪器
杨梅苷为淡黄色粉末,能溶于水,纯度98%,由中国医学科学院药用植物研究所化学室提供;盐酸维拉帕米注射液购于上海禾丰制药有限公司;肌酸激酶(CK)试剂盒、乳酸脱氢酶(LDH)试剂盒、天门冬氨酸氨基转移酶(AST)试剂盒、超氧化物歧化酶(SOD)试剂盒、过氧化氢酶(CAT)试剂盒、丙二醛(MDA)试剂盒购于南京建成生物工程研究所;一抗β-actin、Bcl-2、Bax、Caspase-3、Caspase-9和ERK、p-ERK均购于美国Santa Cruz公司;NaCl、KCl、CaCl2、KH2PO4、MgSO4·7H2O、NaHCO3、Glucose、EDTA-Na、浓HCl等均由北京化学试剂公司提供。其他试剂均为分析纯。
K-H液配制:用电子天平精密称取 NaCl 20.67 g,NaHCO36.27 g, KCl 1.05 g,KH2PO40.48 g,Glucose 5.99 g,MgSO4·7H2O 0.87 g,CaCl20.85 g充分溶解于1 L蒸馏水,用酸度计调节pH=7.40,通过真空抽滤除去杂质。
美国Radnoti 离体灌流系统;成都泰盟BL-420/820四道生理记录仪;天津奥特赛恩斯AP-01P型真空泵;梅特勒pH 计;DY89-Π型电动玻璃匀浆机;MQX200型酶标仪;TGL-16高速台式冷冻离心机;PYY-7C型电泳仪;Chemi DOCTM型凝胶成像系统。
1.3分组与给药
雄性SD大鼠60只,随机分为6组:正常对照组(Control)、模型组(Model)、阳性给药组(Verapamil 100 μg/L)和杨梅苷低中高剂量组(Myricitrin 2.5, 5, 10 mg/L),每组10只。
1.4 Langendorff离体心脏灌流技术检测血流动力学[10-11]
将SD大鼠用20%乌拉坦腹腔麻醉后,舌下静脉给予肝素(25 mg/kg)。迅速开胸,切断主动脉,取出心脏置于K-H营养液的玻璃器皿中,使心脏迅速停搏。分离主动脉,经主动脉逆行插管并结扎固定于灌流装置中的心脏套管上,釆用Langendorff法逆灌含氧K-H液,切开左心耳,将带有测压导管的球囊插入左心室,测压导管另一端连接多道生理记录仪,向球囊内缓缓注入适量蒸馏水。全过程采用K-H液灌注,并连续通入体积分数95% O2和5% CO2的混合气体,灌流液温度维持在37 ℃,灌流液流速恒定为7 mL/min。
正常对照组:待心脏功能处于稳定状态15 min后,恒定流速灌流90 min。模型组:待心脏功能处于稳定状态15 min后,恒定流速继续灌流15 min,然后停灌30 min,再灌45 min。阳性给药组:待心脏功能处于稳定状态15 min后,改用100 μg/L盐酸维拉帕米注射液恒定流速继续灌流15 min,然后停灌30 min,再灌45 min。杨梅苷低中高剂量组:待心脏功能处于稳定状态15 min后,恒定流速改用低中高(2.5, 5, 10 mg/L)浓度的杨梅苷继续灌流15 min,然后停灌30 min,再灌45 min。分别记录各组血流动力学参数,即左室发展压(left ventricular develop pressure, LVDP)、左室内压最大上升速率(maximal positive velocity of left ventricular pressure, +dp/dtmax)、左室内压最大下降速率(maximal negative velocity of left ventricular pressure, -dp/dtmax)、心率(heart rate, HR)。
1.5测定冠脉流出液中LDH、CK及AST的活性
收集再灌注45 min时的灌流液冻存于-80℃待测。按试剂盒说明书操作,测定灌流液中LDH、CK及AST的活性。
1.6测定心肌组织匀浆中LDH、CK、AST的活性,SOD、CAT的活性,MDA的含量
取出心脏,冰水浴研磨,制备10%心肌组织匀浆。按试剂盒说明书操作,测定心肌组织匀浆中LDH、CK、AST的活性, SOD、CAT的活性,MDA的含量。
1.7HE染色观察心肌组织病理情况
灌注完毕,将心脏迅速放入4%多聚甲醛中固定,经脱水,浸蜡包埋,切片与贴片,脱蜡染色,脱水透明,封固,观察心肌组织病理情况。
1.8Western blot检测凋亡相关蛋白表达
灌注完毕,低温下将心脏组织剪碎,加入RIPA蛋白裂解液(含蛋白裂解液、蛋白酶抑制剂和磷酸酶抑制剂),快速匀浆、裂解、离心,提取总蛋白。采用BCA蛋白定量法测定蛋白浓度,加入loading buffer煮沸5 min,使蛋白充分变性。取等量样本上样于10% SDS-聚丙烯酰胺凝胶电泳分离。电泳完毕后,将蛋白质转移至NC膜上,用5%脱脂牛奶室温封闭3 h。分别加入相应一抗(β-actin、Bcl-2、Bax、Caspase-3、Caspase-9、ERK、p-ERK),4 ℃孵育过夜。次日,用TBST洗涤3次,加入HRP标记的二抗,室温孵育2 h。再用TBST洗涤3次,加入增强型ECL显色液避光孵育5 min,用凝胶成像系统进行显影拍照。实验结果重复三次,用Gel-Pro 灰度分析软件计算各组蛋白条带灰度值,以β-actin为内参蛋白,各组蛋白水平以对照的百分比表示。
1.9统计方法

2 结果
2.1杨梅苷对大鼠离体工作心脏血流动力学指标的影响
平衡时,各组间的血流动力学指标均无显著性差异。停灌30 min,再灌45 min后,与正常对照组比较,模型组HR、LVDP、± dp/dtmax均明显降低(P< 0.05)。与模型组比较,阳性给药组和杨梅苷给药组HR、LVDP、± dp/dtmax均明显改善。且杨梅苷低中高剂量组对血流动力学指标的影响呈现出一定的剂量依赖关系,高剂量效果最好(图1)。

注:A. 心率HR;B. 左室发展压LVDP;C. 左室内压最大上升速率+ dp/dtmax;D. 左室内压最大下降速率-dp/dtmax。图1 杨梅苷对大鼠离体工作心脏血流动力学指标的影响 ± s, n=10 )Note: A. heart rate (HR); B. left ventricular develop pressure (LVDP); C. maximal positive velocity of left ventricular pressure (+ dp/dtmax); D. maximal negative velocity of left ventricular pressure (-dp/dtmax).Fig.1 Effect of myricitrin on myocardial hemodynamic parameters in isolated rat hearts ± s, n=10 )
2.2杨梅苷对大鼠离体工作心脏组织匀浆和冠脉流出液中LDH、CK及AST活性的影响
与正常对照组比较,模型组心肌组织匀浆中LDH、CK及AST活性明显降低(P< 0.01),灌流液中LDH、CK及AST活性明显升高(P< 0.01),说明缺血再灌注引起心肌组织受损,心肌三酶漏出量增加。与模型组相比,杨梅苷给药组心肌组织匀浆内LDH、CK及AST活性增高(P< 0.05),而灌流液中LDH、CK及AST活性明显降低(P< 0.05),并呈一定量效关系,提示杨梅苷可能通过增强心肌细胞膜稳定性,减少心肌三酶的漏出量,发挥心肌保护作用(图2)。
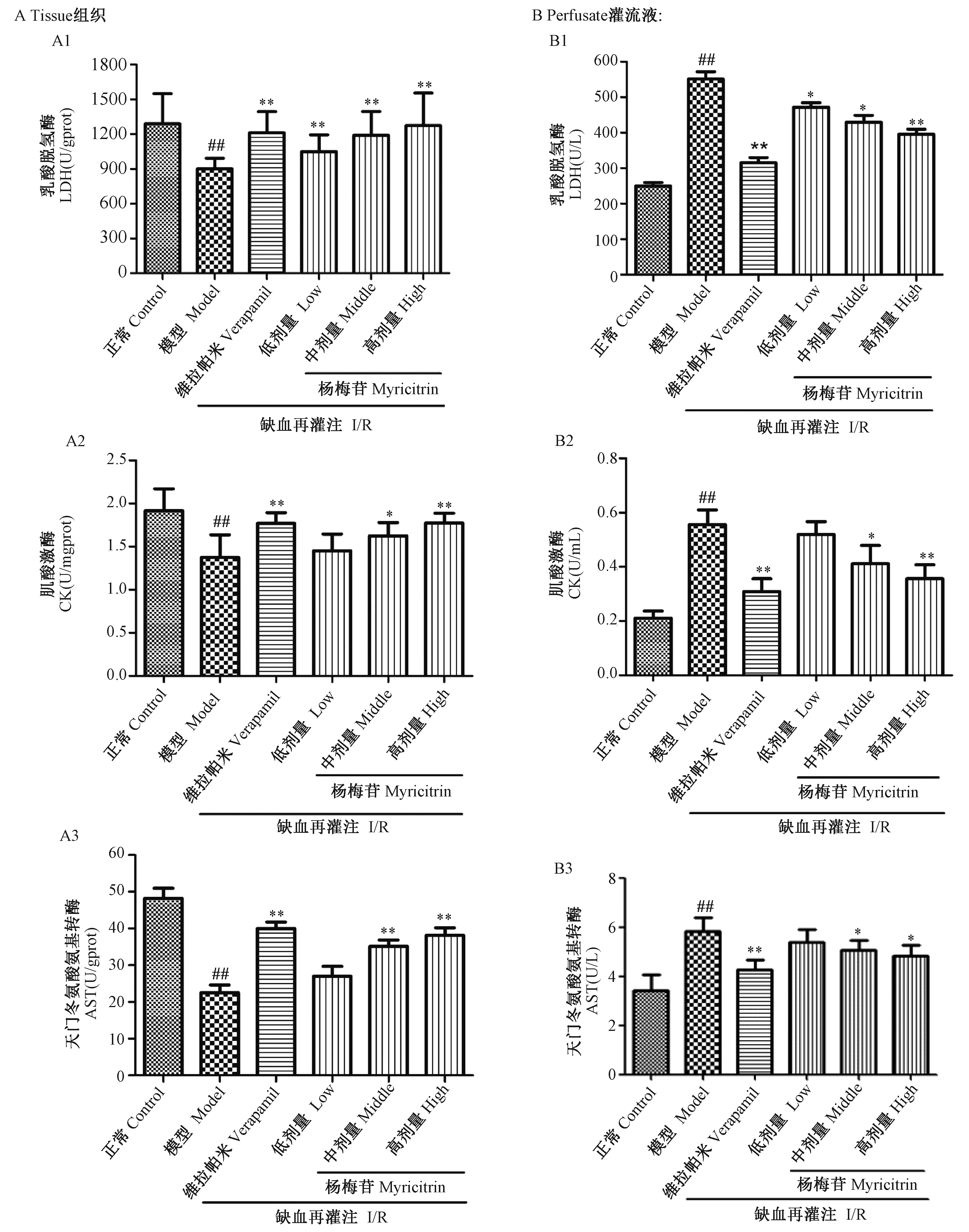
注:A. 心肌组织中心肌酶水平(A1. LDH(U/gprot);A2. CK(U/mgprot);A3. AST(U/gprot));B. 冠脉流出液中心肌三酶水平(A1. LDH(U/L);B2. CK(U/mL);B3. AST(U/L))。与正常组相比,##P < 0.01;与模型组相比,*P < 0.05,**P < 0.01。图2 杨梅苷对大鼠离体工作心脏组织匀浆和冠脉流出液中心肌酶水平的影响 ± s, n =10 )Note: A. The levels of cardiac enzymes in myocardial tissue (A1. LDH (U/gprot); A2. CK (U/mgprot); A3. AST (U/gprot)). B. The levels of cardiac enzymes release in perfusate (B1. LDH (U/L); B2. CK (U/mL); B3. AST (U/L)). ##P < 0.01, vs. the control group; *P < 0.05, **P < 0.01, vs. the model group.Fig.2 Effect of myricitrin on the levels of cardiac enzymes in myocardial tissue and perfusate after I/R ± s, n=10 )
2.3杨梅苷对大鼠离体工作心脏组织匀浆SOD、CAT活力及MDA含量的影响
与正常对照组比较,模型组大鼠心肌组织中SOD、CAT活性明显降低(P< 0.05),而MDA含量明显增加(P< 0.05)。与模型组比较,杨梅苷给药组大鼠心肌组织中SOD、CAT活性明显升高,而 MDA 含量明显减少,并呈一定量效关系,差异具有统计学意义(P< 0.05)(图3)。
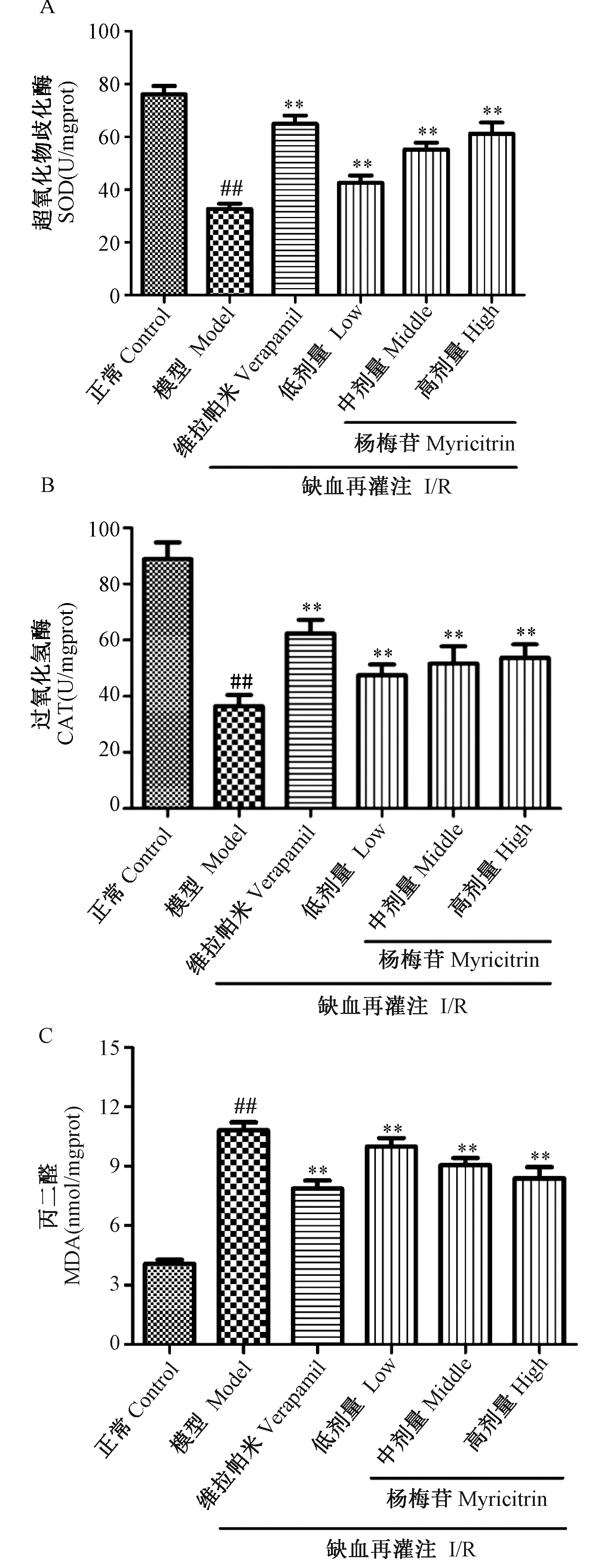
注:A. SOD(U/mgprot);B. CAT(U/mgprot);C. MDA(nmol/mgprot)。与正常组相比,##P < 0.01;与模型组相比,*P < 0.05,**P < 0.01。图3 杨梅苷对大鼠离体工作心脏SOD、CAT活力及MDA含量的影响Note: A. SOD (U/mgprot); B. CAT (U/mgprot); C. MDA (nmol/mgprot). ##P < 0.01, vs. the control group; *P < 0.05, **P < 0.01, vs. the model group.Fig.3 Effect of myricitrin on the activities of SOD, CAT and the content of MDA in myocardial tissue after
2.4杨梅苷对大鼠离体工作心脏组织病理学变化的影响
心肌缺血再灌注过程中会涉及到心肌细胞的水肿、组织坏死等病理学变化。我们通过心脏病理切片检测心脏的病理学变化情况。本实验结果显示,正常对照组无明显病理学变化;模型组大部分心肌呈灶性坏死,纤维组织肿胀、断裂;杨梅苷低中高剂量组对心肌损伤有不同程度的改善,心肌纤维断裂和坏死区域减少,剂量依懒性的减轻心肌组织病变程度(图4)。
2.5杨梅苷对大鼠离体工作心脏凋亡相关蛋白表达的影响
与正常对照组相比,模型组心肌组织中凋亡蛋白Caspase-3、Caspase-9 及促凋亡蛋白Bax显著增加,而抗凋亡蛋白Bcl-2表达下调(P< 0.01)。与模型组相比,杨梅苷高剂量组能够显著抑制凋亡蛋白的表达,促进抗蛋白Bcl-2表达(P< 0.05,图5 C)。此外,模型组p-ERK的表达较正常组显著增加,杨梅苷预给药可以抑制ERK的磷酸化(P< 0.05,图5 E)。
3 讨论
缺血心肌恢复血液灌流,常导致缺血心肌损伤加重,出现再灌注损伤。心肌收缩和舒张功能下降是I/R损伤的主要表现。HR、LVDP、± dp/dtmax是衡量心肌舒缩功能的常用指标。其中,LVDP反映等容收缩期左室内压变化,体现心肌顺应性;+ dp/dtmax可间接反映心肌收缩的缩短程度,是评价心肌收缩性能的敏感指标;-dp/dtmax是用于反映心脏舒张功能的敏感指标。本研究釆用Langendorff离体心脏灌流技术,模拟心肌缺血再灌注损伤模型,测定HR、LVDP、± dp/dtmax等血流动力学指标。实验结果表明,模型组心脏的HR、LVDP、± dp/dtmax均明显降低,提示缺血再灌注后心脏功能受损。相对于模型组,杨梅苷低中高剂量组在再灌注期左室HR、LVDP、± dp/dtmax显著升高,表明杨梅苷预处理可改善缺血再灌注心脏收缩及舒张功能,其中高剂量作用最明显。
MDA是脂质过氧化反应产生的活性物质,具有生物毒性;SOD、CAT是能够清除自由基的酶,维持机体内氧化和抗氧化的动态平衡。因此,心肌组织中MDA、SOD、CAT水平可间接反应心肌损伤的程度和清除自由基的能力[12]。心肌细胞内含有大量的心肌三酶CK、LDH和AST,正常情况下,心肌三酶存在于细胞内,但当心肌受损时,心肌细胞膜被破坏,其通透性改变,心肌三酶和自由基释放到血液中,通过脂质过氧化反应对心肌造成进一步的损害[13],因此心肌三酶含量也可以反映心肌组织受损情况。为进一步研究杨梅苷对心肌缺血再灌注损伤的保护作用,我们测定了心肌组织中心肌三酶和抗氧化酶的活力,实验结果表明,与模型组相比,杨梅苷能减少LDH、CK及AST的外漏,提高SOD、CAT的活性,降低MDA的含量。由此可见,杨梅苷可以保护心肌细胞,提高细胞膜的稳定性,增强细胞的抗氧化应激能力。HE染色后发现I/R模型组心肌损伤严重,杨梅苷可改善I/R的心肌损伤,减少心肌纤维断裂和坏死区域。上述结果证明杨梅苷对I/R诱导的心肌损伤具有显著的保护作用。
1994年Gottlieb等[14]利用家兔离体心脏灌注模型发现再灌注损伤促进了细胞凋亡。此后,许多研究证实,心肌缺血再灌注损伤能够引起心肌细胞凋亡[15]。凋亡是细胞在基因调控下的程序性死亡。凋亡信号通路主要包括外源性途径(死亡受体凋亡途径)和内源性途径(线粒体凋亡途径)。在生理条件下,心肌细胞有序而协调地激活凋亡诱导基因(Bax、Fas和p53等)和凋亡抑制基因(Bcl-2等),共同调控细胞代谢而维持细胞内环境的稳定,但在缺血再灌注过程中,凋亡相关基因及其表达产物发生了变化,从而导致心肌细胞凋亡的发生[16-17]。本研究结果表明,杨梅苷可显著抑制促凋亡蛋白Bax的表达,下调Caspase-3和Caspase-9的表达,并促进抗蛋白Bcl-2表达。提示杨梅苷可调节抗凋亡蛋白Bcl-2和促凋亡蛋白Bax之间平衡,抑制Caspase家族蛋白的激活,从而发挥抗凋亡作用。同时杨梅苷可以降低ERK1/2的磷酸化水平,提示杨梅苷可能通过抑制ERK信号转导通路来缓解缺血再灌注引起的心肌细胞凋亡。
综上所述,杨梅苷对大鼠离体心脏缺血再灌注损伤具有一定的保护作用,其保护作用可能与杨梅苷的清除氧自由基、增强抗氧化酶活性、抑制细胞凋亡等作用有关,进一步的作用机制可能是通过抑制ERK信号转导通路缓解缺血再灌注引起的心肌细胞凋亡。由于心肌缺血再灌注过程中细胞凋亡的发生是多因素和多途径的[18],所以阻断细胞凋亡级联反应中的关键环节和抑制参与多信号途径的介质可能是防治缺血再灌注引起的细胞凋亡的有效方法。

注:A.正常对照组;B.模型组;C.杨梅苷低剂量组(Myr 2.5 mg/L);D.杨梅苷中剂量组(Myr 5 mg/L);E.杨梅苷高剂量组(Myr 10 mg/L);F.阳性给药组(维拉帕米100 μg/L)。图4 杨梅苷对大鼠离体工作心脏组织病理学变化的影响Note: A. control gtoup; B. model group; C. myricitrin low dose group (Myr 2.5 mg/L); D. myricitrin middle dose group (Myr 5 mg/L); E. myricitrin high dose group (Myr 10 mg/L); F. positive administration group (Ver 100 μg/L).Fig.4 Effect of myricitrin on the pathological changes of isolated rat hearts

注:A. Westen blot检测凋亡相关蛋白和ERK1/2及p-ERK1/2蛋白表达情况;B. Caspase-3和Caspase-9相对表达水平 C. Bcl-2相对表达水平;D. Bax相对表达水平;E. p-ERK1/2相对ERK1/2表达水平;与对照组比较,# P < 0.01,与模型组比较,。图5 杨梅苷对大鼠离体工作心脏凋亡相关蛋白表达的影响Note: A. The expression of proteins related to apoptosis and ERK1/2 determined by Western blot analysis; B. Statistical results of Caspase-3, Caspase-9 expression levels relative to the control group; C. Statistical results of Bcl-2 expression level relative to the control group; D. Statistical results of Bax expression level relative to the control group; E. Statistical results of p-ERK1/2/ ERK1/2 expression level relative to the control group. ##P < 0.01, vs. the control group; *P < 0.05, **P < 0.01, vs. the model group.± s, n=3).Fig.5 Effect of myricitrin on the expression of apoptosis related proteins in isolated rat hearts
[1]Minamino T. Cardioprotection from ischemia/reperfusion injury: basic and translational research [J]. Circ J, 2012, 76(5): 1074-1082.
[2]Braunwald E, Kloner R A. Myocardial reperfusion: a double-edged sword? [J]. J Clin Invest, 1985, 76(5): 1713-1719.
[3]Ibanez B, Heusch G, Ovize M,etal. Evolving therapies for myocardial ischemia/reperfusion injury [J]. J Am Coll Cardiol, 2015, 65(14): 1454-1471.
[4]Hausenloy D J, Yellon D M. Myocardial ischemia-reperfusion injury: a neglected therapeutic target [J]. J Clin Invest, 2013, 123(1): 92-100.
[5]Domitrovic R, Rashed K, Cvijanovic O,etal. Myricitrin exhibits antioxidant, anti-inflammatory and antifibrotic activity in carbon tetrachloride-intoxicated mice [J]. Chem Biol Interact, 2015, 230: 21-29.
[6]Winekenstadde D, Angelis A, Waltenberger B,etal. Phytochemical profile of the aerial parts of Sedum sediforme and anti-inflammatory activity of myricitrin [J]. Nat Prod Commun, 2015, 10(1): 83-88.
[7]Huang Q, Gao B, Wang L,etal. Protective effects of myricitrin against osteoporosis via reducing reactive oxygen species and bone-resorbing cytokines [J]. Toxicol Appl Pharmacol, 2014, 280(3): 550-560.
[8]Qin M, Luo Y, Meng X B,etal. Myricitrin attenuates endothelial cell apoptosis to prevent atherosclerosis: An insight into PI3K/Akt activation and STAT3 signaling pathways [J]. Vascul Pharmacol, 2015, 70: 23-34.
[9]孙桂波,秦蒙,罗云,等. 杨梅苷对氧化应激诱导血管内皮细胞凋亡的保护作用及其机制探讨 [J]. 药学学报, 2013, 48(04): 615-620.
[10]周文武,林玲,陈军,等. 冠脉结扎法制做大鼠心肌缺血模型 [J]. 中国实验动物学报, 2004, 12(04): 36-40.
[11]徐明亮,王丽丽,李琳,等. 白鲜皮水提物对大鼠心肌缺血再灌注损伤的保护作用 [J]. 中国实验动物学报, 2013, 21(01): 47-52.
[12]Kaminski K, Bonda T, Wojtkowska I,etal. Oxidative stress and antioxidative defense parameters early after reperfusion therapy for acute myocardial infarction [J]. Acute Card Care, 2008, 10(2): 121-126.
[13]Jaeschke H, Woolbright B L. Current strategies to minimize hepatic ischemia-reperfusion injury by targeting reactive oxygen species [J]. Transplant Rev (Orlando), 2012, 26(2): 103-114.
[14]Gottlieb R A, Burleson K O, Kloner R A,etal. Reperfusion injury induces apoptosis in rabbit cardiomyocytes [J]. J Clin Invest, 1994, 94(4): 1621-1628.
[15]Lin M, Li L, Li L,etal. The protective effect of baicalin against renal ischemia-reperfusion injury through inhibition of inflammation and apoptosis [J]. BMC Complement Altern Med, 2014, 14(19):1-9
[16]Huttemann M, Helling S, Sanderson T H,etal. Regulation of mitochondrial respiration and apoptosis through cell signaling: cytochrome c oxidase and cytochrome c in ischemia/reperfusion injury and inflammation [J]. Biochim Biophys Acta, 2012, 1817(4): 598-609.
[17]Gottlieb R A. Cell death pathways in acute ischemia/reperfusion injury [J]. J Cardiovasc Pharmacol Ther, 2011, 16(3-4): 233-238.
[18]Murphy E, Steenbergen C. Mechanisms underlying acute protection from cardiac ischemia-reperfusion injury [J]. Physiol Rev, 2008, 88(2): 581-609.
Protective effects of myricitrin on ischemic/reperfusion injury in isolated rat hearts
CHEN Ya-ping1, ZHANG Bin2, LIU Gui-yan1, LIN Wen-bin3, WANG Min2, SUN Gui-bo2, SUN Xiao-bo2
(1. School of Life Science, Beijing Institute of Technology, Beijing 100081, China;2. Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences,Peking Union Medical College, Beijing 100193, China; 3. Center of Research and Development onLife Sciences and Environmental Sciences, Harbin University of Commerce, Harbin 150076, China)
ObjectiveTo investigate the protective effect of myricitrin on myocardial ischemia/reperfusion injury in isolated rat hearts and its underlying mechanism. Methods Sixty SD rats were randomly divided into: (1) control group; (2) model group; (3) positive administration group (verapamil of 100 μg/L); (4) three dose groups with varying amount of myricitrin (2.5, 5, 10 mg/L). Each group included ten rats. The myocardial ischemia/reperfusion injury model was constructed using the Langendorff method. The isolated working hearts were ischemia for 30 min followed by reperfusion for 45 min after in equilibrium for 15 min. During the process, we determined myocardial hemodynamic parameters, myocardial enzyme indicators (lactate dehydrogenase (LDH), creatine kinase (CK) and aspartate aminotransferase (AST)) and antioxidative parameters (superoxide dismutase (SOD), catalase (CAT) and malondialdehyde (MDA)). Furthermore, we performed histopathological examination of left ventricles and detected the expression of apoptosis related proteins (e.g., Bcl-2, Bax, Caspase-3 and Caspase-9) by western blot. Results Compared with the model group, myricitrin could significantly improve cardiac constriction and relaxation function, decrease the levels of LDH, CK and AST in perfusate, enhance the activities of SOD and CAT, and decrease the content of MDA in myocardial tissue. The cardiac protective effect of myricitrin was further confirmed by histopathological examination. Apparently, myricitrin pretreatment restrained myocardial apoptosis as evidenced by increasing the level of Bcl-2 expression, decreasing the levels of Bax, Caspase-3 and Caspase-9 expression, and inhibiting the phosphorylation of ERK. Conclusions Myricitrin had a protective effect on myocardial ischemia/reperfusion injury. It showed ability of improving myocardial contractile function, increasing anti-oxidation ability and inhibiting apoptosis. The possible mechanism of cardiac protection of myricitrin was that the agent attenuated myocardial cell apoptosis induced by ischemia reperfusion via inhibiting ERK signaling pathway.
Myricitrin; Myocardial ischemia/reperfusion; Cardiac hemodynamics; Myocardial enzymes; Cell apoptosis
国家科技部“重大新药创制”科技重大专项资助项目 (2012ZX09501001-004);
陈亚萍(1992-),女,硕士,研究方向:心血管药理学。
孙晓波(1958-),男,博士,研究员,博士生导师,研究方向:中药及复方药效物质基础及分子机制,E-mail: sun-xiaobo@163.com;孙桂波(1973-),女,博士,研究员,博士生导师,研究方向:中药及复方药效物质基础及分子机制,E-mail: sunguibo@126.com。
研究报告
R-332
A
1671-7856(2016) 05-0031-09
10.3969.j.issn.1671-7856. 2016.005.005
2016-03-23
