骆驼奶对2型糖尿病大鼠糖脂代谢及PPAR-γ、TNF-α mRNA的影响
2016-08-08张泉龙李茂星邱建国张汝学
周 珺,张泉龙,杨 茜,李茂星,邱建国,张汝学
(兰州军区总医院高原环境损伤防治重点实验室,国家中医药管理局临床中药学重点学科,兰州 730050)
骆驼奶对2型糖尿病大鼠糖脂代谢及PPAR-γ、TNF-α mRNA的影响
周珺,张泉龙,杨茜,李茂星,邱建国,张汝学
(兰州军区总医院高原环境损伤防治重点实验室,国家中医药管理局临床中药学重点学科,兰州730050)
目的研究骆驼奶(CM)对2型糖尿病大鼠体重、血糖、血脂、胰岛素,PPARγ和TNF-α基因表达的影响。 方法采用高脂饲料加小剂量(30 mg/kg)链脲佐菌素(STZ)腹腔注射诱导2型糖尿病大鼠模型,将其分为4组,即正常对照(control)组、模型(model)组、骆驼奶低剂量(CM-L)组(3.5 mg/kg·d)、骆驼奶高剂量(CM-H)组(10 mg/kg·d),每周测定体重和血糖,第4周进行葡萄糖耐量实验,给药4周后断头处死,测定血脂(TC、TG、HDL-C、LDL-C)、胰岛素水平,检测脂肪组织PPARγ和肝脏组织TNF-α mRNA表达量。结果与正常对照组相比,模型组大鼠体重明显下降(P< 0.01),空腹血糖、糖耐量0、30、60、120 min血糖,以及血清TC、TG、LDL-C含量均显著增高(P< 0.01),HDL-C含量下降,胰岛素水平升高。CM可缓解糖尿病大鼠体重下降,降低高血糖,CM-H组在给药第4周达到显著降糖效果,并显著降低糖耐量30 min血糖(P< 0.05)。CM有降低糖尿病大鼠TC、TG、LDL-C含量,升高HDL-C含量,降低胰岛素趋势,其中CM-H剂量组可显著降低TG、LDL-C含量(P< 0.05)。与正常对照组比较,模型组PPARγ mRNA显著下调(P< 0.05),TNF-α mRNA显著上调(P< 0.01),CM使糖尿病大鼠的PPARγ mRNA升高,其中,CM-H组差异显著(P< 0.05),CM可降低其TNF-α mRNA表达量。 结论CM可缓解2型糖尿病大鼠体重下降,改善高血糖、糖耐量异常、血脂紊乱等症状,其机制可能与调节PPARγ、TNF-α表达有关。
骆驼奶;2型糖尿病;血糖;血脂;PPARγ;TNF-α
2型糖尿病多表现为胰岛素分泌不足及胰岛素抵抗,现有最有效的降糖药—胰岛素制剂均为注射剂,使用极其不方便。研究发现,骆驼奶(camel milk, CM)中的胰岛素含量较高,1 mL骆驼奶中含有52个微单位的胰岛素,而等量牛奶的胰岛素含量仅为16个微单位[1]。骆驼奶中还含有一种富含半胱氨酸的蛋白质,其氨基酸序列与胰岛素蛋白家族极其相似,这种蛋白质就是不被胃酸分解破坏的降糖活性物质—胰岛素/ 类胰岛素蛋白[2],因此这种成分被认为是治疗糖尿病的功效因子之一。骆驼奶对于糖尿病的防治具有较好的应用前景[3],临床试验证实,患者每天饮用0.5 L骆驼奶,将使胰岛素治疗用量平均减少30%,有饮用骆驼奶习惯的人群患糖尿病的比率比无饮用骆驼奶习惯的人群下降0.15%~0.3%[4]。然而骆驼奶对糖脂代谢的具体效果不明,其是否参与糖脂代谢关键基因的调节。本文采用高脂饲料加小剂量STZ联合诱导2型糖尿病大鼠模型,通过CM干预,研究CM对糖尿病大鼠糖脂代谢及关键基因的影响,探索其对2型糖尿病大鼠脂代谢紊乱的影响并探讨其可能机制,为CM应用提供依据。
1 材料和方法
1.1材料
1.1.1实验动物
Wistar大鼠,清洁级,♀,体重180~220 g,由兰州大学医学院动物实验中心提供【SCXK(甘)2012-0200】,饲养于兰州军区兰州总医院动物实验科【SYXK(军)2012-0029】,普通饲料由该实验科自行配制,自由摄食进水,室温19℃~24℃。
1.1.2药品与试剂
链脲佐菌素(STZ,批号S0130)购自Sigma公司;骆驼奶(camel milk, CM,批号191531-740, 规格328 g/罐)购自新疆旺源驼奶实业有限;血糖检测试剂盒(批号:1210121)、总胆固醇(TC)(批号:1210141)、甘油三酯(TG)(批号:1210111),高密度脂蛋白胆固醇(HDL-C)(批号:1210081),低密度脂蛋白胆固醇(LDL-C)(批号:1210091)检测试剂盒均购自四川省迈克科技有限责任公司;胰岛素(FINS)放射免疫分析试剂盒(批号:20121120)为天津九鼎生物技术有限公司产品;RNAiso Plus(TakaRa,BK4606);PrimeScriptTM RT Master Mix(TakaRa,DRR036A);SYBR® Premix Ex TaqTM Ⅱ(Ti RNaseH Plus)(TakaRa,RR820A)。 其它试剂均为国产分析纯。
1.1.3实验器材
Vitalab ISP-21半自动生化分析仪,荷兰Vital Scientific公司;BP210S电子天平,赛多利斯有限公司;Biofuge Stratos高速台式冷冻离心机,德国Heraeus公司;Multiscan MK3 酶标仪,美国Thermo Electron公司;Telstar Mini-V PCR超净工作台,西班牙TERRASSA-SPAIN医疗器械公司;SN-682放射免疫γ-计数器,中国科学院上海原子核研究所日环仪器厂。ABI7300定量PCR仪,美国应用生物系统公司。
1.2方法
1.2.1高脂饲料加小剂量STZ联合诱导糖尿病大鼠模型的建立
高脂饲料饲养加小剂量STZ联合诱导建立2型糖尿病大鼠模型。购买的雌性Wistar大鼠在我实验科适应性饲养1周后,根据体重平均分组,一组为正常对照组(10只),给与普通饲料,其余均饲以高脂饲料,喂养2个月后大鼠禁食16 h,腹腔注射STZ(30 mg/kg,i.p.)诱发2型糖尿病模型,选取空腹血糖值≥15 mmol/L大鼠纳入试验。
造模成功后,大鼠分为正常对照组、糖尿病组、CM-L组(3.5 mg/kgd)、CM-H组(10 mg/kgd)。正常对照组及模型组每日给予等量蒸馏水,约1 mL/100g 体重。以上各组均为灌胃(i.g.)给药,连续给药4周,在末次给药后大鼠禁食不禁水6 h后断头处死并收集躯干血,4000 r/min,4℃离心10 min,将血浆分装于不同的离心管中-20℃保存待用。
1.2.2体重、血糖
每周测定一次空腹体重和空腹血糖,测血糖前大鼠禁食不禁水6~7 h,眼眶静脉丛采血;实验结束时收集血液。0.1 mol/L 肝素钠抗凝,离心并分离血浆。用葡萄糖氧化酶法测定血浆葡萄糖含量。
1.2.3葡萄糖耐量的测定
实验动物禁食6 h(8:30~14:30)后,腹腔一次性注射50%葡萄糖(2.5 g/kg),测定注射 0、30、60、120 min血糖值。
1.2.4血脂、胰岛素含量的测定
血浆TG用GPO-PAP法测定,TC用COD-CE-PAP法测定,HDL-C用PTA-Mg2+沉淀法测定,LDL-C用聚乙烯硫酸沉淀法测定。采用放免法测定胰岛素含量。
1.2.5RT-PCR检测脂肪组织PPAR-γ和肝脏组织TNF-αmRNA表达
TRIzol法提取总RNA,一步法逆转录合成cDNA。进行实时荧光定量PCR。PPAR-γ(153 bp)上游引物5′ GGAGCCTAAGTTTGAGTTTGC-TGTG3′,下游引物5′ TGCAGCAGGTTGTCTTGG ATG3′;TNF-α(75 bp)上游引物5′ ATACACTGGCC CGAGGCAAC 3′,下游引物5′ CCACATCTCGGA TCATGCTTT-C3′;以β-actin(150 bp)为内参照,上游引物5′ GGAGATTACTGCCCTGGCTCCTA 3′,下游引物5′ GACTCATCGTACTCCTGCTTGCTG 3′。实验结果采用2-ΔΔCt进行相对定量。
1.2.6统计学处理
2 结果
2.1大鼠体重变化
表1所示,正常组大鼠体重缓慢上升,糖尿病大鼠体重明显下降(P<0.01),随病程的延长糖尿病大鼠体重呈下降趋势,CM组大鼠体重下降缓慢,但与模型组相比,无显著统计学意义。
2.2骆驼奶对糖尿病大鼠血糖水平的影响
与正常对照组比较,模型组和CM各组大鼠0~4周血糖值均明显高于正常对照组(P< 0.01),与模型组比较,CM有降低2型糖尿病大鼠血糖趋势,随实验进程模型组血糖逐渐升高,CM-H组在给药第4周达到显著降糖效果(P< 0.05)。
2.3骆驼奶对糖尿病大鼠糖耐量的影响
与正常对照组相比,糖尿病大鼠0、30、60、120 min血糖均显著增高(P< 0.01);CM可降低糖尿病大鼠30、60、120 min血糖,其中CM-H组可显著降低30 min血糖值(P< 0.05)。

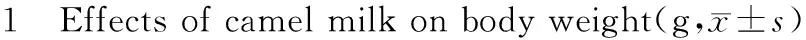

组别Group只数n剂量(g/kg∙d)Dose(g/kg∙d)0周0week1周1week2周2week3周3week4周4week正常组Controlgroup60199.70±18.68203.10±19.27208.90±18.14211.40±16.59215.20±18.39模型组Modelgroup60181.86±9.34b175.86±10.33b168.71±12.67b166.86±7.17b164.60±17.98b骆驼奶-低剂量组CM-Lgroup63.5182.88±12.82b177.00±12.12b175.57±17.46b174.57±14.09b172.67±18.79b骆驼奶-高剂量组CM-Hgroup610182.13±16.44b178.88±15.68b176.75±15.17b175.63±14.11b176.00±13.85b
注:aP<0.05,bP<0.01 与正常组比较。
Note:aP<0.05,bP<0.01 vs control group.

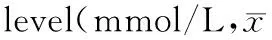

组别Group只数n剂量(g/kg∙d)Dose(g/kg∙d)空腹血糖(mmol/L)FBG(mmol/L)0周0week1周1week2周2week3周3week4周4week正常组Controlgroup605.51±0.596.21±0.866.23±1.126.30±0.896.37±0.98模型组Modelgroup6019.76±5.43b20.79±4.45b23.64±3.74b24.39±6.51b25.30±5.19b骆驼奶-低剂量组CM-Lgroup63.519.23±4.91b20.41±4.68b22.82±5.06b22.09±4.00b21.29±5.90b骆驼奶-高剂量组CM-Hgroup61018.33±5.50b19.49±5.02b18.66±6.49b18.31±6.40b18.45±6.01bc
注:aP<0.05,bP<0.01 与正常组比较;cP<0.05 与模型组比较。
Note:aP<0.05,bP<0.01 vs control group;cP<0.05 vs model group.

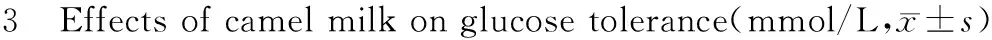
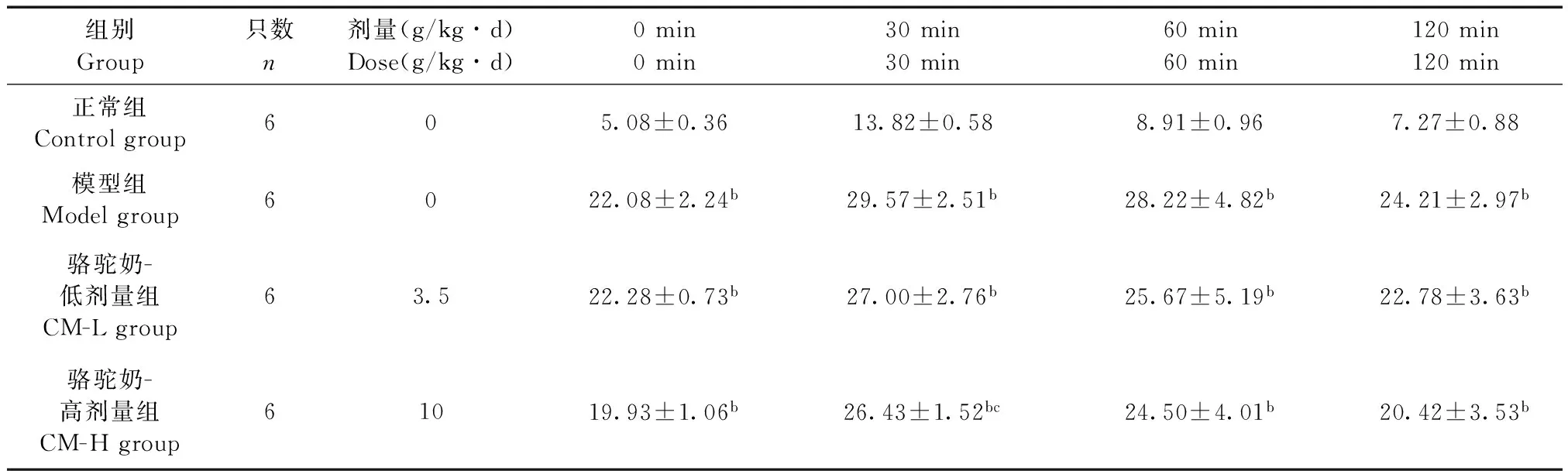
组别Group只数n剂量(g/kg∙d)Dose(g/kg∙d)0min0min30min30min60min60min120min120min正常组Controlgroup605.08±0.3613.82±0.588.91±0.967.27±0.88模型组Modelgroup6022.08±2.24b29.57±2.51b28.22±4.82b24.21±2.97b骆驼奶-低剂量组CM-Lgroup63.522.28±0.73b27.00±2.76b25.67±5.19b22.78±3.63b骆驼奶-高剂量组CM-Hgroup61019.93±1.06b26.43±1.52bc24.50±4.01b20.42±3.53b
注:aP<0.05,bP<0.01 与正常组比较;cP<0.05 与模型组比较。
Note:aP<0.05,bP<0.01 vs control group;cP<0.05 vs model group.


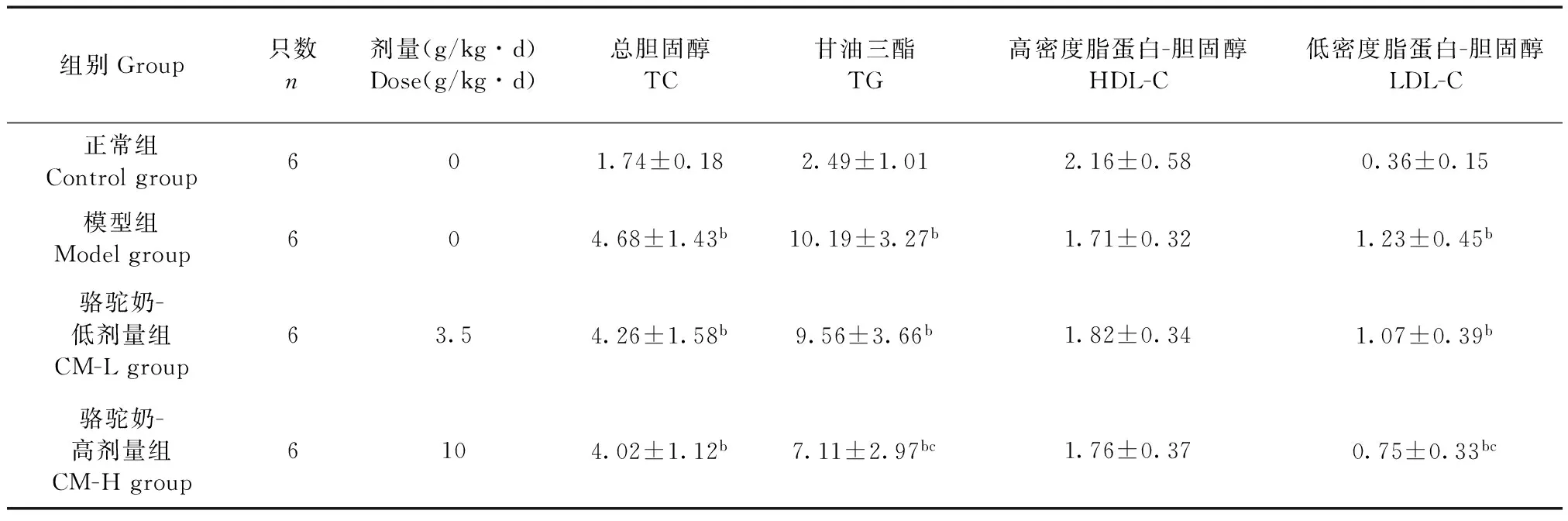
组别Group只数n剂量(g/kg∙d)Dose(g/kg∙d)总胆固醇TC甘油三酯TG高密度脂蛋白-胆固醇HDL-C低密度脂蛋白-胆固醇LDL-C正常组Controlgroup601.74±0.182.49±1.012.16±0.580.36±0.15模型组Modelgroup604.68±1.43b10.19±3.27b1.71±0.321.23±0.45b骆驼奶-低剂量组CM-Lgroup63.54.26±1.58b9.56±3.66b1.82±0.341.07±0.39b骆驼奶-高剂量组CM-Hgroup6104.02±1.12b7.11±2.97bc1.76±0.370.75±0.33bc
注:aP<0.05,bP<0.01 与正常组比较;cP<0.05 与模型组比较。
Note:aP<0.05,bP<0.01 vs control group;cP<0.05 vs model group.
2.4骆驼奶对糖尿病大鼠血脂水平的影响
表4结果可见:与正常组相比,模型组大鼠TC、TG、LDL-C含量显著增高(P< 0.01),HDL-C含量下降。CM-H组可显著降低TG、LDL-C含量(P< 0.05)。
2.5骆驼奶对糖尿病大鼠胰岛素水平的影响
图1结果显示:与正常对照组相比,模型组胰岛素水平升高,CM可降低糖尿病大鼠的胰岛素水平,但无显著统计学差异(P> 0.05)。
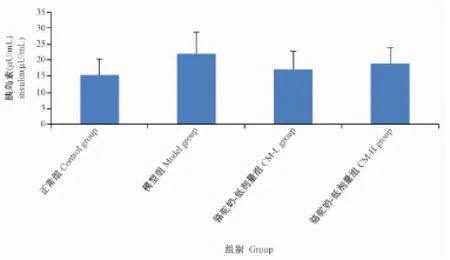
图1 骆驼奶对胰岛素水平的影响Fig.1 Effects of camel milk on insulin ±s)
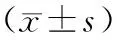


组别Group只数n剂量(g/kg∙d)Dose(g/kg∙d)PPARγmRNATNF-αmRNA正常组Controlgroup601.000±0.0001.000±0.000模型组Modelgroup600.821±0.158a1.893±0.661b骆驼奶-低剂量组CM-Lgroup63.50.909±0.1921.675±0.362b骆驼奶-高剂量组CM-Hgroup6101.083±0.137c1.618±0.489b
注:aP<0.05,bP<0.01 与正常组比较;cP<0.05 与模型组比较。
Note:aP<0.05,bP<0.01 vs control group;cP<0.05 vs model group.
2.6RT-PCR检测脂肪组织PPAR-γmRNA和肝脏组织TNF-αmRNA表达
由表5可见,与正常对照组相比较,糖尿病大鼠PPARγ mRNA显著下调(P< 0.05),TNF-α mRNA均显著上调(P< 0.01)。CM-H显著升高糖尿病大鼠的PPARγ mRNA(P< 0.05),同时降低糖尿病大鼠的TNF-α mRNA表达量,但无统计学差异。
3 讨论
2型糖尿病常伴随胰岛素抵抗的发生,胰岛素敏感性降低,导致胰岛素相对缺乏,机体内分泌代谢严重紊乱,导致体重的明显下降。脂肪正常代谢途径受阻,脂代谢紊乱。而机体内脂蛋白脂酶活力减弱,以及某些代谢关键基因的变化,导致游离TC、TG、LDL-C浓度增高,HDL-C浓度减低,肝脏对游离脂肪酸的摄取超过肝细胞处置的能力,导致甘油三酯的堆积[5-8]。本实验结果证实,糖尿病大鼠血糖水平升高,糖耐量受损,TG、TC、LDL-C水平升高,HDL-C水平降低,胰岛素水平升高。这与相关研究报道一致[8-9]。
研究认为,食物蛋白通过增强饱腹感帮助机体降低脂肪量,间接改善机体代谢健康,同时乳制品蛋白质派生的支链氨基酸(BCAAs)的合成代谢促进骨骼肌生长和功能发挥,而BCAAs又可促进肌肉蛋白合成,以及骨骼肌代谢的功能[10]。研究发现,骆驼奶中的胰岛素含量较高,1 mL骆驼乳中含有的胰岛素是等量牛奶的3.25倍[1]。骆驼奶中还含有一种富含半胱氨酸的蛋白质,其氨基酸序列与胰岛素蛋白家族极其相似,这种蛋白质就是不被胃酸分解破坏的降糖活性物质—胰岛素/类胰岛素蛋白[2],因此这种成分被认为是治疗糖尿病的功效因子之一。
本实验证实,CM可有效改善2型糖尿病大鼠糖脂代谢,缓解糖尿病大鼠体重的明显下降,使体重状况与正常组接近,不同程度的改善糖尿病大鼠的高血糖、高胰岛素和糖耐量异常状态,降低TC、TG、LDL-C含量,升高HDL-C水平。
PPARγ在糖脂代谢中发挥着重要的作用。本研究发现糖尿病大鼠的PPARγ表达在mRNA水平上明显低于正常大鼠。作为成脂过程的转录因子,糖尿病大鼠胰岛素效应组织PPARγ的表达降低,可通过影响前脂细胞分化和成熟脂细胞功能参与胰岛素抵抗的形成[11],而CM可通过升高PPARγ mRNA表达量增加胰岛素敏感性。TNF-α是一种主要由炎性细胞分泌的细胞因子,与细胞凋亡和免疫有关。近年来,TNF-α在IR相关疾病中的作用越来越受到重视[12]。有研究报道表明,TNF-α可加速脂肪细胞的脂解,促使游离脂肪酸(FFA)从细胞溢出,参与肥胖及胰岛素抵抗的发生[12]。本实验研究发现,糖尿病TNF-α mRNA均显著上调,说明其肝脏胰岛素抵抗和炎症损伤的程度较高。CM具有降低TNF-α mRNA表达的趋势,提示CM可通过调节TNF-α mRNA表达作用改善糖脂代谢紊乱。
综上所述,CM可改善糖尿病大鼠的糖脂代谢异常状态,其机制可能与调节糖脂代谢相关基因PPARγ,TNF-α的改变有关。
[1]Zagorski O, Maman A, Yaffe A,etal. Insulin in milk a comparative study[J]. International Journal of Animal Science, 1998, 13(3): 241-244.
[2]Beg OU, von Bahr-Lindström H, Zaidi ZH,etal. Characterization of a camel milk protein rich in proline identifies a new beta-casein fragment[J]. Regul Pept. 1986, 15(1):55-61.
[3]王瑞, 周克夫, 崔若辰, 等. 骆驼奶防治糖尿病研究进展及应用前景[J]. 《新疆师范大学学报》(自然科学版), 2014,33(4): 17-20.
[4]Agrawal RP, Swami S C, Beniwal R,etal. Effect of camel milk on glycemic control, lipid profile and diabetes quality of life in type 1 diabetes: A randomised prospective cotrolled cross over study[J]. Indian Journal of Animal Science, 2003, 73(10): 1105-1110.
[5]Leite SA, Anderson RL, Kendall DM,etal. A1C predicts type 2 diabetes and impaired glucose tolerance in a population at risk: the community diabetes prevention project[J]. Diabetol Metab Syndr. 2009, 1(1):5-9.
[6]Chakravarthy MV, Semenkovich CF. The ABCs of beta-cell dysfunction in type 2 diabetes[J]. Nat Med. 2007, 13(3):241-242.
[7]Klein S. Abdominal adiposity: An emerging marker. Introduction[J]. Clin Cornerstone. 2008, 9(1):8-10.
[8]周珺. 2型糖尿病患者HPA轴功能的临床研究及药物治疗新途径的实验性探索[D]. 兰州大学,2011.
[9]Taylor AI, Frizzell N, McKillop AM,etal. Effect of RU486 on hepatic and adipocyte gene expression improves diabetes control in obesity-type 2 diabetes[J]. Horm Metab Res. 2009, 41(12):899-904.
[10]McGregor RA, Poppitt SD. Milk protein for improved metabolic health: a review of the evidence[J]. Nutr Metab (Lond). 2013, 10(1):46.
[11]Janani C, Ranjitha Kumari BD. PPAR gamma gene—a review[J]. Diabetes Metab Syndr. 2015, 9(1):46-50.
[12]Michaud M, Balardy L, Moulis G,etal. Proinflammatory Cytokines, Aging, and Age-Related Diseases[J]. J Am Med Dir Assoc. 2013,14(12):877-82.
Effects of camel milk on glycolipid metabolism and PPARγ、TNFα mRNA expression in rats of type 2 diabetes mellitus
ZHOU Jun, ZHANG Quan-long, YANG Qian, LI Mao-xing, QIU Jian-guo, ZHANG Ruxue
(Key laboratory of the prevention and cure for the plateau environment damage, PLA; Clinical Pharmacy Key Discipline of State Administration of Traditional Chinese Medicine, Lanzhou 730050 , China)
ObjectiveTo investigate the effects of camel milk on body weight, blood glucose, lipid, insulin and PPAR-γ、TNF-α mRNA expressions in type 2 diabetes rats. MethodsType 2 diabetes was induced by high fat diet and small dose of STZ(i.g. 30 mg/kg), rats were divided into four groups, normal control(control) group, diabetes model(model) group, camel-low dose(CM-L) group(3.5 mg/kg·d), camel-high dose(CM-H) group(10 mg/kg·d). Body weight and fasting blood glucose were measured every week. Glucose tolerance test(OGTT) was conducted at 4th week. After 4 weeks administration, animals were decapitated, plasma lipid(TC、TG、HDL-C、LDL-C), insulin were assayed. The expression of PPAR-γ and TNF-α mRNA were measured using RT-PCR method. ResultsCompared with control group, the weight of model group lowered significantly(P< 0.01), FBG and blood glucose at 0、30、60、120 min of OGTT, as well as the TC, TG, LDL-C concentrations increased(P< 0.01), while HDL-C content reduced, and insulin level was higher than control rats. Compared with model group, body weight increased and blood glucose decreased in CM group, CM-H reduced the fasting glucose levels in 4th week and decreased the 30min glucose level significantly(P< 0.05). CM lowered the TC, TG, LDL-C, insulin and increased HDL-C concentration, and it is significantly in CM-H(P<0.05). There is a marked decrease in PPARγ mRNA expression(P< 0.05) and a significant increase in TNF-α mRNA expression(P< 0.01)in diabetes rats. Compared with model rats, PPARγ mRNA expression was ascended by CM administration, and it is notably in CM-H group(P< 0.05), while the TNF-α mRNA expression of diabetes rats was lower, but there is no significant. ConclusionsCM can improve the lowered body weight, hyperglycosemia, abnormal glucose tolerance and dyslipidemia in type 2 diabetes. The mechanism of these maybe associated with the regulation of PPARγ and TNF-α mRNA.
Camel milk;Type 2 diabetes mellitus;Blood glucose;Blood lipid;PPARγ;TNF-α
国家自然科学基金资助项目(81173620;30772773)。
周珺(1986-),女,药师,硕士,主要从事药理学研究工作。
张汝学(1963-),男,硕士生导师,教授。E-mail:zhoujunh@163.com。
研究报告
R-332
A
1671-7856(2016) 05-0025-06
10.3969.j.issn.1671-7856. 2016.005.004
2016-02-23
