单糖标准品的选择和不同试验产地金线莲中多糖含量分析
2016-08-08林守二黄丽英吴兴明陈瑜黄庆佐黄冰兰福建医科大学药学院福建福州50004福建省永安市农业局永安66000福建医科大学基础医学院
林守二黄丽英吴兴明陈瑜黄庆佐黄冰兰(福建医科大学药学院,福建福州50004;福建省永安市农业局,永安66000;福建医科大学基础医学院)
单糖标准品的选择和不同试验产地金线莲中多糖含量分析
林守二1黄丽英1吴兴明2陈瑜3黄庆佐1黄冰兰1(1福建医科大学药学院,福建福州350004;2福建省永安市农业局,永安366000;3福建医科大学基础医学院)
目的:建立金线莲多糖(Anoectochilus roxburghii polysaccharide,ARPS)的含量测定方法,比较不同试验产地的金线莲药材中多糖的含量,并研究选择用来换算ARPS含量的最合适标准单糖。方法:采用水提醇沉法制备粗ARPS,用Sevage法脱去其中的蛋白。通过比较不同单糖与样品溶液的紫外吸收谱图来选择最合适的单糖标准品,同时由精制ARPS求出换算因子f,通过苯酚-硫酸法测定不同试验产地的金线莲中多糖的含量。结果:以葡萄糖为标准单糖计算ARPS含量,求得换算因子f=1.06,平均回收率为97.94%,测得不同试验产地的药材中ARPS的含量从2.01%~17.49%不等。结论:该方法简便、稳定、可行,不同试验产地的金线莲药材中多糖的含量差异较大,该结果为金线莲培植与进一步研究提供参考依据。
金线莲;多糖;含量测定;单糖标准品;试验产地
金线莲(Anoectochilus roxburghii)为兰科开唇兰属植物,是民间常用的多年生珍稀草药,多用于治疗糖尿病、高脂血症、乙型肝炎等疾病[1],有“药王”“金草”之称。其一般分布在海拔300~1 200 m的丘陵地带,福建、台湾、浙江、江西、广东和广西等地有野生金线莲[2]。金线莲富含多糖、挥发油、微量元素、强心苷类、三萜类、有机酸、甾体化合物、黄酮类化合物、生物碱等多种成分[3-4],其中关于多糖类的研究较多。
根据研究报道,植物多糖具有免疫调节、抗肿瘤、抗氧化、抗病毒、降血脂等生物活性[5],其在保健食品、畜牧生产及其他领域均有较广泛应用[6]。关于金线莲多糖(ARPS)的应用研究报道也逐渐增加,刘青等[7]发现金线莲多糖具有较强的清除氧自由基作用和体外抗氧化活性。许丹妮等[8]通过研究,发现金线莲多糖能提高免疫抑制小鼠体质量及免疫器官指数,促进脾淋巴细胞增殖。王常青等[9]研究发现台湾金线莲多糖对肺腺癌细胞具有较好的杀伤作用,表明其具有作为抗肿瘤药物或辅助抗肿瘤药物的应用前景。翁秀华等[10]研究发现金线莲多糖对人前列腺癌细胞PC-3的增殖具有显著的抑制作用。
金线莲多糖的含量受较多因素的影响。龚秀会等[11]通过对不同基原金线莲植物的化学成分比较,发现组培的金线莲样品中多糖含量远高于文献报道的野生金线莲样品。黄瑞平等[12]在不同月龄金线莲多糖的比较中发现多糖含量随着金线莲的栽培月龄的增加而降低。杨翠芹等[13]讨论了不同培养条件对金线莲多糖含量的影响,表明较高的蔗糖浓度对多糖积累最有利,且随着继代天数的延长,多糖含量表现出先减少后增加的趋势。顾慧芬等[14]通过对台湾产的野生与组培金线莲有效成分分析比较,发现组培苗与野生品的多糖含量相近。
苯酚-硫酸法测定多糖含量的原理是多糖经浓硫酸水解产生单糖,单糖在浓硫酸加热作用下,失去3分子水,生成糠醛类衍生物,糠醛类衍生物进一步与苯酚生成有色物质,其反应式如图1所示。
但是不同单糖在苯酚-硫酸法中的显色程度、脱水难易、脱水产物的结构和稳定性都存在差异,而金线莲多糖是由多种单糖组成的杂多糖,且不同单糖经过苯酚-硫酸法显色后所得标准曲线斜率差异较大,所以选择合适的单糖作为标准参考十分重要。
本实验分别比较了甘露糖、鼠李糖、葡萄糖、半乳糖和岩藻糖与ARPS经过苯酚-硫酸法反应后的紫外-可见吸收谱图,选择与ARPS吸收谱图最为接近的葡萄糖作为单糖标准品,首次对单糖标准品的选择进行系统研究,并用精制后的ARPS求得换算因子f,对不同试验产地的金线莲中多糖的含量进行分析,研究金线莲含量分析的可行方法,为金线莲培植与进一步研究提供参考依据。
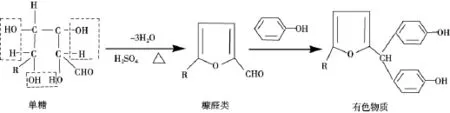
1 单糖的苯酚-硫酸法显色反应
1 实验材料
1.1 主要仪器
SZ-97自动三重纯水蒸馏器(上海亚荣生化仪器厂);倾倒式粉碎机(上海淀久中药机械制造有限公司);电热恒温鼓风干燥箱(上海精宏实验设备有限公司);DZF-6050型真空干燥箱(上海博讯实业有限公司);BS124S电子天平(北京赛多利斯仪器系统有限公司);KQ-250DE型数控超声波清洗器(昆山市超声仪器有限公司);LXJ-IIB型低速大容量多管离心机(上海安亭科学仪器厂);RE-2000旋转蒸发器(上海亚荣生化仪器厂);SHB-Ⅲ循环水式多用真空泵(郑州长城科工贸有限公司);FD-1冷冻干燥机(北京博医康技术公司);HH-2数显恒温水浴锅(国华电器有限公司);岛津2450型紫外可见分光光谱仪(岛津国际贸易(上海)公司)。
1.2 试剂
氯仿(分析纯,南京力盛化学试剂有限公司);无水乙醇,正丁醇(分析纯,国药集团化学试剂有限公司);苯酚(分析纯,天津市福晨化学试剂厂);硫酸(分析纯,衡阳市凯信化工试剂有限公司);甘露糖,半乳糖(标准品,阿拉丁试剂公司);鼠李糖(标准品,德国AlfaAesa公司);葡萄糖(分析纯,上海实验试剂有限公司);岩藻糖(分析纯,厦门泰京生物技术有限公司);二次蒸馏水(实验室自制)。
1.3 金线莲药材
金线莲药材来源和培养模式如表1,2,药材经福建医科大学药学院天然药物化学系鉴定。来自福建永安林下金线莲培养基地,栽培方式:金线莲幼苗经人工栽培4个月后移栽至试验田。试验地分为4个区(即样一、样二、样三、对照区),每区为4平方米;每个区均施10次肥料;每隔10天施一次肥(阴雨天顺延);每次施1小包肥料,对照区只施相应数量的清水,具体方案如表1。福建南靖金线莲幼苗下土种植后,施不同量氨基酸培养,台湾品种移至南靖栽培,方法同福建南靖,具体方案如表2。广西的金线莲为野生品。
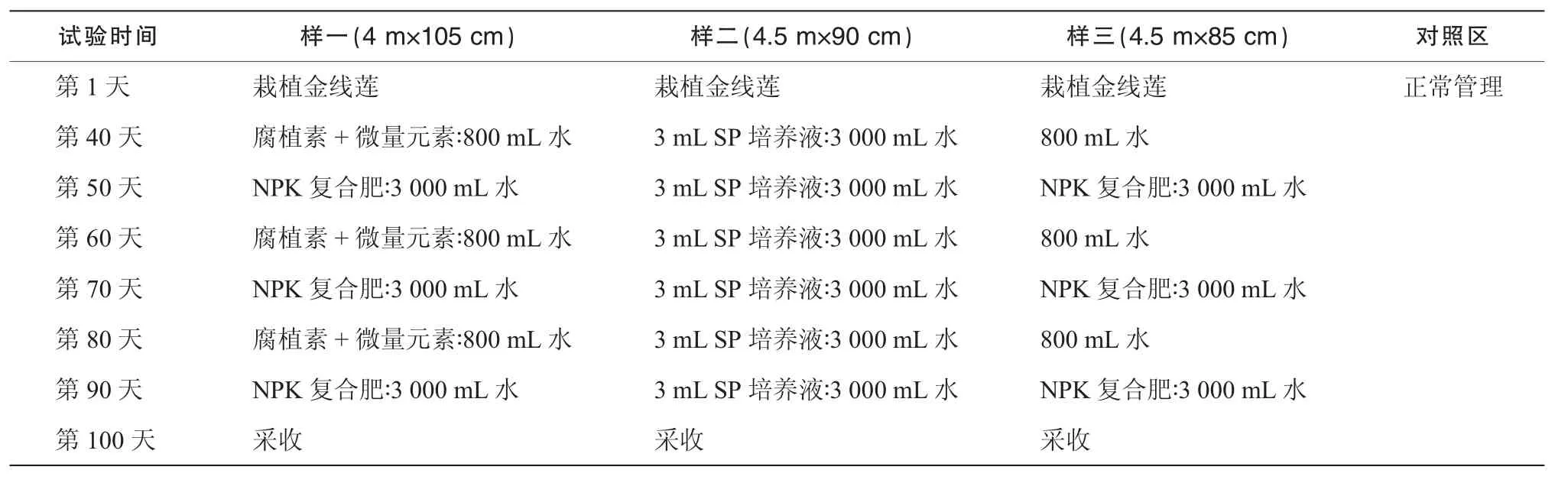
表1 福建永安金线莲施肥试验方案
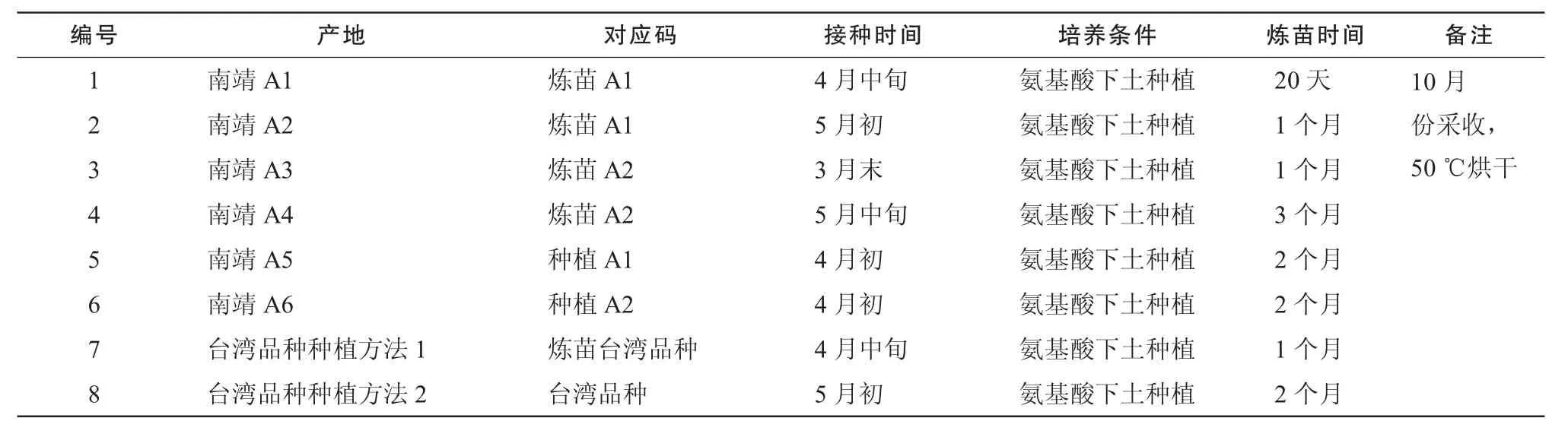
表2 福建南靖金线莲的培养条件
2 实验方法
2.1 金线莲多糖的超声提取及Sevage法去除蛋白
将不同试验产地的金线莲全草晾干,60℃真空干燥,粉碎,过80目筛。分别称取不同的金线莲粉末10 g,按料液比1∶20加水,60℃超声提取30 min,4 200 r/m in离心15 m in,取上清液,滤渣加200 m L的水,重复提2次。合并3次离心后的上清液,过滤,低压旋转蒸发浓缩至20 m L左右。
往浓缩后的上清液中加入20 m L的氯仿和5 m L正丁醇,剧烈振荡20 m in,4 200 r/m in离心15 min,去除中间蛋白质层,重复3次,加入3倍体积的无水乙醇,4℃过夜沉淀,去上清液,离心收集沉淀物,冷冻干燥至恒重,得到金线莲粗多糖干浸膏,分别称量13种金线莲粗多糖干浸膏的质量,并分别计算粗多糖干浸膏得率[15]。

2.2 吸收波长及单糖标准品的选择
2.2.1 5%苯酚液的配制将固体苯酚于60℃的水浴中加热溶解,取100 g左右于圆底烧瓶中,另加入0.1 g铝片和0.05 g碳酸氢钠,油浴200℃加热蒸馏,收集馏分。称取10 g所收集的馏分于190 g的蒸馏水中溶解,置于棕色瓶中备用。
2.2.2各单糖标准溶液及样品溶液的配制文献[16-17]研究表明,金线莲中多糖主要是由葡萄糖、甘露糖、鼠李糖、半乳糖和岩藻糖组成,本实验分别取上述5种单糖标准品,经苯酚-硫酸法显色后,将其紫外-可见吸收谱图与样品溶液相比较,以选取最合适单糖标准品。
分别精密称取甘露糖、鼠李糖、葡萄糖、半乳糖和岩藻糖的单糖标准品50 mg于5个50 m L的容量瓶中,加水定容,即得5种1.0 mg/m L的单糖标准储备液,4℃冷藏备用。再分别精密称取13种干浸膏50 mg于13个50 m L的容量瓶中,加水定容,即得1.0 mg/m L的样品溶液,4℃冷藏备用。
2.2.3吸收波长的选择精密量取13种1.0 mg/m L的样品溶液1.00 m L于13个10 m L容量瓶中,加水定容摇匀,即得13种0.1 mg/m L的样品溶液。再分别量取各样品溶液1.00 m L于13支10 m L具塞试管中,各加入5%苯酚0.6 m L,浓硫酸6.0 m L,混匀,置于100℃水浴中,15 m in后取出,立即放入冰水浴中冷却15 m in,室温放置15 m in,用紫外-可见分光光度仪扫描300~700 nm的吸收曲线。
2.2.4不同单糖吸收谱图绘制分别精密量取1.0 mg/m L的单糖标准储备液1.00 m L于10 m L容量瓶中,加水定容摇匀,即得5种0.1 mg/m L的单糖标准品溶液。再分别量取各单糖标准品溶液1.00 m L按照“2.2.3”苯酚-硫酸法的反应流程操作后,用紫外-可见分光光度仪扫描300~700 nm波长范围内的吸收谱图。
2.3 换算因子f的测定
精密称取经高速逆流色谱法(high-speed countercurrent chromatography,HSCCC)纯化过的金线莲精制多糖10 mg,加入50 m L容量瓶中,加水定容摇匀即得0.2 mg/m L的储备液。精密量取该储备液0.50 m L,水补足至1.00 m L,按“2.2.3”的方法测定吸光度值,并按下式计算换算因子f。

其中W为所称多糖质量;C为供试液中葡萄糖浓度;D为稀释体积。
3 结果与讨论
3.1 单糖标准品的选择
目前多糖测定基本以葡萄糖为标准品,但是植物多糖是由不同单糖以不同的摩尔比例按一定的排列顺序构成的,而不同单糖在苯酚-硫酸法中的显色程度、脱水难易、脱水产物的结构和稳定性都存在差异,在无法获得与待测多糖组成完全一致的标准多糖的条件下,选择显色后谱图与待测多糖最为接近的标准单糖作为参考较为准确,故本实验对不同单糖与待测金线莲多糖显色后的谱图作了对比,以期能够更加准确通过标准曲线换算待测多糖的含量。
按“2.2.3”实验方法,得金线莲多糖样品溶液和不同单糖样品溶液经过苯酚-硫酸法显色后的紫外-可见吸收谱图,如图2~3。各不同样品溶液的吸收光谱图形状和峰位置几乎相同(如图2所示),最大吸收波长均为(482±0.5)nm。
图2是葡萄糖标准品和样品溶液的吸收曲线,图3是甘露糖、鼠李糖、半乳糖和岩藻糖的吸收曲线。由图2,3显示每条曲线主要有两个吸收峰,分布在320 nm和480 nm左右,在480 nm附近的吸收峰为多糖经苯酚-硫酸法显色后的吸收峰,是重点考察对象。葡萄糖和样品溶液两个吸收峰分别位于320 nm和482 nm处,且320 nm的峰吸收值大于482 nm,肩峰的位置均是528 nm。鼠李糖和岩藻糖在478 nm处有最大吸收,甘露糖和半乳糖分别是在483 nm和482 nm处有最大吸收,另1个吸收峰皆为(320±1)nm,且478 nm 或482 nm或483 nm的峰吸收值大于320 nm,即长波长峰值大于短波长峰值,肩峰的位置分别是526 nm和528 nm。
由于不同单糖经过苯酚-硫酸法后所得吸收曲线和最大吸收值位置不同,导致标准曲线斜率差异较大,并将直接影响到金线莲多糖含量测定时的计算,所以选择合适的单糖作为标准参考十分重要。综上所述,葡萄糖标准品和样品溶液的吸收曲线最为相似,所以实验选用葡萄糖作为单糖标准品。这与文献[18]研究芦荟多糖的实验结果不同,其可能是由于所研究药材不一样,得到的多糖样品组成也不同。
3.2 苯酚-硫酸法测定波长的选择
多糖经浓硫酸水解产生单糖,单糖在浓硫酸加热作用下,失去3分子水,生成糠醛类衍生物,糠醛类衍生物进一步与苯酚合成有色物质。实验中发现,13种样品溶液经苯酚-硫酸法显色后均是在(482±0.5)nm处有最大吸收,最终选择482 nm作为测定时的吸收波长。在一定浓度范围内,显色程度与糖的浓度成线性关系,以此来计算样品中多糖的含量。
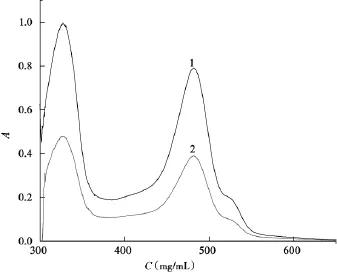
2 葡萄糖和ARPS经过苯酚-硫酸法后的紫外-可见吸收谱图

3 不同单糖经过苯酚-硫酸法后的紫外-可见吸收谱图
3.3 葡萄糖标准曲线的绘制
精密量取0.1 mg/m L的葡萄糖溶液0,0.20,0.40,0.60,0.80,1.00 m L于6支10 m L具塞试管中,水补足至1.00 m L,按“2.2.3”苯酚-硫酸法反应后,以0号管为空白对照,于482 nm的固定波长处测定吸光度,每浓度设重复测定3次。以葡萄糖浓度C(mg/m L)为横坐标,吸光度值A为纵坐标,绘制葡萄糖浓度与吸光度的标准曲线,如图4所示,并得到线性回归方程:
A=7.513C+0.012 4,
R2=0.999 7。葡萄糖溶液的浓度在0.02~0.10 mg/m L范围内呈良好的线性关系。
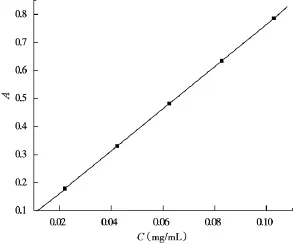
4 葡萄糖标准曲线
3.4 精密度试验
分别精密量取0.1 mg/m L的葡萄糖液0.50 m L 5份,0.1 mg/m L的南靖A3区样品3溶液1.00 m L 5份于10 m L的具塞试管中,加水补足至1.00 m L,另取1.00 m L的水作为空白对照,按“2.2.3”苯酚-硫酸法反应后于482 nm处分别测定吸光度。葡萄糖液的平均吸光度为0.398 4,RSD=0.96%,南靖A3区样品溶液的平均吸光度为0.526 3,RSD=0.83%,表明该方法精密度良好。
3.5 稳定性试验
继精密度测定后,每隔15 m in在482 nm处测定各管的吸光度,结果如表3所示,表明此方法在2 h内稳定。
3.6 用精制的金线莲多糖计算换算因子f
金线莲多糖是由多种单糖组成的杂多糖,不同糖在苯酚-硫酸法中的显色程度、脱水难易、脱水产物的结构和稳定性都存在差异,因此单纯以葡萄糖标准曲线换算的测定结果会存在一定误差。董群等[19]讨论了在苯酚-硫酸法中多糖换算因子f的计算方法,但其需要先测定多糖的糖组成及准确的摩尔比。另外,在一些文献中虽有用精制多糖计算换算因子,但可能因精制多糖杂质去除程度不够,所得f值为2~4,使得所测含量乘以f后成倍增加。本实验采用经HSCCC精制后的金线莲多糖来计算换算因子f的值,精制多糖组成上与待测样品最为接近,且纯度达到90%以上,可有效消除单纯以葡萄糖为标准计算多糖含量而带来的误差,测得f为1.06,结果更加接近真实值。
3.7 多糖的含量测定
精密量取1.0 mg/m L的13种样品溶液各1.00 m L于13个10 m L容量瓶中,加水定容,即得13种0.1 mg/m L的样品溶液。准确移取0.1 mg/m L的各样品溶液1.00 m L于10 m L具塞试管中,按“2.2.3”的方法测定吸光度值,每种溶液平行测定3管,每管设重复测定3次,并按下式计算多糖含量:
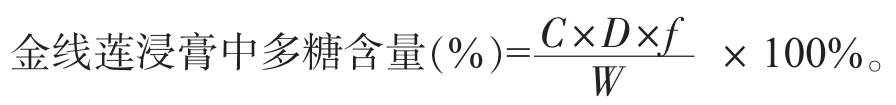
金线莲药材中多糖含量(%)=浸膏中含量×浸膏得率。
其中C为样品中对应葡萄糖浓度;D为稀释体积;f为换算因子;W为原料干质量。

表3 稳定性试验

表4 不同金线莲中粗多糖干浸膏得率比较
按实验方法“2.1”,计算得金线莲粗多糖干浸膏得率如表4所示。结果表明永安对照区的得率最低,南靖A1区得率最高。
各个样品中金线莲多糖的含量如表5所示,浸膏中多糖含量40%~79%,药材全草中多糖含量2.01%~17.49%,相差8倍多,表明不同栽培方式对药材多糖含量有着重大的影响,且组培的金线莲药材中多糖含量普遍高于野生的,南靖产的金线莲药材中多糖含量普遍高于永安产的,台湾品种金线莲药材中多糖含量也较高。
3.8 加样回收试验

加样回收试验结果如表6,表明该方法回收率良好。
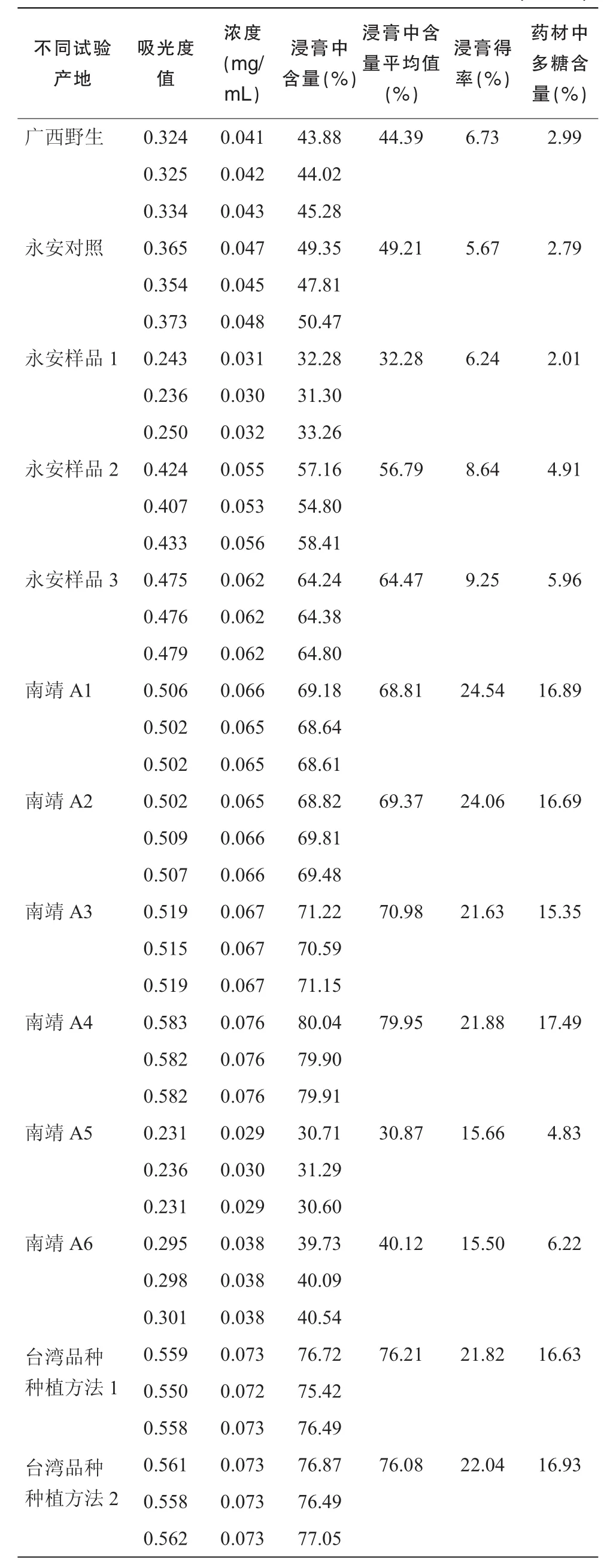
表5 不同试验产地金线莲中多糖的含量测定结果(n=3)
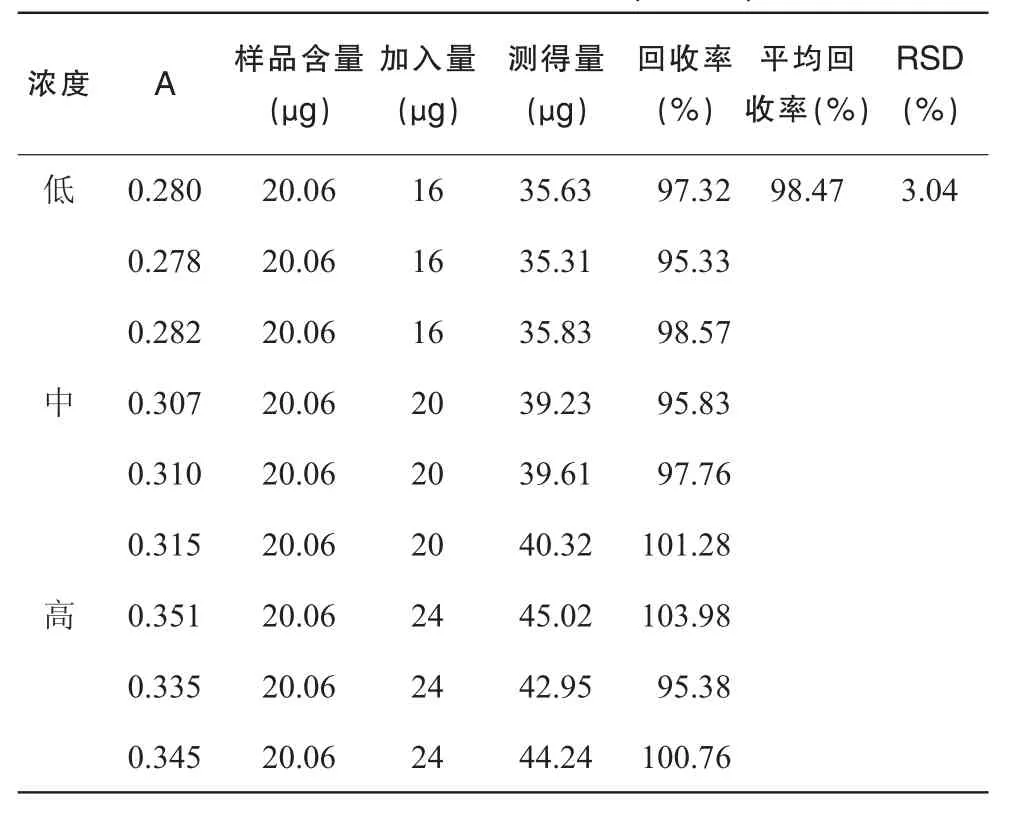
表6 回收率试验结果(n=9)
4 结论
在苯酚-硫酸法测定多糖含量中,由于不同单糖在苯酚-硫酸法中的显色程度、脱水难易、脱水产物的结构和稳定性都存在差异,而植物多糖是由不同单糖通过糖苷键连接而成的杂多糖,所以选择合适的单糖作为标准参考十分重要。本实验中的金线莲多糖与葡萄糖经过苯酚-硫酸法显色后的紫外吸收谱图最为相似,故选择葡萄糖作为单糖标准品进行含量计算。苯酚-硫酸法为多糖含量测定的经典方法,方法学考察结果进一步证明其适用于测定多糖的含量。不同产地及不同培养条件的金线莲中多糖含量差异较大,药材全草中多糖含量为2.01%~17.49%,相差8倍多,表明栽培方式对药材多糖含量有着重大的影响,且人工栽培的金线莲药材中多糖含量普遍高于野生品种,但对于药材的质量评价还有待于对活性成分的进一步研究。
[1]福建中医药研究所.福建药物志(第2册)[M].福州:福建科技出版社,1982:215.
[2]刘冬生.金线莲人工培养关键技术[J].南方园艺,2013,24(3):50-55.
[3]罗晓青,吴明开,查兰松,等.珍稀药用植物金线莲研究现状与发展趋势[J].贵州农业科学,2011,39(3):71-74.
[4]Han MH,Yang XW,Jin YP.Novel triterpenoid acylestefs and alkaloids from Anoectochilus roxburghll[J].Phytochem ical Analysis,2008,19(5):434-438.
[5]刘姚,欧阳克蕙,葛霞,等.植物多糖生物活性研究进展[J].江苏农业科学,2013,41(7):1-4.
[6]申利红,王建森,李雅,等.植物多糖的研究及应用进展[J].中国农学通报,2011,27(2):349-352.
[7]刘青,刘珍伶,周娟.金线莲多糖的体外抗氧化活性[J].华侨大学学报,2010,31(6):718-720.
[8]许丹妮,李健,马玉芳,等.金线莲多糖对免疫抑制小鼠脾淋巴细胞增殖及免疫器官的影响[J].中兽医医药杂志,2011(3):15-17.
[9]王常青,严成其,王勇,等.台湾金线莲多糖的分离纯化及其体外抑瘤活性研究[J].中国生化药物杂志,2008,29(2):93-96.
[10]翁秀华,王长连,袁曦,等.金线莲对人前列腺癌PC-3细胞增殖能力的影响[J].中国医院药学杂志,2011,31(13):1083-1086.
[11]龚秀会,许敏,董鸿竹,等.不同基原金线莲植物的化学成分比较研究[J].安徽农业科学,2012,40(36):17530-17531.
[12]黄瑞平,黄颖桢,陈菁瑛,等.不同月龄金线莲多糖和总黄酮含量的比较[J].热带生物学报,2012,3(2):174-176.
[13]杨翠芹,秦耀国,曾富春,等.不同培养条件对金线莲多糖与总生物碱含量的影响[J].中国农学通报,2010,26(23):259-262.
[14]顾慧芬,庄意丽,梅其春.野生与组培金线莲有效成分的比较及RAPD分析[J].中成药,2011,33(8):1364-1367.
[15]李会霞,叶舟,陈伟,等.不同提取工艺对茶树菇多糖得率及抗脂质过氧化作用的影响[J].热带作物学报,2009,30(9):1246-1250.
[16]张锦雀.金线莲多糖分离纯化、结构表征及其抗肿瘤作用研究[D].福建:福建医科大学,2009.
[17]张晓辉.金线莲多糖结构分析及抗糖尿病活性研究[D].广东:汕头大学,2011.
[18]陈伟,陈俊,林新华,等.库拉索芦荟多糖的分离纯化和含量测定[J].中国现代应用药学杂志,2005,22(2):131-133.
[19]董群,郑丽伊,方积年.改良的苯酚-硫酸法测定多糖和寡糖含量的研究[J].中国药学杂志,1996,31(9):550-553.
Selection of Standard M onosaccharide and Analysis of Polysaccharide Content in Anoectochilus Roxburghii from Different Experimental Provenances
Lin Shouer1,Huang Liying1,Wu Xingm ing2,Chen Yu3,Huang Qingzuo1,Huang Binglan1(1 College of Pharmacy,Fujian Medical University,Fujian Fuzhou 350004,China;2 Agricultural Bureau of Yong'an,Yong'an 366000;3 College of Preclinical Medicine Fujian Medical University)
Objective:To develop a method for determ ination of content of Anoectochilus roxburghii polysaccharide(ARPS),compare the contents of ARPS in the plants from various experimental provenances and select the optimal standard monosaccharide to calculate the ARPS content.M ethods:Crude ARPS was prepared by water extraction-alcohol precipitation method,and deproteinized by Sevage method.The optimal standard monosaccharide was selected by comparing the UV spectra of various monosaccharides and sample solutions. Meanwhile,the conversion factor(f)was calculated w ith refined ARPS,based on which the content of ARPS from various experimental provenances were determined by phenol-sulfuric acid method.Results:The ARPS content was calculated using glucose as the standard monosaccharide.The conversion factor f was 1.06 and the average recovery rate was 97.94%.The contents of ARPS in plants from various experimental provenances ranged from 2.01% to 17.49%.Conclusion:The method is simple,stable and feasible.The contents of ARPS in plants from various
experimental provenances were significantly different.The results provide a basis for the cultivation and further study of Anoectochilus roxburghii.
Anoectochilus roxburghii;Polysaccharide;Content Determination;Standard Monosaccharide;Experimental Provenances
10.3969/j.issn.1672-5433.2016.07.004
福建省卫生教育联合攻关计划项目(wkj-FJ-33);福建省自然基金项目(2012J01368,2012J01363)
林守二,女,在读硕士。研究方向:天然药物分析。E-mail:893447163@qq.com
黄丽英,女,教授,博士生导师。研究方向:天然药物分析。通讯作者E-mail:fjmuhly88@sina.com
2015-11-18)
