芸豆萌发前后淀粉理化特性变化
2016-08-07曹龙奎王倩文
曹龙奎,王倩文
(1.国家杂粮工程技术研究中心/黑龙江八一农垦大学,大庆163319;2.黑龙江八一农垦大学食品学院)
芸豆萌发前后淀粉理化特性变化
曹龙奎1,王倩文2
(1.国家杂粮工程技术研究中心/黑龙江八一农垦大学,大庆163319;2.黑龙江八一农垦大学食品学院)
通过对芸豆萌发前后各时期淀粉理化特性进行研究,采用扫描电子显微镜法、激光粒度分布仪、X-射线衍射等方法测定淀粉理化特性变化并进行分析。结果表明:萌发过程中淀粉酶活性增加,在酶的作用下淀粉发生降解,淀粉的结构、组成等发生变化,从而影响淀粉的特性,对食品加工产生影响。随着萌发的进行,淀粉颗粒形态发生变化,完整的淀粉颗粒被破坏,表面出现不规则的缺痕和孔道,直链淀粉、支链淀粉含量比例先减小后增加,淀粉的溶解度先降低后增加,膨胀度先增加后降低。
萌发;芸豆淀粉;理化特性
芸豆是我国杂豆出口最主要的商品,约占我国各杂豆出口的60%。芸豆营养成分含量丰富,富含蛋白质、必需氨基酸、维生素B族、矿物质元素钙、铁等。具有提高人体免疫能力,增强抗病能力,对肿瘤细胞的发展有抑制作用等。但芸豆存在营养不平衡和抗营养成分等不利因素,这些问题限制了芸豆的开发与加工。萌发使酶活性增强,催化酶促反应发生并进行生物转化,从而导致营养结构、理化特性等发生变化。食品加工与淀粉来源,直链淀粉、支链淀粉的比例,热机械历程等存在很大的相关性。萌发过程中淀粉酶活性增加,在酶的作用下淀粉发生降解,淀粉酶将淀粉转化成葡萄糖。淀粉的降解使淀粉的结构、组成等发生变化,从而影响淀粉的特性,对食品加工产生影响。
国内外有研究表明,经萌发处理后的杂粮具有良好的风味和口感,降低或消除其中有毒有害物质或抗营养物质的含量,改变了淀粉的理化特性,增加了蛋白质和淀粉的消化性,在一定程度上调整了营养结构,提高了其营养价值及保健功能。通过对芸豆萌发各时期的主要营养成分、理化特性变化进行分析,为进一步研究和开发具有生理活性的杂粮食品提供理论基础。
1 材料与方法
1.1 材料与试剂
紫花芸豆,大庆市谷麦良园米业有限公司;直链淀粉标准品,Sigma试剂公司;支链淀粉标准品,Sigma试剂公司;氢氧化钾,天津市大茂化学试剂厂;盐酸,广州万从化工有限公司;碘化钾,郑州智逸化工产品有限公司;碘,上海氏典化工科技发展有限公司;石油醚,廊坊维尔康生物化工有限公司;乙醇,中国医药上海化学试剂公司。
1.2 仪器与设备
酸度计FE20K,瑞士METTLER TOLEDO公司;紫外可见分光光度计T6,北京普析通用仪器有限责任公司;扫描电子显微镜Quanta 200F,荷兰FEI公司;激光粒度分布仪Bettersize2000,丹东百特仪器有限公司;电热恒温水浴锅DK-S24型,上海森信实验仪器有限公司;离心机TD5A型,长沙英太仪器有限公司;低速大容量离心机LD4-40,北京京立离心机有限公司;鼓风干燥箱DGG-9053A型,上海森信实验仪器有限公司;冰箱,Haier公司;差式扫描量热仪DSC1,瑞士METTLER TOLEDO公司;水份分析仪MB25,常州奥豪斯仪器有限公司。
1.3 试验方法
国内外许多研究表明,经萌发处理后可以降低或消除杂粮中有毒、有害或抗营养物质的含量,在一定程度上可调整营养结构,改善风味、口感,改变淀粉的理化特性,增强杂粮的营养价值及消化性等。通过对紫云芸豆进行萌发处理,取同一生长条件下,不同芽长、不同萌发时间的芸豆为样品,研究萌发前后芸豆淀粉理化性质变化。
1.3.1 芸豆萌发处理
选择色泽新鲜、籽粒饱满、无虫蛀、无霉烂、无残破豆粒、发芽势强的优质紫云芸豆,清洗3遍,用0.5%次氯酸钠浸泡5 min,进行杀菌处理,再用去离子水反复冲洗,洗去残留的次氯酸钠。将芸豆捞出,用蒸馏水浸泡12 h(无光照)。将浸泡后的芸豆放置在发芽盘中室温下进行萌发处理(无光照),每天淋水3次。分别取萌发后不同时期、不同长度芸豆作为试验样品并放在40℃烘箱中烘干,然后将种子用粉碎机粉碎,过60目筛。测定样品以可食部100%取样。

表1 芸豆样品(共1 0个样品)Table 1 The samples of kidney bean(A total of 10)
1.3.2 淀粉提取
对萌发前后各时期的样品采用碱法进行淀粉的提取。取芸豆全粉,按料液比1∶3室温下浸泡12 h(0.3%NaOH溶液),将混匀的浸泡液过200目筛进行除杂处理,在3 000 r·min-1条件下离心5 min,弃去上清液后取下层沉淀,加入同比例蒸馏水混匀成浆,调节pH至中性,重复离心与清洗过程,剥刮掉沉淀上层的残余物质。在40℃条件下干燥处理,粉碎过100目筛,即得芸豆淀粉。
1.3.3 芸豆淀粉组分测定
萌发前后各时期的芸豆样品采用碱法提取淀粉。对淀粉中水分,蛋白质,脂肪,灰分含量分别进行测定,采用双波长法测定淀粉中直链、支链淀粉含量[1-2]。
1.3.4 芸豆淀粉颗粒形态测定
1.3.4.1 芸豆淀粉颗粒形貌测定
芸豆萌发前后淀粉颗粒形貌采用扫描电子显微镜进行观察。测定前样品首先干燥处理,使用双面胶粘取适量干燥好的样品固定,并进行喷金处理,以10 KV的加速电压进行观察并拍摄具有代表性的淀粉颗粒形貌,照片放大倍率为5 000×5 000。
1.3.4.2 芸豆淀粉颗粒粒度分布测定
淀粉颗粒粒度分布采用Bettersize2000激光粒度分布仪进行测定,通过自动循环分散系统将样品输送到激光粒度仪的测定区域,分散剂采用蒸馏水,根据Mie散射原理对散射光产生的电信号进行处理,得到所测样品的粒度分布结果。
1.3.4.3 芸豆淀粉颗粒晶体结构测定
芸豆萌发前后淀粉的结晶度采用XRD法进行测定。特征射线为Cu Kα,入射线波长λ=0.154 18 nm,Ni滤波片,管压40 kV,管流40 mA,扫描范围3~60°,扫描步长0.02度,每步停留时间6 s,狭缝1 mm。
1.3.5 芸豆淀粉膨胀度与溶解度测定
取500 mg芸豆淀粉于50 mL离心管中,加入蒸馏水25 mL,振荡后分别在30~90℃不同温度下加热30 min,每5 min振荡1次,取出冷却至室温,3 000 r·min-1离心20 min,将上清液倒入恒重铝盒中,于130℃烘干至恒重,在干燥箱中冷却至室温称重,同时准确称取离心管和沉淀的质量,计算淀粉溶解度与膨胀度。
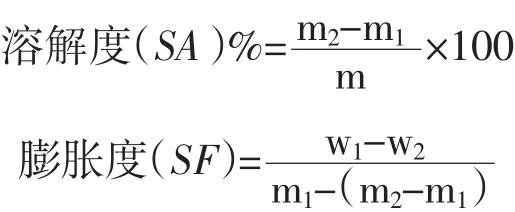
m1——铝盒质量,g;m2——干燥冷却后上清液与铝盒共同质量,g;m——称取样品质量,g;w1——离心后离心管与沉淀共同质量,g;w2——离心管质量,g。
2 结果与分析
2.1 芸豆淀粉组成
芸豆淀粉基本组分见表2。通过作图法(如图1)确认直链淀粉、支链淀粉的最大吸收波长和参比波长为λ直1=612 nm,λ直2=425 nm;λ支1=535 nm,λ支2= 725 nm。利用已知的吸收波长和参比波长进行标准曲线的绘制,以浓度为横坐标,直链淀粉、支链淀粉标准溶液中分别取一定梯度的浓度为横坐标,以其相应的吸光度值△A(△A=λ1-λ2)为纵坐标绘制标准曲线(如图2、3)。得直链淀粉回归方程为y=0.007 7x-0.002 7,相关系数R2=0.999 4,支链淀粉回归方程为y=0.002 1x-0.000 8,相关系数R2=0.999 2。计算直链淀粉、支链淀粉含量。如表2所示,芸豆淀粉10种样品蛋白质、脂肪、灰分含量均较少,提取淀粉含量较高,直链淀粉、支链淀粉含量及比例发生变化,直链淀粉含量先降低后增加,支链淀粉含量先增加后降低。
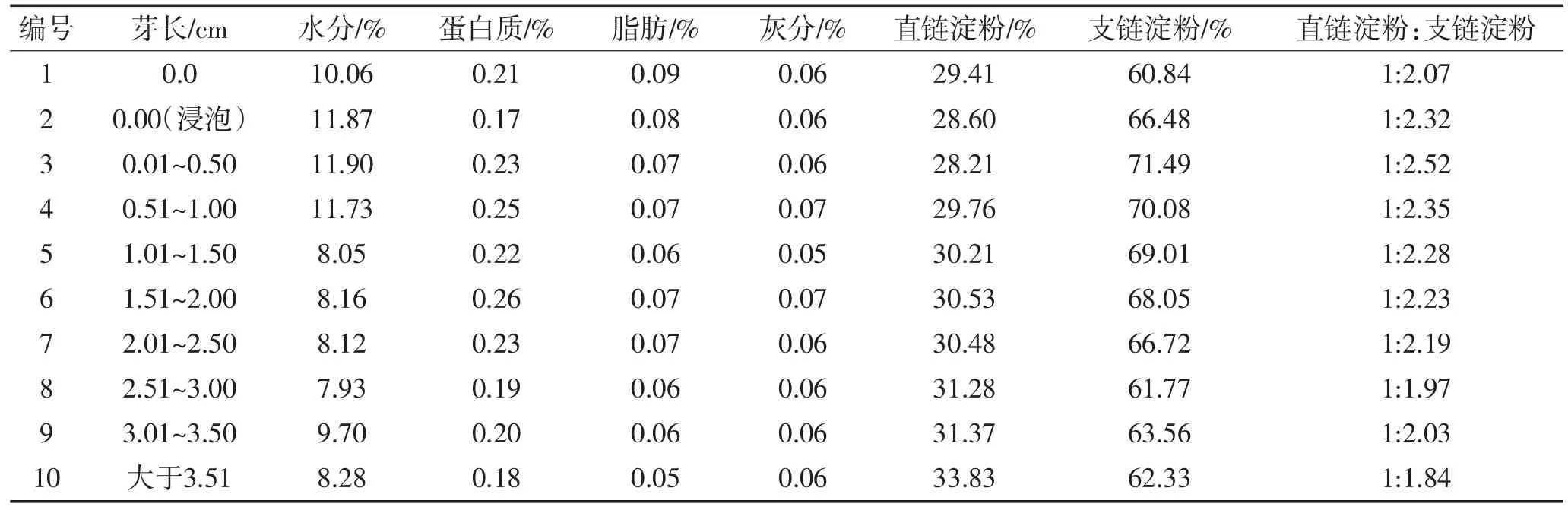
表2 芸豆淀粉基本成分T a b le 2 T h e c o m p o s itio n o f th e k id n e y b e a n s ta rc h
2.2 芸豆淀粉颗粒形态
2.2.1 芸豆萌发前后淀粉颗粒形貌
芸豆萌发前后淀粉颗粒形貌变化通过扫描电子显微镜观察。如图4所示,淀粉颗粒多呈卵形,小淀粉颗粒呈圆形,并且表面光滑。芸豆萌发初期,淀粉颗粒保持完整仅有微小变化,随着萌发的进行,完整的淀粉颗粒被破坏,表面出现不规则的缺痕和孔道。在整个萌发过程中酶催化使淀粉发生水解作用,酶水解作用首先攻击淀粉颗粒表面,使表面形成不规则的缺痕和孔道[3],随着萌发的进行,酶作用于表面上的离散点,形成淀粉内部的通道,酶进入内部通道,然后从内部向外水解淀粉[4],淀粉不断被分解,缺痕继续增多、扩展,连成网状结构,使淀粉分裂成细粒。此外,淀粉在提取过程中,离心后对淀粉的提取、剥刮,上层淀粉颗粒遭到了一定程度的破坏[5]。扫描电子显微镜对淀粉团粒表面、内部结构、酶攻击和转换模式等方面的观察发挥着极其重要的作用[6]。对淀粉内部结构的了解,有助于掌握淀粉的功能特性和转化方式,优化淀粉改性条件,提高淀粉产品品质性能。
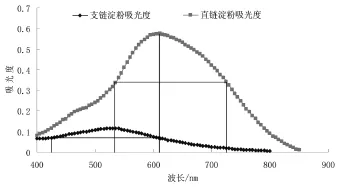
图1 直链淀粉、支链淀粉光谱扫描图Fig.1 UV-visible scanning spectra of amylose and amylopecti
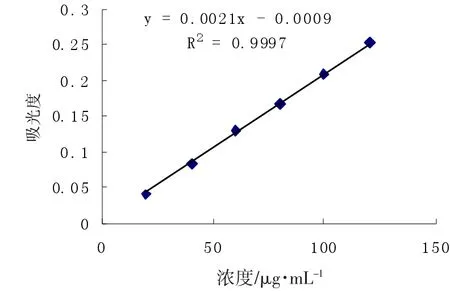
图2 直链淀粉标准曲线Fig.2 Standard curve of amylase
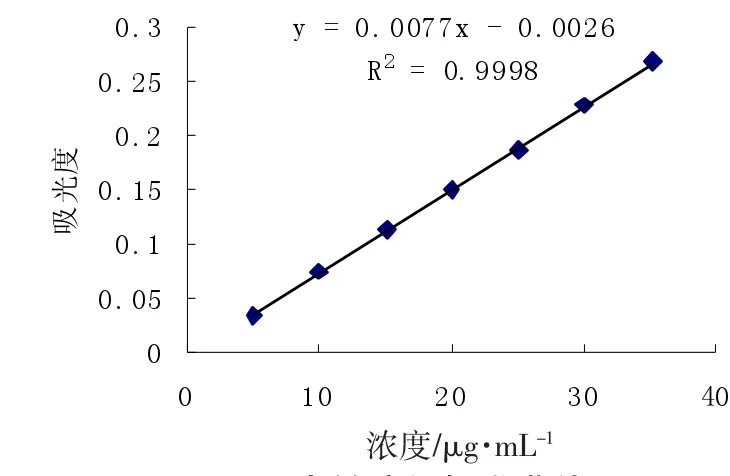
图3 支链淀粉标准曲线Fig.3 Standard curve of amylopectin


图4 扫描电子显微镜观察淀粉颗粒形貌Fig.4 Morphology of the kidney bean starch granules observed by scanning electron microscop
2.2.2 芸豆萌发前后淀粉颗粒粒度分布
粒度分布反映出一系列不同粒径颗粒分别占粉体总量的百分比。芸豆萌发前后淀粉颗粒粒度分布采用激光粒度分布仪进行测定。萌发前后的淀粉颗粒粒度分布图均为单一峰,淀粉颗粒粒度范围为0.452~61.74 μm。未萌发的芸豆淀粉颗粒体积平均径为28.91 μm,中位径(D50)为28.97 μm,即大于或小于28.97 μm的颗粒的体积均占总体积的50%。芸豆萌发过程中,淀粉水解酶催化淀粉水解,完整淀粉粒被破坏,随着芽长的增长,淀粉颗粒粒径逐渐减小,淀粉颗粒不断分解直至分裂成细粒。当芽长大于3.51 cm时,芸豆淀粉体积平均径为25.42 μm,中位径(D50)为25.81 μm,即大于或小于25.81 μm的颗粒的体积均占总体积的50%。
2.2.3 芸豆萌发前后淀粉X射线衍射
淀粉颗粒不是一种淀粉分子,而是由许多直链和支链淀粉分子构成的聚合体,这种聚合体不是无规律的,它由两部分组成,即有序的结晶区和无序的非结晶区。X-射线衍射可以反映出淀粉颗粒大范围的有序排列(结晶度)。淀粉颗粒的晶体结构类型有三种,即为A型、B型、C型。芸豆萌发前后X-射线衍射图如图5所示,萌发处理后的芸豆淀粉保留了未萌发时芸豆淀粉的衍射图谱特征峰,并与C型图谱相一致,即芸豆萌发前后淀粉颗粒晶型为C型。由此表明,萌发过程中的淀粉水解反应主要发生在淀粉颗粒的无定形区[7]。芸豆萌发前后2θ为14.920~ 15.190,16.980~17.200,22.940~23.180处出现明显的强吸收峰,但不同芽长的芸豆淀粉衍射强度及位置略有差异。淀粉颗粒的结晶部分主要来自支链淀粉分子的非还原性末端附近[8],结晶度与萌发过程中直链淀粉和支链淀粉含量及其比例的变化有关,结晶度总体呈下降趋势。结晶度的大小与淀粉的物理、机械性能有着紧密的关系。
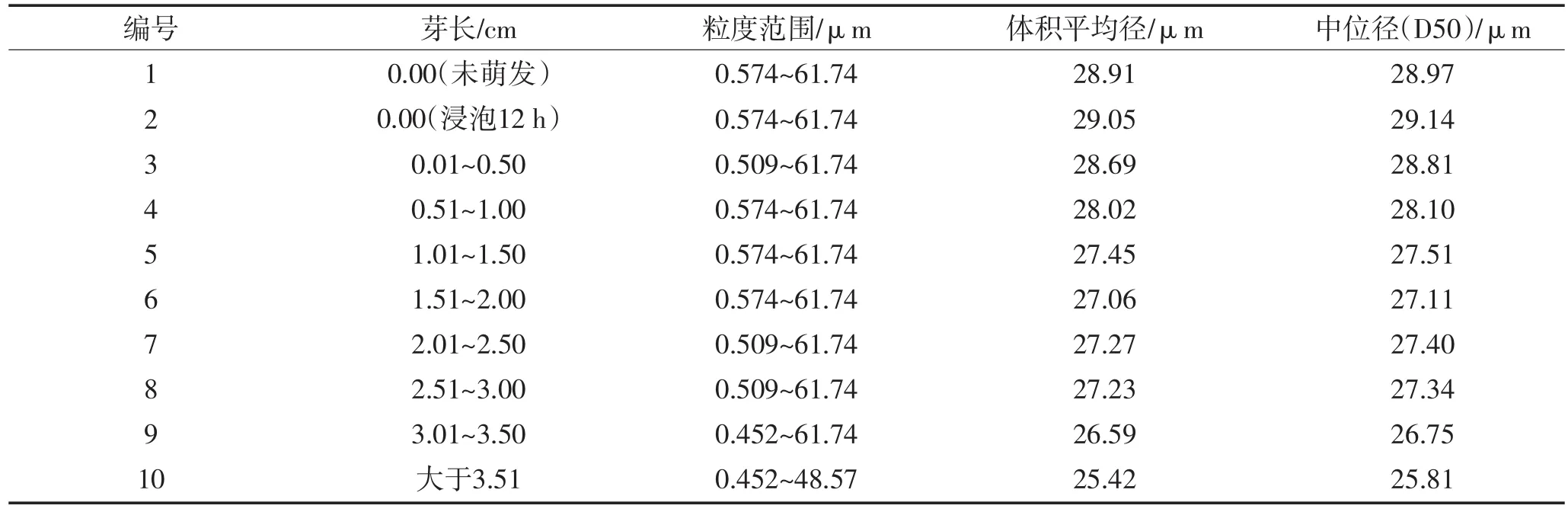
表3 淀粉颗粒粒度分布Table 3 Particle size distribution for the kidney bean starch
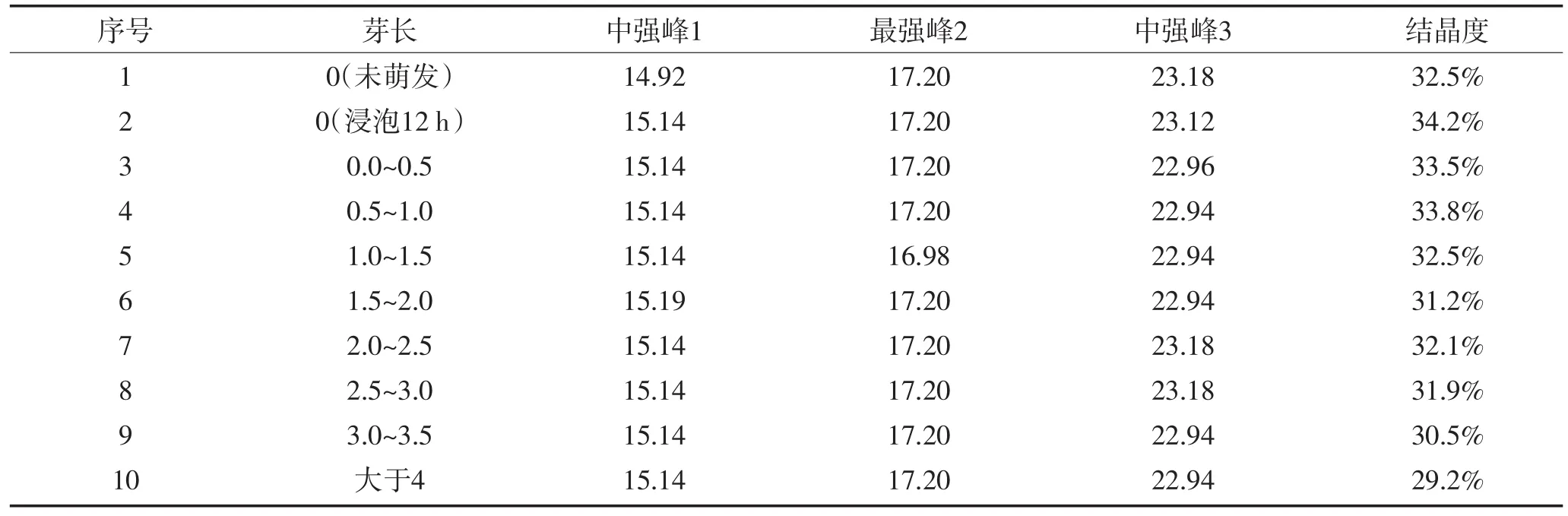
表4 淀粉颗粒X射线衍射Table4 Degree of starch granuleo bserved by X-ray diffraction
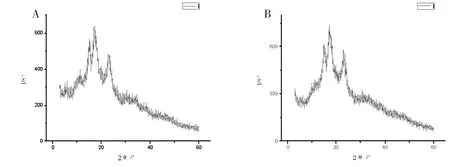
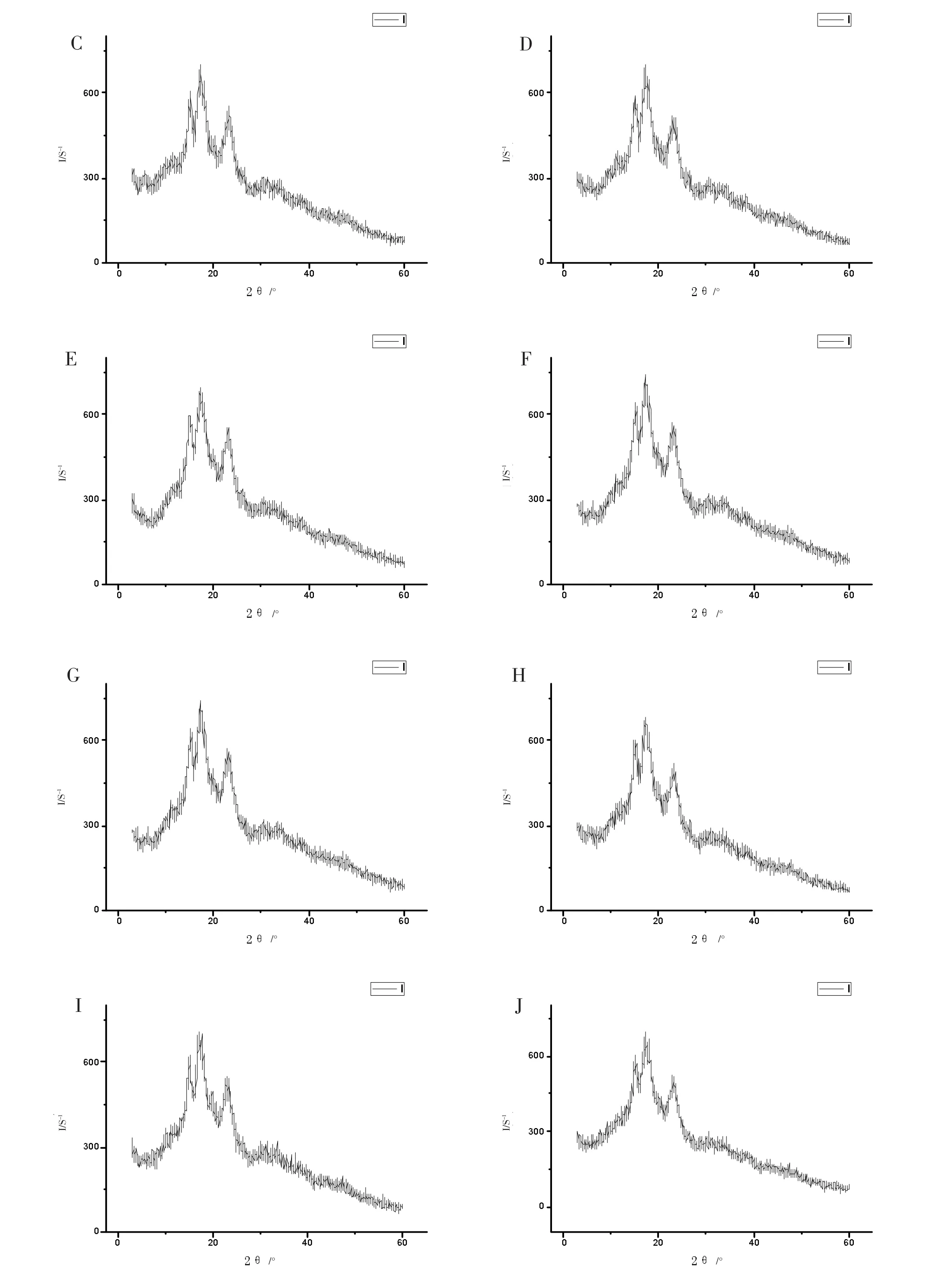
图5 淀粉颗粒射线衍射图Fig.5 X-ray diffraction patterns of the kidney bean starc
2.3 芸豆萌发前后淀粉溶解度、膨胀度
溶解度和膨胀度是淀粉颗粒与水结合强度的表征。淀粉的溶解度主要反映直链淀粉特性。随着温度的增加,开始大量吸水,部分直链淀粉分子从颗粒中被沥滤出来,水溶性组分浸出增加,温度增加,淀粉分子的流动性加强,削弱了淀粉分子的结合力,可溶部分逐渐浸出,提高了淀粉的溶解度及淀粉间的孔隙度。淀粉的膨胀主要反映支链淀粉的特性。水分子进入淀粉颗粒,是从非结晶部分开始,淀粉颗粒内部结构未发生改变。
未萌发和萌发的芸豆淀粉的溶解度(如图6)和膨胀度(如图7)均随着温度的增加而增强。当温度为30~60℃时,淀粉的溶解度和膨胀度增加较小,当温度为70~90℃时,溶解度和膨胀度明显增加。芸豆萌发,酶活性增强,淀粉酶被激活,使淀粉发生降解[9-10],淀粉结构、组成发生变化,引起了直链淀粉、支链淀粉发生变化。淀粉的溶解和膨胀与淀粉颗粒的大小、形态、组成等有关[11]。芸豆萌发,直链淀粉含量先增加后减小,70℃时未萌发的芸豆淀粉溶解度、膨胀度为1.789 9%、3.588 8,芽长为0.01~0.50 cm时芸豆淀粉的溶解度、膨胀度为1.274 6%、5.239 8,芽长大于3.51 cm时淀粉的溶解度、膨胀度为2.751 2%、3.318 2。随芸豆萌发的进行,淀粉的溶解度先降低后增加,膨胀度先增加后降低,淀粉的溶解度和膨胀度为颗粒内键的结合程度提供了有力依据[12],反映了萌发后内部结合程度的变化。脂类物质及脂肪与直链淀粉形成的脂肪-直链淀粉复合物对淀粉的溶解度、膨胀度有抑制作用。
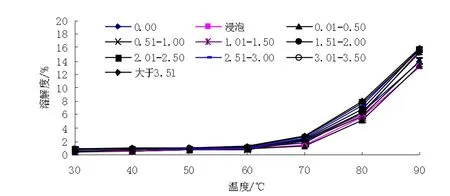
图6 30~90℃下芸豆淀粉溶解度Fig.6 Kidney bean starch solubility under 30-90℃
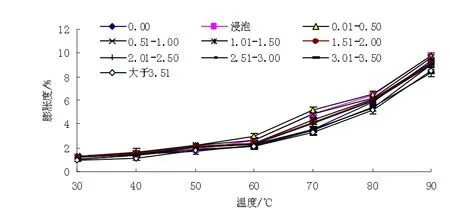
图7 30~90℃下芸豆淀粉膨胀度Fig.7 Kidney bean starch swelling under 30-90℃
3 结论
萌发过程中淀粉酶活性增加,在酶的作用下淀粉发生降解,淀粉的结构、组成等发生变化,从而影响淀粉的特性,对食品加工产生影响。以萌发前后10种紫云芸豆全粉作为原料提取淀粉,分析理化特性变化及原因。萌发促使了直链淀粉含量呈先减小后增加的趋势。淀粉的溶解度、膨胀度均随温度的增加而增加,随着萌发的进行,溶解度先减小后增加,膨胀度先增加后减小。通过研究萌发处理前后紫云芸豆淀粉理化性质的变化规律,对芸豆及其淀粉加工及品质产生影响,并在一定程度上使理化特性可控,有利于芸豆食品的开发和利用,为进一步研究、开发、生产加工具有生理活性的杂粮食品提供理论基础。
[1] 金玉红,张开利,张兴春,等.双波长法测定小麦及小麦芽中直链、支链淀粉含量[J].中国粮油学报,2009,24(1):137-140.
[2] 陈丽娜,石矛.双波长法测定油莎豆直、支链淀粉含量的研究[J].食品科技,2010,35(8):325-327.
[3] ClaverIP,Zhangl. Impactofthesoakandthemaltonthe physicochemicalpropertiesofthesorghumstarches[J].International Journal of Molecular Sciences,2010,11:3002-3015.
[4] MacGregorAW,BalanceDL.Hydrolysisoflargeandsmall starchgranulesfromnormal andwaxybarleycultivarsby α-amylasesfrombarleymalt[J].CerealChem,1980,57:397.
[5] FengfengWu,Haiying Chen,Na Yang,etal.Effectofgerminationtimeonphysicochemicalpropertiesofbrownrice flourandstarchfromdifferentricecultivars[J].Journalof CerealScience,2013,58:263-271.
[6] GallantDJ,BouchetB,BaldwinPM.Microscopyofstarch:Evidenceofanewlevelofgranuleorganization[J].CarbohydrPolym,1997,32:177-191.
[7] 乔潇,郎秀峰.功能化多肽的研究概述[J].河北科技师范学院学报,2015,29(1):70-76.
[8] 曹龙奎,李凤林.淀粉制品生产工艺学[M].北京:中国轻工业出版社,2008.
[9] LorteiE,AlpiA,PerataP.Alpha-amylaseexpressionunder anoxiainriceseedlings:Anupdate[J].RussianJournalof PlantPhysioligy,2003,50(6):737-742.
[10] Gamel T H,Linssen J P,Mesallem A S,et al.Effect of seed treatments on the chemical composition and properties oftwo amaranth species:starch and protein[J].Journal of the Science of Food and Agriculture,2005,85(2):319-327.
[11]Tester R F.Morrison W R.Swelling and gelatinization of cereal starches.Effects of amylopectin,amylase,and lipids[J].Cereal Chemistry,1990,67:551-557.
[12]张钟,王丽,田奎.发芽对黑糯玉米淀粉特性的影响[J].中国粮油学报,2006,21(5):54-57.
[13]史蕊,钱丽丽,闫平,等.黑龙江不同地域大米糊化特性和直链淀粉含量的研究[J].黑龙江八一农垦大学学报,2014,26(6):54-57.
[14]于立梅,钟惠曾,于新,等.大豆发芽过程中营养成分变化规律的研究[J].中国粮油学报,2010,25(8):19-22.
Changes in before and after Germ ination of Physicochem ical Properties of K idney Bean Starch
Cao Longkui1,W ang Qianwen2
(1.National Engineering Research Center for Coarse Cereals,Heilongjiang Bayi Agricultural University,Daqing 163319;2.College of Food Science,Heilongjiang Bayi Agricultural University)
The changes of physicochemical properties of the kidney bean starches during kidney bean germination were investigated and analyzed by Scanning Electron Microscope method,Laser Particle Size Distribution Analyzer and X-Ray Diffraction.The results showed that the germination process increased enzyme activation,the starch degraded by the enzyme,the structure and component of starch changed.The results may affect the food quality during processing.Starch particle morphology changed,it was destroyed after germination and pits and holes appeared on the surface of some starch granules.The amylopectin/amylose ratio decreased first,then increased during germination.The changes of solubility were similar to the ratio,the changes of swelling were opposite to the ratio.
germination;kidney bean starch;physicochemical properties
S856.5
A
1002-2090(2016)03-0087-08
10.3969/j.issn.1002-2090.2016.03.018
2015-09-10
黑龙江省科技攻关项目(GC12B401);国家星火计划项目(2013GA670001);国家杂粮工程技术研究中心组建项目(2011FU125X07)。
曹龙奎(1965-)男,教授,沈阳农业大学毕业,现主要从事粮油精深加工方面的教学与研究工作。
