慈竹WRKY转录因子基因克隆及其胁迫诱导表达
2016-08-07刘红梅胡尚连卢学琴龙治坚
刘红梅,胡尚连*,曹 颖,卢学琴,徐 刚,龙治坚,任 鹏
(1.西南科技大学生命科学与工程学院,绵阳 621010;2.四川省生物质资源利用与改性工程技术研究中心,绵阳 621010)
慈竹WRKY转录因子基因克隆及其胁迫诱导表达
刘红梅1,2,胡尚连1,2*,曹 颖1,2,卢学琴1,2,徐 刚1,2,龙治坚1,2,任 鹏1,2
(1.西南科技大学生命科学与工程学院,绵阳 621010;2.四川省生物质资源利用与改性工程技术研究中心,绵阳 621010)
为了解慈竹WRKY生物学功能以及通过基因工程手段改良竹类植物。利用已获得慈竹转录组数据,克隆获得2条WRKY转录因子,分别命名为BeWRKY1 (GenBank:KJ462124)和BeWRKY2 (GenBank:KJ462125),两者分别编码189和295个氨基酸残基。序列分析表明,两者编码的蛋白均含有一个完整的WRKY superfamily的保守结构域。BeWRKY1属于Ⅱc亚家族;BeWRKY2则与TaWRKY16和AtWRKY39等聚为一枝,属于Ⅱd亚家族。定量PCR分析表明,BeWRKY1和BeWRKY2分别在茎和完全展开叶中具有较高表达量。200mmol·L-1NaCl和20% PEG 6000胁迫处理激活了BeWRKY1表达,却减少了BeWRKY2的转录积累。结果表明BeWRKY1可能短时间内迅速参与逆境响应;BeWRKY2对干旱和ABA胁迫伤害更为敏感,而可能不参与高盐类胁迫保护反应。
慈竹;WRKY;克隆;生物信息学分析;胁迫诱导
WRKY蛋白是植物特有的转录因子家族[1],含有高度保守的WRKY域的锌指蛋白,其保守域约由60个氨基酸残基组成[2]。根据WRKY结构域和锌指结构的数量将其分为Ⅰ类、Ⅱ类、Ⅲ类[3]。Ⅰ类含有两个WRKY结构域,Ⅱ类和Ⅲ类虽都含有一个WRKY结构域,但锌指结构不同。其中的Ⅱ类还根据不同的序列特征分为5个亚群[4]。目前已从拟南芥[5]、水稻(Oryzasativa)[6]、小麦(Triticumaestivum)[7]、(Solanumlycopersicum)[2]、毛竹(Phyllostachysheterocyclacv.Pubescens)[8]等植物中克隆得到大量的WRKY转录因子,但在慈竹中尚未见报道。WRKY蛋白具有快速、瞬时、具组织特异性诱导表达特性。其不仅与植物的生物与非生物胁迫应答密切相关,也与植物生长发育调控有关[9-11]。WRKY在非生物胁迫和非生物方面,研究表明水稻OsWRKY11[12]和OsWRKY45[ 13]、菊花WRKY3[14]、有24条WRKY基因[15]以及拟南芥AtWRKY30[16]均表现由抗干旱胁迫的能力,其中OsWRKY45不但具有抗干旱的能力还有抗高温和抗病毒的能力[13]。在植物生长发育以及衰老过程中,研究发现ScWRKY1转录因子在胚胎形成过程中发挥着至关重要的作用[17]。科学家发现在拟南芥的幼片和成熟叶片AtWRKY6转录因子几乎不表达,而在其衰老叶片中检测到很高的表达量,因此判断其与植物衰老程序密切相关[18]。虽然目前大量的WRKY转录因子功能已被证实,但还有大部分WRKY转录因子待更深入的进行研究。
慈竹(Bambusaemeiensis)是我国西南地区普遍栽培的大型丛生竹种[19],广泛用于造纸和园林绿化[20],在所有竹种中慈竹属于iV级纸浆竹[21],是重要的工业原料。但慈竹易受多种不利因素的影响而大面积减产。既影响新竹,又影响笋的生长[22];因此改良慈竹品种迫在眉睫。近年来随着基因组和转录组测序技术的广泛应用,毛竹、麻竹等竹种的基因组和(或)转录组数据已经被公布[23-24],但慈竹的研究相对较少。本课题组利用RNA-Seq技术进行了慈竹笋转录组研究,为发现慈竹笋发育、特征代谢合成和分解途径等提供了大量的候选基因,还为慈竹SSR和SNP等分子标记的开发提供了极为丰富的序列基础(数据待发表)。本研究以此转录组数据为基础,筛选并克隆了其中2个WRKY转录因子,并进行生物信息学和胁迫诱导表达模式分析,为了解慈竹WRKY生物学功能以及通过基因工程手段改良竹类植物奠定了一定基础。
1 材料与方法
1.1 实验试剂和菌株
OMEG植物总RNA提取试剂盒购自成都博瑞克生物技术有限公司;PrimerScript RT reagent Kit perferct real Time反转录试剂盒、TaKaRa LA Taq 聚合酶、T4-DNA连接酶、PGM-T vector、EcoRⅠ均购至天津的TaKaRa公司;胶回收试剂盒,质粒试剂盒,DH5α感受态细胞;IPTG、X-Gal、Amp+等购至北京的天根公司;Nacl、PEG -6000、ABA均为国产分析纯试剂。
1.2 慈竹WRKY转录因子的克隆
采集西南科技大学资源圃中的慈竹笋(露出地面100 cm)用于转录组高通量测序。以获得的慈竹转录组数据为基础,从100 cm高的慈竹笋克隆了2个WRKY基因:WRKY1的引物为5′ATGGCGGCTTCGTTAGGACTAA 3′(上游引物)和5′TCAGAAGAGCAGTGAGCCTGCA 3′(下游引物);WRKY2的引物为5′ATGGAGGAAGTGGAGGAGGCCA 3′(上游引物)和5′CTAAGCTTGCGCAGACTGAGTT 3′(下游引物)。采用 LA-Taq酶(TaKaRa)进行目的基因扩增。将PCR回收产物连接到pGM-T载体,测序分析。
1.3 氨基酸多序列比对和系统发育树的构建
通过NCBI里的BLAST进行在线分析与之相近物种的同源率。利用ClustalW2将两者编码的氨基酸序列与GenBank数据库中获得的毛竹、小麦的全长WRKY编码的氨基酸序列进行比对分析。利用Mega5.2的Pairwise alignment和Multiple alignment程序对克隆获得的慈竹BeWRKY1和BeWRKY2以及在GeneBank里搜索得到的毛竹、小麦、水稻、拟南芥、大麦(Hordeumvulgare)的151条WRKY进行分析,再采用Construct/Test Neibhbor-Joining Tree生成系统发育进化树。
1.4 WRKY基因编码蛋白的三级结构预测
利用ExPaSy(www.expasy.ch/tools/)工具中的 CPH models程序在线对慈竹、毛竹、小麦和水稻进行同源模建,再利用RasMol预测软件对预测的WRKY基因编码蛋白的三维结构进行分析。
1.5 慈竹WRKY基因的表达模式和胁迫诱导表达分析
用Real-timePCR方法进行组织表达模式和胁迫诱导表达分析。分别采集慈竹的竹笋(100 cm),当年生且完全抽枝的慈竹茎秆、完全展开叶和未完全展开叶进行组织表达模式分析,每一个分析取三次生物学重复。取培养30 d且生长状态良好的慈竹实生幼苗(蛭石+1/10倍Hogland营养液培养),参考拟南芥[25]、玉米[26]、毛竹[8,27]的胁迫处理方法,分别以NaCl(0、50、100、150、200、250 mmol·L-1)、PEG-6000(0、5、10、15、20、25%)、ABA(0、5、10、50、100、200 μmol·L-1)进行预实验,每个处理重复3次(每个重复取3个独立植株)。由预试验结果分析,本试验分别以NaCl(0、200 mmol·L-1)、PEG6000(0、20%) 、ABA(0、200 μmol·L-1)进行胁迫处理,每个处理重复3次(每个重复取3个独立植株),分别在0 h(未处理的对照)、6 h、12 h、24 h、48 h及7 d(天)取样,保存于-80 ℃冰箱备用。采用Plant RNA Kit试剂盒提取RNA,用PrimeScript®RT reagent Kit perfect real Time反转录试剂盒合成cDNA。分别以WRKY1F/R(5′GGCAAGAAGGCTGTCAAG3′;5′ACCCCGTCGTAGGTAGTG3′)和WRKY2F/R(5′TTTCCAGTCCTTCTTGTCG3′;5′CACTTTCCATTCCCATCC3′)为引物,以慈竹Tublin基因[19]为内参(Tublin-F 5′GCCGTGAACTCATCCCCTT3′;Tublin-R 5′TTGTTCTTGGCATCCCACAT3′),在Bio-Rad公司的iQ5 Multicolor上进行Real- time PCR分析,用2-ΔΔCT计算法计算其表达量[28]。
2 结果分析
2.1 慈竹WRKY转录因子的克隆和氨基酸多序列比对
根据设计的引物,以100 cm高的慈竹笋cDNA为模板,进行PCR扩增,获得了两个WRKY转录因子。测序分析结果表明,BeWRKY1(GenBank:KJ462124)长570 bp,编码189个氨基酸残基;BeWRKY2(GenBank:KJ462125)长888bp,编码295个氨基酸残基。将克隆到的慈竹BeWRKY1和BeWRKY2,与毛竹的PheWRKY1(GenBank:GU944762.1)、小麦的TaWRKY16(GenBank:EU665428.1)的氨基酸序列比对。结果表明,这四个WRKY转录因子均含有一个WRKY保守域结构(图1,黑色框区域)。BLAST结果表明,慈竹BeWRKY1 和毛竹的PheWRKY1 基因的相似性最高,为92%,都属于酸性蛋白;慈竹BeWRKY2 基因与小麦的TaWRKY16也有较高的相似性,为89%,均属于碱性蛋白。

图1 四个WRKY转录因子编码的氨基酸多序列比对Fig.1 Amino acid sequence alignmen of four WRKY transcription factors
2.2 WRKY转录因子系统发育树的构建
利用Mega5.2构建进化树,对慈竹、毛竹、小麦、水稻、拟南芥以及大麦共计151条WRKY转录因子进行分析。所有的转录因子聚成三大类,分别为Ⅰ类,Ⅱ类和Ⅲ类。Ⅱ类又聚成Ⅱa,Ⅱb,Ⅱc,Ⅱd及Ⅱe5个亚类。图2A可知,BeWRKY1与PheWRKY1、AtWRKY50 和OsWRKY67 聚成一小枝,它们属于Ⅱc亚类;BeWRKY2与TaWRKY16、AtWRKY39和AtWRKY74聚为一枝,属于Ⅱd亚类。
用MEME软件分析这些WRKY氨基酸序列的保守基序(图2-B)。其中,BeWRKY2和BeWRKY2、PheWRKY1和TaWRKY16均有3个motif。其中motif 1的宽度为35,其正则表达式为[ER]GC[GP][AV][KR]K[HR]VER[CD][VGR]DDP[SCR][MY][LV]I[TV]TY[DE]G[EV]H[NK]H[AT][RT][MP][GP][FT][GQ];motif 2的宽度为41,其正则表达式为[KR][IV][GP][AF][IR][ST][NR][KS][EI][AV][DE]I[LP][DP]D[EG][FY][KS]WRKYG[KQ]K[AP][IV]K[GN]SP[HN]PR[GN]YY[KR]CS[ST];motif 3宽度为27,正则表达式为[AE][LMT][DS]D[HP][VHR][NP][AFS][EQ][QY][AS]P[AR][PR][RV][CF][AST]G[AR]G[DE]D[GH]N[GDE][KN][CDT]。从motif模式图中看出,BeWRKY1和PheWRKY12、BeWRKY2和TaWRKY2结构相似,与进化树分析结果一致,进步一论证了它们同属于WRKYⅡ类家族。

图2 慈竹BeWRKY1和BeWRKY2基因与其他物种WRKY基因编码氨基酸的聚类(A)和氨基酸序列保守基序分析(B)Fig.2 A:Cluster of the deduced amino acid sequences of BeWRKY1 and BeWRKY2; B:The analysis of their conserved motifs Be:Bambusa emeiensis Os:Oryza sativa At:Arabidopsis thaliana Ta:Triticum aestivum Hv:Hordeum vulgare L. Phe:Phyllostachys heterocycla cv. Pubescens
2.3 慈竹、毛竹、小麦WRKY转录因子编码的蛋白三级结构预测
蛋白质三级结构是在二级结构上折叠,盘绕而成。CPH models在线预测慈竹、毛竹和小麦的WRKY转录因子编码蛋白的三级结构。如图3所示,三个不同物种均含有丰富的β-折叠?β-转角,无其它的结构。慈竹BeWRKY2与小麦TaWRKY16编码的蛋白质的β-折叠、β-转角数量相同,两者结构相似。慈竹BeWRKY1与PheWRKY1编码的蛋白质有相同数量的β-转角,但慈竹的β-折叠比毛竹多3个,两者结构存在一定的差别。
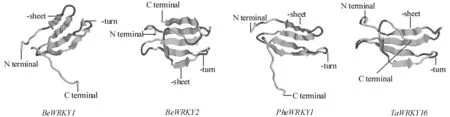
图3 慈竹、毛竹和小麦WRKY转录因子编码蛋白质的三级结构Fig.3 Model of the tertiary structure of protein coded by WRKY transcription factors from Bambusa emeiensis,Phyllostachys heterocycla cv.Pubescens and Triticum aestivum
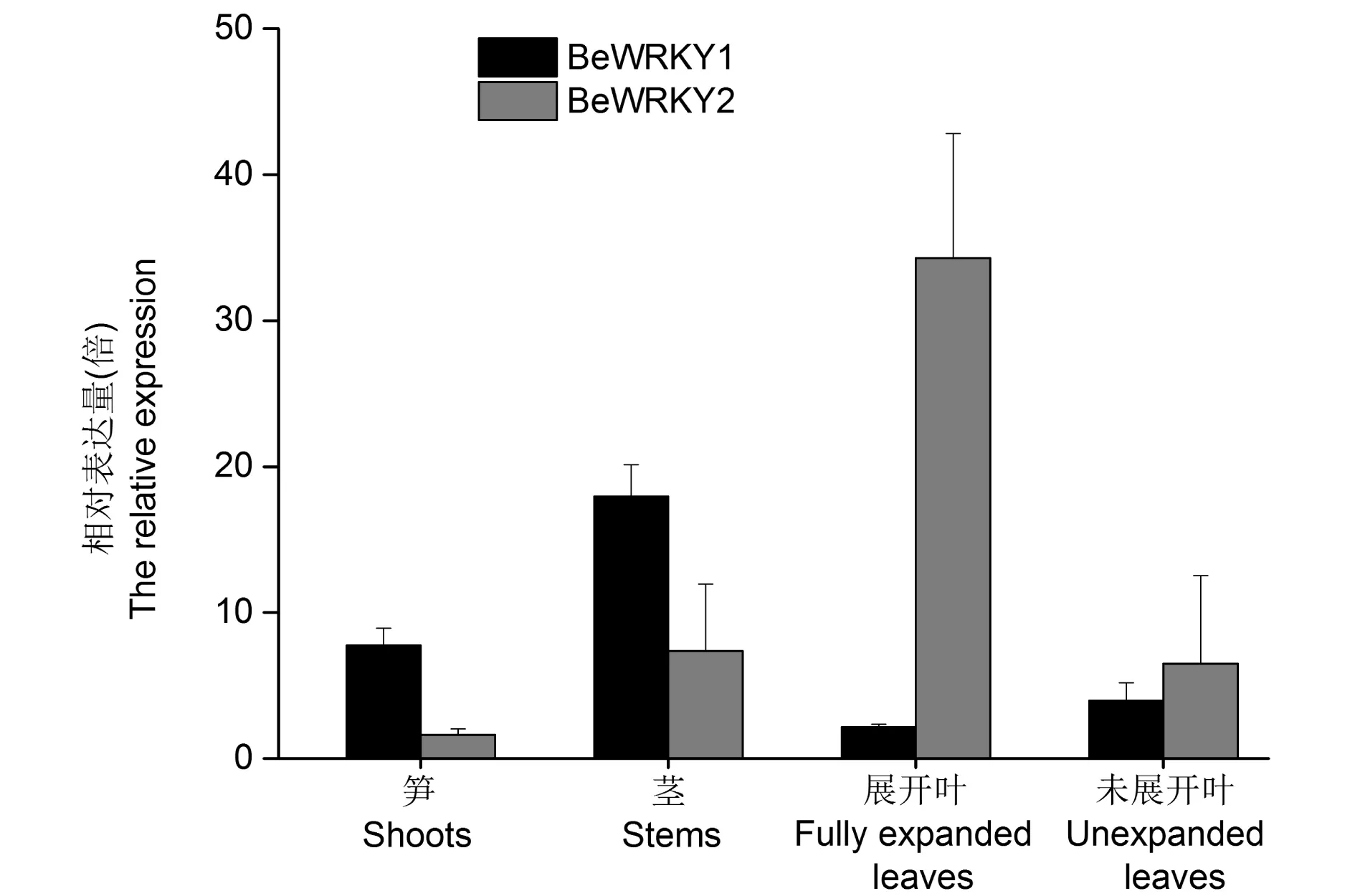
图4 实时定量PCR分析BeWRKY1,BeWRKY2在不同组织的表达Fig.4 Quantitative real-time PCR analysis of the expression patterns of BeWRKY1 and BeWRKY2 in different tissues
2.4 慈竹BeWRKY1、BeWRKY2基因组织表达分析
分析BeWRKY1和BeWRKY2基因在慈竹中组织特异性表达。结果表明,这两个转录因子具有一定的组织表达特异性(图4)。BeWRKY1相对表达量依次为茎>笋>未展开叶>完全展开叶,各个部位的相对表达量的差异较大,在茎中表达量最高。而BeWRKY2的相对表达量为完全展开叶>茎>未展开叶>笋,展开叶的相对表达量高于其他各部位的相对表达量。
2.5 胁迫处理对叶片中BeWRKY1和BeWRKY2表达影响
用实时定量PCR分析了在不同胁迫处理下慈竹幼苗叶片中BeWRKY1和BeWRKY2的表达情况,并进行显著性分析(Tublin基因为内参)。如图5A所示,在NaCl(200 mmol·L-1)和PEG- 6000(20%)胁迫6 h,BeWRKY1表达水平在6 h时显著性上调,分别是未处理的3.3倍、1.5倍,但随着胁迫时间的延长,它的表达量缓慢下降,说明此基因可能短时间内迅速参与逆境响应。在NaCl胁迫处理48 h和7 d时,BeWRKY2的表达水平并没有明显变化,可见盐胁迫对BeWRKY2转录积累的影响较小;而在PEG和ABA胁迫处理的慈竹幼苗叶片中,BeWRKY2的表达在6 h后显著下调:胁迫至12 h时,BeWRKY2的表达水平降至最低,随后逐渐回升,7 d时与对照基本持平(图5B),说明BeWRKY2对干旱和ABA胁迫更为敏感。
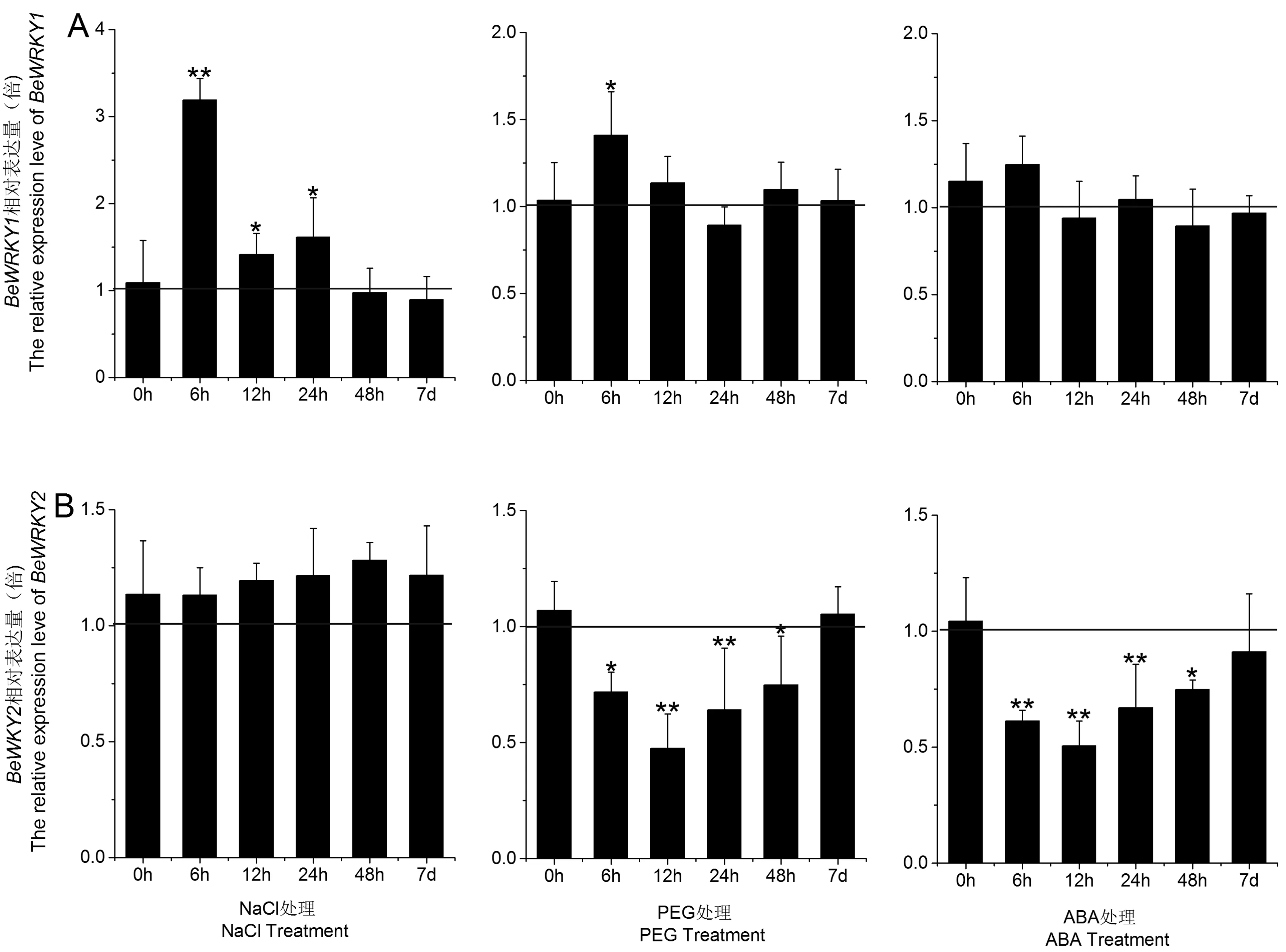
图5 胁迫处理下BeWRKY1和BeWRKY2的表达量变化Fig.5 Differential expression of BeWRKY1 and BeWRKY2 under stress treatments
3 讨论与结论
WRKY转录因子广泛存在于植物中,是近年来发现的植物体内特有的一类转录因子,其与植物的非生物及生物胁迫应答[12-13]、抗病[8]、生长发育[29]、以及衰老息息相关[15]。近年来WRKY 转录因子在植物抗病反应中的研究已经成为植物分子生物学领域的前沿课题。
本研究以慈竹转录组数据为基础,克隆了两条慈竹WRKY转录因子序列BeWRKY1和BeWRKY2。其中BeWRKY1与已经报道的毛竹PheWRKY1转录因子同源率高达92%,都属于酸性蛋白;BeWRKY2与小麦TaWRKY16转录因子同源最高为89%,均属于碱性蛋白。系统进化树分析表明,BeWRKY1与PheWRKY1、AtWRKY50 和OsWRKY67 聚成一小枝,属于Ⅱc亚家族类。这一家族中的某些成员,如与PheWRKY1等,在抗病方面以及抗非生物胁迫具有一定的功能[8]。而BeWRKY2与AtWRKY39、AtWRKY74和TaWRKY2聚为一枝,属于Ⅱd亚家族类。研究表明AtWRKY39突变体种子在高温处理下萌发率降低,存活率也大大降低。反之,过表达植株对热高温胁迫耐受力增强。在高温胁迫下拟南芥AtWRKY39突变体植物中水杨酸调控的PR1和水杨酸相关的MBF1c基因均表现为下调,在过表达植株中两基因的表达增强,表明AtWRKY39正调控水杨酸和茉莉酮酸通路相互作用应答高温胁迫[30]。推断这一亚家族中的成员可能与抗高温干旱有关。
慈竹两个WRKY转录因子均有WRKY superfamily的保守结构域,但编码的蛋白理化参数差异较大。实时定量PCR结果表明,BeWRKY1和BeWRKY2分别在茎和展开叶的表达量较高,表明这两个转录因子在抗逆方面可能具有不同的功能。逆境诱导表达的结果也证实了这一推论。在200 mmol·L-1NaCl和20% PEG 6 000处理下,BeWRKY1在胁迫处理6 h时表达量均明显升高,说明此基因可能短时间内迅速参与逆境响应;胁迫后期其表达量又缓慢下降至与0 h基本持平,可能是植物体避免过度应答造成伤害的一种自我保护特性[2]。研究报道多个WRKY转录因子参与植物抗旱和抗盐胁迫[31]。如与BeWRKY1同属于Ⅱc家族的TaWRKY10(GenBank:HQ700327)基因在小麦受高盐、干旱胁迫下均表现为先急剧上调后缓慢下降与0h持平。在过表达TaWRKY10的烟草植株中,TaWRKY10通过降低ROS积累和激活胁迫防御相关基因的表达来提高抗旱和抗盐的能力[32]。另外Babitha等证明Ⅱc 家族的AtWRKY28过表达的拟南芥植物在高盐、干旱和氧化处理下抗胁迫能力明显增强[33]。在干旱和ABA胁迫下,BeWRKY2表达明显降低,表明BeWRKY2对干旱和ABA胁迫伤害更为敏感,而可能不参与高盐类胁迫保护反应。据研究报道属于Ⅱd家族的水稻OsWRKY11基因增强了水稻耐高温和干旱的能力[12],因此BeWRKY2可能与抗干旱等有关。BeWRKY1和BeWRKY2的抗非生物胁迫功能仍需进一步验证。
慈竹WRKY转录因子的研究处于初级阶段,其功能还需要进一步深入研究。BeWRKY1和BeWRKY2转录因子的克隆、信息学分析、表达模式的分析和功能初步探究可为以慈竹品种改良提供理论依据。现阶段本研究室已经成功构建了BeWRKY1和BeWRKY2的过表达载体和RNAi表达载体,并转化烟草和杨树,为深入研究其功能奠定了基础。
[1] Eulgem T,Somssich IE.Networks of WRKY transcription factors in defense signaling[J].Current Opinion in Plant Biology,2007,(10):366-371.
[2] 金慧,栾雨时.番茄WRKY基因的克隆与分析[J].西北农业报,2011,20(4):96-101.
[3] Park CJ,Shin YC,Lee BJ,et al.A hot pepper gene encoding WRKY transcription factor is induced during hypersensitive response to Tobacco mosaic virus and Xanthom-onas campestris[J]. Planta,2006,223(2):168-179.
[4] 刘戈宇,胡鸢雷,祝建波.植物WRKY蛋白家族的结构及其功能[J].生命的化学,2006,26(3):231-233.
[5] Johnson CS,Kolevski B,Smyth DR. a trichome and seed coat development gene of Arabidopsis,encodes a WRKY transcription factor[J].Plant Cell,2002,14(6):1359-1375.
[6] Qiu YP,Jing SJ,Fu J,et al.Cloning and analysis of expression profile of 13 WRKY genes in rice[J]. Chinese Science Bulletin,2004,49(20):1860-1869.
[7] 刘磊.小麦WRKY基因的克隆、表达分析及其遗传转化[D].华中科技大学,2011.1.
[8] 崔晓伟.PheWRKY1基因的克隆与功能分析[D].中国林业科学研究院,2011,7.
[9] Tripathi P,Rabara RC,Rushton PJ. A systems biology perspective on the role of WRKY transcription factors in drought responses in plants[J].Planta,2014,239(2):255-266.
[10] Rushton DL,Tripathi P,Rabara RC,et al.WRKY transcription factors:key components in abscisic acid signalling[J].Plant Biotechnol J,2012,10(1):2-11.
[11] Thao NP,Tran L-SP.Potentials toward genetic engineering of drought-tolerant soybean[J].Crit Rev Biotechnol,2012,32(4):349-362.
[12] Wu X,Shiroto Y,Kishitani S,et al.Enhanced heat and drought tolerance in transgenic rice seedlings overexpressingOsWRKY11 under the control ofHSP101 promoter[J].Plant Cell Rep,2009,28(1):21-30.
[13] Qiu Y,Yu D.Over-expression of the stress-inducedOsWRKY45 enhances disease resistance and drought tolerance inArabidopsis[J]. Environ Exp Bot,2009,65(1):35-47.
[14] Liu QL,Zhong M,Li S,et al. Overexpression of achrysanthemum transcription factor gene,DgWRKY3,in tobacco enhances tolerance to salt stress[J]. Plant Physiology and Biochemistry,2013(69):27-33.
[15] Zhou QY,Tian AG,Zou HF,et al. Soybean WRKY-type transcription factor genes,GmWRKY13,GmWRKY21,andGmWRKY54,confer differential tolerance to abiotic stresses in transgenicArabidopsisplants[J].Plant Biotechnol J,2008,6(5):486-503.
[16] Scarpeci TE,Zanor MI,Mueller-Roeber B,et al.Overexpression ofAtWRKY30 enhances abiotic stress tolerance during early growth stages inArabidopsisthaliana[J]. Plant Mol Biol,2013,83(3):265-277.
[17] Lagace M,Matton DP. Characterization of a WRKY transcription factor expressed in late torpedo-stage embryos ofSolanumchacoense[J]. Planta,2004,219(1):185-189.
[18] Robatzek S,Somssich IE. A new member of the Arabidopsis WRKY transcription factor family,AtWRKY6,is associated with both senescence- and defence-related processes[J]. Plant J,2001,28(2):123-133.
[19] 吴晓宇,胡尚连,曹颖,等.慈竹CCoAOMT基因的克隆及生物信息学分析[J].南京林业大学学报:自然科学版,2012,36(3):17-22.
[20] 段春香,董文渊,刘时才,等.慈竹无性系种群生长与立地条件关系[J].林业科技开发,2008,22(3):42-44.
[21] 陈其兵,蒋瑶,卢学琴,等.四川不同地区慈竹的遗传多样性研究[J].西北农林科技大学学报,2009,37(6):187-193.
[22] 刘怀,赵志模,邓永学,等.竹裂爪螨毛竹种群与慈竹种群对不同寄主植物的适应及其生殖隔离[J]. 应用生态学报,2004,15(2):299-302.
[23] Liu M,Qiao G,Jiang J,et al.Transcriptome Sequencing and De Novo Analysis for Ma Bamboo (DendrocalamuslatiflorusMunro)Using the Illumina Platform [J]. PloS One,2012,7(10):e46766.
[24] Peng Z,Zhang C,Zhang Y,et al. Transcriptome Sequencing and Analysis of the Fast Growing Shoots of Moso Bamboo (Phyllostachysedulis)[J]. PloS one,2013,8(11):e78944.
[25] Shan H,Chen SM,Jiang JF,et al. Heterologous Expression of the ChrysanthemumR2R3-MYBTranscription FactorCmMYB2 Enhances Drought and Salinity Tolerance,Increases Hypersensitivity to ABA and Delays Flowering inArabidopsisthaliana[J]. Molecular Biotechnology,2012,Volume 51(2),160-173.
[26] Luan M,Xu M,Lu Y,et al. Family-wide survey of miR169s and NF-YAs and their expression profiles response to abiotic stress in maize roots [J]. PLoS One,2014,9(3):e91369.
[27] Liu L,Cao XL,Bai R,et al. Isolation and Characterization of the Cold-Induced Phyllostachys edulis AP2/ERF Family Transcription Factor,peDREB1 [J]. Plant Mol Biol Rep,2012,30:679-689.
[28] Livak KJ,Schmittqen TD. Analysis of relative gene expression data using real time quantitative PCR and the 2-△△Ctmethod [J]. Methods,2001,25(4):402-408.
[29] Mochida K,Yoshida T,Sakurai T,et al.In silico analysis of transcription factor repertoire and prediction of stress responsive transcription factors in soybean[J]. DNA Res,2009,16(6):353-369.
[30] Li SJ,Zhou X,Chen LG,et al. Functional characterization ofAradopsisbidopsisthalianaWRKY39 in heat stress[J].Mol.Cells,2010(29):475-483.
[31] Golldack D,Luking I,Yang O. Plant tolerance to drought and salinity:stress regulating transcription factors and their functional significance in the cellular transcriptional network[J].Plant Cell Rep, 2011,30:1383-1391.
[32] 王晨.小麦基因组中WRKY转录因子家族基因鉴定、克隆和TaWRKY10基因的功能分析[D].华中科技大学,2013,5.
[33] Babitha K,Ramu S,Pruthvi V,et al.Co-expression ofAtbHLH17 andAtWRKY28 confers resistance to abiotic stress inArabidopsis[J]. Transgenic Res,2013,22(2):327-341.
Cloning of WRKY Transcription Factors inBambusaemeiensisand Stress-induced Expressions
LIU Hong-mei1,2,HU Shang-lian1,2*,CAO Ying1,2,LU Xue-qin1,2, XU Gang1,2,LONG Zhi-jian1,2,REN Peng1,2
(1.College of Life Science and Engineering,Southwest University of Science and Technology,Mianyang 621010,Sichuan,China;2.Engineering Research Center for Biomass Resource Utilization and Modification of Sichuan Province, Mianyang 621010,Sichuan,China)
In order to explore the biological function of WRKY inBambusaemeiensisthen modify bamboo plants through genetic engineering. Two WRKY genes were cloned based on RNA transcriptome data ofBambusaemeiensis,which were named asBeWRKY1 (GenBank:KJ462124) andBeWRKY2(GenBank:KJ462125),and encoded 189 and 295 amino acids,respectively. Blastp analysis indicated that both of them contained a WRKY conserved domain. BeWRKY1 belonged to Ⅱc subfamily,whereas BeWRKY2,aligned withTaWRKY16 andAtWRKY39,belonged to Ⅱd subfamily. Real-time PCR analysis showed thatBeWRKY1 exhibited higher expression in stems,while the expression level ofBeWRKY2 was higher in the full expanded leaves. 200 mmol·L-1NaCl and 20% PEG 6000 stresses triggeredBeWRKY1 expression,but decreased the transcript accumulation ofBeWRKY2.The results showed thatBeWRKY1 may response to stress in short time.BeWRKY2 was more sensitive to drought and ABA stresses,but did not participate in the protection of high salt stress response.
Bambusaemeiensis;WRKY;Cloning;Bioinformatics analysis;Stress-induced expression
2016-01-25
国家自然科学基金青年基金项目(31400257,31400333);四川省“十三五”重点攻关资助项目(2016NYZ0038)
刘红梅(1988-),女,汉,硕士研究生,从事植物遗传与品种改良研究。通信作者:胡尚连(1966-),女,汉,教授,博士,从事植物生理与生物技术研究。E-mail:hushanglian@126.com
