胃癌细胞miR-100表达及对靶基因ZBTB7A的调控作用
2016-08-07张小平邬万新
方 莹 张小平 邬万新
胃癌细胞miR-100表达及对靶基因ZBTB7A的调控作用
方 莹 张小平 邬万新
目的探讨胃癌细胞miR-100表达及其对ZBTB7A基因的调控作用。方法使用人胃癌细胞株SGC-7901(低分化、转移)和BGC-823(低分化),将实验细胞分为SGC-7901miR-100组、SGC-7901miR-100抑制剂组、SGC-7901Si-阴性对照组、SGC-7901Si-ZBTB7A组、BGC-823 miR-100组、BGC-823 miR-100抑制剂组、BGC-823 Si-阴性对照组及BGC-823 Si-ZBTB7A组。定量PCR法检测各组miR-100及ZBTB7A mRNA的表达,免疫印迹法检测ZBTB7A蛋白表达水平,细胞迁移与体外侵袭实验测定体外细胞迁移和侵袭能力,通过质粒构建及双荧光素酶报告基因检测ZBTB7A 3′UTR载体相关的荧光素酶的活性情况。结果荧光素酶报告基因检测显示,在miR-100过度表达的SGC7901和BGC823细胞中,与荧光素酶活性相关的ZBTB7A 3′UTR载体显著减少,分别为(46.4±1.9)%和(55.7±2.3)%;miR-100被敲除时,ZBTB7A 3′UTR载体相关的荧光素酶的活性上调,分别为(32.7±1.9)%和(25.4±3.3)%。蛋白免疫印迹法显示,过表达的miR-100导致SGC7901和BGC823细胞中ZBTB7A表达的蛋白水平分别降低(81.8±3.8)%和(62.9± 1.3)%;当miR-100被敲除时,ZBTB7A的蛋白水平分别上调(38.1±2.7)%和(46.5±3.4)%。结论ZBTB7A是miR-100的靶基因,miR-100表达可以下调ZBTB7A的表达,从而抑制胃癌细胞的转移和生长。
胃癌;miR-100;ZBTB7A
胃癌是一个重大的世界性的公共卫生问题,是癌症相关致死的第二大常见原因[1],当前对miRNA的研究给胃癌的治疗提供了新的策略和方向。miR-100是一种非编码、由20~25核苷酸组成的RNA,属于MicroRNAs(miRNAs)的一种,常在人类癌症中出现异常表达,ZBTB7A是一个肿瘤抑制基因,而在胃癌中,ZBTB7A基因是否是miR-100的靶点,以及对胃癌的转移和侵袭的联系仍然未知,本文以此为出发点,探究胃癌中miR-100的异常表达对ZBTB7A基因的作用。
1 实验材料
1.1 实验细胞系使用人胃癌细胞株SGC-7901(低分化、转移)和BGC-823(低分化)。购于美国典型培养物保藏中心(马纳萨斯,VA,美国)以及上海癌症研究所(上海,中国)。所有细胞系均在37℃,适宜湿度,和5%CO2的环境中培养,于RPMI 1640培养液中,添加10%的胎牛血清(FBS)。
1.2 试剂和药品Trizol试剂(Takara公司),一抗兔体ZBTB7A(1:1000,剑桥,英国),一抗小鼠抗β-Actin(1:1000)。预染标准分子量蛋白marker(Fermentas)。双荧光素酶载体pmirGLO,内切酶XbaI、SacI,T4 DNA连接酶,感受态细菌DHS a(Transgen),双荧光素酶检测试剂盒(Promega),Pre-miR-100,Negative Control,si-ZBTB7A,Anti-miR-100 inhibitor,X-treme GENE transfection reagent(Roche)。
2 实验方法
2.1 细胞分组及转染将SGC-7901细胞系和BGC-823细胞系分为8组,即SGC-7901miR-100组;SGC-7901miR-100抑制剂组;SGC-7901Si-阴性对照组(SCC-7901-空质粒转染组);SGC-7901Si-ZBTB7A组;BGC-823 miR-100组;BGC-823 miR-100抑制剂组;BGC-823 Si-阴性对照组(BGC-823-空质粒转染组);BGC-823 Si-ZBTB7A组。分别对每组细胞进行转染[2],转染步骤按Roche公司GENE transfection reagent试剂盒说明书进行。将BGC823和SGC7901细胞消化接种于12孔板,每孔接种1× 105个细胞,待其贴壁后转染,于2个EP管中,1个EP管加入47μL无血清培养基和3μL相对应的转染质粒,另一个EP管加入48μL无血清培养基和2μLX-treme GENE转染试剂,将两个EP管混合并孵育15min,将转染试剂添加到12孔板内,培养箱孵育72h之内通过荧光显微镜观察并验证其转染效率,每组转染效率大于70%的样本即可满足后续实验要求。
2.2 定量PCR按Trizol试剂盒的说明进行定量聚合酶链反应(PCR)[3],对处于对数生长期的四组细胞提取细胞总RNA,通过紫外分光光度计对RNA浓度及纯度进行测定。每组取5μL总RNA,通过反转录试剂盒将总RNA反转录成cDNA,以此为模板进行PCR扩增,之后予2%琼脂糖凝胶电泳,Band Scan 6.0图像分析软件对各电泳条带灰度值进行分析,目的条带的灰度值与内参灰度值的比值为miRNA和ZBTB7A mRNA的相对表达量。每个样品分析3次。
2.3 免疫印迹法在细胞中加入RIPA裂解液提取总蛋白,通过12%SDS变性聚丙烯酰胺凝胶(SDSPAGE)电泳分离获得的蛋白质,转移至PVDF膜,封闭后将膜加入目标蛋白的抗体ZBTB7A(1:1000,剑桥,英国)或β-actin(1:1000)进行孵育2h,经洗膜封闭再将膜置于含HRP标记的二抗,ECL反应显色、曝光。进行3次独立的蛋白免疫印迹分析实验。
2.4 细胞迁移与体外侵袭实验使用8μm孔径(24-well insert、Corning、纽约、美国)的Transwell,对体外细胞迁移和侵袭能力的测定[4]。通过48h的转染后再对细胞进行消化,在每个8μm孔径的小室中铺入80μL的1:8基质胶,在每个小室中接种1×105个转染后的细胞,添加100μL不含血清的RPMI1640培养基,在Transwell的下室中加入含有血清的完全RPMI1640培养基,于培养箱中孵育24h,棉签拭去上室细胞,用4%多聚甲醛进行15min的固定后用结晶紫常规染色10min,最后显微镜下随机选取5个视野拍照并计数。在迁移实验中不需要在小室中铺基质胶,于培养箱中孵育16h。
2.5 荧光素酶报告基因检测质粒构建参照文献[2]。将推定的miR-100的基因启动子区域包含的结合位点通过PCR扩增放大并亚克隆到pGL3-Basic载体上游区(Promega)。从SGC7901细胞和BGC823细胞中提取Total RNA,并扩增出ZBTB基因的3'UTR区,3'-UTR片段与pmirGLO载体连接。分别将PremiR-100及NC与构建好的荧光载体共转染至胃癌细胞内,于12孔板中37℃下孵育48h,用细胞裂解液将细胞裂解,取50μL裂解液转移至96孔板内,每孔加50μL萤火虫、海肾荧光素酶底物,于高灵敏度化学发光检测仪上检测并读取平均值。进行3次独立的荧光素酶报告基因实验。
2.6 统计学方法应用SPSS18.0统计软件进行分析,计量资料以均数±标准差(x±s) 表示,并进行正态性及方差齐性检验,多组均数比较采用ANOVA分析,两两比较采用Dunnett-t检验,Spearman相关分析检测miR-100和ZBTB7A表达水平之间的关系。P<0.05认为差异有统计学意义。
3 实验结果
3.1 胃癌细胞ZBTB7A是miR-100的直接功能靶基因荧光素酶报告基因检测显示在miR-100中过度表达的SGC7901和BGC823细胞中,与荧光素酶活性相关的ZBTB7A pmirglo3′UTR载体显著减少,与阴性对照组比较,分别下调(46.4±1.9)%和(55.7± 2.3)%(P均<0.01)。当miR-100被敲除时,ZBTB7A pmirglo-3′UTR载体相关的荧光素酶的活性分别上调(32.7±1.9)%和(25.4±3.3)%(P均<0.05)。见图1(封二)。
3.2 miR-100表达水平与胃癌细胞ZBTB7A蛋白表达呈负相关免疫印迹法实验表明,过表达的miR-100导致SGC7901和BGC823细胞中的ZBTB7A表达的蛋白水平分别降低(81.8±3.8)%(P<0.01)和(62.9± 1.3)%(P<0.05)。当miR-100被敲除时,ZBTB7A的蛋白水平出现分别上调(38.1±2.7)%(P<0.05)和(46.5± 3.4)%(P<0.05),见图2(封二)。spearman相关性分析:miR-100表达水平与胃癌中ZBTB7A蛋白表达呈负相关,见图3(封二)。
3.3 ZBTB7A下调抑制胃癌细胞的迁移和侵袭与空质粒转染的Si-阴性对照组比较,通过si-ZBTB7A敲除SGC7901和BGC823细胞中的ZBTB7A后,RT-qPCR检测SGC7901和BGC823细胞中的ZBTB7AmRNA和蛋白表达显著减少,分别下调(84.6±2.9)%(P<0.01)和(70.4±1.2)%(P<0.05),免疫印迹法检测SGC7901和BGC823细胞中ZBTB7Am-RNA和蛋白表达分别下调(56.9±2.9)%和(73.2± 1.2)%(均P<0.01),见图4(封二)。通过Transwells对体外胃癌细胞迁移和侵袭能力的测定,ZBTB7A敲除的胃癌细胞的迁移和侵袭能力被抑制,SGC7901胃癌细胞转移细胞数下降(59.4±1.3)%(P<0.01),侵袭细胞数下降(48.4±2.7)%(P<0.05),BGC823胃癌细胞转移细胞数下降(36.4±2.4)%(P<0.05),侵袭细胞数下降(41.9±3.0)%(P<0.05),见图5~6(封二)。显示提示在胃癌的发病机制中,ZBTB7A可能扮演了重要角色,将有可能作为判断胃癌患者预后的生物标志物。见表1~2。
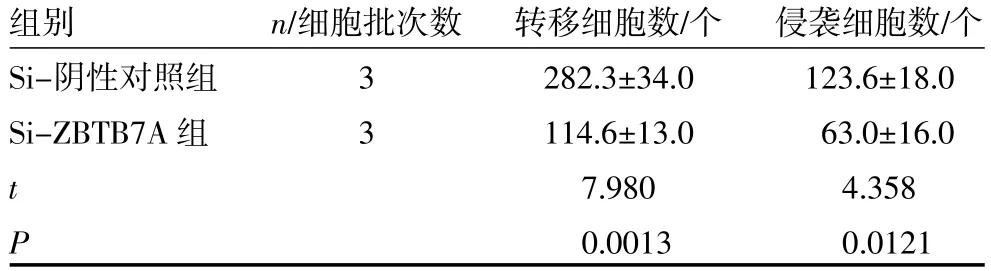
表1 SGC7901 transwell迁移、侵袭能力(x±s)

表2 BGC823 transwell迁移、侵袭能力(x±s)
4 讨论
目前已知miR-100是儿童肾上腺皮质肿瘤和卵巢透明细胞癌的mTOR基因的靶点[5-6]。在急性髓系白血病,miR-100通过下调RBSP3促进癌细胞增殖[7]。miR-100在胃癌组织和细胞系中也出现显著下调,miR-100的下调促进了胃癌细胞在体外和体内的侵袭和转移[8]。
ZBTB7A是POK(POZ/BTB and Kruppel)转录因子家族的一个成员,可直接结合到启动子区域并对糖酵解关键基因的转录抑制。以往研究表明,ZBTB7A在多种肿瘤的原癌基因失调中扮演了重要的角色[9]。在一些文献中ZBTB7A曾被描述为前列腺癌[10]和结肠癌[11]的一个肿瘤抑制基因,在这些肿瘤中,ZBTB7A的缺乏使其表现出更强的侵袭性,但是肿瘤相关基因受到不同的机制调控,因此在不同的人类肿瘤中表现出不一致的功能。Mann等[12]报道ZBTB7A通过抑制ARF促进细胞转化,ZBTB7A也促进细胞增殖和转基因小鼠淋巴瘤的形成。Fang等[13]发现ZBTB7A通过p53、p21和p27的表达来促进细胞增殖。
许多科研工作者通过研究发现MicroRNAs对胃癌的发生及转归存在重要的作用,陈宗科等[14]发现miR-24在胃癌细胞株SGC-7901和BGC-803及胃癌组织中的表达呈现上调,可能参与了胃癌发生;林巧爱等[15]发现miR-143在胃癌组织较癌旁正常胃黏膜组织中的表达呈现下调,在胃癌分化度的区分上有更好的敏感性及特异性。然而在人类胃癌中miR-100的功能及其临床病理意义尚未描述清楚,前面有论述miR-100在胃癌组织和细胞系中也出现显著下调[9],然而关于miR-100下调后ZBTB7A表达以及miR-100与ZBTB7A的关系目前尚无相关文献进行研究以及解释,因此本研究基于ZBTB7A基因是否是miR-100的靶点,以及对胃癌的转移和侵袭的联系仍然未知为出发点,探究胃癌中miR-100的异常表达对ZBTB7A基因的作用,为临床治疗提供可靠的分子机制。
本研究通过双荧光素酶报告基因与免疫印迹法发现miR-100过度表达的SGC7901和BGC823细胞中,与荧光素酶活性相关的ZBTB7A 3′UTR载体显著减少,ZBTB7A表达的蛋白水平降低。同时观察到人胃癌中ZBTB7A的表达与miR-100之间呈负相关。这证实ZBTB7A是miR-100在胃癌中的靶基因。发现通过SiRNA敲除ZBTB7A显著减少了体外培养的胃癌细胞的迁移和侵袭能力,提示在胃癌的发病机制中,ZBTB7A可能扮演了重要角色,将有可能作为判断胃癌患者预后的生物标志物。
[1]Parkin DM,Bray F,Ferlay J,et al.Global cancer statistics[J].2002 CA Cancer J Clin,2005,55(2):74-108.
[2]Gao P,Xing AY,Zhou CY,et al.The molecular mechanism of microRNA-145 to suppress invasion-metastasis cascade in gastric cancer[J].J Oncogene,2013,32(4):491-501.
[3]Nakada C,Matsuura K,Tsukamoto Y,et al.Genome-widemicroRNA expression pro?ling in renal cell carcinoma:signi? cant down-regulation of miR-141 and miR-200c[J].J Pathol,2008,216(4):418-427.
[4]Gao P,Wong CC,Tung EK,et al.Deregulation of microRNA expression occurs early and accumulates in early stages of HBV-associated multistep hepatocarcinogenesis[J].J Hepatol,2011,54(6):1177-1184.
[5]Doghman M,El WA,Cardinaud B,et al.Regulation of insulin-like growth factor-mammalian target of rapamycin signaling by microRNA in childhood adrenocortical tumors[J].Cancer Res,2010,70(11):4666-4675.
[6]Nagaraja AK,Creighton CJ,Yu Z,et al.A link between mir-100 and FRAP1/mTOR in clear cell ovarian cancer[J].Mol Endocrinol,2010,24(2):447-463.
[7]Zheng YS,Zhang H,Zhang XJ,et al.MiR-100 regulates cell differentiation and survival by targeting RBSP3.a phosphatase-like tumor suppressor in acute myeloid leukemia[J].Oncogene,2012,31(1):80-92.
[8]王雨濛,王启之.miR-100与胃癌关系的研究进展[J].国际消化病杂志,2015,35(3):153-155.
[9]Zu X,Ma J,Liu H,et al.Pro-oncogene Pokemon promotes breast cancer progression by upregulating survivin expression[J].Breast Cancer Res,2011,13(2):R26.
[10]Wang G,Lunardi A,Zhang J,et al.Zbtb7a suppresses prostate cancer through repression of a Sox9-dependent pathway for cellular senescence bypass and tumor invasion[J].Nat Genet,2013,45(7):739-746.
[11]Liu XS,Haines JE,Mehanna EK,et al.ZBTB7A acts as a tumor suppressor through the transcriptional repression of glycolysis[J].Genes Dev,2014,28(17):1917-1928.
[12]Mann KM,Ward JM,Yew CC,et al.Sleeping beauty mutagenesis reveals cooperating mutations and pathways in pancreatic adenocarcinoma[J].Proc Natl Acad Sci USA,2012,109(16):5934-5941.
[13]Fang F,Yang L,Tao Y,et al.FBI-1 promotes cell proliferation and enhances resistance to chemotherapy of hepatocellular carcinoma in vitro and in vivo[J].Cancer,2012,118(1):134-146.
[14]陈宗科,秦蓉,储婧,等.miR-24和miR-22在胃癌中的表达及其临床意义[J].安徽医科大学学报,2013,48(2):167-170.
[15]林巧爱,李玲玲,巩文辞,等.miR-143在胃癌中的表达及其临床病理意义[J].中国病理生理杂志,2010,26(9):1674-1678.
(收稿:2016-04-23修回:2016-07-13)
Expression of m iR-100 and Its Effect on ZBTB7A Gene in Gastric Cancer
Fang Ying,Zhang Xiaoping,Wu Wanxin.Department of Pathology,First Hospital of Jiaxing,Jiaxing(314000),China
Objective To investigate on the effect of miR-100 expression on ZBTB7A gene in gastric cancer. Methods Gastric cancer cell lines SGC-7901(poorly differentiated and metastasized)and BGC-823(poorly differentiated)were used in this study.They were divided into 8 groups:SGC-7901miR-100 group,SGC-7901miR-100-inhibited group,SGC-7901 Si-negative control group,and SGC-7901 Si-ZBTB7A group,BGC-823miR-100 group, BGC-823miR-100-inhibited group,BGC-823miR-100 negative control group,and BGC-823 Si-ZBTB7A group. Real-time quantitative PCR was used to analyze the mRNA expression of miR-100 and ZBTB7A;Western blot was used to detect the level of ZBTB7A protein;cell migration and invasion assay was used to assess in vitro the migration and invasion ability of cells.The luciferase activity of ZBTB7A 3'UTR vector was measured by plasmid construction and dual-luciferase report assay.Results The relative luciferase activity of the ZBTB7A 3'UTR vector were significantly reduced in miR-100 overpressing SGC7901 and BGC823 cells by(46.4±1.9)%and(55.7±2.3)%, respectively;when miR-100 was knocked down,the upregulated luciferase activity of ZBTB7A 3'UTR vector was observed by(32.7±1.9)%and(25.4±3.3)%,respectively.Western blot results showed that overexpression of miR-100 reduced the protein level of ZBTB7A in SGC7901 and BGC823 cells by(81.8±3.8)%and(62.9±1.3)%,respectively; the protein level of ZBTB7A was upregulated by(38.1±2.7)%and(46.5±3.4)%when miR-100 was knocked down. Conclusion ZBTB7A is a direct target of miR-100 in gastric cancer.The expression of miR-100 can downregulate the expression of ZBTB7A,resulting in inhibiting the metastasis and growth of gastric cancer.
gastric cancer;miR-100;ZBTB7A
浙江省嘉兴市第一医院病理科(嘉兴314000)
方莹,Tel:13857329715;E-mail:64111309@qq.com
