ARTP诱变选育高产油脂酵母菌
2016-08-06刘冬邱婧云王霞钟海清万琳琳杨清香河南师范大学生命科学学院河南新乡453007河南省高校资源微生物与功能分子重点实验室河南师范大学河南新乡453007
刘冬,邱婧云,王霞,钟海清,万琳琳,杨清香,2,*(.河南师范大学生命科学学院,河南新乡453007;2.河南省高校资源微生物与功能分子重点实验室(河南师范大学),河南新乡453007)
ARTP诱变选育高产油脂酵母菌
刘冬1,邱婧云1,王霞1,钟海清1,万琳琳1,杨清香1,2,*
(1.河南师范大学生命科学学院,河南新乡453007;2.河南省高校资源微生物与功能分子重点实验室(河南师范大学),河南新乡453007)
从实验室保藏的15株酵母中筛选获得一株油脂产量相对较高的酵母菌KC 8,经96 h摇瓶发酵培养后,油脂产量为1.22 g/L。利用分子生物学鉴定,该菌株的26S rDNA序列与胶红酵母(Rhodotorula mucilaginosa)具有100%相似性;以KC 8为出发菌株,经ARTP诱变,最终从300株诱变存活菌株中筛选得到高产油脂突变菌株Y3,经96 h摇瓶发酵培养后,油脂产量为2.38g/L;对菌株Y3的培养条件进行优化,菌株在葡萄糖为碳源,硫酸铵为氮源,碳氮比为90∶1,培养基初始pH为6.5时,在28℃恒温条件下摇瓶发酵培养96 h后,油脂产量最高达到了3.96 g/L;GC-MS对油脂组分进行分析结果表明,该脂肪酸主要由棕榈油酸、油酸、亚油酸、硬脂酸、二十碳烯酸和二十四烷酸组成,与植物油成分相似。
酵母;油脂;ARTP诱变;脂肪酸组分
当今世界,随着经济发展,化石能源的大量消耗和环境污染的日益严重,人们迫切地寻求一种新的绿色能源来缓解这些危机,因此,生物柴油便应运而生。生物柴油具有低含硫量、易燃烧、可再生、储运安全等优点,可以作为化石燃料的替代品[1]。目前,生物柴油的生产主要以动植物油脂原料[2],生产成本高,原料供应不足等问题始终制约着生物柴油的规模化生产。因此,必须发展新型、低成本的油脂生产技术,来解决生物柴油生产中的难题。
在自然界中,一些微生物能够通过自身代谢将碳氢化合物、碳水化合物以及普通油脂等转化为油脂,贮存在菌体细胞内,我们通常将油脂的含量超过菌体自身生物总量20%的微生物称为产油微生物[3]。产油微生物种类繁多,在细菌、真菌以及藻类中都能发现,在某些真菌中,其菌体内的油脂含量甚至超过了生物量的70%。微生物油脂的脂肪酸组主要为C16、C18系脂肪酸(如硬脂酸、油酸和亚油酸),与植物油脂成分相似[4]。微生物自身生产油脂与传统的油脂生产相比,具有生产周期短、成本低、不受季节、场地的限制,以及容易实现大规模生产等优点。因此,对产油脂微生物的研究,并选育出高油脂产率微生物有着重大意义。
近年来,国内外的研究人员通过从自然界中筛选、优化培养基以及采用诱变等方式来获得高油脂产率的产油菌株[5-8],通过诱变育种的方式可以提高微生物的油脂产量。本研究从实验室保藏的酵母菌中筛选得到一株油脂产率较高的酵母菌株作为诱变出发菌株,通过采用新型的常压室温等离子体(ARTP)诱变技术对其进行诱变处理,以获得高油脂产率的突变株,并对获得的高产油脂突变株的培养条件进行优化,进一步提高其油脂产量。
1 材料与方法
1.1菌株与培养基
酵母菌:由河南师范大学资源微生物与功能分子河南省高校重点实验室保存,共15株。
斜面活化培养基(g/L):葡萄糖20,蛋白胨20,酵母膏10,琼脂20,pH自然。
种子液培养基(g/L):葡萄糖20,蛋白胨20,酵母膏10,pH自然。
发酵培养基(g/L):葡萄糖20,酵母膏0.5,(NH4)2SO42,KH2PO41,MgSO4·7 H2O 0.5,pH 7.0。
以上培养基均在0.1 MPa灭菌30 min。
1.2产油酵母菌菌株的筛选
取一环保藏菌种接种至斜面培养基,28℃恒温培养48 h活化菌种。用5 mL无菌水将斜面菌种洗下,转接入装液量为20 mL/100 mL的种子培养基中,28℃,180 r/min恒温震荡培养36 h,获得种子液。按10%接种量接入装液量50 mL/250 mL的发酵培养基中,28℃,180 r/min恒温震荡培养96 h。取少量菌液,采用苏丹黑染色的方法对产油脂酵母进行初筛[9]。然后将菌液8 000 r/min离心10 min,收集菌体测定酵母生物量和油脂产量,选用油脂产量最高的菌株做为出发菌株进行诱变育种,并对该菌株进行分子生物学鉴定[10]。
1.3生物量的测定
菌体生物量的测定采用菌体干质量法[11]。
菌体生物量/(g/L)=菌体干质量(g)/发酵液体积(L)
1.4油脂的提取和产量测定[12]
取45 mL发酵液于50 mL离心管中,6 000 r/min离心10 min,蒸馏水洗涤3次,收集菌体,加入4 mol/L的盐酸15 mL,混匀后室温下浸泡1 h,沸水浴5 min后迅速冷却,6 000 r/min离心10 min,去除HCl,向离心管中加入15 mL氯仿/甲醇(体积比1∶1)溶液,室温下震荡混匀,6 000 r/min离心10 min,取氯仿层,加入相同体积的0.1%的NaCl(质量分数)溶液,振荡混匀,6 000 r/min离心10 min,用已知质量的蒸馏瓶收集氯仿层后,通过旋转蒸发仪将氯仿蒸干,再次称量瓶中,得出油脂产量以及油脂产率。
将浸提液适当稀释后,利用分光光度计在487 nm处测定其吸光度值,然后按下式计算类胡萝卜素的产量:
油脂产率/%=油脂产量/干菌体质量×100
1.5酵母菌生长曲线的测定[13]
菌株在斜面培养基上活化后,取一环接种至种子培养基中,28℃,180 r/min恒温振荡培养,培养过程中从4 h后开始,每隔2 h取样测菌液在600 nm处的OD值,培养时间为横坐标,OD值为纵坐标,绘制菌株的生长曲线。
1.6诱变处理及正向突变菌株的筛选
菌悬液的制备:从斜面活化培养基上挑取适量菌体接种到种子培养基中,28℃,180 r/min恒温振荡培养至对数期,6 000 r/min离心10 min收集菌体,用无菌水洗涤3遍,重悬浮,制成菌体细胞浓度为108CFU/mL的菌悬液。
常压室温等离子体(ARTP)诱变:采用清华大学化工系自主研发的ARTP II常压室温等离子体诱变仪对菌悬液进行诱变处理。固定仪器的电源功率、气流量、等离子体发射源与菌悬液之间的距离等条件,将处理时间作为诱变的可变参数[14]。在本研究中ARTP的设定条件为:处理距离2 mm,处理功率120 W,气流量10 SLM,处理时间分别为0、30、60、90、120、150、180 s,处理后菌悬液进行适当稀释涂布到固体培养基上,28℃恒温培养2 d~3 d,计算致死率并绘制致死曲线。
正向突变菌株的筛选:首先通过苏丹黑染色的方法对突变株进行初筛,选取油脂含量较多的突变株,按照前述方法通过对突变株进行生物量以及油脂产量测定来进行高产油脂突变株的筛选。
1.7遗传稳定性试验
将筛选获得的高产油脂红酵母菌株接种至斜面固体培养基上传代培养,共传10代,取第0、2、4、6、8、10次传代的菌进行摇瓶发酵培养,测其生物量和油脂产量,检测筛选得到的高产油脂菌株的遗传稳定性。
1.8培养条件的优化
采用单因素试验法研究不同碳源(葡萄糖、蔗糖、麦芽糖),不同氮源(硫酸铵、氯化铵、硝酸铵),不同碳氮比(30∶1、50∶1、70∶1、90∶1、110∶1、130∶1)和不同发酵培养基初始pH(5.0、5.5、6.0、6.5、7.0、7.5、8.0)对菌株产油脂发酵的影响,对其培养条件进行优化。
1.9油脂成分的分析
1.9.1油脂的甲酯化[15]
称取提取的酵母油脂100 mg,向其加入2 mL的 0.6 mol/L的氢氧化钾-甲醇溶液和2 mL的正己烷,振荡2 min,在室温下放置15 min后,加入5 mL蒸馏水,静置分层,取正己烷层,用0.45 μm滤膜过滤后制得脂肪酸甲酯样品,采用气相色谱-质谱联用法(GC-MS)测定其脂肪酸组成。
1.9.2GC-MS试验条件[16]
GC条件:进样器240℃;程序升温:初始温度50℃,保留5 min;以10℃/min的速度升至170℃,保留10 min;以3℃/min的速度升至205℃,保留20 min;再以10℃/min的速度升至250℃,保留5 min;离子源温度200℃,传输线温度250℃。
MS条件:电子轰击(EI)离子源,电子能量70 eV,离子源温度230℃,质荷比扫描范围35~450。
2 结果及分析
2.1产油脂酵母菌菌株的筛选及鉴定
按照材料方法所述从15株酵母菌中获得一株生物量,油脂产量均较高的菌株KC 8,在发酵培养基中经96 h摇瓶发酵培养后,其生物量为(14.02±0.15)g/L,油脂产量为(1.22±0.07)g/L。
对其26S rDNA片段进行测序(GenBank登录号:KP760069)并在NCBI进行Blast同源性检索,结果表明与Rhodotorula mucilaginosa有100%的相似性,构建系统发育树(图1)表明,KC 8与Rhodotorula mucilaginosa聚为一簇,因此该红酵母菌株KC 8的鉴定结果为胶红酵母(R.mucilaginosa)。

图1 基于26S rDNA基因序列的系统进化树Fig.1 Phylogenetic tree based on 26S rDNA sequences
2.2菌株生长曲线的测定
诱变处理一般选取对数期的菌株,此时菌体生长状况比较同步,代谢活性高而稳定,生活力强,易变异且重复性好。菌株KC 8在种子液培养基中的生长曲线见图2。
由图2可知,菌株KC 8在种子液培养基中28℃,180 r/min恒温震荡培养,培养至12 h~24 h期间处于对数期,本试验选取培养20 h后的菌液进行诱变处理。
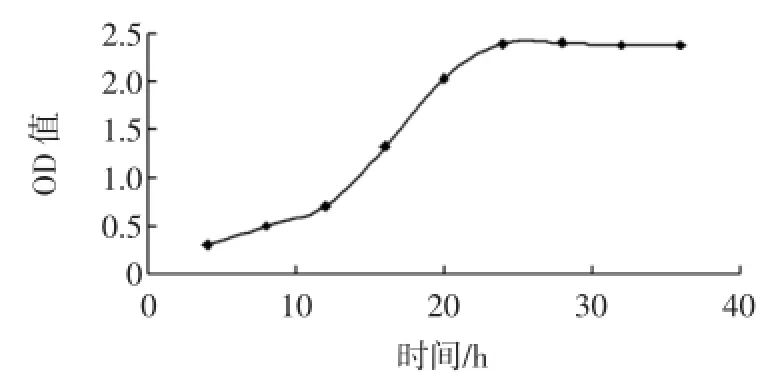
图2 菌株KC 8在种子液培养基中的生长曲线Fig.2 The growth curve of initial strain KC 8 in seed culture
2.3ARTP诱变致死率曲线的测定
ARTP诱变的致死结果如图3所示。

图3诱变致死曲线Fig.3 The curve of mutation fatality rate
对酵母菌诱变处理时间在30 s到150 s范围内,随着等离子体对菌体细胞的照射时间的延长,致死率逐渐升高。当照射时间为120 s时,致死率为85%左右,而当照射时间为150 s时,菌体细胞几乎全部被杀死,致死率接近100%。当致死率在85%左右时,有较高的正突变率[17],因此选择照射时间为120 s。
2.4高产油脂酵母菌株的筛选
按照方法1.6对红酵母菌株KC 8进行诱变处理,从诱变后获得的突变株中挑选出300株生长良好的菌株,测其生物量及油脂产量。通过对突变株的筛选,共获得4株油脂产量明显提高的菌株,分别命名为Y1、Y2、Y3、Y4,各自的生物量、油脂产量及产率如表1所示。
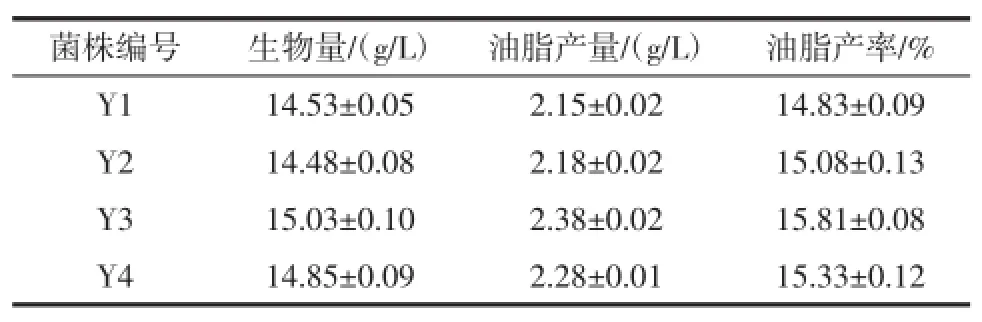
表1 各突变株的生物量、油脂产量及油脂产率Table 1 The biomass,oil yield and oil productivity of each mutant strain
ARTP诱变是一种新型诱变技术,和传统诱变方法相比,ARTP诱变对遗传物质的损伤机制多样,获得突变型多样性的可能性较大,研究结果表明,ARTP技术可以快速有效地突变细菌、放线菌、霉菌、酵母等微生物[18-20]。由表1可以看出,筛选获得的4株突变株的生物量以及油脂产量与出发菌株KC 8相比,均有不同程度的提高。其中,突变株Y 3的有着较高的生物量和油脂产量,分别是出发菌株KC 8的1.07倍和1.95倍。从表1可以看出,出发菌株经过ARTP诱变后,其生物量变化不是太大,而油脂产量却有大幅升高。这与金丽华等[14]报道的利用ARTP诱变技术选育高产油脂的酿酒酵母研究中的结果相一致,因此,证明了新型的ARTP诱变技术对提高该红酵母油脂产量的作用比较明显。
2.5菌株Y3遗传稳定性试验
将菌株Y3传代10次,取第0、2、4、6、8、10次传代的菌进行摇瓶发酵培养,并分别测定每次传代菌株的生物量和油脂产量,测定结果如表2所示,菌株的油脂产量比较稳定,说明该菌株的产脂稳定性较好。

表2 突变株Y3的遗传稳定性Table 2 The hereditary stability of mutant strain Y3
2.6菌株Y3发酵条件的优化
2.6.1碳源对菌株Y3油脂发酵的影响
分别选用了葡萄糖、蔗糖和麦芽糖作为发酵培养基的单一碳源,其他条件不变,待其发酵96 h以后,测得不同碳源发酵条件下的菌株生物量和油脂产量,结果如图4所示。

图4 碳源对菌株Y3的油脂发酵的影响Fig.4 Effect of carbon source on fermentation efficiency of the strain Y3
葡萄糖和蔗糖作为发酵培养基的单一碳源时,菌体的生物量和油脂产量均较高,其中以蔗糖为碳源时,菌体的生物量最高,为(15.09±0.10)g/L,以葡糖糖为碳源时,菌体的油脂产量最高,为(2.37±0.02)g/L,当以麦芽糖为碳源时,菌体的生物量和油脂产量均为最低,分别为(9.32±0.12)g/L和(1.07±0.08)g/L。因此,菌株Y3发酵培养基的最适碳源为葡萄糖。
2.6.2氮源对菌株Y3油脂发酵的影响
以葡萄糖作为发酵培养基的碳源,分别选用硫酸铵、氯化铵、硝酸铵作为氮源,其他条件不变,发酵96 h以后,测得不同碳源发酵条件下的菌株生物量和油脂产量,结果如图5所示。
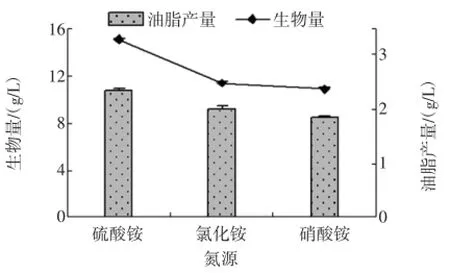
图5 氮源对菌株Y3的油脂发酵的影响Fig.5 Effect of nitrogen source on fermentation efficiency of the strain Y3
菌株Y3以硫酸铵为氮源时,菌体的生物量和油脂产量均为最高,分别为(15.02±0.11)g/L,(2.34±0.03)g/L,说明硫酸铵为该菌株发酵培养基的最适氮源;当发酵培养基分别以氯化铵和硝酸铵作当氮源时,菌体的生物量和油脂产量差别不大,但均不是最高,说明菌株Y3对氯化铵和硝酸铵的利用效率不如硫酸铵。
2.6.3碳氮比对菌株Y 3油脂发酵的影响
固定发酵培养基中氮源即 (NH4)2SO4的用量,以葡萄糖(碳源)为变量,分别测定菌株Y 3在碳氮比为30∶1、50∶1、70∶1、90∶1、110∶1、130∶1的发酵培养基中发酵96 h后,菌体的生物量以及油脂产量,结果如图6所示。
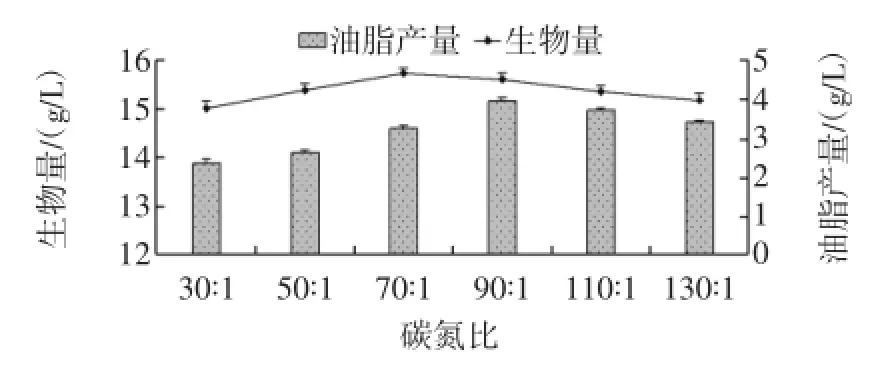
图6 碳氮比对菌株Y3油脂发酵的影响Fig.6 Effect of carbon-to-nitrogen ratio on fermentation efficiency of the strain Y3
当碳氮比在30∶1到70∶1范围内时,菌体的生物量随着碳氮比的增大而逐渐升高,并在碳氮比为70∶1时达到最大值,为(15.73±0.11)g/L。而当碳氮比为90∶1,生物量开始下降,说明当培养基中的氮源过少时,不利于菌体的生长,但是此时,菌体的油脂产量却达到了最大值,为(3.95±0.07)g/L,说明当培养基中氮源缺乏而碳源充足时,更有利于菌体油脂的积累。
2.6.4培养基初始pH对菌株Y3油脂发酵的影响
发酵培养基以葡萄糖为碳源,硫酸铵为氮源,碳氮比为90∶1,用盐酸和氢氧化钠分别调至pH为5.0、5.5、6.0、6.5、7.0、7.5、8.0,并分别测定菌株Y3在不同pH的发酵培养集中发酵96 h后的菌体生物量和油脂产量,结果如图7所示。

图7 培养基初始pH对菌株Y3油脂发酵的影响Fig.7 Effect of initial pH on ermentation efficiency of strain Y3
培养基的初始pH的过低或者过高都不利于菌株的生长和油脂的积累,当发酵培养基初始pH为6.5时,菌株的油脂产量达到了最大值,为(3.96±0.03)g/L,因此,发酵培养基的最适初始pH为6.5。
从对菌株Y3的发酵培养条件优化结果可以看出,菌株Y3油脂发酵的最适碳源为葡萄糖,氮源为硫酸铵,碳氮比为90∶1,发酵培养基的初始pH为6.5,在该发酵条件下,菌株Y3经摇瓶发酵培养96 h后,菌株的生物量为(14.98±0.11)g/L,油脂产量为(3.96± 0.05)g/L,油脂含量占菌体干重的26.4%。
2.7油脂的组分分析
采用GC-MS对制得的脂肪酸甲酯化样品进行上样分析,菌株Y3所产的油脂脂肪酸甲酯的总离子流图见图8。
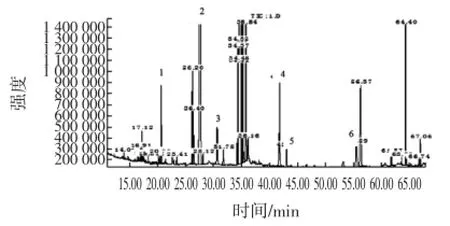
图8 菌株Y3菌体油脂脂肪酸甲酯的总离子流图Fig.8 Total ion chromatogram for fatty acid methyl esters of Y3
从图8可以看出,各种脂肪酸甲酯都得到了分离,共分离出6种(具体组分见表3)。
油脂组分测定结果如表3所示。
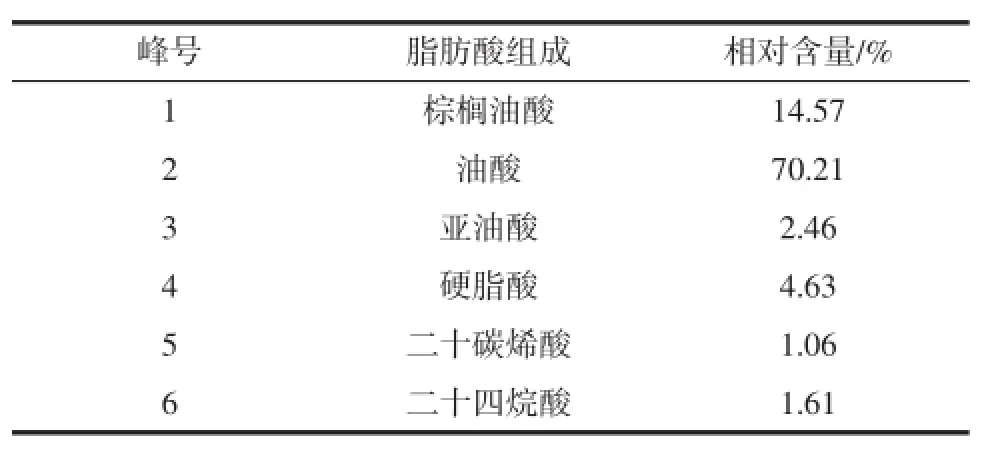
表3 菌株Y3菌油脂脂肪酸组成及相对含量Table 3 Fatty acid composition and relative content of strain Y3
菌株的脂肪酸主要由C16和C18的脂肪酸组成,占脂肪酸总量的91.87%。该脂肪酸中包含了饱和脂肪酸和不饱和脂肪酸,其中油酸的含量最高,占脂肪酸总量的70.21%,其次是棕榈油,占脂肪酸总量的14.57%,二十碳烯酸和二十四烷酸的含量较少,分别占脂肪酸总量1.06%、1.61%。从测定结果可以看出,该脂肪酸组成与植物油成分相似,因此可以替代植物油来生产生物柴油,很好的解决了生物柴油生产中原料不足的问题。
3 结论
本试验通过对实验室保藏的红酵母进行筛选,得到了一株油脂产量较高的红酵母菌株KC 8,经鉴定为胶红酵母(R.Mucilaginosa),其类油脂产量为(1.22± 0.07)g/L;对菌株KC 8进行ARTP诱变,筛选获得一株高产油脂的突变菌株Y3,油脂产量为(2.38±0.02)mg/L;对菌株Y3的培养条件优化结果表明,该菌株油脂发酵的最适碳源为葡萄糖,氮源为硫酸铵,碳氮比为90∶1,发酵培养基的初始pH为6.5,在该发酵条件下,菌株Y3经摇瓶发酵培养96 h后,菌株的生物量为(14.98± 0.11)g/L,油脂产量为(3.96±0.05)g/L,油脂含量占菌体干重的26.4%;GC-MS对油脂组分进行分析结果表明,该脂肪酸主要由棕榈油酸、油酸、亚油、硬脂酸、二十碳烯酸和二十四烷酸组成,与植物油成分相似,菌株Y3是一株遗传性状稳定,产油脂能力强的酵母菌株,可以用来替代植物油生产生物柴油,具有良好开发前景。
[1]易绍金,郑义平.产油微生物的研究及其应用[J].中外能源,2006,11(2):90-94
[2]赵宗保,胡翠敏.能源微生物油脂技术进展[J].生物工程学报,2011,27(3):427-435
[3] Wynn J P,Ratledge C.The biochemistry and molecular biology of lipid accumulation in oleaginous microorganisms[J].Adv Appl Microbiol,2002,51:1-51
[4]刘波,孙艳,刘永红,等.产油微生物油脂生物合成与代谢调控研究进展[J].微生物学报,2005,45(1):153-156
[5]Chanchaichaovivat A,Ruenwongsa P,Panijpan B.Screening and identification of yeast strains from fruits and vegetables:Potential for biological control of postharvest chilli anthracnose(Colletotrichum capsici)[J].Biological Control,2007,42(3):326-335
[6]Li Y,Zhao Z K,Bai F.High-density cultivation of oleaginous yeast Rhodosporidium toruloides Y4 in fed-batch culture[J].Enzyme and Microbial Technology,2007,41(3):312-317
[7]Pan L X,Yang D F,Huang S Y,et al.Screening of oleaginous yeast byutilizingxylosebymicrowaveirradiationmutation[J].China Brewing,2009,204(3):62-64
[8] Jia Z,DanHong S,XiaoDong Z.Researches on mutation breeding and fermentation conditions of oleaginous yeast[J].Journal of Zhejiang University(Agriculture and Life Sciences),2009,35(5):497-502
[9]Pan L X,Yang D F,Shao L,et al.Isolation of the oleaginous yeasts from the soil and studies of their lipid-producing capacities[J].Food Technol Biotechnol,2009,47(2):215-220
[10]蔡柏岩,接伟光,葛菁萍,等.黄檗根围丛枝菌根(AM)真菌的分离与分子鉴定[J].菌物学报,2008,27(6):884-893
[11]张杰,张晓东,许海朋,等.Cryptococcus curvatus O3酵母菌培养及产油脂特性[J].微生物学通报,2009,36(1):41-45
[12]孙晓璐,孙玉梅,曹芳,等.对产油脂酵母的细胞破碎方法及油脂提取效果的比较[J].河南工业大学学报(自然科学版),2007,28(4):67-69
[13]汪福源,许激扬,唐宁.诱变红酵母RY-17生物合成番茄红素的研究[J].药物生物技术,2006,12(6):375-378
[14]金丽华,方明月,张翀,等.常压室温等离子体快速诱变产油酵母的条件及其突变株的特性[J].生物工程学报,2011,27(3):461-467
[15]Wang L,Sun Y,Zhao Z.Effect of fermentation condition on fatty acid components of the lipid produced by Trichosporon fermentans [J].China Brewing,2006,10(136):20-23
[16]马占军,蔡冠竟,杨旭俊,等.一株高效产油脂真菌的选育及其油脂成分分析[J].厦门大学学报(自然科学版),2012(6):1079-1084
[17]康富帅,颜兵,吕南拳,等.低嘌呤酿酒酵母的ARTP法诱变育种[J].现代食品科技,2014,30(2):188-191
[18]徐振杰,胡容,李珍,等.高产油脂红酵母的选育及培养条件优化[J].食品科学,2011,32(11):209-215
[19]何建华,蒋玮,吕贝贝,等.ARTP诱变筛选草菇优良菌株及RAPD分析[J].核农学报,2014,28(11):1950-1955
[20]Zhang X,Zhang XF,Li HP,et al.Atmospheric and room temperature plasma(ARTP)as a new powerful mutagenesis tool[J].Applied microbiology and biotechnology,2014,98(12):5387-5396
Mutation Breeding of Yeast with High Lipid Production by Atmospheric and Room Temperature Plasmas
LIU Dong1,QIU Jing-yun1,WANG Xia1,ZHONG Hai-qing1,WAN Lin-lin1,YANG Qing-xiang1,2,*
(1.College of Life Sciences,Henan Normal University,Xinxiang 453007,Henan,China;2.Key Laboratory for Microorganisms and Functional Molecules(Henan Normal University),Xinxiang 453007,Henan,China)
A high lipids producing strain,KC 8,was selected from 15 yeast strains which were stored in our lab.KC8 could produce 1.22 g/L lipids after 96 h flask fermentation.Analysis on the 26S rDNA sequence indicated that KC 8 had 100%identity with Rhodotorula mucilaginosa.Using KC 8 as a starting strain,atmosphericand room temperature plasma(ARTP)was used to induce mutation for screening strains of higher lipids production.Finally,Y 3 was obtained from 300 strains of screening.The yield of lipid was 2.38 g/L after 96 hours flask fermentation by Y 3.After optimized the fermentation conditions,the lipid productivity reached 3.96 g/L under the following conditions:glucose as carbon source,(NH4)2SO4as nitrogen source,ratio of carbon to nitrogen at 90∶1,initial pH 6.5,incubated at 28℃for 96 h shaking fermentation.Gas chromatography-mass spectrometer(GC-MS)analysis indicated that the fatty acids were mainly composed of palmic acid,oleic acid,linoleic acid,stearic acid,eicosenoic acid and tetracosanoic acid.The compositions of fatty acids were similar to those of vegetable oil.
yeast;lipid;atmospheric and room temperature plasma mutation;fatty acid composition
10.3969/j.issn.1005-6521.2016.10.042
国家自然科学基金(No.NSFC21077032;NSFC21277041);河南省高校科技创新团队(No.13IRTSTHN009)作者简介:刘冬(1988—),男(汉),硕士研究生,研究方向:环境微生物。
*
杨清香(1966—),女(汉),教授,博士,研究方向:环境微生物。
2015-05-06
