紫娟茶中花青素提取物含量的不确定度评定
2016-08-06戴妙妙上海市质量监督检验技术研究院上海201114
戴妙妙(上海市质量监督检验技术研究院,上海201114)
紫娟茶中花青素提取物含量的不确定度评定
戴妙妙
(上海市质量监督检验技术研究院,上海201114)
紫娟茶由含酸甲醇提取后,经过乙醚、氯仿的液液分配以及Amberlite XAD-7HP树脂的吸附洗脱,得到花青素粗提物。针对花青素提取物,采用DPPH法研究探讨了其抗氧化性及清除自由基的能力,并针对抗氧化性试验进行了不确定度的评定,得到的扩展不确定度为0.132 2(以Trolox mg/kg计),说明测量结果有较高的质量,使用这种抗氧化方法得到的结果是可信的。本研究的结果为紫娟茶花青素的深入研究与有效开发利用,提供了必备的表征条件和理论参考,并有助于食品原料的深度加工和功能性检测方法的应用与开发。
紫娟茶;花青素;抗氧化性;不确定度
紫娟茶树[1]是一种较特异的植株,具有紫茎、紫叶、紫芽(紫色的芽尖)的特征,以谐音为其取名“紫娟”(Zi juan)。紫娟茶叶与普通的紫芽茶叶不同,特别是外形明显不同,其加工成的烘青绿茶,干茶的色泽为紫色,汤色也为黑紫色,香气纯正,滋味浓强,在国内茶叶中也属于较罕见的品种。
紫娟茶中含有种类丰富的活性成分,其芽叶经过蒸馏得到的浸出物含量为44.58%,茶多酚(Tea Polyphenols)的含量为 35.52%,咖啡碱(Theine)31.01 mg/g,花青素29.14mg/g,黄酮类化合物12.82mg/g,锌30.25 mg/kg,氨基酸总量346.19 mg/g,儿茶素(Catechin)总量201.86 mg/g,其中的花青素含量高出普通红芽茶(5 mg/g~10 mg/g)两倍[2]。根据云南省茶叶研究所生化试验分析证明,紫娟茶有降血压、降血脂、预防心脑血管疾病、抗高蛋白过敏及抗HIV宿主细胞功效等作用,并能缓解眼疲劳、预防视力下降等功效。其较高含量的锌、黄酮类、超量的花青素是其呈现上述功效的主要物质。
花青素作为天然抗氧化剂在食品工业中有着广阔的发展空间,由于食品安全是重大民生问题,因此国家对食品检测也高度关注。从检测行业来说抗氧化性检测将会是一个热门焦点,也就是说对抗氧化性检测的不确定度评定将是一个重要的环节。
不确定度(Uncertainty)[3]是一个表示测量结果与被测量值分散性的参数。它是度量测量结果可信程度的一个最重要的依据。测量结果是否能被采用很大程度上取决于其的不确定度大小。不确定度越小,表明测试结果越接近于被测量的真值(True value of a quantity),质量越是高,其可以被其他使用该测试方法的人使用;反之,不确定度过大,说明测量结果的水平过低,其没有被使用的价值。在ISO/IEC导则25中明确,实验室的每个报告,都必须包含测试结果不确定度的说明[4]。在ISO/IEC 17025:2005中规定,测试报告需伴有评估测量不确定度一同出具[5]。所以,不确定度评定在检测领域中的重要性不言而喻。
1 材料与方法
1.1原料
紫娟茶:市售,于4℃冰箱保藏,待用。
1.2仪器
CP214C电子天平:Ohaus;RE5203旋转蒸发仪:上海亚荣生化仪器厂;FE20精密pH计、XS105DU分析天平:Mettler Toledo;HHS-21-4孔型电热恒温水浴锅:上海医疗机械五厂;SHB-IIIA循环水式多用真空泵:上海豫康科教仪器设备有限公司;90-1恒温磁力搅拌器:上海精科实业有限公司;LGJ-18C冷冻干燥机:北京四环科学仪器厂有限公司;P1000、P5000移液器:Gilson;PE Lambda25紫外可见分光光度计:Perkin Elmer。
1.3试剂
甲醇、乙酸乙酯、氯仿、乙醚(均为AP纯)、无水乙醇(HPLC纯):国药集团化学试剂有限公司;三氯乙酸(TFA,HPLC纯):Aladdin;Amberlite XAD-7HP大孔吸附树脂:Rohm&Haas;纯度>98.0%(GC)(T)的水溶性VE(Trolox)、纯度>97.0%的1,1-二苯基-2-苦基肼自由基(DPPH):CTI。
1.4花青素的制备[6]
称取300 g紫娟茶叶于5 L烧杯中,加1 L 2% TFA甲醇浸提液至浸没茶叶,4℃下避光静置21 h,过滤收集滤液,残渣继续用1 L 2%TFA甲醇浸提液浸泡,4℃下避光静置4 h,收集滤液,共重复3次。合并3次浸提滤液,得到紫娟茶浸提滤液约4 L。4 L紫娟茶浸提滤液在35℃下旋转蒸发蒸去甲醇,直至无甲醇残留,得到紫娟茶粗提液约500 mL,调节pH<2。500 mL紫娟茶粗提液,先用乙醚进行3~5次萃取,每次乙醚使用100 mL~200 mL,直至有机层无色显现,收集水层,旋转蒸发除去乙醚,乙醚能除去紫娟茶粗提液中的脂质脂溶性色素等;再用氯仿进行3~5次萃取,每次氯仿使用100 mL~200 mL,至有机相无色,取水层,旋转蒸发除去氯仿,水溶液浓缩至300 mL,调节pH<2,氯仿能除去紫娟茶粗提液中的咖啡碱。将300 mL紫娟茶粗提水溶液以16 mL/min的流速,缓慢滴入层析柱(Φ2.5 cm×60 cm)中,静置20 min~30 min,使其充分吸附在树脂上[7]。先用1 L 0.1%TFA水溶液洗脱,除去一些水溶性的单糖、氨基酸等小分子的杂质;再用2 L 0.1%TFA甲醇溶液洗脱,直至无有色物质洗脱下来,收集洗脱液。将紫娟茶粗提洗脱液在35℃下旋转蒸发蒸去甲醇,直至无甲醇残留,再将其置于-60℃冷阱中冷冻6 h,随后在1.0 Pa真空度下冷冻干燥18 h以上,得到紫娟茶粗提物27.6 g。称取上述20.0 g紫娟茶粗提物于烧杯中,加400 mL乙酸乙酯,磁力搅拌30 min,进行3次固液萃取,收集不溶固体,旋转蒸发蒸去乙酸乙酯,直至无乙酸乙酯残留,再将其置于-60℃冷阱中冷冻6 h,随后在1.0 Pa真空度下冷冻干燥18 h以上,得到花青素粗提物4.3 g,于4℃冰箱保藏备用。
1.5DPPH反应体系中的抗氧化性试验[8]
称取0.001 g样品于烧杯中,加无水乙醇溶解,移入容量瓶中,加无水乙醇定容至50 mL。吸取1 mL样液,移入容量瓶中,加4 mL 0.1 mmol/L DPPH的乙醇溶液,定容至5 mL,室温静置30 min,用比色皿,于517 nm波长处,测定吸光度值。以乙醇代替样品做空白。计算结果以Trolox mg/kg计。
2 结果与分析
2.1数学模型
在此是把测量中用作获得被测量的计算公式当为数学模型,因为该公式中已将所有对检测结果有影响的输入量都显现了出来。

式中:W为样品浓度(以Trolox计),mg/kg;C0为样品液校正后浓度,mg/mL;V为样品定容体积,mL;V0为样品进样量,mL;V1为反应体系体积,mL;M为样品质量,g;Frec为回收率校正因子。
2.2不确定度分量来源分析
分析结果的测量不确定度的来源主要包括4个方面:1)外标法校准过程引入的不确定度。在外标法校准过程中,由最小二乘法线性拟合带来的不确定度、标准品不确定度以及配制过程中天平、移液管、容量瓶允差及温度不同的不确定度。2)样品质量不确定度。它是由称量样品天平的最大允差带来。3)体积引入不确定度。该不确定度包括移液器和容量瓶校准产生的不确定度、温度和重复性变化。4)样品显色过程对回收率影响导致的不确定度。这4个方面不确定度的因果关系如图1所示。
2.3不确定度分量评定[9-11]
2.3.1C0的标准不确定度u(C0)
1)用最小二乘法拟合标准曲线校准所产生的不确定度

图1因果关系图Fig.1 Cause and effect diagram
用5种浓度标准溶液,紫外可见分光光度计测定3次,得到吸光度值Y,用最小二乘法进行拟合,得到直线方程(a为斜率,b为截距)和线性相关系数r。

根据数学模型求方差和传播系数
方差:uc2(X)=c2(Y)u2(Y)+c2(a)u2(a)+c2(b)u2(b)
5个浓度水平,每个浓度进样3针数据如表1。

表1 校准曲线数据Table 1 The data of the calibration curve
根据数据利用工作站绘制校准曲线,得方程Y= 0.904 0-111.51X;r=0.998 8
由方程可得:a=-111.51,b=0.904 0;
样品质量M为0.001 g,样品定容体积V为50 mL,样品进样量V0为1 mL,反应体系体积V1为5 mL,测得C0=0.003 3 mg/mL。
①回归曲线的标准偏差(即y的标准偏差)

式中:Yij为标准物质和各自内标物在仪器上的响应值比值;Yi为回归曲线的计算值;n为测量点个数;m为每个测量点重复的次数;为自由度。
计算各个Yi和Yij-Yi值,如表2。

表2 Yi和Yij-Yi值数据Table 2 The data of Yiand Yij-Yi
可由表算得:

自由度为:m·n-2=3×5-2=13
②斜率a的标准偏差


自由度为:m·n-2=13
③截距b的标准偏差
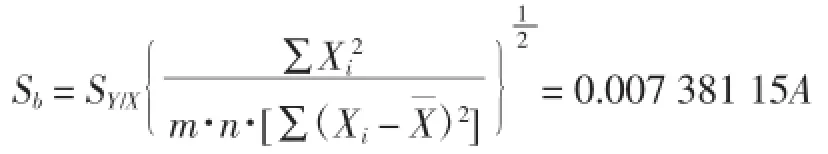
自由度为:m·n-2=13
2)计算不确定度分量

u1是Y残差的标准偏差SY/X
u1=SY/X=0.013 537 19A
自由度:v1=m·n-2=13
传播系数:c(y)=1/a=-0.008 967 81 mg/mL/A
标准物质引入的不确定度u2
梯希爱(上海)化成工业发展有限公司(CTI)提供标准物质水溶性VE(Trolox),纯度Specifications min 98.0%(GC)(T),Results 99.9%(GC)(T)。正态分布变化,置信因子k=2,置信概率p=95%。
u2=0.969%/98.0=0.000 098 92
自由度:v2=∞
传播系数:c(y)=-0.008 967 81 mg/mL/A
重复测定u3
重复测量标准溶液各10次,取5个点中测量数据标准
自由度:v3=n-1=10-1=9
传播系数:c(y)=-0.008 967 81 mg/mL/A

自由度:v=m·n-2=13
③u(b)=Sb=0.007 381 15A
自由度:v=m·n-2=13
u(C0)的各不确定度分量结果见表3。

表3 u(C0)不确定度分量表Table 3 The uncertainty subscale of u(C0)

2.3.2样品质量不确定度u(M)
电子天平证书给出MPE值±0.000 02 g,均匀分布变化,置信因子,置信概率p=100%。

2.3.3体积引入不确定度u(△V)
称取0.001 g样品于烧杯中,加无水乙醇溶解,移入容量瓶中,加无水乙醇定容至50 mL。吸取1 mL样液,移人容量瓶中,加4 mL 0.1 mmol/L DPPH的乙醇溶液,定容至5 mL,室温静置30 min,用比色皿,于517 nm波长处,测定吸光度值。
2.3.3.150 mL A级容量瓶的不确定度uv1
其中包括三个部分:第一,容量瓶体积的不确定度,容量瓶(50 mL)的容量允差为±0.05 mL,按均匀分布换算成标准偏差为=0.028 87 mL;第二,定容时的估读误差,估计为±0.005 mL,按均匀分布换算成标准偏差为=0.002 887 mL;第三,容量瓶和溶液的温度与校正时的温度不同引起的体积不确定度,设温度变化范围(20±5.0)℃,膨胀系数α=2.1×10-4,置信因子,按矩形分布变化换算成标准偏差为

2.3.3.25 mL A级容量瓶的不确定度uv2

2.3.3.35mL移液器的不确定度uv3
其中包括3个部分:第一,厂家给出的移液器(5 mL)系统误差为±0.03 mL,按均匀分布换算成标准偏差为0.017 32 mL;第二,重复测量的不确定度为±0.008mL,按均匀分布换算成标准偏差为0.004619mL;第三,移液器和溶液的温度与校正时的温度不同引起的体积不确定度,设温度变化范围(20±5.0)℃,膨胀系数α=2.1×10-4,置信因子,按矩形分布变化换算成标准偏差为0.003 031。
2.3.3.41 mL移液器的不确定度uv4

所以:

2.3.4样品提取过程对回收率影响导致的不确定度
对样品进行加标回收,通过10次回收,计算回收率。见表4。
根据贝塞尔公式:
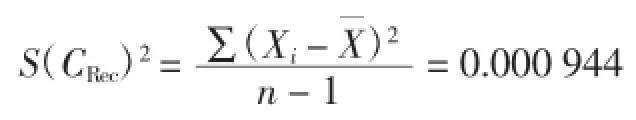
标准偏差:S(CRec)=0.097 160
不确定度具体表现在10次测量样品回收率平均值的标准偏差 S(CRec),标准不确定度

当t值大于或等于双边临界值t(95.2)=4.30时,则与1有显著性差异,说明frec必须使用修正结果。反之,则不使用。计算结果见表5。

表5 ucrel(W)Rec显著性检验Table 5 Significant test of ucrel(W)Rec
3 结果与讨论
3.1合成不确定度

3.2扩展不确定度U
根据国际惯例,取扩展因子k=2,置信概率p=95%。

3.3不确定度分量列表
各不确定度分量对扩展不确定度U的影响见图2。

图2 不确定度分量图Fig.2 Uncertainty component diagram
4 结论
应用DPPH反应体系中花青素浓度(以Troloxmg/kg计)的测量结果进行评定,得到合成标准不确定度为0.066 091(以Trolox mg/kg计)和扩展不确定度为0.132 2(以Trolox mg/kg计),从数值上来说本标示的不确定度较小,所述结果与被测量的真值较接近,质量较高,水平较高,它使用价值也较高。所以符合本文测量条件的测量结果,一般可参照使用本不确定度的评定结果以考察结果的准确性。通过对各不确定度分量的评估,从中找出其最大分量为urel(C0),对产生这一分量的测试要素——样液校正后浓度,加以控制,就可获得更准确、更精确的测试结果。测量不确定度评定在实际工作中有重要意义,特别是在检测结果为临界值时显得尤为重要。本方法在实际检测工作中具有较强的应用价值。
[1]杨兴荣,包云秀,黄玫.云南稀有茶树品种“紫娟”的植物学特性和品质特征[J].茶叶,2009,35(1):17-18
[2]蔡丽,梁名志,夏丽飞,等.“紫娟”茶外观表象差异研究[J].西南农业学报,2010,23(3):700-703
[3]International Organization for Standardization(ISO).International Vocabulary of Basic and General Terms in Metrology(VIM)3rdEdition(2004)[S].Geneva:ISO copyright office:16-18
[4]International Organization for Standardization(ISO).Guide to the Expression of Uncertainty in Measurement(GUM)(1993,corrected 1995)[S].Geneva:ISO copyright office:8-9
[5]International Organization for Standardization(ISO).ISO/IEC17025:2005.General Requirements For The Competence Of Testing And Calibration Laboratories[S].Switzerland:ISO copyright office:14-15
[6]Cuevas-Rodríguez EO,Dia VP,Yousef GG,et al.Inhibition of proinflammatory responses and antioxidant capacity of Mexican blackberry(Rubusspp.)extracts[J].JAgricFoodChem,2010,58(17):9542-9548
[7]朱风姝,杜彬,李军,等.大孔树脂分离葡萄酒下脚料中原花青素的研究[J].食品工业,2008(1):6-9
[8]Paweł Pas'ko,Henryk Barton',Paweł Zagrodzki,et al.Anthocyanins,total polyphenols and antioxidant activity in amaranth and quinoa seeds and sprouts during their growth[J].Food Chemistry,2009,115 (3):994-998
[9]陈奕钦.测量不确定度“93国际指南”应用实例[M].北京:中国计量出版社,1998:296-301
[10]戴妙妙,奚迪.电池中汞含量的不确定度评定[J].自动化仪表,2010,31(6):21-23
[11]史政,戴妙妙,马会凯.紫外可见光分光光度计在环保监测领域的应用[J].自动化仪表,2011,32(6):64-66
Evaluation for Measurement Uncertainty of Anthocyanins from Zi Juan Tea
DAI Miao-miao
(Shanghai Institute of Quality Inspection and Technical Research,Shanghai 201114,China)
Anthocyanins from Zi juan tea were exteacted by using acid-containing methanol as solvent and patitioned with ether and chloroform.The extract of anthocyanins was purified by Amberlite XAD-7HP chromatography.The antioxidant and free radical scavenging capacity of anthocyanin extracts were evaluated by DPPH method.The uncertainty of the antioxidant was assessed.The expanded uncertainties were 0.132 2(Trolox mg/kg),which showed that the level of the measurement had the high quality and the data resulted by these methods was worth believing.This study will provide scientific basis for developing and utilizating of Zi juan tea and contribute the depth of processing of food materials and functional application.
Zi juan tea;anthocyanin;antioxidant activity;uncertainty
10.3969/j.issn.1005-6521.2016.10.040
戴妙妙(1984—),女(汉),工程师,工程硕士,研究方向:产品安全研究。
2015-04-14
