杧果感染细菌性角斑病菌后的生理代谢变化
2016-08-05詹儒林李国平赵艳龙常金梅何衍彪
郑 磊,詹儒林,柳 凤,李国平,赵艳龙,常金梅,何衍彪
(1.海南大学环境与植物保护学院,海南 海口 570228;2.中国热带农业科学院南亚热带作物研究所,广东 湛江 524091)
杧果感染细菌性角斑病菌后的生理代谢变化
郑 磊1,2,詹儒林2,柳 凤2,李国平2,赵艳龙2,常金梅2,何衍彪2
(1.海南大学环境与植物保护学院,海南 海口 570228;2.中国热带农业科学院南亚热带作物研究所,广东 湛江 524091)
为探讨杧果对细菌性角斑病的抗性与生理指标变化的关系,以感抗杧果品种红杧6号(抗病品种)、贵妃杧(感病品种)为材料,采用刺伤接种法,测定杧果叶片中的超氧阴离子(O2-·)、过氧化氢(H2O2)、可溶性总糖、还原糖、游离氨基酸、可溶性蛋白及丙二醛(MDA)的含量。结果表明,杧果受Xanthomonas campestris pv.mangiferaeindicae侵染后,其体内O2-·、H2O2、可溶性总糖、还原糖、游离氨基酸含量的变化与杧果抗性呈正相关;而MDA、可溶性蛋白含量的变化与抗性呈负相关。X.campestris pv.mangiferaeindicae侵染杧果后,O2-·、H2O2、可溶性总糖、还原糖、游离氨基酸、可溶性蛋白和MDA含量的变化规律与杧果抗性密切相关,初步确定为抗性生理指标,可作为该病防控与育种的辅助指标。
杧果;细菌性角斑病;抗性;生化物质;碳水化合物;活性氧
郑磊,詹儒林,柳凤,等.杧果感染细菌性角斑病菌后的生理代谢变化[J].广东农业科学,2016,43(4):67-72.
由油菜黄单孢菌杧果致病变种(X.campestris pv.mangiferaeindicae)引起的杧果细菌性角斑病分布很广,在世界各杧果产区普遍发生,目前该病在海南、广东等地均有报道,局部地区严重发生,该病主要为害杧果叶片、花芽、枝条和果实,感病后表现出病斑周围黄晕、流胶和表面隆起等症状。一般造成的直接经济损失达15%~30%,严重的可高达50%,且近年来有为害加重的趋势。植物受病原菌侵染后,体内会产生一系列代谢变化,如蛋白质、碳水化合物、酶、氨基酸等组分含量的变化,而这些变化与植物抗病性密切相关[1-4]。植物发生病害后会发生生理生化变化,而抗病性是由多种因素所形成的综合作用[5]。目前,国内对该病的研究主要集中在地理分布、病害发生流行规律、病原菌鉴定、病害诊断和防治等方面[6-11]。而关于杧果细菌性角斑病抗性与杧果叶片组织中生理指标变化的关系目前报道仍不多。本研究以抗病品种红杧6号、感病品种贵妃杧为材料,采用刺伤接种法,研究了杧果受X.campestris pv.mangiferaeindicae侵染后生理指标的变化,旨在为阐明寄主与病原物的互作关系和丰富杧果细菌性角斑病病理的基础理论,为进一步研究该病害发生的内在机制以及杧果细菌性角斑病的防控提供理论依据。
1 材料与方法
1.1 试验材料
供试病原菌为杧果细菌性角斑病菌野油菜黄单胞菌杧果致病变种(X.campestris pv.mangiferaeindicae)。供试品种包括红杧6号、贵妃杧,均采自中国热带农业科学院南亚热带作物研究所杧果种质资源圃。根据不同品种的病情指数分为抗病和感病植株。
1.2 试验方法
试验于2015年6月在中国热带农业科学院南亚热带作物研究所杧果种质资源圃进行,以生长一致的盆栽杧果苗为材料,每个品种处理5棵,采用刺伤接种法接种,以摇床培养2 d的病原菌悬浮液作为接种菌液。破伤面积控制在2~4 cm2,盖上棉花保湿,以相同处理的无菌水为对照,分别于接种后12、24、48、96、144、192 h取样,随机取5片叶片测定生理生化指标。3次重复,取平均值。
可溶性总糖含量的测定采用蒽酮-硫酸比色法,还原糖含量的测定采用3,5-二硝基水杨酸法,游离氨基酸含量的测定采用茚三酮法,可溶性蛋白含量的测定采用考马斯亮蓝G-250法,H2O2含量的测定参照林植芳等[12]的方法,超氧阴离子(O2-·)产生速率的测定参照王爱国等[13]和高俊凤[14]的方法。MDA含量的测定参照Wang等[15]方法并稍作改进,称取0.5 g鲜样,添加2 mL预冷的5%三氯乙酸冰浴下研磨成匀浆,于4℃ 12 000 r/min离心10 min,取上清液3 mL,加入3 mL 0.67% TBA摇匀于沸水中煮0.5 h后冷却,然后在450、532、600 nm处测定吸光值,以TCA调零,按下式计算MDA(μmol/g,FW)含量:

式中,Vt表示提取液总体积(mL),Vs表示反应用体积(mL),m表示样品鲜重(g)。
1.3 数据处理及统计分析
所有数据采用Excel作图和SAS软件对数据进行分析。
2 结果与分析
2.1 不同品种杧果接种病菌后可溶性总糖含量的动态变化
植物糖含量的变化与植物的抗性密切相关。图1显示,整体上接种病原菌后不同抗性杧果叶片的可溶性总糖含量均低于对照,抗性品种红杧6号接种后12~48 h稍有上升并略高于对照,96 h后显著下降并低于对照。而贵妃杧品种的叶片中,发病24 h之后可溶性总糖含量显著下降且低于对照,与未接种相比,感病品种贵妃杧可溶性总糖含量的降幅(32.38%)显著高于红杧6号(5.31%),但抗性品种红杧6号的可溶性总糖含量(48.54 mg/g)高于感病品种贵妃杧(41.99 mg/g)。由可溶性总糖含量的变化规律来看,可溶性总糖含量变化与杧果抗病性呈正相关。

图1 不同品种杧果接种病菌后可溶性总糖含量的动态变化
2.2 不同品种杧果接种病菌后还原糖含量的动态变化
从图2可以看出,接种病原菌后对不同抗性杧果叶片还原糖含量均有一定影响。感病品种贵妃杧和抗病品种红杧6号的还原糖含量在接种后12~48 h均先上升后下降,随后均明显下降且低于对照,接种后144 h降至最低(分别是对照的0.53 和0.51倍),两个处理间差异不大,总体来看贵妃杧和红杧6号都呈下降趋势,从变化幅度水平看,与对照相比贵妃杧降幅较大,初步推测可能是贵妃杧由于病原菌的侵染,以还原糖作为碳源消耗的原因。从还原糖含量变化的规律来看,还原糖含量与抗病性呈正相关。

图2 不同品种杧果接种病菌后还原糖含量的动态变化
2.3 不同品种杧果接种病菌后游离氨基酸含量的动态变化
氨基酸是构成蛋白质的基本单位,是一项重要的生理指标,植物受到病原菌侵染后游离氨基酸含量会发生变化。由图3可知,红杧6号、贵妃杧接种后游离氨基酸含量均显著高于对照,均呈现先上升后下降的趋势。从游离氨基酸含量来看贵妃杧(每100 g 26.3 mg,FW)高于红杧6号(每100 g 26.13 mg,FW),差异不显著。但红杧6号氨基酸含量的增幅(135.86%)显著高于贵妃杧(78.56%)。从游离氨基酸含量的变化规律来看,游离氨基酸含量变化动态与抗病性呈正相关。

图3 不同品种杧果接种病菌后游离氨基酸含量的动态变化
2.4 不同品种杧果接种病菌后MDA含量的动态变化
植物细胞受病害胁迫会发生膜脂化氧化,MDA是其最终产物之一,其含量高低反映植物受害的程度。从图4可以看出,接种后红杧6号、贵妃杧的MDA含量均显著高于对照,两个杧果品种都呈现先上升后下降的趋势,且同时在接种后96 h达到最大值。从MDA含量来看,贵妃杧的MDA含量高于红杧6号,差异显著,说明膜脂化氧化损伤程度比红杧6号更严重。但红杧6号MDA含量的增幅在接种后12~48 h较高,而贵妃杧在接种后96~192 h增幅较高,这与接种病菌后寄主的显症时间相吻合,说明MDA与杧果抗细菌性角斑病密切相关。

图4 不同品种杧果接种病菌后MDA含量的动态变化
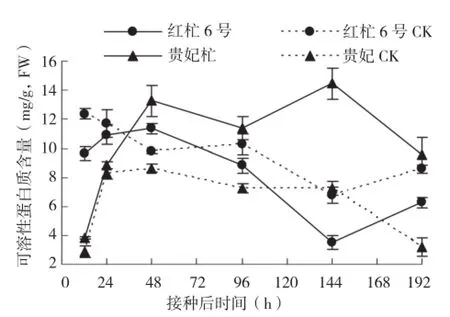
图5 不同品种杧果接种病菌后可溶性蛋白含量的动态变化
2.5 不同品种杧果接种病菌后可溶性蛋白含量的动态变化
蛋白质是一项重要的生理指标,植物受病原菌的侵染会引起植物体内蛋白质含量的变化。两个杧果品种植株叶片中可溶性蛋白含量变化如图5所示,接种后红杧6号的可溶性蛋白含量低于对照,呈下降的趋势;而贵妃杧的可溶性蛋白含量则高于对照。接种后12~48 h红杧6号的可溶性蛋白含量相对较平稳,而贵妃杧的可溶性蛋白含量则急剧上升且高于对照;接种后48~192 h红杧6号的可溶性蛋白含量急剧下降且低于对照,接种后144 h达到最低且比对照低94.55%,贵妃杧的可溶性蛋白含量则高于对照且保持较高水平。这可能是由于病原菌的侵入,导致寄主在抗病过程中消耗蛋白以供应能量,或使蛋白表达受阻,所以抗性品种红杧6号可溶性蛋白含量低于对照。从变化规律来看,蛋白质含量变化与抗病性呈负相关。
2.6 不同品种杧果接种病菌后H2O2含量的动态变化
从图6可以看出,接种后红杧6号、贵妃杧的H2O2含量均显著高于对照,红杧6号的H2O2含量在接种后24 h后达到一个峰值,显著高于对照,接种后48 h降低但仍高于对照,而后随着病原菌的入侵H2O2含量继续增加,贵妃杧的H2O2含量接种后继续上升,在接种后48 h达到峰值,比对照提高37.14%,差异达显著水平,随后H2O2含量相对较平稳。从整体含量上看,红杧6号的H2O2含量高于贵妃杧含量,红杧6号H2O2含量的平均增幅(51.9%)显著高于贵妃杧(26.25%),说明H2O2含量与抗病性密切相关且呈正相关。

图6 不同品种杧果接种病菌后H2O2含量的动态变化
2.7 不同品种杧果接种病菌后O2-·产生速率的动态变化
由图7可知,两种杧果品种接种后O2-·的产生速率都有所提高,红杧6号接种后12 h其O2-·产生速率显著高于对照,分别在接种后48 h和144 h达到峰值Ⅰ、峰值Ⅱ,峰值Ⅱ大于峰值Ⅰ,并且显著高于对照,接种后红杧6号的O2-·产生速率呈现先下降后上升循环的趋势。接种后96 h贵妃杧的O2-·产生速率显著高于对照,随后显著下降,192 h后又升高;贵妃杧的O2-·生产速率呈现出先下降后上升的趋势。两个处理间的O2-·生产速率相差不大,但红杧6号O2-·产生速率的增幅显著大于贵妃杧,说明O2-·产生速率与抗病性呈正相关。

图7 不同品种杧果接种病菌后O2-·产生速率的动态变化
3 结论与讨论
病原菌侵染植物后,寄主体内会发生一系列的生理代谢变化,如体内碳水化合物、氨基酸、蛋白质等的含量都会发生变化,而这些变化与植物抗病性有着密切关系[1-4]。糖作为植物本身各类代谢的物质和能量来源,也可以作为病原菌的营养来源。糖含量与植物的抗病性有一定关系[1],有报道认为糖含量越高越抗病[16],有研究发现含糖量越高越有利于病害发生[17],但也有学者认为糖含量与抗病性没有相关性[18]。蛋白质是基因表达的产物,同时也是植物性状表现的物质基础,蛋白质含量与品种抗病性有一定关系。李佐同等[19]认为可溶性蛋白含量与抗病性呈正相关,郭陞垚等[20]则认为蛋白质含量与抗病性呈负相关。氨基酸作为蛋白质的基本组成单位,是一切生命存在的基石,参与到所有生命,因此植物生长发育离不开氨基酸。杨辉等[21]认为氨基酸含量与抗病性呈正相关,胡莉莉[22]研究发现氨基酸含量与抗病性呈负相关,而张淑红[23]则认为氨基酸与抗病性不相关。当植物细胞受到严重破坏后产生活性氧进而发生膜质过氧化反应,MDA含量会提高[24],其含量高低反映植物受害程度。有研究发现MDA含量与抗病性呈负相关[25],也有研究发现其与抗病性呈正相关[26]。正常情况下,植物体内的活性氧浓度极低且处于一种动态平衡状态,当受到病原物胁迫后其失去平衡,造成活性氧的大量积累,称为氧迸发[27]。植物体内所产生的活性氧与植物抗病性密切相关[28],曾永三等[29]研究发现抗病品种的O2-·产生速率小于感病品种,王晨芳等[30]研究发现抗性品种的H2O2含量以及O2-·产生速率均高于感病品种。由此可见这些生理指标与寄主抗病性有着重要的关系。
本研究结果表明,不同抗性杧果品种感病后还原糖含量、可溶性总糖含量均小于对照,且感病品种降幅均大于抗病品种,与王玲平[31]研究结果相似。这可能是由于病原菌的入侵使作为营养物质的糖被消耗,说明糖含量越高越抗病;也可能与杧果机体自身和不同病原菌有关,也有可能是在杧果与病原菌的互作过程中,糖相关代 谢基因被抑制的结果,这有待进一步深入研究。接种后不同品种杧果叶片内MDA含量均高于对照,感病品种的MDA含量显著高于抗病品种。接种后12~48 h抗病品种MDA含量的增幅大于感病品种,接种后96~192 h感病品种MDA含量的增幅大于抗病品种。这可能是因为接种前期由于受病原菌的侵染,抗病品种机体中大量产生活性氧,导致机体发生过敏反应而表现为抗病,使得MDA大幅增加。随着发病时间的推移,感病品种的MDA含量较高且增幅较大,说明感病品种受损害程度比较严重,MDA含量变化与杧果抗病性呈负相关,与陆君[25]的研究结果一致。接种后感病品种的可溶性蛋白含量均高于对照,而抗病品种的可溶性蛋白含量则低于对照。可溶性蛋白含量与抗病性呈负相关,与张淑红[23]研究结果相似。一方面,可能是病原菌刺激了机体蛋白质的降解,降解产物有可能参与其他代谢途径,阻止病害发生,从而表现为抗病;另一方面,也可能是感病品种由于病原菌的入侵,抗病基因表达受到抑制,而寄主与细菌性角斑病菌相互作用的蛋白有可能是致病蛋白,也可能与机体自身有关,这有待进一步深入研究。不同抗性杧果品种接种后H2O2含量及O2-·产生速率均高于对照,抗病品种叶片中的H2O2含量显著高于感病品种,且抗病品种H2O2含量的增幅显著高于感病品种,而抗病品种的O2-· 产生速率增幅显著高于感病品种,这与王晨芳等[30]研究结果相似。这推测可能是抗病品种与病原菌互作产生大量的活性氧,从而发生过敏性细胞死亡反应,限制了病原菌的进一步扩散,从而表现为抗病;感病品种未发生过敏反应从而表现为感病。
本研究发现了不同抗性杧果受X.campestris pv.mangiferaeindicae侵染后还原糖、可溶性糖、氨基酸、H2O2、O2-·、MDA和可溶性蛋白含量的变化过程与杧果抗细菌性角斑病的关系,结果表明:还原糖、可溶性总糖、氨基酸、H2O2和O2-·的变化与杧果抗病性呈正相关,MDA和可溶性蛋白的变化与杧果抗病性呈负相关。初步确定这些指标与杧果抗病性有密切的联系,而寄主对病原物的抗性是由一系列生理生化过程决定的,抗性与寄主体内的多种化合物种类及其含量有关。要全面了解抗病性的生理生化机制,还需要从包括酶、酚类以及核酸等多种生化组分的作用进一步开展研究,为抗病育种提供相关理论基础。
[1]Olson A,Aert A,Asiegbu F,et al.Insight into tradeoff between wood decay and parasitism from the genome of a fungal forest pathogen[J].New Phytologist,2012,194(4):1001-1013.
[2]Taheri P,Tarighi S.A survey on basal resistance and riboflavin-induced defense responses of sugar beet against Rhizoctonia solani[J].Journal of Plant Physiology,2011,168:1114-1122.
[3]Sels J,Mathys J,De C B,et al.Plant pathogenesisrelated(Pr)proteins:A focus on Pr peptides[J].Plant Physiology and Biochemistry,2008,46(11):941-950.
[4]张笑宇.马铃薯抗黑痣病鉴定技术及其抗病机制研究[D].呼和浩特市:内蒙古农业大学,2012.
[5]丁九敏,高洪斌,刘玉石,等.黄瓜霜霉病抗性与叶片中生理生化物质含量关系的研究[J].辽宁农业科学,2005(1):11-13.
[6]漆艳香,谢艺贤,蒲金基,等.海南省杧果细菌性黑斑病原菌生理生化特性初步研究[J].中国农学通报,2014,30(28):301-305.
[7]Pruvost O,Couteau A,Perrier X,et al.Phenotypic diversity of Xanthomonas sp.Mangiferaeindicae[J].Journal of Applied Microbiology,1998,84:115-124.
[8]何汉生,董春,朱彬年,等.杧果细菌性黑斑病的发生与防治研究初报[J].广东农业科学,1996(6):35-37.
[9]漆艳香,谢艺贤,蒲金基,等.杧果细菌性黑斑病研究现状及展望[J].中国南方果树,2014,43(6):27-31.
[10]Midha S,Ranjan M,Sharma V,et al.Genome sequence of Xanthomonas citri pv.mangiferaeindcae Strain LMG 941[J].Journal of Bacteriology,2012,194(11):3031.
[11]Pruvost O,Verniere C,Vital K,et al.Insertion sequence and tandem repeat-based genotyping techniquce for Xanthomonas citri pv.Mangiferaeindicae [J].Phytopathology,2011,101(7):887-893.
[12]林植芳,李双顺,林桂珠,等.衰老叶片和叶绿体中H2O2的累积与膜脂化氧化的关系[J].植物生理学通讯,1988,14(1):16-22.
[13]王爱国,罗广华.植物的超氧物自由基与羟胺反应的定量关系[J].植物生理学通讯,1990(6):55-57.
[14]高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2006.
[15]Wang Y L,Wang X D,Zhao B,et al.Reduction of hyperhydricity in the culture of Lepidium meyenii shoots by the addition of rare earth elements[J].Plant Growth Regulation,2007,52(2):151-159.
[16]田丽波,商桑,司龙亭,等.苦瓜对白粉病的抗性与相关生理生化指标的关系[J].西北农业学报,2015,24(9):166-173.
[17]朱键鑫.黄瓜不同品种对白粉病的抗性研究[D].扬州:扬州大学,2008.
[18]刘会宁,李从玉.6个生理生化指标与葡萄抗白粉病的关系[J].中国南方果树,2015,44(5):79-82.
[19]李佐同,靳学慧,张亚玲,等.水稻幼苗可溶性糖及可溶性蛋白含量与抗瘟性的关系[J].北方水稻,2009,39(4):6-9.
[20]郭陞垚,陈剑洪,肖宇,等.不同抗性花生品种接种疮痂病菌后其生理特征及产量的变化[J].中国农学通报,2015,31(9):88-92.
[21]杨辉,沈火林,张煜.黄瓜花叶病毒诱导辣椒抗病性的生化变化研究[J].西北农业学报,2006,15 (6):221-224.
[22]胡莉莉.香蕉抗枯萎病生理生化基础的研究[D].海口:华南热带农业大学,2006.
[23]张淑红.枣树抗枣疯病生理机制的研究[D].保定:河北农业大学,2004.
[24]王生荣,朱克恭.植物系统获得抗病性研究进展[J].中国生态农业学报,2002,10(2):32-35.
[25]陆君.稻曲病菌与水稻互作的初步研究[D].武汉:华中农业大学,2013.
[26]姜慎.34个水稻品种对稻曲病的抗性评价及抗相关稻曲病的生化分析[D].海口:海南大学,2010.
[27]郑文宇,丁筑红,刘程,等.“花壳”病毒对辣椒防疫系统的影响[J].植物生理学报,2013,49(4):357-361.
[28]柳凤,欧雄常,詹儒林,等.Fusarium mangiferae对杧果顶芽内活性氧代谢的影响[J].果树学报,2015,32(1):94-99.
[29]曾永三,王振中.豇豆与绣菌互作中的活性氧代谢研究[J].植物病理学报,2004,34(2):146-153.
[30]王晨芳,黄丽丽,张宏昌,等.小麦条锈菌互作过程中活性氧及保护酶系的变化研究[J].植物病理学报,2009,39(1):52-60.
[31]王玲平.黄瓜感染枯萎病菌后生理生化变化及其与抗病性关系的研究[D].太谷:山西农业大学,2001.
(责任编辑 张辉玲)
Physiological metabolic changes of mango infected by bacterial leaf spot pathogen
ZHENG Lei1,2,ZHAN Ru-lin2,LIU Feng2,LI Guo-ping2,ZHAO Yan-long2,CHANG Jin-mei2,HE Yan-biao2
(1.College of Environment and Plant Protection,Hainan University,Haikou 570228,China;2.South Asia Tropical Crop Research Institute,Chinese Academy of Tropical Agricultural Sciences,Zhanjiang 524091,China)
To explore the relationship of resistance to bacterial angular leaf spot in mango and changes of its physiological parameters,we tested the contents of superoxide anion (O2-·),hydrogen perox-ide,total soluble sugars,reducing sugars,free amino acids,soluble proteins and malondialdehyde (MDA) in mango leaves of No.6 Hongmango (resistance) and Guifeimango (susceptible).It indicated that mango infected by X.campestris pv.mangiferaeindicae,the changes of the contents of its superoxide anion (O2-·),hydrogen peroxide (H2O2),total soluble sugars,reducing sugars and free amino acids were positively correlated with mango resistance,malondialdehyde (MDA) and soluble proteins were negatively correlated with mango resistance.After X.campestris pv.mangiferaeindicae infected mango,variation from the contents of its superoxide anion (O2-·) production rate,hydrogen perox-ide (H2O2),total soluble sugars,reducing sugars,free amino acids,soluble proteins and malondialdehyde (MDA) were closely related to the mango resistance.They were initially identified as resistant physiological indexes,and could be used as auxiliary indicators of the disease prevention,control and breeding.
mango;bacterial leaf spot;resistance;biochemicals;carbohydrate;reactive oxygen species
S667.7
A
1004-874X(2016)04-0067-06
10.16768/j.issn.1004-874X.2016.04.014
2015-11-11
中央级非盈利性研究机构基本科研业务费研究专项(1630062014007);海南省自然科学基金(20163109)
郑磊(1988-),男,在读硕士生,E-mail:1210043316@qq.com
柳凤(1984-),女,博士,助理研究员,E-mail:liufengneau@163.com
