洞悉工艺流程命题的“三板斧”破解工艺流程试题的“四步曲”
2016-08-04王民会
王民会
工艺流程题利用陌生度高、信息量大、综合性强这“三板斧”将考生的分数拉开,是区分度较高的试题。现从工艺流程题的命题特点和工艺流程题的解题技巧两个方面进行探讨,以期帮助考生走出困境。
一、工艺流程题命题的“三板斧”
第一板斧:陌生度高——“吓退”考生
1.题干陌生:在高考有限的时间内,考生都不愿意进入一个陌生的环境,而陌生物质的制备或探究,让考生从心理上产生畏惧感,导致思维受阻。
2.图框陌生:酸浸、反萃取等等,专业术语一大堆,看不懂,想不明白,让人望而生畏。总之,陌生的物质制备,陌生的工艺流程,体现考查的公平性,考查考生化学基本功和心理素质。
第二板斧:信息量大——“烦死”考生
1.文字多:题干和问题设置一般500字左右,图框的篇幅约占200字~300字。
2.步骤多:工艺流程题中流程图一般5步~8步;专业术语多,或明或暗陷阱多,考生读不懂,无法一步一步按部就班进行推导。
3.知识超纲,信息多:学生读不懂,必须借助文字、图表信息等,考查学生的信息提取能力。
信息量大,导致考生在高考这个时间紧,任务重的特殊环境中,无法精心读题和吸收信息,望而生畏,草草撤兵,导致得分不高。
第三板斧:综合性强——难住考生
分离提纯、化学原理、实验设计、基本操作和元素化合物知识融合为一体,能力要求高,考查考生的分析推断和综合运用知识的能力。通过计算、实验条件的控制和陌生方程式的书写拉开考生的分数。
二、破解工艺流程题的四步曲
第一步:明白从哪里来,到哪里去
1.试题背景陌生,但是题干中目的表述很明确,所以快速浏览题干,知道流程目的,明白从哪里来,到哪里去即可,不必关注过程。
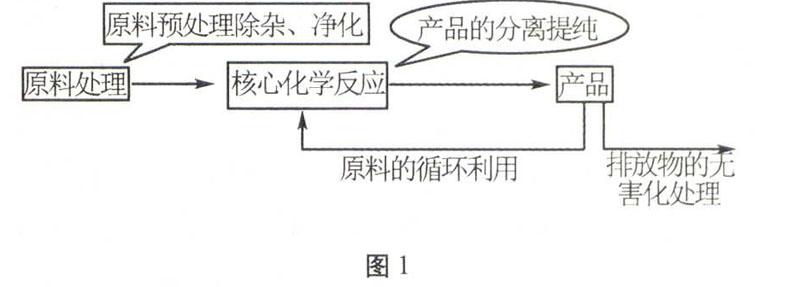
2.从纷繁复杂的试题中抽象概括,可以看到工艺流程题的结构特点(如图1所示)。审题思路是主线主产品,分支副产品,回头为循环。
图1高考试题都是“纸老虎”,“高考要求较高的信度、效度,必要的区分度和适当的难度”,所以高考试题是戴着“镣铐”命题,既要体现选拔性,又要达到一定的优秀率和及格率,导致很多设问是孤立的,一些设问是送分的,一个问题解决不了不影响下一个问题的解决;6个设问中必须用到流程图的一般不超过3个,其他设问一般可以直接作答。
第二步:“难得糊涂”
文字多、信息多、专业术语多,步骤多,面对“图框”中的这个具体过程要“难得糊涂”,命题人不想让你在短短几分钟内将图框读的明明白白,你就不必非读明白不可,不必一步步推导出来。注意:万不可在这个“图框”的城池下,屯兵太久,耗费大量精力,尤其有些框图,只有流程,在每一个阶段并没有物质出现时,可以绕过图框,直奔问题。带着问题,研究图框局部。
第三步:山重水复疑无路,柳暗花明又一村
带着问题,直接研究图框局部,有些问题感觉有多种可能或无从下手时,一定要关注信息。因为图框复杂,多处超纲,超纲之处如果考你,必有提示,此时关注信息最合适,有“山重水复疑无路,柳暗花明又一村”的感觉。如果开始就关注信息,自己读不懂,还浪费时间。
第四步:借问酒家何处有,牧童遥指杏花村
物质的分离提纯是一步一步进行的,面对多种离子,当你无法判断哪一种离子进入溶液,哪一种留在滤渣中时,可以借助“借问酒家何处有,牧童遥指杏花村”,瞻前顾后的首尾分析法可解决这个问题。
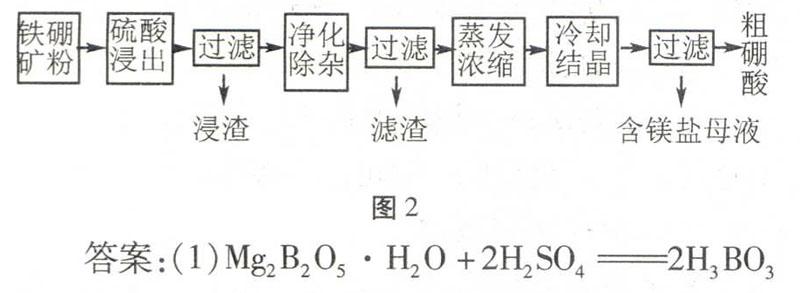
例1(2015年新课标Ⅰ)硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图2所示回答问题。(1)写出Mg2B2O5·H2O与硫酸反应的化学方程式。为提高浸出速率,除适当增加硫酸浓度外,还可采取的措施有(写出两条)。(2)利用的磁性,可将其从“浸渣”中分离。“浸渣”中还剩余的物质是(化学式)。(3)“净化除杂”需先加H2O2溶液,作用是。然后再调节溶液的pH约为5,目的是。(4)“粗硼酸”中的主要杂质是(填名称)。(5)以硼酸为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂,其电子式为。(6)单质硼可用于生成具有优良抗冲击性能硼钢。以硼酸和金属镁为原料可制备单质硼,用化学方程式表示制备过程。
图2答案:(1)Mg2B2O5·H2O+2H2SO42H3BO3+2MgSO4。升高温度;将矿石粉碎,增大矿石的接触面积。(2)Fe3O4,CaSO4和SiO2。(3)将Fe2+氧化为Fe3+;使Al3+和Fe3+完全沉淀。(4)(七水)硫酸镁。(5)Na+HH∶B····∶HH-。(6) 2H3BO3△B2O3+3H2OB2O3+3Mg△2B+3MgO
解析第(1)问:根据题干由Mg2B2O5·H2O制取硼酸,通过分析反应物和生成物中各元素的化合价没有发生变化,一般情况下发生复分解反应,且得到硼酸的操作为过滤,可知硼酸难溶于水,可得方程式为:
Mg2B2O5·H2O+2H2SO42H3BO3+2MgSO4
提高浸出速率,可从加快反应速率角度作答:升高温度、增大浓度、增大接触面积等。部分考生答:增大压强或加入催化剂。这时注意:将物质放入到硫酸溶解,一般不需要增大压强和加入催化剂。第(5)问:NaBH4的电子式:Na只有+1价,从信息“它是有机合成中的重要还原剂”分析H为-1价,B为+3价,含有钠离子为离子化合物,可得电子式Na+HH∶B····∶HH-。第(6)问:以硼酸类比H3AlO3(即Al(OH)3)受热易分解的特点和铝热反应可得方程式。第(2)问:关注题干信息,学过Fe3O4为磁性氧化铁;SiO2 与硫酸不反应,为滤渣,考生易漏掉CaSO4,题干信息中有CaO,用硫酸酸浸,生成微溶物CaSO4。第(3)问:在图框中与H2O2溶液反应的只有Fe2+,所以其作用是Fe2+氧化为Fe3+。第(4)问:得到“粗硼酸”时,过滤,有镁盐的母液滤出,可判断是镁盐,再根据前面用硫酸酸浸来判断是硫酸镁。
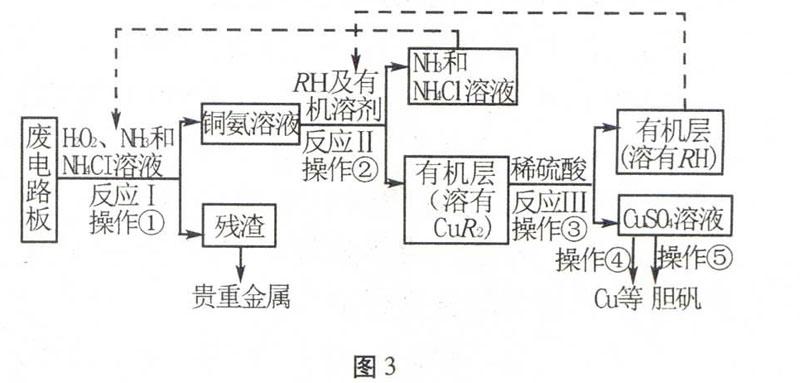
例2(2015年天津)废旧印刷电路板是一种电子废弃物,其中铜的含量达到矿石中的几十倍。湿法技术是将粉碎的印刷电路板经溶解、萃取、电解等操作得到纯铜等产品。某化学小组模拟该方法回收铜和制取胆矾,流程简图如图3。
图3回答下列问题:图4(1)反应Ⅰ是将Cu转化为Cu(NH3)2+4,反应中H2O2 的作用是 。写出操作①的名称: 。(2)反应Ⅱ是铜氨溶液中的Cu(NH3)2+4与有机物RH反应,写出该反应的离子方程式:。操作②用到的主要仪器名称为,其目的是(填序号)。
a.富集铜元素;b.使铜元素与水溶液中的物质分离;c.增加Cu2+在水中的溶解度。
(3)反应Ⅲ是有机溶液中的CuR2与稀硫酸反应生成CuSO4和 。若操作③使用图4装置,图中存在的错误是 。
(4)操作④以石墨作电极电解CuSO4 溶液。阴极析出铜,阳极产物是 。操作⑤由硫酸铜
溶液制胆矾的主要步骤是 。
(5)流程中有三次实现了试剂的循环使用,已用虚线标出两处,第三处的试剂是 。循环使用的NH4Cl在反应Ⅰ中的主要作用是。
答案:(1)作氧化剂过滤(2)Cu(NH3)2+4+2RH2NH+4+2NH3+CuR2 分液漏斗 a b(3)RH 分液漏斗尖端未紧靠烧杯内壁 液体过多(4)O2 H2SO4 加热浓缩 冷却结晶 过滤(5)H2SO4 防止由于溶液中的c(OH-)过高,生成Cu(OH)2沉淀
解析第(1)问:反应Ⅰ是将Cu转化为Cu(NH3)2+4,Cu被氧化,需要氧化剂,而NH3 、NH4Cl和H2O2比较,H2O2做氧化剂合适。操作①是把滤渣和液体分离,所以操作为过滤。第(2)问:是一个陌生的离子方程式,在图框中根据箭头的方向寻找反应物(Cu(NH3)2+4与有机物RH)和生成物(NH4Cl、NH3、有机层CuR2),此五种物质中只有NH4Cl可以拆开且反应物中无Cl-,书写可得方程式。操作②是把水层和有机层分离,所以为分液操作,主要仪器为分液漏斗;铜元素富集在有机层,所以该操作的目的是富集铜元素,使铜元素与水溶液中的物质分离。而不影响Cu2+在水中的溶解度。第(3)问:根据图框中箭头提示,反应物是CuR2与稀硫酸,反应生成物是CuSO4和RH; 第(5)问:循环使用的物质必然是在图框中加入的物质,而在此图框中只加入了三次物质,第一次是:NH3、NH4Cl和H2O2,第二次是: RH和有机溶剂,第三次是:稀硫酸。前两次的物质均已循环利用,第三处的试剂只能是稀硫酸。
(收稿日期:2016-01-15)
