血管分叉处无残端慢性闭塞病变前向开通新方法:斑块挤压碎裂开通技术
——附2例报告
2016-08-04姜东炬胡高频付荣贾玉琳
姜东炬 胡高频 付荣 贾玉琳
·病例报告·
血管分叉处无残端慢性闭塞病变前向开通新方法:斑块挤压碎裂开通技术
——附2例报告
姜东炬胡高频付荣贾玉琳
116021辽宁大连,解放军第210医院心内科,沈阳军区大连心血管内科疾病诊疗中心
【关键词】经皮冠状动脉介入治疗;血管分叉部位;慢性闭塞;无残端;斑块挤压
一般认为,当慢性完全闭塞(CTO)病变位于血管分叉部位且于另一主支或分支开口处没有残端时,导丝很容易进入另一主支或分支,是前向导丝技术成功率低的重要冠状动脉解剖结构特点之一[1]。笔者经过探索,提出一种在上述CTO病变情况下可以提高前向导丝技术成功率的新方法:血管分叉处无残端CTO病变斑块挤压碎裂开通技术,并通过以下2例报告介绍该方法。
1临床资料
1.1病例1
患者男,55岁。因“间断劳累性胸痛1年”入解放军第210医院。半个月前因突发剧烈胸痛诊断为急性下壁ST段抬高心肌梗死并行急诊经皮冠状动脉介入治疗(PCI),开通梗死相关血管左回旋支(LCX)并置入1枚支架,左前降支(LAD)中段为CTO病变,右冠状动脉(RCA)未见明显狭窄病变。既往高血压病史5年,无糖尿病史。吸烟史10年(20支/d)。无特殊家族史。入院时血压140/90 mmHg(1 mmHg=0.133 kPa),双肺未闻及干、湿啰音,心率73次/min,律齐,各瓣膜未闻及病理性杂音。实验室检查:低密度脂蛋白胆固醇(LDL-C)3.2 mmol/L,其余指标均正常。入院心电图示:窦性心律,Ⅱ、Ⅲ、aVF导联见病理性Q波,Ⅱ、Ⅲ、aVF、V3~V6导联ST段下移,T波倒置。超声心动图示:左心系统略增大,右心系统正常,左心室前壁、下壁运动幅度减低,左心室射血分数49%。诊断:冠心病,下壁心肌梗死(近期),高血压病(3级)。

图1 箭头示LAD于D1发出处闭塞,无残端;图2 箭头示球囊扩张LAD-D1分叉部位后撤回指引导管内;图3 箭头示采用微导管tip-injction技术证实导丝通过LAD闭塞段进入D2血管真腔;图4 LAD闭塞病变处置入Firebird 2.75 mm×30 mm支架,血管开通;LAD,左前降支;D1,第一对角支;D2,第二对角支
入院后继续给予口服阿司匹林(拜阿司匹林)100 mg、每日1次,硫酸氢氯吡格雷(泰嘉)75 mg、每日1次,以及冠心病二级预防用药,并决定行LAD-CTO病变PCI。经右侧桡动脉送入6 F EBU 3.5指引导管至左冠状动脉开口,造影显示LCX支架良好,支架内无再狭窄或血栓病变,LAD中断CTO病变处有第一对角支(D1)发出,无明显残端(图1)。试用pilot150、miracle6导丝均无法进入闭塞段,导丝反复滑入D1。沿滑入D1的pilot150导丝送入Apex 2.0 mm×15 mm球囊(美国波士顿科学公司),球囊远端1/3进入对角支,以10~12 atm(1 atm=101.325 kPa)对LAD-D1分叉部位扩张2次,再调整pilot150导丝顺利通过LAD闭塞病变段进入其远端,沿导丝送入Finecross微导管采用tip-injection技术确认导丝远端位于第二对角支(D2)真腔,沿微导管送入Runthrough导丝并将其调整到LAD远端(图2~3)。扩张LAD闭塞病变段后置入Firebird 2.75 mm×30 mm支架(图4)。术后患者劳累性胸痛症状缓解。1.2病例2
患者男,64岁。因“反复劳累性胸痛半年,加重1周”入解放军第210医院。既往高血压病史10年,无糖尿病史。吸烟40年(20~40支/d)。无特殊家族史。入院时血压145/90 mmHg,双肺未闻及干、湿啰音,心率80次/min,律齐,各瓣膜未闻及病理性杂音。实验室检查:LDL-C 4.0 mmol/L,估算的肾小球滤过率(eGFR)50 ml/mim,其余指标均正常。心电图示:窦性心律,Ⅰ、aVL、Ⅱ、Ⅲ、aVF、V2~V6导联ST段下移,aVR导联ST段抬高。超声心动图示:各房室腔大小正常,室间隔厚度13 mm,左心室前壁运动幅度减低,左心室射血分数50%。诊断:冠心病,不稳定型心绞痛,高血压病(3级),高血压心脏病。
入院后给予口服阿司匹林(拜阿司匹林)100 mg、每日1次,硫酸氢氯吡格雷(泰嘉)75 mg、每日1次,磺达肝癸钠2.5 mg、每日1次皮下注射,以及冠心病二级预防用药基础上行冠状动脉造影检查。造影示严重三支血管病变,左主干(LM)末端狭窄90%,LAD及LCX开口为CTO病变,中间支开口狭窄99%,TIMI血流I级(图5),RCA开口至近端狭窄80%~90%,左心室后侧支(PLA)近端狭窄70%,左心室后降支(PDA)开口至近端狭窄80%,PLA及PDA向LAD闭塞段以远发出侧支循环(图6)。在患者及家属拒绝接受冠状动脉旁路移植术后决定行PCI。经右侧桡动脉送入6 F BL3.0指引导管至左冠状动脉开口,拟首先开通LAD,但由于LAD开口无明显残端,试用Runthrough及pilot150导丝均无法进入LAD闭塞段,反复滑入中间支(图7)。沿滑入中间支的Runthrough导丝送入Apex 2.5 mm×20 mm球囊,球囊远端1/3进入中间支,近端2/3位于LM内,以12 atm进行扩张后回撤球囊至指引导管内,造影见LAD、LCX同时开通,TIMI血流Ⅲ级,在反复调整导丝进入LAD未成功情况下,调整导丝进入LCX(图8),沿导丝送入Apex 2.5 mm×20 mm球囊,以16 atm预扩张LM-LCX病变后,采用Crossover技术于LM-LCX置入Buma 3.0 mm×30 mm支架(图9)。术后患者胸痛症状显著减轻。其余血管病变拟择期行PCI。
2讨论
CTO病变一般是指冠状动脉完全闭塞时间超过3个月的病变[2]。资料显示,成功开通CTO病变可能使患者获益,包括缓解心绞痛症状[3]、提高运动耐量[4]和左心室射血分数[5]、改善患者对急性冠状动脉综合征的耐受力[6]及预后[7]。但与非闭塞病变相比,CTO手术成功率低。目前,CTO病变PCI治疗失败的主要原因仍为导丝不能成功通过闭塞病变。尽管逆向导丝技术的应用明显提高了CTO病变PCI治疗的成功率[8],但与前向导丝技术比较,逆向导丝技术对术者及导管室器械要求条件高且放射线剂量和对比剂用量较大[9],所以大多数情况下前向导丝技术仍为首选。但当CTO病变位于血管分叉部位且于另一主支或分支开口处没有残端时,导丝很容易进入另一主支或分支,前向导丝技术成功率低。尽管在这种情况下可以采用血管内超声指导下定向穿刺技术或在靶血管存在合适的侧支循环时采用逆向导丝技术等方法,但均增加了技术难度。
本文报告病例中所采用的血管分叉处无残端CTO病变斑块挤压碎裂开通技术,为前向开通CTO病变提供了新的方法。CTO病变处边支的存在不但不是前向导丝技术成功率低的标志,反而为血管分叉处无残端CTO病变斑块挤压碎裂开通技术提供了解剖基础。该方法具体操作步骤为:(1)在导丝不能进入CTO病变的情况下将软导丝送入分叉处另一主支或边支(图10)。(2)沿导丝送入挤压CTO斑块球囊,球囊直径与分叉处另一主支或边支口部直径比值,当口部无病变时为1.25∶1,口部有病变时为1∶1,以保证球囊既对CTO病变近端纤维帽产生足够的挤压作用使其碎裂,又不至于导致另一主支或分支过度损伤。本文2例患者选择的挤压球囊直径与边支口部直径比值约为1.25∶1,球囊远端1/3~1/2置于另一主支或边支内,以6~12 atm对另一主支或边支口部进行扩张,以挤压CTO病变近端纤维帽使其斑块碎裂(图11~12)。(3)送入另一根导丝,导丝特点根据斑块撕裂情况进行选择,沿撕裂出斑块的腔隙通过CTO病变(图13)。
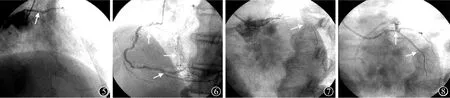
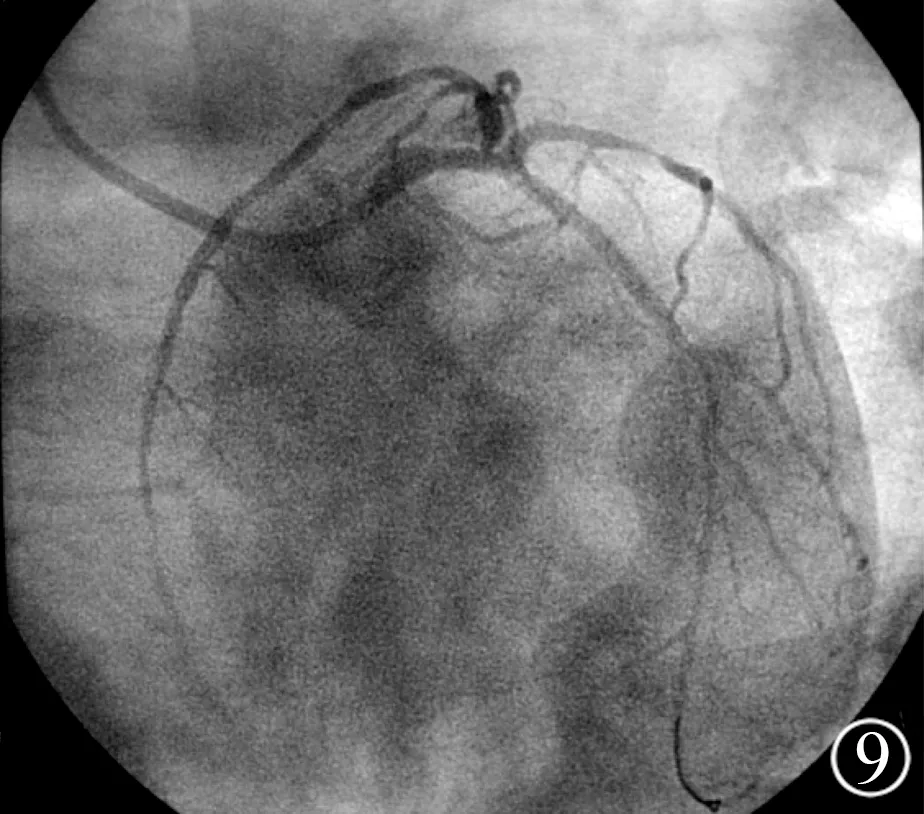
图5LM末端狭窄90%,LAD及LCX开口为CTO病变,中间支开口狭窄99%,TIMI血流Ⅰ级;图6 RCA开口至近端狭窄80%~90%,PLA近端狭窄70%,PDA开口至近端狭窄80%,PLA及PDA向LAD闭塞段以远发出侧支循环;图7LAD开口无明显残端,试用Runthrough及pilot150导丝无法进入LAD闭塞段,反复滑入中间支;图8沿滑入中间支的Runthrough导丝送入Apex 2.5 mm×20 mm球囊,球囊远端1/3进入中间支,近端2/3位于LM内,以12 atm进行扩张后回撤球囊至指引导管内,造影见LAD、LCX同时开通,TIMI血流Ⅲ级,在反复调整导丝进入LAD未成功情况下,调整导丝进入LCX;图9沿导丝送入Apex 2.5 mm×20 mm球囊以16 atm预扩张LM-LCX病变后,采用Crossover技术于LM-LCX置入Buma 3.0 mm×30 mm支架;LM,左主干;LAD,左前降支;LCX,左回旋支;CTO,慢性完全闭塞;PLA,左心室后侧支;PDA,左心室后降支;1 atm=101.325 kPa
血管分叉处无残端CTO病变斑块挤压碎裂开通技术的优点在于使原本复杂的PCI问题变得简单化且相对安全,如果CTO病变无残端处另一主支或分支在球囊斑块挤压时受损,必要情况下也可以及时置入支架,避免严重后果发生。

图10 在导丝不能进入慢性完全闭塞(CTO)病变的情况下将软导丝送入分叉处另一主支或边支;图11~12 沿导丝送入挤压CTO斑块球囊,球囊直径与分叉处另一主支或边支口部直径比值,当口部无病变时为1.25∶1,口部有病变时为1∶1,球囊远端1/3~1/2置于另一主支或边支内,以6~12 atm(1 atm=101.325 kPa)对另一主支或边支口部进行扩张,以挤压CTO病变近端纤维帽使其斑块碎裂;图13 送入另一根导丝,沿撕裂出斑块的腔隙通过CTO病变
参考文献
[1] 葛均波,葛雷. 冠状动脉慢性完全闭塞病变介入治疗. 北京:人民卫生出版社,2009:15.
[2] Stone GW, Kandzari DE, Mehran R, et al. Percutaneous recanalization of chronically occluded coronary arteries: a consensus document: Part I. Circulation, 2005,112(15):2364-2372.
[3] Grantham JA, Jones PG, Cannon L, et al. Quantifying the early health status benefits of successful chronic total occlusion recanalization: Results from the FlowCardia's Approach to Chronic Total Occlusion Recanalization (FACTOR) Trial. Circ Cardiovasc Qual Occlusions, 2010, 3(3):284-290.
[4] Finci L, Meier B, Favre J, et al. Long-term results of successful and failed angioplasty for chronic total coronary arterial occlusion. Am J Cardiol, 1990,66(7):660-662.
[5] Baks T, van Geuns RL, Duncker DJ, et al. Prediction of left ventricular function after drug-eluting stent implantation for chronic total coronary occlusions. J Am Coll Cardiol, 2006,47(4):721-725.
[6] Claessen BE, van der Schaaf RJ, Verouden NJ, et al. Evaluation of the effect of a concurrent chronic total occlusion on long-term mortality and left ventricular function in patients after primary percutaneous coronary intervention. JACC Cardiovasc Interv, 2009,2(11):1128-1134.
[7] Joyal D, Afilalo J, Rinfret S. Effectiveness of recanalization of chronic total occlusions: a systematic review and meta-analysis. Am Heart J, 2010, 160(1):179-187.
[8] 李成祥. 冠状动脉慢性闭塞病变的逆向技术. 中国介入心脏病学杂志, 2014,22(10): 675-680.
[9] Galassi AR, Tomasello SD, Reifart N, et al. In-hospital outcomes of percutaneous coronary intervention in patients with chronic total occlusion: insights from the ERCTO (European Registry of Chronic Total Occlusion) registry. EuroIntervention,2011,7(4):472-479.
DOI:10.3969/j.issn.1004-8812.2016.04.015
通信作者:姜东炬,Email:jiangdj1962@126.com
【中图分类号】R541.4
(收稿日期:2016-01-02)
