黑曲霉F5菌株产高温糖化酶的液体发酵优化分析
2016-08-03常吕珍杨云娟张润美李万军牟兴玲黄遵锡唐湘华
常吕珍,杨云娟,2,张润美,李万军,牟兴玲,黄遵锡,2,唐湘华,2
(1.云南师范大学生命科学学院,云南昆明650500; 2.云南省生物质能与环境生物技术重点实验室,云南昆明650500)
黑曲霉F5菌株产高温糖化酶的液体发酵优化分析
常吕珍1,杨云娟1,2,张润美1,李万军1,牟兴玲1,黄遵锡1,2,唐湘华1,2
(1.云南师范大学生命科学学院,云南昆明650500; 2.云南省生物质能与环境生物技术重点实验室,云南昆明650500)
摘要:实验通过对黑曲霉F5菌株进行了温度、pH值、碳源、氮源、磷酸盐的筛选及正交优化,结果表明,发酵培养基最优条件为:30%马铃薯汁,2%蛋白胨,0.4%磷酸二氢铵,pH4.5,在30℃下发酵培养4 d糖化酶活力达到87.3 IU/mL;糖化酶的最适反应温度为65℃,pH5.0。
关键词:黑曲霉; 糖化酶; 筛选; 优化
糖化酶(Glucoamylase,EC 3.2.1.1)又名葡萄糖淀粉酶,是一种酸性糖苷水解酶,从淀粉或者淀粉类似物的非还原端按顺序切开α-1,4糖苷键,也能水解α-1,6糖苷键、α-1,3糖苷键,产生葡萄糖。一般淀粉水解程度达80%。目前,糖化酶被广泛用于燃料乙醇、固态白酒、抗生素、有机酸、淀粉糖、饲料行业,是应用和工业酶学领域使用最广泛的酶制剂之一[1-4]。而黑曲霉则是生产糖化酶的重要菌株之一[5-6]。多年来,糖化酶的研究工作多集中在产酶能力的选育、基因分子水平的改造和发酵条件的优化。梁新红[7]、宋水山[8]、陈冠军[9]等人对黑曲霉产糖化酶的研究中获得不同变异菌株黑曲霉代谢分泌形成的糖化酶最适反应温度在40~60℃,但用于工业化生产时多在40℃条件下进行。本实验工作采用自行筛选的黑曲霉F5进行产高温糖化酶的研究,力图在云南固态发酵小曲酒工艺中进行糖化工艺的调整,采用高温糖化酶加速原料的预处理,再接种根霉提高根霉的糖化效率,使酵母代谢途径加速流向酒精发酵终端。
本研究针对产高温糖化酶的黑曲霉F5菌株进行了温度、pH值、碳源、氮源、磷酸盐[10-13]的优化实验,以期望寻找耐酸、耐高温的糖化酶用于淀粉质原料预处理,降低能耗,提高DE值,简化生产工艺。
1 材料与方法
1.1材料及仪器
实验菌株:黑曲霉F5来自富士山火山口土样,由云南师范大学微生物实验室选育。
基础培养基[15]:MgSO40.5 g、FeSO40.01 g、KCl 1 g、琼脂20 g、pH值自然、水1000 mL。
查氏培养基[15]:NaNO32 g、KCl 1g、磷酸氢二钾0.1 g、MgSO40.5 g、FeSO40.01 g、蔗糖30 g、琼脂20 g、pH值自然、水1000 mL。
仪器设备:移液枪、磁力搅拌器、离心机、电热恒温培养箱、超净台、高压灭菌锅、摇床、涡旋振荡器、紫外分光光度计。
1.2黑曲霉F5种子平板制备
配制查氏培养基,121℃、0.1 MPa灭菌30 min,在超净台中倒平板,并将已纯化好的F5菌株接种于该平板培养基中,放置于30℃恒温培养箱中培养3 d,获得黑曲霉F5的孢子平板。
1.3葡萄糖标准曲线的制作
参考文献按[14]进行标准曲线的制作[14]。
1.4高温糖化酶活力测定
取3支试管,分别编号为空白管、样品管A、样品管B,向3支管中分别加入pH5.0的1%可溶性淀粉底物1.8 mL,65℃保温5 min;向样品管A、B中加入一定稀释梯度的待测酶液0.2 mL,65℃精确保温15 min后加入3 mL DNS试剂终止反应,混合均匀;另向空白管中补加待测酶液0.2 mL;将3支管放入沸水浴中煮沸5 min,流水冷却,加入10 mL蒸馏水,涡旋振荡器上混匀,540 nm下测定吸光度。
酶活定义:在pH5.0、65℃条件下,1 mL酶液每1 min水解1%的淀粉底物产生1 μmol还原糖所需要的酶量为1个酶活单位,用U表示。
1.5最适反应温度、最适反应pH值的筛选
向基础培养基中加入马铃薯汁20%、硫酸铵0.5%、磷酸氢二钾0.1%,pH值自然,以121℃、0.1 MPa灭菌30 min,冷却,接种培养3 d的1 cm2左右F5孢子菌丝体,在30℃、188 r/min条件下摇床培养4 d,测定酶活。
最适反应温度的测定:取过滤的发酵液经适当稀释后分别在反应温度为20℃、30℃、40℃、50℃、55℃、60℃、65℃、70℃、75℃、80℃条件下进行反应,按照1.4步骤进行酶活测定。
最适反应pH值的测定:取过滤的发酵液经适当稀释后分别在pH值为3.0、4.0、5.0、6.0、7.0、8.0的1%淀粉底物中,按照1.4步骤进行酶活测定。
1.6碳源的选择
1.6.1不同碳源的选择
向基础培养基中分别加入马铃薯汁20%、小麦淀粉2%、可溶性淀粉2%、玉米淀粉2%、木薯淀粉2%、糊精2%6种选择性碳源,在每种培养基中再补加硫酸铵0.5%,磷酸氢二钾0.1%,pH值自然,121℃、0.1 MPa灭菌30 min,冷却,接种培养3 d的1 cm2左右F5孢子菌丝体,在30℃、188 r/min条件下摇床培养4 d,测定酶活。
1.6.2碳源不同浓度梯度的筛选
2组碳源培养基的配制:向基础培养基中分别加入马铃薯汁:10%、15%、20%、25%、30%,硫酸铵0.5%,磷酸氢二钾0.1%,pH值自然;小麦淀粉:0.5%、1%、2%、4%、6%;硫酸铵0.5%,磷酸氢二钾0.1%,pH值自然。将2组配制好的培养基在121℃、0.1 MPa条件下同时灭菌30 min,冷却,接种培养3 d的1 cm2左右F5孢子菌丝体,在30℃、188 r/min条件下摇床培养4 d,测定酶活。
1.7氮源的选择
1.7.1不同氮源的选择
向基础培养基中分别加入蛋白胨0.5%、尿素0.5%、明胶0.5%、硝酸铵0.5%、硫酸铵0.5%、硝酸钠0.5%;马铃薯汁25%,磷酸氢二钾0.1%,pH值自然,121℃、0.1 MPa灭菌30 min,冷却,接种培养3 d的1 cm2左右F5孢子菌丝体,在30℃、188 r/min条件下摇床培养4 d,测定酶活。
1.7.2氮源不同浓度梯度的筛选
向基础培养基中分别加入蛋白胨0.5%、1%、2%、4%、6%;马铃薯汁25%,磷酸氢二钾0.1%,pH值自然,121℃、0.1 MPa灭菌30 min,冷却,接种培养3 d的1 cm2左右F5孢子菌丝体,在30℃、188 r/min条件下摇床培养4 d,测定酶活。
1.8磷酸盐的选择
1.8.1不同磷酸盐选择
向基础培养基中分别加入磷酸氢二钾0.1%、磷酸二氢钾0.1%、磷酸氢二钠0.1%、磷酸二氢铵0.1%、磷酸钙0.1%;马铃薯汁25%,蛋白胨2%,pH值自然,121℃,0.1 MPa灭菌30 min,冷却,接种培养3 d的1 cm2左右F5孢子菌丝体,在30℃、188 r/min条件下摇床培养4 d,测定酶活。
1.8.2磷酸盐不同浓度梯度的筛选
向基础培养基中分别加入磷酸二氢铵0.05%、0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.8%、1.0%;马铃薯汁25%,蛋白胨2%,pH值自然,121℃、0.1 MPa灭菌30 min,冷却,接种培养3 d的1 cm2左右F5孢子菌丝体,在30℃、188 r/min条件下摇床培养4 d,测定酶活。
1.9黑曲霉F5正交试验
以马铃薯汁、蛋白胨、磷酸二氢铵、pH值为4个因素,分别做3个水平,进行正交试验,见表1。
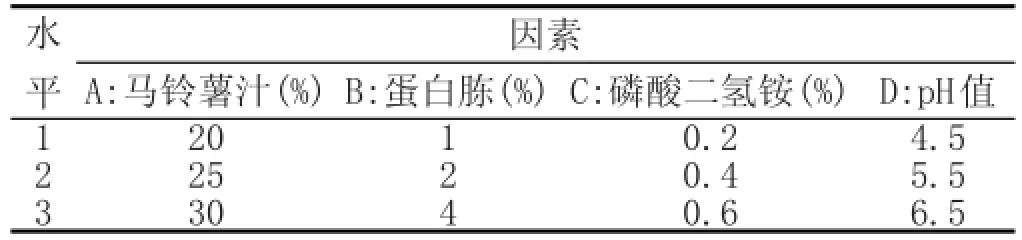
表1 因素水平表
取27个300 mL锥形瓶,按照正交表4个因素配制正交培养基,以121℃、0.1 MPa灭菌30 min,冷却,接种培养3 d的1 cm2左右F5孢子菌丝体,在30℃、188 r/min条件下摇床培养4 d,测定酶活。
2 结果与讨论
2.1葡萄糖标准曲线的制作(图1)
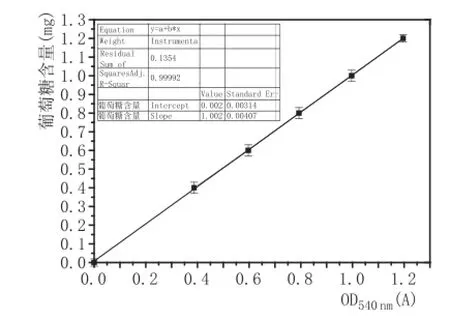
图1 葡萄糖标准曲线图
由图1可知,葡萄糖标准曲线为y=1.002x+0.002,R2= 0.99992>0.95,线性关系显著,可用于后续研究工作。
2.2最适反应温度、最适反应pH值的筛选(图2、图3)
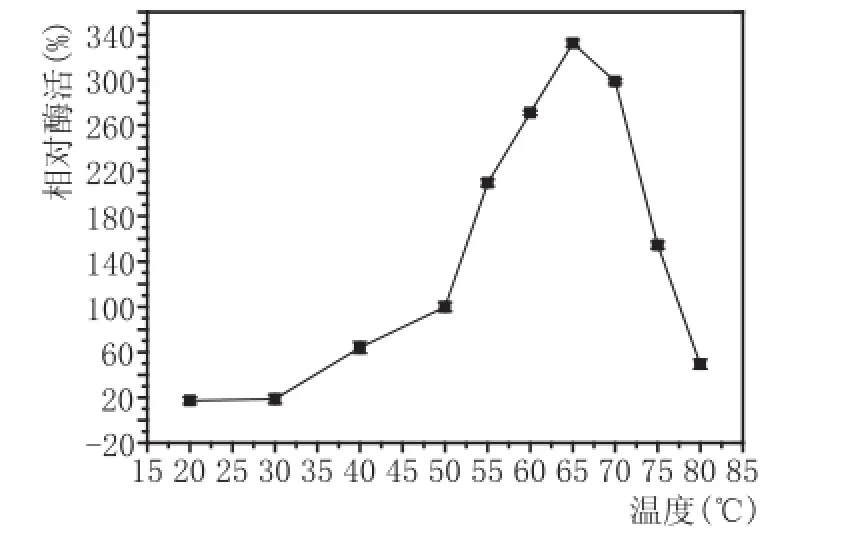
图2 最适温度筛选结果图
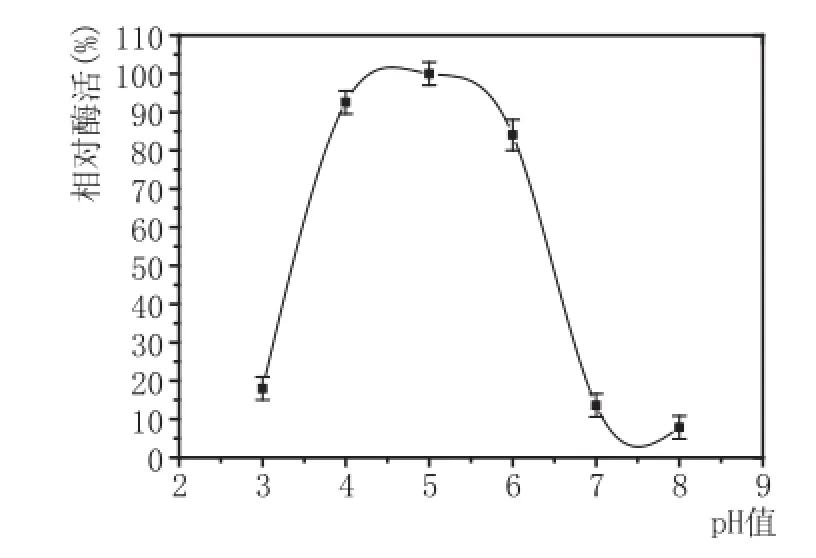
图3 最适pH值筛选测定结果图
由图2、图3可知,黑曲霉F5菌株最适温度为65℃,低于50℃以下会导致酶活性不足,高于80℃则酶蛋白变性失活;最适pH值为5.0,pH值在4~6之间,酶活力能保持80%以上,比较适合与淀粉酶配合使用,用于糖化工艺。
2.3碳源的选择
如图4所示,马铃薯汁和小麦淀粉产生的酶活最高,可采用马铃薯汁和小麦淀粉作为主要的碳源;图5表明,小麦淀粉在浓度大于2%后,随着浓度的升高,酶活力逐渐降低,而随着小麦淀粉浓度的升高,酶活力降低的原因可能是培养基浓度升高,黑曲霉生长过于旺盛,大量形成菌丝体,产酶代谢途径受到抑制,产酶能力降低;而马铃薯汁在大于20%后,酶活力还有明显的增加趋势,其原因可能是因为马铃薯汁中含有某些氨基酸或者维生素,促进了黑曲霉的生长,其代谢产物也有一定的提升,促使酶活力也呈上升趋势。因此,在碳源的选择上使用马铃薯汁作为最佳碳源是最适合的,且浓度为25%,产酶能力最高。
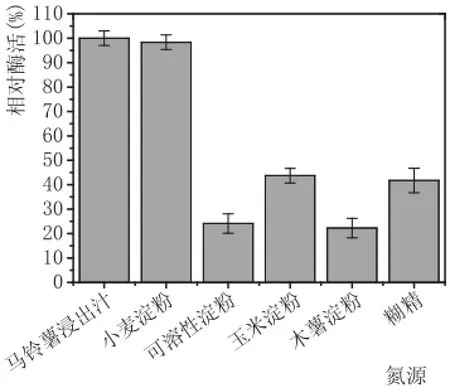
图4 不同碳源酶活力测定结果图
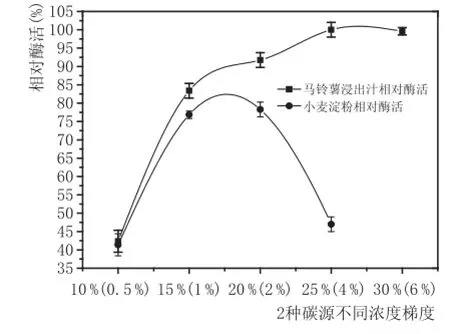
图5 两种碳源不同浓度梯度酶活力测定结果图
2.4氮源的选择(图6)
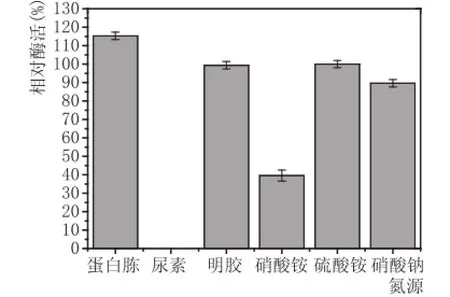
图6 不同氮源酶活力测定图
由图6所示,采用的6种氮源中蛋白胨为F5最佳氮源,这与赵林果等[16]在研究碳源和氮源对黑曲霉分泌β-葡萄糖苷酶的影响中蛋白胨为最佳氮源相一致。该菌株F5对尿素氮源不利用,生长不佳,产生的糖化酶活力不高,这与张秋菊等[17]在探讨固态发酵中不同碳源和氮源对黑曲霉解磷效果的影响,尿素的发酵液中有效磷含量有所减少相一致,而作为有机氮源,反而有助于F5菌株的生长和产酶。以蛋白胨为优化氮源,蛋白胨浓度添加量为2%时酶活力较高,实验选择浓度2%蛋白胨作为最佳氮源。随着蛋白胨浓度的增加,大量的氮源用于菌丝体的生长,延长了生物量的繁殖时间,导致产酶阶段延后甚至不利于产酶(见图7)。

图7 氮源不同浓度梯度酶活力测定图
2.5磷酸盐的选择(图8、图9)
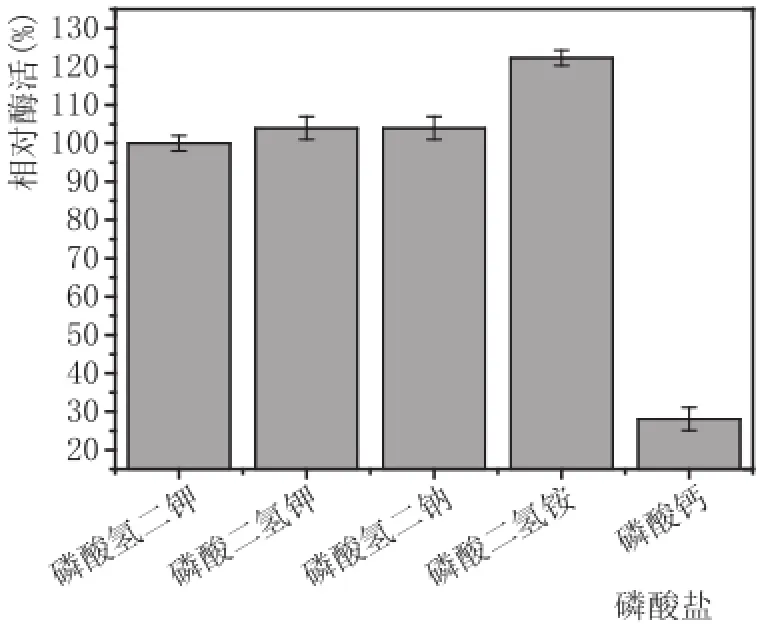
图8 不同磷酸盐酶活力测定图
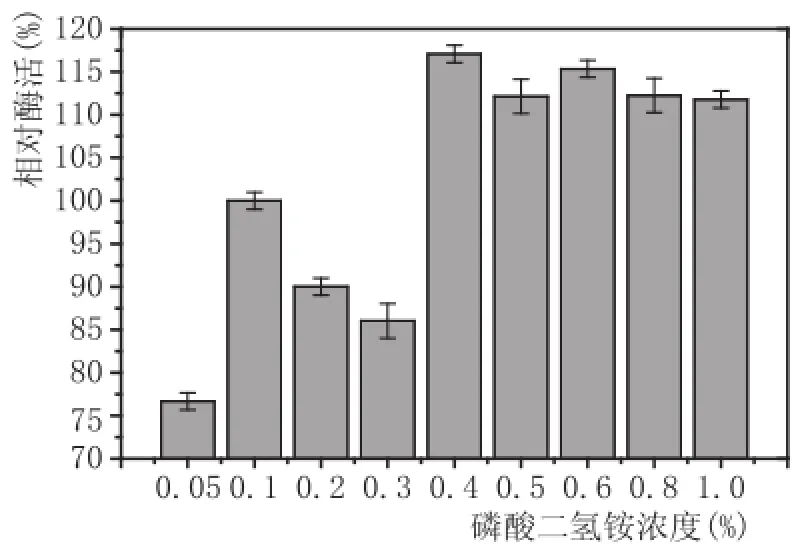
图9 磷酸盐不同浓度梯度酶活力测定图
由图8可以看出,5种磷酸盐中,磷酸二氢铵酶活力最高,磷酸氢二钾、磷酸二氢钾、磷酸氢二钠酶活力相差不大,表明其对产酶影响不大,而磷酸钙产生的酶活最低,其主要原因可能是磷酸钙为沉淀物质,不利于黑曲霉F5菌丝体的吸收利用,而磷酸二氢铵中可能存在着氮源,导致生长过程中促进产酶,因而酶活力最高。在以优化磷酸二氢铵浓度中,当磷酸二氢铵浓度为0.4%时,酶活力最高(见图9)。
综上所述,F5菌株最佳碳源为马铃薯汁,浓度为25%;最佳氮源为蛋白胨,浓度为2%;最佳磷酸盐为磷酸二氢铵,浓度为0.4%。形成的粗酶的最适反应温度为65℃,最适反应pH5.0。
2.6黑曲霉F5正交试验
由4因素3水平进行了正交试验,结果见表2。

表2 L9(3)4正交试验结果
由表2进行直观分析可知,根据R极值大小可看出,
RpH值>R蛋白胨>R磷酸二氢铵>R马铃薯汁,说明pH值对产酶能力影响最显著;马铃薯汁影响效果最弱。从水平因子考虑,其最优组合形成的最佳培养基配比为:马铃薯汁30%,蛋白胨2%,磷酸二氢铵0.4%,pH4.5。
2.7验证试验
取4个三角瓶分别编号为1号、2号、3号、4号,配制4瓶培养基:马铃薯汁30%,蛋白胨2%,磷酸二氢铵0.4%,pH4.5,在121℃、0.1 MPa下灭菌30 min,冷却,接种培养3 d的1 cm2左右F5孢子菌丝体,在30℃、188 r/min条件下摇床培养4 d,测定酶活(见表3)。

表3 验证试验结果
通过补充验证试验,看其生长稳定性及产酶稳定性,酶活比正交试验优化实验高8.7%左右,3个样品产生的酶活平均范围为87.3 IU/mL±4.7 IU/mL。
3 结论
本实验通过对黑曲霉F5菌株进行了温度、pH值、碳源、氮源、磷酸盐的筛选及正交试验优化,结果表明:发酵最佳碳源为30%马铃薯汁;最佳氮源为2%蛋白胨,最佳磷酸盐为0.4%磷酸二氢铵,最适pH4.5,通过发酵产酶以后最高酶活能达到87.3 IU/mL,发酵产生的糖化酶最适反应温度为65℃,最适pH5.0。根据以上数据,最适反应温度为65℃的糖化酶可采用中温蒸煮和低温蒸煮同步进行,用于液态白酒的生产。在白酒的生产过程中,通过添加该糖化酶能降低能耗,缩短反应时间,其酶稳定性及其应用将在后续工作中完成。
[1]李冰洁.黑曲霉变异株Sp-56在糖化酶生产工业中的应用[J].微生物学杂志,1995(1):16-20.
[2]Giordano R L C,Trovati J,Schmidell W.Continuous production of ethanol from starch using glucoamylase and yeast co-immobilized in pectin gel[J].Applied Biochemistry& Biotechnology,2008,147(1):47-61.
[3]Kumar P,Satyanarayana T.Optimization of culture variables for improving glucoamylase production by alginate-entrapped Thermomucor indicae-seudaticae using statistical methods[J]. Bioresource Technology,2007,98(6):1252-1259.
[4]王海燕,秦浚川,王敖全,等.黑曲霉酸性α-淀粉酶基因和糖化酶基因对工业酒精酵母的整合及其共表达[J].微生物学报,2004,44(4):483-485.
[5]单海艳.黑曲霉生产糖化酶及酶活测定[J].牡丹江大学学报,2010,19(7):92-94.
[6]Wallis G L F,Swift R J,Hemming F W,et al.Glucoamylase overexpression and secretion inAspergillus niger:analysis of glycosylation[J].Biochimica et BiophysicaActa,1999,1472 (3):576-586.
[7]梁新红,孙俊良,唐玉,等.黑曲霉糖化酶分离纯化与酶学性质研究[J].河南科技学院学报:自然科学版,2011,39(4):24-27.
[8]宋水山,浜田信威,竹西繁行.黑曲霉糖化酶的纯化及特性鉴定[J].河北省科学院学报,1992(1):57-64.
[9]陈冠军,曹淑桂,罗贵民,等.黑曲霉糖化酶热稳定性的研究[J].中国生物工程杂志,1990(3):29-33.
[10]孙俊良,李新华,梁新红,等.不同碳源对黑曲霉产糖化酶活力的影响[J].食品科学,2008,29(08):433-436.
[11]孙继祥.黑曲霉产糖化酶液态发酵条件优化[J].酿酒科技,2011(10):45-47.
[12]钟浩,谭兴和,熊兴耀,等.黑曲霉固态发酵产糖化酶的研究[J].中国酿造,2009(1):26-29.
[13]贺莹,高丽芳,焦红英.黑曲霉产糖化酶固态发酵营养条件优化研究[J].中国酿造,2013,32(9):88-90.
[14]孔维瑞,郭福宗,唐湘华,等.产糖化酶根霉菌的分离及其酶学性质研究[J].酿酒科技,2012(9):32-35.
[15]沈萍,范秀荣,李广武.微生物学实验[M].3版.北京:高等教育出版社,1996.
[16]赵林果,游丽金,倪浩,等.碳源和氮源对黑曲霉分泌β-葡萄糖苷酶的影响[J].南京林业大学学报:自然科学版,2009,32 (6):1-4.
[17]张秋菊,王伯铎,叶劲松,等.固态发酵中碳氮源对黑曲霉解磷效果的影响[J].现代农业科技,2010(21):293-295.
优先数字出版时间:2016-03-23;地址:http://www.cnki.net/kcms/detail/52.1051.TS.20160323.1550.010.html。
中图分类号:TS261.1;Q93-3;TS262.3;TQ92
文献标识码:A
文章编号:1001-9286(2016)07-0032-05
DOI:10.13746/j.njkj.2016003
基金项目:2014年云南师范大学大学生科研训练基金项目。
收稿日期:2016-01-06
作者简介:常吕珍(1990-),女,云南镇雄人,在读本科,生物技术专业。
通讯作者:唐湘华(1973-),男,讲师,从事应用微生物发酵工程研究,E-mail:txhact@gmail.com。
Optimization of the Liquid Fermentation Conditions of Aspergillus Niger Strain F5 to Produce Thermotolerant Glucoamylase
CHANG Lvzhen1,YANG Yunjuan1,2,ZHANG Runmei1,LI Wanjun1,MOU Xingling1,HUANG Zunxi1,2and TANG Xianghua1,2
(1.School of Life Sciences,Yun'nan Normal University,Kunming,Yun'nan 650500;2.Yun'nan Provincial Key Lab for Biomass Energy and Environmental Biotechnology,Kunming,Yun'nan 650500,China)
Abstract:In this study,the factors influencing the thermotolerant glucoamylase yield of Aspergillus niger strain F5,including temperature,pH value,carbon source,nitrogen source and phosphate salt,were investigated.The optimum culture medium was composed of 30%potato juice,2%peptone,and 0.4%ammonium dihydrogen phosphate with pH 4.5.After 4 d culture at 30℃,the activity of the produced glucoamylase reached up to 87.3 IU/ml.The best reaction temperature of glucoamylase was 65℃and the best reaction pH was 5.0.
Key words:Aspergillus niger;glucoamylase;screening;optimization
