浏阳黑山羊瘤胃上皮细胞周期分布、增殖和凋亡特点
2016-08-03韩奇鹏揭红东王凯军张佩华周传社孔志伟汤少勋
韩奇鹏 罗 玲 揭红东 王凯军 张佩华* 周传社 孔志伟 汤少勋
(1.湖南农业大学,动物科学技术学院,畜禽遗传改良湖南省重点实验室,长沙410128;2.中国科学院,亚热带农业生态研究所,亚热带农业生态过程重点实验室,湖南省畜禽健康养殖工程技术中心,农业部中南动物营养与饲料科学观测实验站,长沙410125)
浏阳黑山羊瘤胃上皮细胞周期分布、增殖和凋亡特点
韩奇鹏1,2罗玲1揭红东1王凯军1张佩华1*周传社2*孔志伟2汤少勋2
(1.湖南农业大学,动物科学技术学院,畜禽遗传改良湖南省重点实验室,长沙410128;2.中国科学院,亚热带农业生态研究所,亚热带农业生态过程重点实验室,湖南省畜禽健康养殖工程技术中心,农业部中南动物营养与饲料科学观测实验站,长沙410125)
摘要:本研究旨在建立浏阳黑山羊瘤胃上皮细胞的体外培养模型,并对其周期分布、增殖和凋亡特点进行研究。试验采集60日龄浏阳黑山羊的瘤胃上皮组织,应用0.25%胰蛋白酶+0.02%乙二胺四乙酸(EDTA)消化法对山羊瘤胃上皮组织进行消化,得到单个的山羊瘤胃上皮原代细胞进行体外培养。通过倒置显微镜对原代和传代培养阶段细胞形态进行观察,采用细胞计数法检测细胞的生长活性,应用细胞免疫组化学方法对传代细胞进行鉴定,并用流式细胞术检测山羊瘤胃上皮传代细胞周期分布情况和凋亡比率。结果显示:1)经0.25%胰蛋白酶+0.02% EDTA消化获得的山羊瘤胃上皮原代细胞,培养1 d开始贴壁生长,2 d开始生长较快(对数期),呈典型的“波峰”状生长,3~4 d生长最为迅速,7 d生长速度平稳(平台期)。2)经细胞免疫组化学方法的鉴定,细胞胞浆为黄褐色,即细胞角蛋白19呈阳性表达。3)膜联蛋白-V/碘化丙啶联合染色显示,随着培养时间的延长,细胞凋亡比率显著增加(P<0.01)。结果表明,通过0.25%胰蛋白酶+0.02% EDTA的消化方法成功得到了浏阳黑山羊瘤胃上皮细胞,可为今后研究反刍动物瘤胃相关机制与功能提供模型。
关键词:浏阳黑山羊;瘤胃上皮细胞;周期分布;凋亡
瘤胃作为反刍动物重要的消化器官,了解瘤胃上皮形态结构及功能,对维持消化系统稳定和促进动物健康有着重要的实际意义。反刍动物瘤胃壁分为3层,由腔外向腔内分别为豁浆膜层、豁膜肌层和膜层[1]。瘤胃壁中与其吸收代谢功能联系最紧密的为瘤胃上皮。瘤胃上皮分为4个层,由浆膜层向黏膜层依次是角质层、基底层、棘突层和颗粒层[2]。瘤胃上皮细胞分为基底层细胞、颗粒细胞、棘突层和颗粒层细胞,还有高度分化的角质层细胞[3]。其中,去除角质层细胞等杂细胞得到较多、较纯及生命活性正常的处于中间层的棘突层和颗粒层细胞,是体外分离、培养瘤胃上皮细胞(ruminal epithelium cell,REC)的关键。Weekes[4]采用木瓜酶分裂乳头组织,得到生长正常的离体上皮细胞。Gálfi等[5]为研究瘤胃上皮生酮,首次应用胰蛋白酶连续消化法,先去除坚实的角质层细胞,再连续消化,得到体外研究瘤胃营养代谢最佳的棘状层和颗粒层细胞。之后他们又采用同样的方法,成功地分离培养出了绵羊瘤胃上皮细胞,但是该法需约8 h从基底层和棘层中分离出细胞,限制了上皮细胞代谢研究中的应用[6]。Klotz等[7]对消化缓冲液和胰蛋白酶浓度进行了优化,获得大量细胞形态正常的瘤胃上皮细胞。Stumpff等[8]在前人的基础上改进了取材方法,设计制作了一种模具,使胰蛋白酶只作用于瘤胃乳头,从而分离出较纯净的上皮细胞。范燕茹等[9]为建立驯鹿瘤胃上皮细胞的体外分离及培养方法,用0.25%胰蛋白酶(trypsin)+0.02%乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)消化液37 ℃连续振荡3~4 h消化上皮组织,得出传1代的细胞活性正常的驯鹿原代离体瘤胃上皮细胞。
虽然国内外对瘤胃上皮细胞已有研究,但只停留在获取原代细胞到传1代细胞,对其后续试验研究少有报道。因此,本试验以期建立一种有效、快速的获得山羊瘤胃上皮细胞,且成功进行原代培养的模型,并对其周期分布情况和凋亡比率进行初步研究,为今后研究反刍动物瘤胃相关机制与功能提供技术支持和理论参考。
1材料与方法
1.1试验材料
试验动物为3只60日龄健康的浏阳黑山羊,体重为(6.4±0.8) kg。颈静脉放血致死,取出瘤胃组织,去掉内容物后用生理盐水反复冲洗干净,待用于样品采集。
胎牛血清(FBS)、基本培养基(Dulbecco’s Modified Eagle Medium: Nutrient Mixture F-12,DMEM/F12)、0.25%胰蛋白酶+0.02% EDTA、青-链霉素均购自Gibico公司;两性霉素B+庆大霉素(gentamicin/amphotericin solution)购自Thermo公司(R-015-10);细胞计数试剂盒(Cell Counting Kit-8,CCK-8)购自日本同仁化学研究所;苏木素和磷酸缓冲盐溶液(phosphate buffer saline,PBS)(pH 7.2~7.6)均购自Wellbio公司;两步法试剂盒和对二氨基联苯胺(DAB)试剂盒购自中山金桥公司;免疫组化细胞角蛋白19(cytokeratin-19,CK19)抗体购自Abcam公司;常规化学试剂购自上海国药生物有限公司。
1.2试验方法
1.2.1山羊瘤胃上皮细胞的采集与原代培养
将浏阳黑山羊称重后,颈动脉放血至死,将腹部羊毛用解剖刀刮干净后,新洁尔灭搽拭体表皮毛,置于试验台上,用棉花球沾医用碘酒将腹部搽拭3遍,75%酒精1遍,切开腹部,取出瘤胃,用4 ℃预冷的生理盐水冲洗食糜颗粒后,置于无菌超净台中。采用钝性剥离瘤胃上皮组织,用含2%青-链霉素、1%两性霉素B和1%庆大霉素的洗涤液冲洗瘤胃上皮组织,并放入含2%青-链霉素、1%两性霉素B和1%庆大霉素的DMEM/F12中带回细胞培养室。用PBS清洗瘤胃上皮组织4~5次,剪去结缔、脂肪及可见的导管组织。将瘤胃上皮组织块尽量剪碎(约1 mm3,肉眼观察呈糊状),再用PBS和DMEM/F12各洗涤1次。弃去上清液,往沉淀中加入3倍组织体积的0.25%胰蛋白酶+0.02%EDTA消化液,37 ℃空气浴振荡消化10 min,消化完成后1 000 r/min条件下离心5 min,取上清液(尽量吹吸,促进单个细胞分离),重复3~5次。再将收集的消化液加入适量DMEM/F12完全培养液(含5% FBS、10%青-链霉素、0.1 mg/mL庆大霉素、2.5 μg/mL两性霉素B)重悬细胞,之后依次经100 μm孔径筛网过滤,收集滤液,1 000 r/min离心5 min,去上清,此时可看到细胞沉淀,如果含有黑色细胞层或角质化细胞,则舍去(成年羊通常第1次与第2次消化得到的细胞舍去)。再往沉淀中加入PBS重悬细胞,继续1 000 r/min条件下离心5 min,弃上清,加入适量DMEM/F12培养液垂悬细胞,细胞浓度调整为1×107个/mL,接种于事先准备的培养皿中,置于CO2培养箱(37 ℃,5% CO2)培养。培养30~60 min后,显微镜下观察,吸出上清液,1 000 r/min条件下离心5 min,取沉淀,加入DMEM/F12完全培养基继续培养。
1.2.2山羊瘤胃上皮细胞传代培养
当山羊瘤胃上皮原代细胞长满培养皿的80%~90%时,弃去培养基,用PBS洗涤细胞1~2次后,加入1 mL的含0.25%胰蛋白酶+0.02%EDTA的消化液,放入含5% CO2的37 ℃培养箱中消化2~3 min。放在倒置显微镜下观察细胞开始变亮、变圆时,迅速用含血清的培养基终止消化。将贴壁的细胞吹打为悬液,转移到15 mL离心管中,在4 ℃离心机中1 000 r/min离心5 min,弃去上清液,加入1 mL的培养基重悬细胞,以1∶2进行传代。在含5% CO2的37 ℃培养箱中培养30 min后,转移含细胞的培养基至培养皿中继续培养,重复1次,此步为纯化过程。
1.2.3山羊瘤胃上皮原代和传代细胞形态学观察
采用徕卡DMI3000B型倒置显微镜观察山羊瘤胃上皮原代和传代细胞形态及生长状况。
1.2.4山羊瘤胃上皮传代细胞免疫组化学鉴定
根据上皮细胞的标志性中间丝蛋白为细胞角蛋白,对山羊瘤胃上皮传代细胞角蛋白进行细胞免疫组化学的鉴定。
步骤:1)取对数生长的山羊瘤胃上皮传代细胞用37 ℃的0.25%胰蛋白酶+0.02% EDTA消化液消化下来,当培养在6孔板进行常规的盖玻片爬片传代培养山羊瘤胃上皮细胞,待生长到细胞培养瓶的80%~90%(3 d)。2)取出爬片,先加入PBS清洗数次后,再加入4%的多聚甲醛固定液固定30 min,室温干燥5 min,用PBS冲洗3次,每次为3 min。3)每个孔滴加2滴或100 μL 3%浓度的H2O2,室温下孵育10 min(此步是为了阻断内源性过氧化物物酶的干扰)。用PBS冲洗3次,每次为3 min。4)除去PBS,加封闭血清孵育20 min;每孔加入2滴或100 μL的CK19抗体,37 ℃孵育60 min;再用PBS冲洗3次,每次为3 min。放入湿盒中再放入4 ℃冰箱过夜,放入冰箱时要注意平稳,以防止抗体从组织上滑落下来,次日放入37 ℃恒温箱复温45 min。5)PBS洗涤5次,每次5 min;每孔滴加50~100 μL抗兔/鼠免疫球蛋白G-辣根过氧化物酶(HRP)多聚体,37 ℃孵育30 min,PBS冲洗3次,每次为3 min。6)除去PBS,每孔加入300~400 μL新鲜配制的DAB染色液,显微镜下观察1~5 min。7)蒸馏水冲洗10 min,苏木精复染5~10 min,0.25%浓度的盐酸酒精分化5~10 s,PBS蓝化20 min,各级酒精(60%~100%)脱水,每级5 min,取出后置于二甲苯内10 min,重复2次,中性树胶封片、显微镜观察。
1.2.5山羊瘤胃上皮传代细胞生长活性检测
步骤:1)取对数生长的山羊瘤胃上皮传代细胞用37 ℃的0.25%胰蛋白酶+0.02% EDTA消化液消化下来,在96孔板中配制100 μL的细胞悬液(3×103个/孔),将培养板在培养箱培养(37 ℃,5% CO2)。2)对培养1、2、3、4、5、6、7、8、9 d的山羊瘤胃上皮传代细胞进行检测,并设置不含细胞的培养基为对照。3)向每孔加入10 μL CCK溶液[注意不要再孔中生成气泡,它们会影响光密度(optical density,OD)值的读数]。4)将培养板在培养箱内孵育4 h。5)用酶标仪测定在450 nm处的OD(OD450 nm)。6)以培养天数为横坐标,OD450 nm为纵坐标,绘制曲线图。
1.2.6山羊瘤胃上皮传代细胞周期分布情况
利用流式细胞术(flow cytometry,FCM)检测原代不同培养天数山羊瘤胃上皮传代细胞周期分布情况。
1)细胞培养:山羊瘤胃上皮传代细胞培养于含5% FBS的DMEM/F12培养基中,收集培养了2、4、8 d的传代细胞进行周期检测,每组重复3次。
2)细胞收集:上述处理好的山羊瘤胃上皮细胞,用37 ℃的0.25%胰蛋白酶+0.02% EDTA消化液消化下来,PBS洗2~3次,制成单细胞悬液,并调整细胞数量至1×106个/mL。
3)细胞固定:加入1 mL预冷PBS重悬细胞,800 r/min×5 min,吸净上清;加入400 μL PBS,轻轻重悬细胞,使细胞分离为单个,逐滴加入预冷的100%乙醇1.2 mL,使其终浓度为75%,4 ℃放置过夜固定。
4)细胞标记:①取出固定的样品,800 r/min,离心5 min,弃上清;②加入1 mL预冷的PBS重悬细胞,800 r/min,离心5 min,离心收集细胞;③重复1~2次,去除乙醇;④加入150 μL碘化丙啶(propidium iodide,PI)工作液,4 ℃避光染色30 min;⑤转至流式检测管,上机检测,PI用488 nm氩离子激光器激发,由630 nm通滤光片接收,通过荧光脉冲前向角散射/荧光脉冲侧向角散射(FSC/SSC)散点图收集1×104个细胞,采用设门技术,排除黏连细胞和碎片,分析PI荧光直方图上各细胞周期的百分率。
1.2.7山羊瘤胃上皮传代细胞凋亡比率
山羊瘤胃上皮传代细胞培养于含5% FBS的DMEM/F12培养基中,收集培养了2、4、8 d的传代细胞进行凋亡检测,每组重复3次。步骤:1)用不含EDTA的胰蛋白酶消化液消化,并收集山羊瘤胃上皮传代细胞;2)用PBS洗涤细胞2次,每次2 000 r/min离心5 min,收集1×105~5×105个细胞;3)加入500 μL的结合缓冲液(binding buffer)悬浮细胞;4)加入5 μL膜联蛋白V(annexin V)-异硫氰酸荧光素(FITC)细胞凋亡检测试剂盒中的试剂混匀后,加入5 μL PI,混匀;5)室温、避光,反应5~15 min;6)1 h内,上流式细胞仪观察检测。
1.3数据分析
免疫组化学的采像用普通的电脑采像,图像分析软件为专业图像分析软件(Image-Pro-Plus,IPP);细胞周期与凋亡应用流式细胞仪(BD FACSCalibur)采集数据,并用专业软件(Flowjo)进行图像分析。试验数据用SAS 9.2软件统计分析,统计差异显著性定义为P<0.01,P>0.01则无显著差异。
2结果
2.1山羊瘤胃上皮原代和传代细胞形态
山羊瘤胃上皮原代和传代细胞经0.25%胰蛋白酶+0.02%EDTA酶消化第4次离心后会看到大量的细胞白色沉淀,直到消化至第6次时细胞数量开始减少,且组织变得黏腻。收集后在显微镜下观察,可见较多的细胞,且单个散在,大小均一,具有较好的折光度(图1-A)。调整细胞密度进行培养,培养2 d后大部分贴壁,有未贴壁悬浮的细胞,细胞颜色发暗,并开始生长,呈岛屿状分布,细胞折光度较好,形态较圆,体积较小(图1-B)。4 d后开始迅速生长,细胞增殖明显,显现典型的鹅卵石状,进入对数生长期(图1-C)。经过3~4次的传代纯化培养,得到较纯的山羊瘤胃上皮细胞,呈现典型的鹅卵石状(图1-D)。

A.原代培养1 d的山羊瘤胃上皮细胞;B.原代培养2 d的山羊瘤胃上皮细胞;C.原代培养4 d培养的山羊瘤胃上皮细胞;D.纯化传代培养4 d的山羊瘤胃上皮细胞。
A. goat ruminal epithelial cells of primary culture of 1 d; B. goat ruminal epithelial cells of primary culture of 2 d; C. goat ruminal epithelial cells of primary culture of 4 d; D. goat ruminal epithelial cells of purified subculture of 4 d.
图1山羊瘤胃上皮细胞形态
Fig.1Morphology of ruminal epithelium cells of goats (200×)
2.2山羊瘤胃上皮传代细胞免疫组化学鉴定
经细胞免疫组化学方法的鉴定,细胞胞浆为黄褐色,即细胞CK19呈阳性表达(图2),证明培养的细胞为山羊瘤胃上皮传代细胞。
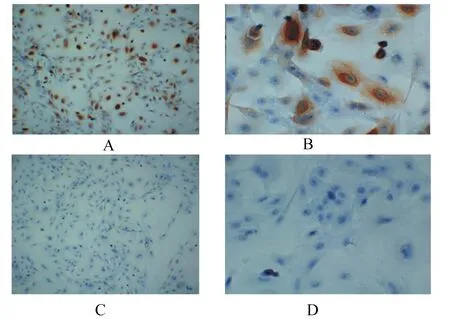
A与B为CK19阳性细胞浆表达;C与D为PBS阴性对照。A、B、C、D苏木素细胞核染色。
A and B were CK19 positive expression in cell plasma; C and D were PBS negative control. A, B, C and D were haematoxylin nuclear staining.
图2山羊瘤胃上皮传代细胞免疫组化学鉴定
Fig.2Immunohistochemical identification of subcultured ruminal epithelium cells of goats (100×)
2.3山羊瘤胃上皮传代细胞生长活性
不同培养时间山羊瘤胃上皮传代细胞的生长活性测定结果如图3所示。山羊瘤胃上皮传代细胞的生长曲线呈典型“S”型。细胞增殖过程,1~2 d为潜伏期,细胞生长缓慢;3~7 d为对数生长期,生长较快;7~8 d为平台期,细胞增殖相对平稳;8 d后进入衰退期,细胞增殖活性开始降低。
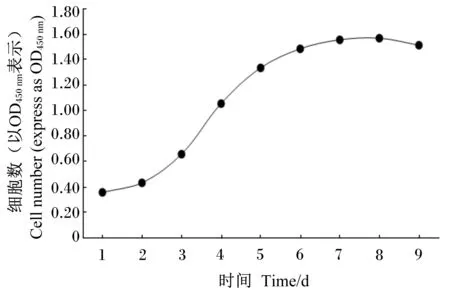
图3 山羊瘤胃上皮传代细胞生长曲线Fig.3 The growth curve of subcultured ruminal epithelium cells of goats
2.4山羊瘤胃上皮传代细胞周期分布情况
不同培养时间山羊瘤胃上皮传代细胞周期分布情况如图4所示。细胞周期一般分为G0/G1、S、G2/M期3部分,在G0/G1期前面都有个凋亡峰(也称sub-G0期),证明有细胞凋亡,且最前面没有细胞碎片峰,证明分析时细胞窗口已经设置好。此外,变异系数(CV)都小于10%,峰形越好,越尖锐,结果越可信。应用SAS 9.2统计分析结果(表1)发现随培养天数的增加,处于G0/G1期的细胞数量显著减少(P<0.01),而处于S期和G2/M期的细胞数量显著增加(P<0.01)。
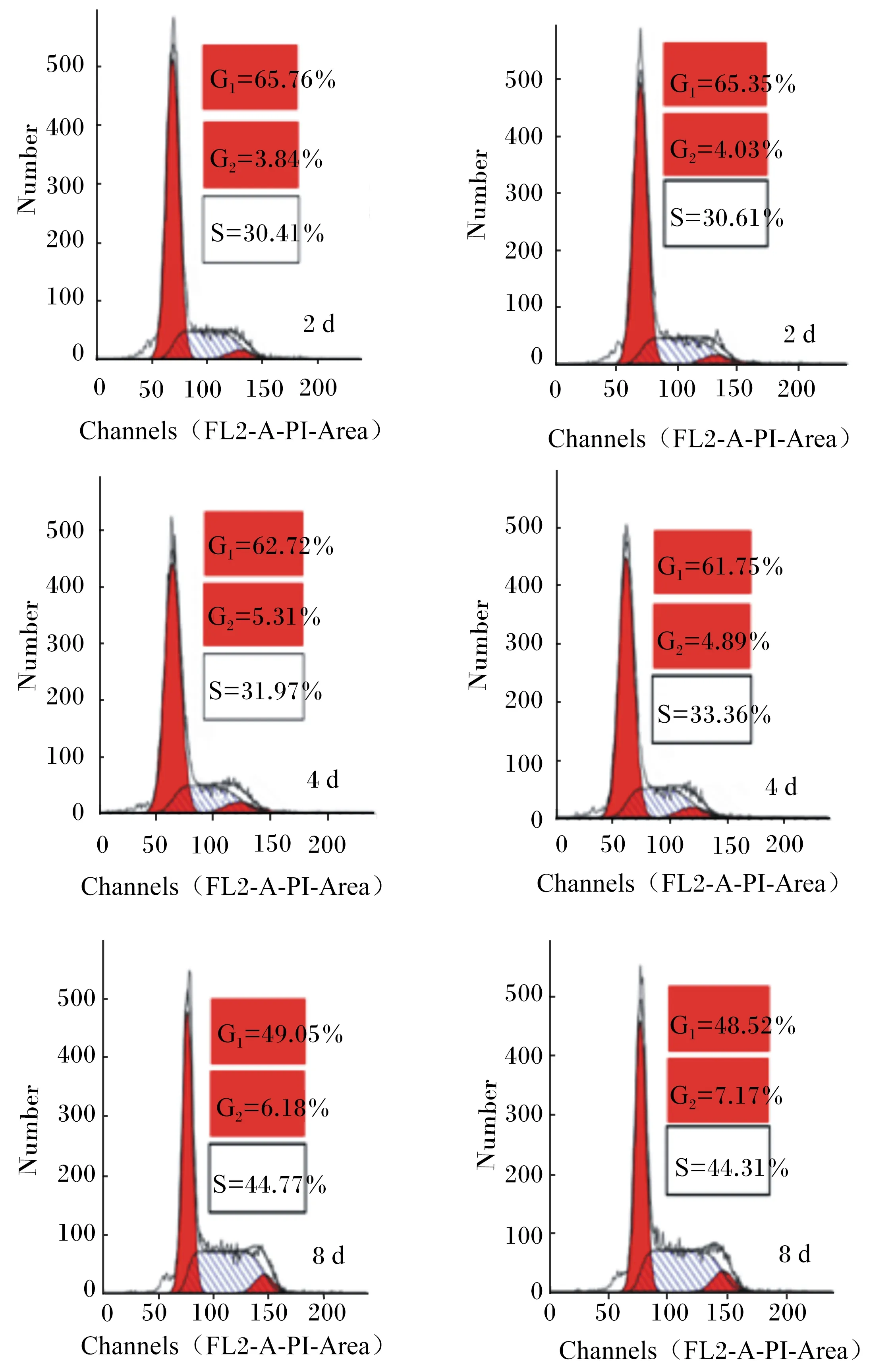
Channels(FL2-A-PI-Area)为PI红色荧光通过PI通道(FL2)的荧光峰面积;Number为细胞数量。G1为DNA合成前期(第1红色峰);S为DNA合成期;G2为DNA合成后期(第2红色峰)。每个时间点2个图分别为2个重复的。
Channels(FL2-A-PI-Area) was fluorescence peak area of PI red fluorescence passed PI channel (FL2); Number was the number of cells. G1was early stage of DNA synthesis (the 1st red peak); S was DNA synthesis stage; G2was late stage of DNA synthesis (the 2nd red peak). Two figures at each time point were two replicates.
图4山羊瘤胃上皮传代细胞周期分布情况
Fig.4Distribution of cell cycle of subcultured ruminal epithelium cells of goats
2.5山羊瘤胃上皮传代细胞凋亡比率
本试验采用流式细胞术(膜联蛋白V/PI双染法)检测不同培养时间山羊瘤胃上皮传代细胞凋亡的结果,如图5所示。通过BD FACSCalibur流式细胞仪采集数据,并用Cell Flowjo专用软件分析,得出细胞凋亡的3个时期凋亡早期(LR)、凋亡中期(UR)、凋亡晚期/坏死(UL)细胞所占的百分比,通过公式“凋亡率(%)=LR+UR+UL”得出山羊瘤胃上皮传代细胞凋亡比率。应用SAS 9.2软件进行统计分析(表2)发现,8 d凋亡比率显著高于2、4 d(P<0.01)。这说明随着细胞培养时间的延长,细胞凋亡比率增加,到8 d时增加的更为明显。

表1 不同细胞培养时间山羊瘤胃上皮传代细胞周期分布Table 1 Cell cycle distribution of subcultured ruminal epithelial cells of goats at different culture time
同行数据肩标不同字母者差异显著(P<0. 01)。下表同。
Values in the same row with different letter superscripts differed significantly (P<0. 01). The same as below.
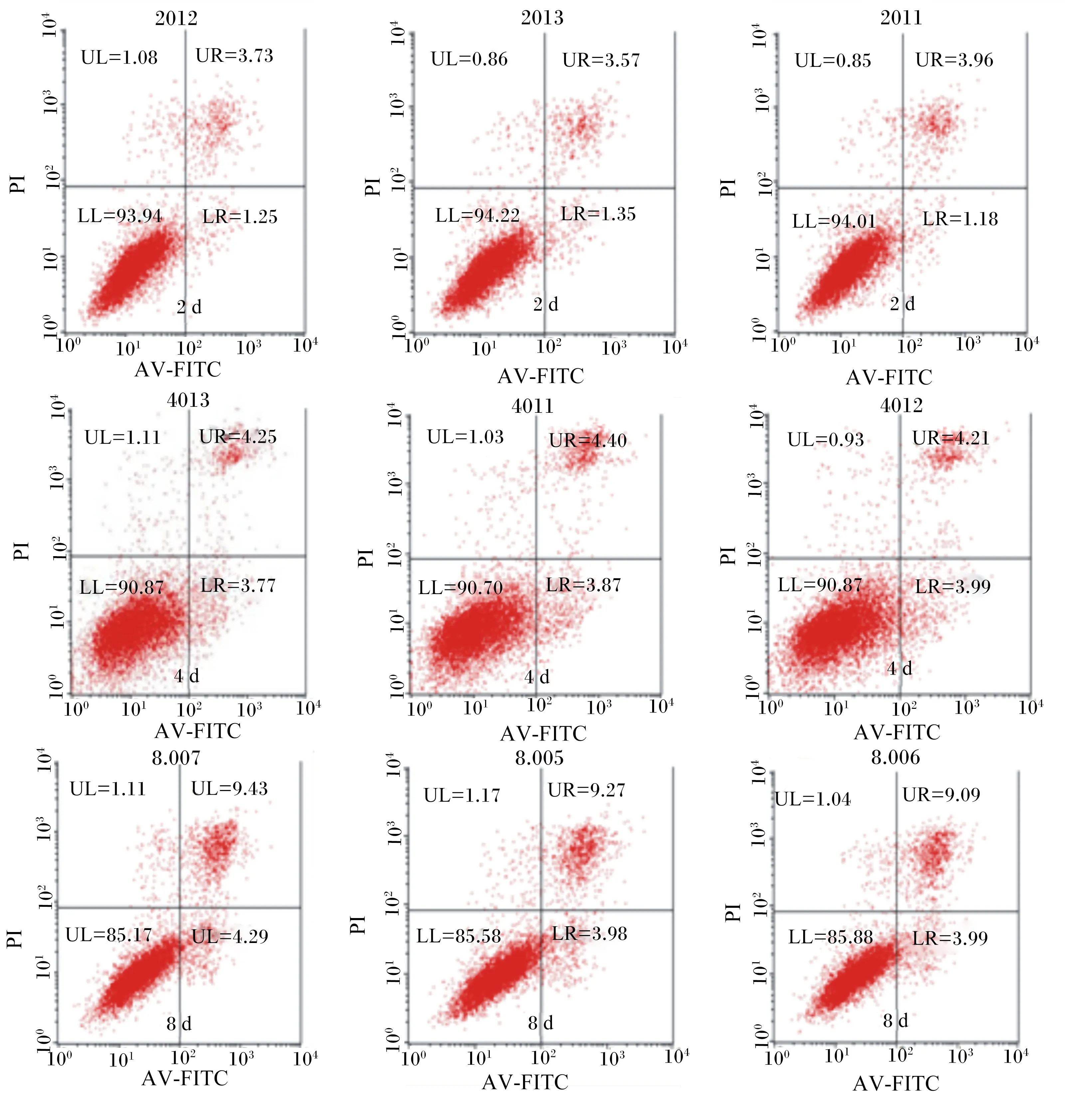
PI:碘化丙啶;AV-FITC:膜联蛋白V-异硫氰酸荧光素。RFI:相对荧光强度;CC:细胞数。LR:凋亡早期;UR:凋亡中期;UL:凋亡晚期/坏死;LL:正常细胞。
PI: propidium iodide; AV-FITC: annexin-fluorescein isothiocyanate. RFI: the relative fluorescence intensity; CC:cell count. LR: early apoptosis; UR: middle apoptosis; UL: late apoptosis/necrosis; LL: normal cells.
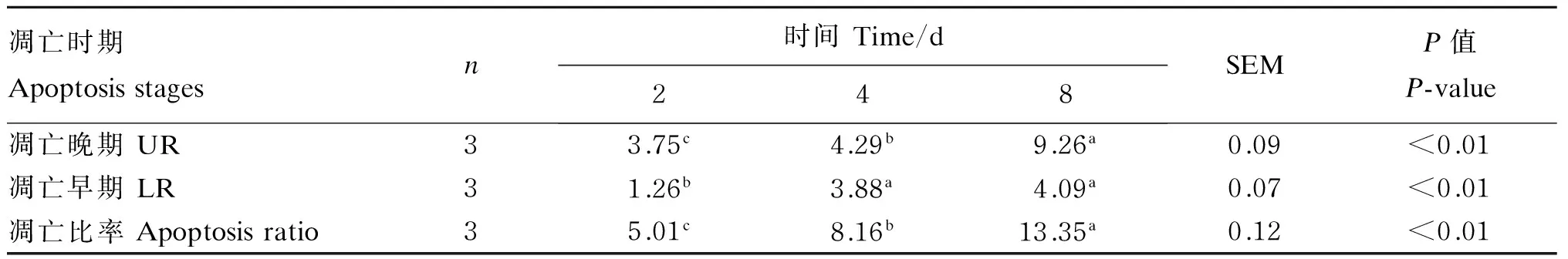
图5 山羊瘤胃上皮传代细胞凋亡比率Fig.5 Apoptosis ratio of subcultured ruminal epithelium cell of goats表2 不同细胞培养时间山羊瘤胃上皮传代细胞凋亡比率Table 2 Apoptosis ratio of subcultured ruminal epithelium cells of goats at different culture time %
3讨论
3.1山羊瘤胃上皮细胞体外分离与培养
体外分离培养一般分为原代培养和传代培养2大类[10],而原代培养方法通常分为时间段、产量高、形态分化良好、组织需要量大的酶消化法和易脱落、成功率低、培养时间长、需要组织量少的组织块培养方法[11]。孙志洪等[12]针对建立山羊瘤胃上皮细胞(RNC)的原代培养方法进行研究,发现浏阳黑山羊瘤胃上皮组织用2.50%胰蛋白酶+0.02% EDTA消化后获得的细胞分离效果及细胞增殖活性最为理想,可用于原代培养。于是本试验应用2.50% 胰蛋白酶+0.02% EDTA消化液10 min连续消化的方法,100 μm孔径筛网过滤,得到较多、活力较强的单个细胞。此外,本试验在瘤胃组织取样中采用的组织洗涤液和原代细胞培养液中加入了2%青-链霉素、1%庆大霉素和两性霉素B,瘤胃上皮细胞可传代到4代以上,且细胞生长活性及形态正常。
由于原代细胞在培养过程中会参杂有生长速度比上皮细胞快的成纤维细胞[13]。根据成纤维细胞对胰蛋白酶+EDTA较敏感,较先脱落,且易贴壁等特点进行细胞纯化[14]。细胞纯化方法有很多种,常用的方法有相差消化法、相差贴壁法和刮除法等[15],还有克隆环和96孔有限稀释法等[16]。Inooka等[17]应用相差消化法,以胰酶消化预处理,再用胰酶消化约2 h,使上皮细胞和成纤维细胞分离,并成功培养出瘤胃上皮细胞。而本试验采用了相差贴壁的方法。具体操作是待原代细胞生长至铺面培养皿底面积的80%~90%时,弃掉培养基,用含2%青-链霉素的PBS洗涤2~3次,再用0.25%胰蛋白酶-EDTA进行消化处理;消化处理后垂悬的细胞放入37 ℃含5% CO2的恒温培养箱中,培养30 min,转移含细胞的培养基到新的培养皿中,重复操作1次,经过2~3代的纯化后,可得到较纯(80 %)的瘤胃上皮细胞。
3.2山羊瘤胃上皮传代细胞凋亡比率与细胞周期分布情况
随着细胞与分子生物技术的不断发展进步,对细胞凋亡的机理认识不断成熟,相应的检测细胞凋亡技术随之完善,主要包括流式细胞术DNA琼脂糖凝胶电泳、电化学方法、蛋白质印迹(Western blot)、原位末端缺Ⅱ标记、RNA的逆转录和cDNA的反转录聚合酶链式扩增反应(reverse transcription-polymerase chain reaction,RT-PCR)等[18-20]。其中流式细胞术根据凋亡细胞从细胞核、细胞器到细胞膜均发生不同程度的细胞生物学和生物化学改变的特性,对凋亡细胞进行快速定量检测。流式细胞术不但可以检测处于细胞凋亡中、晚期的细胞,而且可以检测出处于凋亡早期的细胞。
本试验采用膜联蛋白V和PI联合染色法检测不同培养天数山羊瘤胃上皮传代细胞凋亡比率,发现凋亡比率随时间的增加而增加,到8 d时增加的最多。引起细胞凋亡比率升高的原因可能与极性线粒体受损有关。谭秀文等[21]采用玫瑰红123(rhodamine 123)荧光染色和PI联合染色发现,细胞凋亡比率与极性线粒体受损呈正相关。这是由于线粒体内自由基的积累导致极性线粒体膨大,线粒体内膜产生非特异性孔道,使一些启动细胞凋亡的物质流至胞质进而诱导细胞凋亡[22]。此外,本试验应用流式细胞术对不同培养天数的山羊瘤胃上皮传代细胞周期分布情况进行检测。结果显示,2、4、8 d内增殖期(S、G2/M期)细胞数量明显增多,而静止期(G0/G1期)细胞数量明显减少。这说明培养时间的延长对细胞由静止期进入增殖期没有产生严重的影响。可能的原因是随着时间增加,DNA聚合酶、RNA聚合酶、基因调节蛋白或细胞自身遗传物质未发生损伤。但是,细胞凋亡却随着培养时间的延长,凋亡比率随之增加,这与G0/G1期阻滞成负相关,所以,此问题有待进一步对凋亡机制进行试验研究。
4结论
① 应用0.25 %胰蛋白酶+0.02% EDTA连续消化及相差贴壁的方法得到较多、较纯,且细胞形态结构正常和生命活性较强的山羊瘤胃上皮细胞。
② 应用细胞免疫组化学方法对山羊瘤胃上皮传代细胞进行鉴定,细胞胞浆为黄褐色,即细胞CK19呈阳性表达。
③ 采用细胞计数法检测山羊瘤胃上皮传代细胞的生长活性,其生长活性曲线呈典型“S”型。
④ 采用膜联蛋白V和PI联合染色法检测原代细胞不同培养天数山羊瘤胃上皮传代细胞凋亡比率,发现随着培养时间的延长,细胞凋亡比率显著增加,到8 d时增加的最多。
参考文献:
[1]CHURCH D C.The ruminant animal digestive physiology and nutrition[M].Englewood Cliffs:Prentice Hall,1988.
[2]卢劲晔,黄智南,沈赞明.反刍动物瘤胃上皮的结构特点[J].黑龙江畜牧兽医,2014(16):50-52.
[3]GRAHAM C,SIMMONS N L.Functional organization of the bovine rumen epithelium[J].American Journal of Physiology,2005,288(1):R173-R181.
[4]WEEKES T E C.Theinvitrometabolism of propionate and glucose by the rumen epithelium[J].Comparative Biochemistry and Physiology Part B:Comparative Biochemistry,1974,49(3):393-406.
[7]KLOTZ J L,BALDWIN R L,GILLIS R C,et al.Refinements in primary rumen epithelial cell incubation techniques[J].Journal of Dairy Science,2001,84(1):183-193.
[8]STUMPFF F,GEORGI M I,MUNDHENK L,et al.Sheep rumen and omasum primary cultures and source epithelia:barrier function aligns with expression of tight junction proteins[J].Journal of Experimental Biolony,2011,214(17):2871-2882.
[9]范燕茹,王佩,金鑫,等.中国驯鹿瘤胃上皮细胞的体外分离培养[J].黑龙江畜牧兽医,2014(11):8-10,15,228.
[10]SWEENEY D,HOLLINS F,GOMEZ E,et al.No evidence for altered intracellular calcium-handling in airway smooth muscle cells from human subjects with asthma[J].BMC Pulmonary Medicine,2015,15:12.
[11]JALILZADEH-AMIN G,MAHAM M,DALIR-NAGHADEH B,et al.Effects ofMenthalongifoliaessential oil on ruminal and abomasal longitudinal smooth muscle in sheep[J].Journal of Essential Oil Research,2012,24(1):61-69.
[12]孙志洪,张庆丽,贺志雄,等.山羊瘤胃上皮细胞和空肠黏膜上皮细胞原代培养技术研究[J].动物营养学报,2010,22(3):602-610.
[13]LIU C Q,GUO Y,LU T F,et al.Establishment and genetic characteristics analysis ofinvitroculture a fibroblast cell line derived fromWuzhishanminiature pig[J].Cryobiology,2014,68(2):281-287.
[14]詹康,左晓昕,陈银银,等.猪小肠上皮细胞分离培养与鉴定[J].动物营养学报,2015,27(5):1477-1484.
[15]王海霞.山羊小肠上皮细胞系的建立及其对氮素的利用研究[D].硕士学位论文.扬州:扬州大学,2008.
[16]ROSE M T,ASO H,YONEKURA S,et al.Invitrodifferentiation of a cloned bovine mammary epithelial cell[J].Journal of Dairy Research,2002,69(3):345-355.
[17]INOOKA S,OHWADA S,TAMATE H.Cell cultivation of bovine rumen mucosa tissues[J].Canadian Journal of Animal Science,1984,64(5):110-111.
[18]WLODKOWIC D,SKOMMER J,DARZYNKIEWICZ Z.Cytometry of apoptosis.Historical perspective and new advances[J].Experimental Oncology,2012,34(3):255-262.
[19]BLANKENBERG F G.Invivodetection of apoptosis[J].Journal of Nuclear Medicine,2008,49(Suppl.2):81S-95S.
[20]WLODKOWIC D,TCLFORD W,SKOMMER J,et al.Apoptosis and beyond:cytometry in studies of programmed cell death[J].Methods in Cell Biology,2011,103:55-98.
[21]谭秀文,游伟,刘晓牧,等.培养时间和传代次数对山羊输卵管上皮细胞周期和凋亡的影响[J].解剖学报,2009,40(2):269-273.
[22]胡洁,蔡真.细胞器相关凋亡途径研究进展[J].中国肿瘤生物治疗杂志,2005,12(2):152~154.
(责任编辑王智航)
doi:10.3969/j.issn.1006-267x.2016.07.034
收稿日期:2016-01-25
基金项目:国家自然科学基金面上项目(31372342);国家科技支撑计划课题(2012BAD14B17);中国科学院科技服务网络计划(STS计划)课题(KFJ-EW-STS-071)
作者简介:韩奇鹏(1988—),男,内蒙古赤峰人,硕士研究生,研究方向反刍动物营养。E-mail: 18711069677@163.com *通信作者:张佩华,副教授,硕士生导师,E-mail: peiqin41-@163.com;周传社,研究员,硕士生导师,E-mail: zcs@isa.ac.cn
中图分类号:S826
文献标识码:A
文章编号:1006-267X(2016)07-2269-09
*Corresponding authors: ZHANG Peihua, associate professor, E-mail: peiqin41-@163.com; ZHOU Chuanshe, professor, E-mail: zcs@isa.ac.cn
Characteristics of Ruminal Epithelium Cell Cycle Distribution,Proliferation and Apoptosis ofLiuyangBlack Goats
HAN Qipeng1,2LUO Ling1JIE Hongdong1WANG Kaijun1ZHANG Peihua1*ZHOU Chuanshe2*KONG Zhiwei2TANG Shaohui2
(1. Hunan Provincial Key Laboratory for Genetic Improvement of Domestic Animal, College of Animal Science and Technology, Hunan Agricultural University, Changsha 410128, China; 2. Key Laboratory for Agro-Ecological Processes in Subtropical Region, Hunan Research Center of Livestock &Poultry Sciences, South-Central Experimental Station of Animal Nutrition and Feed Science of Ministry of Agriculture, Institute of Subtropical Agriculture, Chinese Academy of Sciences, Changsha 410125, China)
Abstract:The present study was carried out to establish an in vitro culture model of rumen epithelial cells of Liuyang black goats and investigated cell cycle distribution, proliferation and apoptosis. Ruminal epithelium tissue of 60-day-old Liuyang black goats was collected, and digested with 0.25% trypsin and 0.02% ethylene diamine tetraacetic acid (EDTA) to obtain individual primary cultured ruminal epithelium cells for in vitro culture. The morphous of ruminal epithelial cells in primary culture and subculture was observed under inverted microscope, the growth activity curve of cells was tested by cell number count assay, the identification of subcultured ruminal epithelium cells was carried out using the method of immunohistochemistry, and the subcultured ruminal epithelium cells cycle distribution and apoptosis ratio were determined through flow cytometry method. The results showed as follows: 1) the primary cultured ruminal epithelium cells of goats were obtained by digestion of 0.25% trypsin and 0.02% EDTA, began adherent growth after cultured for 1 d, an exponential growth started and resembled a “hill” in appearance since 2 d, the cell growth rate reached the highest at 3 to 4 d, and got stable at 7 d. 2) Identified by immunohistochemistry method, the cytoplasm was brown, which meant that cytokeratin 19 (CK19) was positive expressed. 3) The combination staining of Annexin V and propidium iodide showed that the apoptosis ratio of cells significantly increased with the prolongation of culture time (P<0.01). In conclusion, the ruminal epithelium cells of Liuyang black goats are obtained successfully by the method of 0.25% trypsin+0.02% EDTA digestion, which provided cell model for further study on mechanism and the function of ruminant rumen.[Chinese Journal of Animal Nutrition, 2016, 28(7):2269-2277]
Key words:Liuyang black goat; ruminal epithelium cell; cycle distribution; apoptosis
