不同蛋白质源对草鱼和花鲈肉质影响的比较研究
2016-08-03于晓彤梁晓芳李军国郑银桦吴秀峰梁旭方
于晓彤 梁晓芳 王 嘉* 韩 芳 李军国 郑银桦吴秀峰 王 鑫 梁旭方 薛 敏,4,5
(1.中国农业科学院饲料研究所,国家水产饲料安全评价基地,北京100081;2.农业部食物与营养发展研究所,北京100081;3.华中农业大学水产学院,武汉430070;4.农业部饲料生物技术重点开放实验室,北京100081;5.淡水水产健康养殖湖北省协同创新中心,武汉430070)
不同蛋白质源对草鱼和花鲈肉质影响的比较研究
于晓彤1梁晓芳2王嘉1*韩芳1李军国1郑银桦1吴秀峰1王鑫1梁旭方3薛敏1,4,5
(1.中国农业科学院饲料研究所,国家水产饲料安全评价基地,北京100081;2.农业部食物与营养发展研究所,北京100081;3.华中农业大学水产学院,武汉430070;4.农业部饲料生物技术重点开放实验室,北京100081;5.淡水水产健康养殖湖北省协同创新中心,武汉430070)
摘要:本试验旨在比较不同蛋白质源对草鱼(Ctenopharyngodon idellus)及花鲈(Lateolabrax japonicas)体成分、肌肉游离氨基酸组成及鱼片质构特性的影响。设计草鱼和花鲈饲料各3种,分别等氮等能。3种草鱼试验饲料分别为以鱼粉为唯一蛋白质源的CI-FM组(对照组),以混合植物蛋白质(豆粕和大豆浓缩蛋白)替代80%鱼粉的CI-PPB80组及以混合植物蛋白质替代100%鱼粉的CI-PPB100组。3种花鲈试验饲料分别为以鱼粉为唯一蛋白质源的LJ-FM组(对照组),以混合植物蛋白质(棉籽浓缩蛋白和大豆浓缩蛋白)替代50%鱼粉的LJ-PPB50组和以混合植物蛋白质替代100%鱼粉的LJ-PPB100组。草鱼初始体重为(153.40±0.30) g,随机分为3组,每组3个重复,每个重复20尾鱼;花鲈初始体重为(12.97±0.03) g,随机分为3组,每组4个重复,每个重复25尾鱼。饲喂8周后,检测2种试验鱼的体成分、肌肉游离氨基酸含量及鱼片质构特性、剪切力、滴水损失及胶原蛋白含量。结果表明:与CI-FM组相比,CI-PPB100组草鱼肌肉粗脂肪含量显著降低(P<0.05),粗灰分含量显著升高(P<0.05);而花鲈肌肉粗脂肪含量则随替代水平的升高呈现先上升后下降的趋势,表现为LJ-PPB50组显著高于LJ-PPB100组(P<0.05)。草鱼肌肉总游离氨基酸及生物胺前体含量各组间无显著差异(P>0.05);随着替代水平的升高,花鲈肌肉总游离氨基酸及呈味氨基酸含量显著降低(P<0.05),生物胺前体含量显著升高(P<0.05)。2种试验鱼肌肉中存在各自的特异性成分。2种试验鱼生、熟鱼片的质构特性差异较大。草鱼的CI-FM组和花鲈的LJ-FM组生鱼片的硬度、黏性、咀嚼力、回弹力及剪切力均分别显著高于同鱼种的其他2组(P<0.05)。对于熟鱼片,草鱼的CI-PPB80组内聚力显著高于其他2组(P<0.05),其他各项指标各组间无显著差异(P>0.05);花鲈的LJ-PPB100组硬度及黏附性显著高于LJ-FM组(P<0.05),其他各项指标各组间无显著差异(P>0.05)。根据结果,混合植物蛋白质替代鱼粉后降低了草鱼和花鲈鱼体脂肪的蓄积,对草鱼肌肉总游离氨基酸含量不造成影响,使花鲈肌肉呈味氨基酸含量下降,必需氨基酸含量减少,生物胺前体含量升高,货架期缩短;高植物蛋白质源饲料使得草鱼和花鲈的肉质均出现明显下降,而高鱼粉饲料可以保证2种试验鱼有较高的肉质。
关键词:草鱼;花鲈;蛋白质源;鱼粉;混合植物蛋白质;游离氨基酸;肉质

草鱼和花鲈均为我国重要的经济鱼类,二者在分类学上地位相差甚远。草鱼属鲤形目鲤科雅罗鱼亚科,是我国四大家鱼之一,同时也是我国淡水养殖中最重要的经济鱼类。2012年我国淡水鱼养殖产量为2 334万t,其中草鱼的产量占将近20%。花鲈属鲈形目科花鲈属,是广温广盐的肉食性鱼类。花鲈肉味鲜美、市场价值高、养殖周期短,是我国海水养殖产量最高的品种。本试验以草鱼和花鲈为研究对象,分别用鱼粉和混合植物蛋白质源作为部分或全部蛋白质源,进行为期8周的养殖试验,旨在比较不同蛋白质源对草鱼和花鲈体成分、肌肉游离氨基酸含量及生、熟鱼片质构特性的影响,为合理利用植物蛋白质源提供理论依据。
1材料与方法
1.1试验饲料
设计草鱼和花鲈饲料各3种,同鱼种的3种饲料等氮等能。3种草鱼试验饲料分别为以鱼粉为唯一蛋白质源的CI-FM组(对照组),以混合植物蛋白质(豆粕和大豆浓缩蛋白)替代80%鱼粉的CI-PPB80组及以混合植物蛋白质替代100%鱼粉的CI-PPB100组。3种花鲈试验饲料分别为以鱼粉为唯一蛋白质源的LJ-FM组(对照组),以混合植物蛋白质(棉籽浓缩蛋白和大豆浓缩蛋白)替代50%鱼粉的LJ-PPB50组和以混合植物蛋白质替代100%鱼粉的LJ-PPB100组。各饲料原料按照添加量从小到大的顺序逐级混匀,草鱼试验饲料制成粒径为3 mm的挤压膨化浮性饲料,花鲈试验饲料制成粒径为2 mm的挤压膨化沉性饲料(TSE65型,北京现代洋工机械科技发展有限公司),自然晾干后在室温下于干燥通风处保存。草鱼和花鲈试验饲料组成及营养水平见表1。
1.2试验鱼与饲养管理
试验所用草鱼为2龄鱼种,购自北京通州小务渔场;试验所用花鲈为当年苗种,购自山东威海裕隆水产开发有限公司,花鲈逐步从海水淡化为淡水苗种。正式试验前进行为期4周的驯化,使其适应环境。试验选择体质健康、大小均匀的草鱼[平均体重为(153.40±0.30) g]和花鲈[平均体重为(12.97±0.03) g],各随机分为3组,进行为期8周的养殖试验,每天表观饱食投喂2次,时间分别为09:00和21:00。草鱼每组3个重复,每个重复20尾;花鲈每组4个重复,每个重复25尾。
养殖试验于国家水产饲料安全评价基地(位于北京昌平区南口镇)室内循环水系统中进行。试验鱼以重复为单位饲养于养殖桶中,养殖桶体积为256 L,试验用水为曝气井水,水流速度约为0.4 L/min。试验期间每日测量温度,每周测定水质情况,水体溶氧浓度>7 mg/L,pH为7.5~8.5,氨氮浓度<0.3 mg/L,亚硝酸盐浓度<0.1 mg/L,草鱼养殖系统水温为22~25 ℃,花鲈养殖系统水温为23~26 ℃。
1.3样品采集
养殖试验结束后,试验鱼禁食24 h后采样,草鱼和花鲈采用相同的采样及分析方法,具体参考张志勇等[6]。

表1 草鱼和花鲈试验饲料组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of experimental diets for Ctenopharyngodon idellus andLateolabrax japonicas (DM basis) %
草鱼预混料为每千克饲料提供 The premix ofCtenopharyngodonidellusprovided the following per kg of diets:VA 28 mg,VD314 mg,VE 300 mg,VB112 mg,VB212 mg,VB616 mg,烟酸 niacin 80 mg,VC 600 mg,泛酸钙 calciumpatotheniate 100 mg,VK 20 mg,生物素 biotin 0.4 mg,VB120.2 mg,叶酸 folic acid 3 mg,玉米蛋白粉 corn gluten powder 314.4 mg,MgSO4·5H2O 500 mg, FeSO4·H2O 300 mg,ZnSO4·H2O 300 mg,MnSO4·H2O 100 mg,Na2SeO367 mg,CoCl2·6H2O 2.5 mg,KI 80 mg,沸石粉 zeolite powder 150.5 mg。花鲈预混料配方引用张志勇等[6]。The premix ofLateolabraxjaponicasreferenced from Zhang et al[6].
1.4指标测定
1.4.1试验饲料及全鱼营养成分
草鱼每桶随机取1尾,花鲈每桶随机取3尾作为全鱼样品,使用匀浆机(Retsch GM300)将全鱼绞碎后于60 ℃烘箱烘干用于体成分的检测。试验饲料和全鱼的水分、粗蛋白质、粗脂肪、粗灰分含量和总能分别采用105 ℃常压干燥法(GB/T 6435—2006)、凯氏定氮法(GB/T 6432—94)、全脂肪测定法(GB/T 6433—2006)、550 ℃灼烧法(GB/T 6438—2007)和氧弹仪燃烧法测定。
1.4.2肌肉游离氨基酸组成
草鱼和花鲈每桶均随机取2尾,去皮后,取两侧肌肉,用冷冻干燥机进行冷冻干燥后粉碎。肌肉样品用8%磺基水杨酸处理后,加蒸馏水稀释并用正己烷进行脱脂。沉淀后离心,吸净上层正己烷,取下层清液过柱净化后上氨基酸分析仪检测游离氨基酸含量。氨基酸分析仪型号Sykam S433D;色谱柱:LCAK07/Li;流动相:流动相A、B、C均为柠檬酸锂,其中流动相A pH=2.9、流动相B pH=4.2、流动相C pH=8.0。
1.4.3鱼片质构特性、剪切力、滴水损失及胶原蛋白含量
鱼片质构特性、剪切力、滴水损失及胶原蛋白含量的测定参照张志勇等[6]。
1.5数据统计与分析
2种试验鱼试验数据均以平均值±标准误(mean±SE)表示,使用SPSS 22.0软件对试验数据进行单因素方差分析(one-way ANOVA),通过Duncan氏法进行多重比较检验;2个鱼种间各指标平均值间的比较,采用独立样本t检验进行检验。2种检验方法均以P<0.05为差异显著性标准。
2结果
2.1不同蛋白质源对草鱼和花鲈末体重和体成分的影响
2种试验鱼的末体重和体成分结果见表2。草鱼鱼体粗蛋白质含量显著低于花鲈(P<0.05),而粗脂肪、粗灰分含量及总能、末体重均显著高于花鲈(P<0.05)。草鱼中,CI-FM组末体重显著低于其他2组(P<0.05);花鲈中,LJ-PPB100组末体重显著低于其他2组(P<0.05)。草鱼中,CI-FM组鱼体粗脂肪含量显著高于CI-PPB100组(P<0.05),而鱼体粗灰分含量则显著低于CI-PPB100组(P<0.05),各组间鱼体粗蛋白质、水分含量及总能并没有显著差异(P>0.05);花鲈中,LJ-PPB50组鱼体粗脂肪含量显著高于LJ-PPB100组(P<0.05),其他各体成分指标组间没有显著差异(P>0.05)。
2.2不同蛋白质源对草鱼和花鲈肌肉中游离氨基酸组成的影响
2种试验鱼的肌肉游离氨基酸组成结果见表3。草鱼与花鲈相比,肌肉中呈味氨基酸、生物胺前体及必需氨基酸与总游离氨基酸的含量有较大区别:草鱼肌肉中呈味氨基酸占总游离氨基酸的比例为31.13%~34.92%,而花鲈则高达68.16%~78.58%;草鱼肌肉中生物胺前体占总游离氨基酸的比例为47.77%~50.66%,花鲈则为12.02%~20.17%;草鱼肌肉中必需氨基酸占总游离氨基酸的比例为55.51%~56.48%,花鲈则为8.52%~18.83%。草鱼肌肉中的生物胺前体、必需氨基酸和总游离氨基酸含量均显著高于花鲈(P<0.05)。
对于肌肉游离氨基酸中的呈味氨基酸含量,草鱼的CI-FM组显著高于CI-PPB100组(P<0.05),与CI-PPB80组无显著差异(P>0.05);同样,随着替代水平的升高,花鲈肌肉游离氨基酸中的呈味氨基酸含量显著下降(P<0.05)。从肌肉中与呈味相关的游离氨基酸看,对于草鱼,谷氨酸含量表现为CI-PPB80组显著低于其他2组(P<0.05),丙氨酸含量表现为CI-PPB100组显著高于CI-PPB80组(P<0.05),甘氨酸含量表现为CI-FM组显著高于其他2组(P<0.05),牛磺酸含量则表现为各组间无显著差异(P>0.05);对于花鲈,谷氨酸及丙氨酸含量均表现为LJ-FM组显著低于LJ-PPB100组(P<0.05),甘氨酸及天冬氨酸含量均表现为LJ-FM组及LJ-PPB50组显著高于LJ-PPB100组(P<0.05),牛磺酸含量则表现为随替代水平的升高而显著降低(P<0.05)。
对于肌肉游离氨基酸中的生物胺前体含量,草鱼各组间无显著差异(P>0.05),花鲈的LJ-PPB100组显著高于其他2组(P<0.05)。从肌肉中与生物胺前体相关的游离氨基酸看,对于草鱼,组氨酸含量表现为CI-FM组显著低于其他2组(P<0.05),酪氨酸及赖氨酸含量均表现为CI-FM组显著高于CI-PPB100组(P<0.05),精氨酸和鸟氨酸含量均表现为各组间无显著差异(P>0.05);对于花鲈,组氨酸、赖氨酸含量均表现为随替代水平的升高而显著升高(P<0.05),而鸟氨酸、色氨酸及精氨酸含量则表现为随替代水平的升高而显著降低(P<0.05)。

表2 草鱼和花鲈的末体重及体成分Table 2 FBW and body composition of Ctenopharyngodon idellus and Lateolabrax japonicas
2种试验鱼的数据分别进行单因素方差分析,组间差异显著(P<0.05)时,草鱼用不同小写字母(a、b、c)肩标表示,花鲈用不同大写字母(A、B、C)肩标表示。2个鱼种间各指标平均值进行独立样本t检验,鱼种间差异显著(P<0.05)时,用不同小写字母(x、y)肩标表示。下表同。
Values of the two species were analyzed by one-way ANOVA, and with different small letter (a, b and c) superscripts forCtenopharyngodonidellusand different capital letter (A, B, C) superscripts forLateolabraxjaponicasindicated significant difference among different groups (P<0.05), respectively. Means of the two species were analyzed byttest, and with different small letter (x and y) superscripts indicated significant difference between two species (P<0.05). The same as below.

表3 草鱼和花鲈肌肉中游离氨基酸组成(鲜重基础)Table 3 Free amino acid composition in muscle of Ctenopharyngodon idellus andLateolabrax japonicas (fresh weight basis) 10-2 g/kg
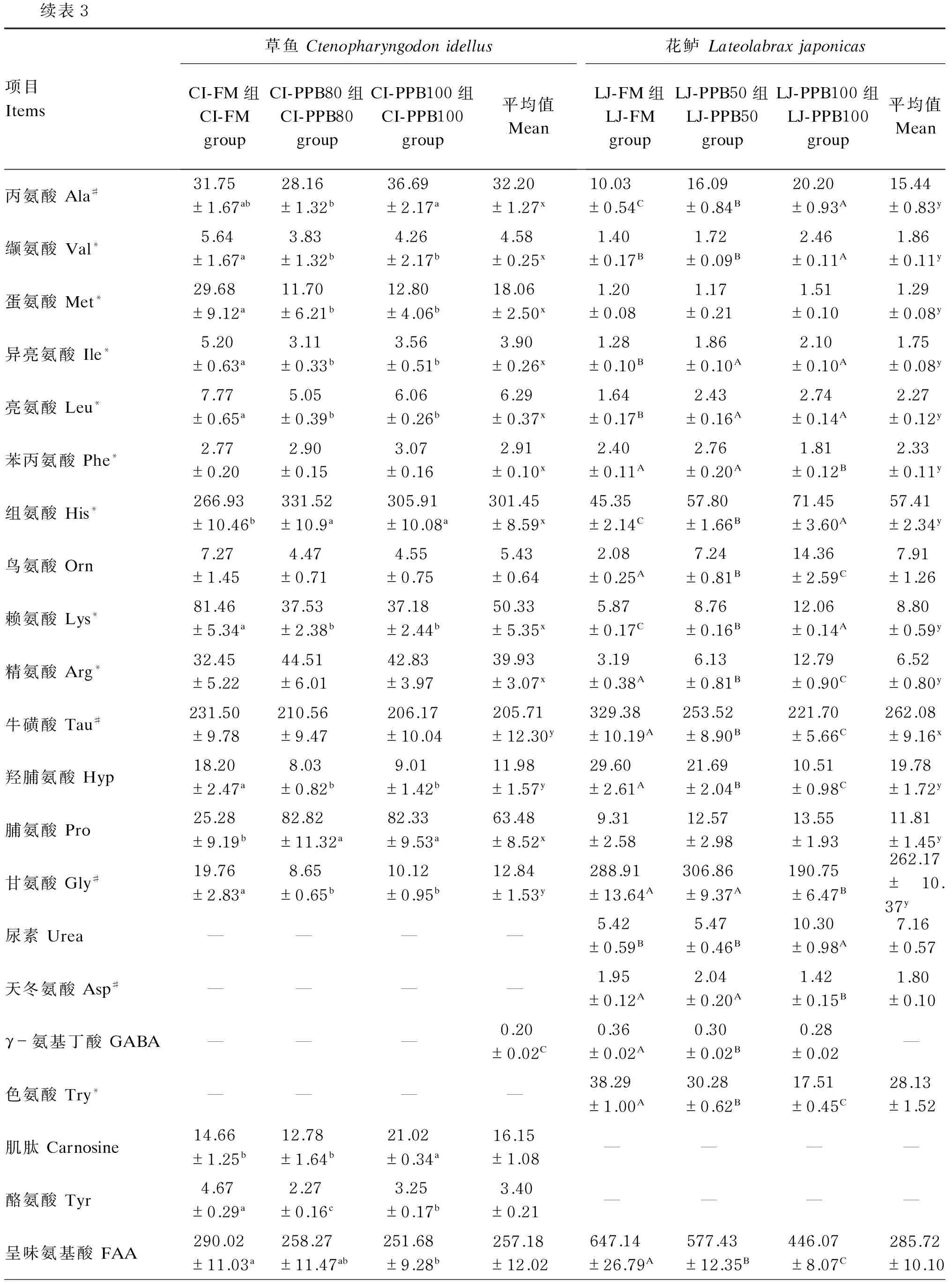
续表3项目Items草鱼CtenopharyngodonidellusCI-FM组CI-FMgroupCI-PPB80组CI-PPB80groupCI-PPB100组CI-PPB100group平均值Mean花鲈LateolabraxjaponicasLJ-FM组LJ-FMgroupLJ-PPB50组LJ-PPB50groupLJ-PPB100组LJ-PPB100group平均值Mean丙氨酸Ala#31.75±1.67ab28.16±1.32b36.69±2.17a32.20±1.27x10.03±0.54C16.09±0.84B20.20±0.93A15.44±0.83y缬氨酸Val*5.64±1.67a3.83±1.32b4.26±2.17b4.58±0.25x1.40±0.17B1.72±0.09B2.46±0.11A1.86±0.11y蛋氨酸Met*29.68±9.12a11.70±6.21b12.80±4.06b18.06±2.50x1.20±0.081.17±0.211.51±0.101.29±0.08y异亮氨酸Ile*5.20±0.63a3.11±0.33b3.56±0.51b3.90±0.26x1.28±0.10B1.86±0.10A2.10±0.10A1.75±0.08y亮氨酸Leu*7.77±0.65a5.05±0.39b6.06±0.26b6.29±0.37x1.64±0.17B2.43±0.16A2.74±0.14A2.27±0.12y苯丙氨酸Phe*2.77±0.202.90±0.153.07±0.162.91±0.10x2.40±0.11A2.76±0.20A1.81±0.12B2.33±0.11y组氨酸His*266.93±10.46b331.52±10.9a305.91±10.08a301.45±8.59x45.35±2.14C57.80±1.66B71.45±3.60A57.41±2.34y鸟氨酸Orn7.27±1.454.47±0.714.55±0.755.43±0.642.08±0.25A7.24±0.81B14.36±2.59C7.91±1.26赖氨酸Lys*81.46±5.34a37.53±2.38b37.18±2.44b50.33±5.35x5.87±0.17C8.76±0.16B12.06±0.14A8.80±0.59y精氨酸Arg*32.45±5.2244.51±6.0142.83±3.9739.93±3.07x3.19±0.38A6.13±0.81B12.79±0.90C6.52±0.80y牛磺酸Tau#231.50±9.78210.56±9.47206.17±10.04205.71±12.30y329.38±10.19A253.52±8.90B221.70±5.66C262.08±9.16x羟脯氨酸Hyp18.20±2.47a8.03±0.82b9.01±1.42b11.98±1.57y29.60±2.61A21.69±2.04B10.51±0.98C19.78±1.72y脯氨酸Pro25.28±9.19b82.82±11.32a82.33±9.53a63.48±8.52x9.31±2.5812.57±2.9813.55±1.9311.81±1.45y甘氨酸Gly#19.76±2.83a8.65±0.65b10.12±0.95b12.84±1.53y288.91±13.64A306.86±9.37A190.75±6.47B262.17±10.37y尿素Urea————5.42±0.59B5.47±0.46B10.30±0.98A7.16±0.57天冬氨酸Asp#————1.95±0.12A2.04±0.20A1.42±0.15B1.80±0.10γ-氨基丁酸GABA———0.20±0.02C0.36±0.02A0.30±0.02B0.28±0.02—色氨酸Try*————38.29±1.00A30.28±0.62B17.51±0.45C28.13±1.52肌肽Carnosine14.66±1.25b12.78±1.64b21.02±0.34a16.15±1.08————酪氨酸Tyr4.67±0.29a2.27±0.16c3.25±0.17b3.40±0.21————呈味氨基酸FAA290.02±11.03a258.27±11.47ab251.68±9.28b257.18±12.02647.14±26.79A577.43±12.35B446.07±8.07C285.72±10.10

续表3项目Items草鱼CtenopharyngodonidellusCI-FM组CI-FMgroupCI-PPB80组CI-PPB80groupCI-PPB100组CI-PPB100group平均值Mean花鲈LateolabraxjaponicasLJ-FM组LJ-FMgroupLJ-PPB50组LJ-PPB50groupLJ-PPB100组LJ-PPB100group平均值Mean生物胺前体Biogenicprecursor396.64±17.72420.31±10.25393.71±11.98403.55±7.97x99.01±4.70C111.75±4.26B132.02±7.52A114.26±3.93y必需氨基酸EAA469.09±17.87462.43±7.90444.86±13.74458.80±7.88x70.19±3.52C93.10±3.37B123.26±6.44A114.26±3.03y总游离氨基酸TFAA830.48±17.28829.59±14.87801.47±31.65820.52±12.64x823.57±35.96A765.37±13.39A654.46±14.86B442.83±10.58y
#为呈味氨基酸;*为必需氨基酸。
# means flavor amino acids; * means essential amino acids.
对于肌肉游离氨基酸中的必需氨基酸含量,草鱼各组间无显著差异(P>0.05),花鲈则随替代水平的升高而显著升高(P<0.05)。肌肉中限制性必需氨基酸中,草鱼的蛋氨酸及赖氨酸含量均表现为CI-FM组显著高于其他2组(P<0.05);花鲈的蛋氨酸含量各组间无显著差异(P<0.05),赖氨酸含量则随替代水平的升高而显著降低(P<0.05)。
由检测结果可知,2种试验鱼的肌肉中均检出一些特异性成分,花鲈肌肉中检出游离氨基酸天冬氨酸和色氨酸,必需氨基酸衍生物γ-氨基丁酸及含氮化合物尿素;草鱼肌肉中则检出肌肽和酪氨酸。
2.3不同蛋白质源对草鱼和花鲈鱼片质构特性、剪切力、胶原蛋白含量及滴水损失的影响
2种试验鱼的鱼片质构特性、剪切力、胶原蛋白含量及滴水损失的结果见表4。草鱼和花鲈鱼片的质构特性差异较大,其中草鱼生鱼片的硬度、内聚力、黏性、咀嚼力、回弹力及剪切力均显著低于花鲈生鱼片(P<0.05);草鱼熟鱼片的黏附性显著高于花鲈,而内聚力、黏性及咀嚼力则显著低于花鲈(P<0.05)。

表4 草鱼和花鲈的鱼片质构特性、剪切力、胶原蛋白含量及滴水损失Table 4 Texture characteristics, shear force, collagen content and drop loss of fillets ofCtenopharyngodon idellus and Lateolabrax japonicas

续表4项目Items草鱼CtenopharyngodonidellusCI-FM组CI-FMgroupCI-PPB80组CI-PPB80groupCI-PPB100组CI-PPB100group平均值Mean花鲈LateolabraxjaponicasLJ-FM组LJ-FMgroupLJ-PPB50组LJ-PPB50groupLJ-PPB100组LJ-PPB100group平均值Mean黏性Gumminess/g113.56±10.01a75.42±6.91b73.37±7.09b87.45±5.91y230.04±18.57A186.74±10.53B186.81±8.63B200.37±8.02x咀嚼力Chewiness/g89.84±7.42a60.35±5.02b60.08±5.23b70.09±4.41y203.53±16.38A153.83±10.53B168.89±8.09B174.61±7.53x回弹力Resilience/g0.099±0.009a0.069±0.006b0.071±0.006b0.081±0.001y0.112±0.010A0.089±0.002B0.081±0.001C0.092±0.002x剪切力Shearforce/g595.55±24.59a357.47±19.97b396.89±30.98b449.97±25.91y968.98±107.70A728.71±47.48B704.03±39.47B800.57±44.97x胶原蛋白含量3.97±0.40a3.03±0.35ab2.75±0.24b3.25±0.222.27±0.18A1.86±0.12AB1.63±0.12B1.92±0.11Collagencontent/(μg/mg)滴水损失Droploss/%6.31±0.61a3.74±0.27b3.60±0.24b4.39±0.336.64±0.51A5.10±0.26B5.91±0.58AB5.88±0.28熟鱼片Cookedfillets/g硬度Hardness350.22±32.69274.22±14.82337.55±27.07320.66±15.91253.30±19.09B253.97±26.17B356.17±46.08A287.81±19.98黏附性Adhesiveness15.72±1.2820.47±1.1720.84±2.5619.01±1.10x6.79±1.26B15.42±1.92A14.64±2.52A12.28±1.28y弹性Springiness0.86±0.010.86±0.010.86±0.010.86±0.000.78±0.020.86±0.020.87±0.020.84±0.01内聚力Cohesiveness0.39±0.013b0.43±0.00a0.40±0.01b0.41±0.01y0.49±0.030.50±0.020.48±0.030.49±0.02x黏性Gumminess114.55±9.83106.06±4.90111.22±6.03110.61±4.06y127.79±13.32128.64±14.13169.76±23.19142.06±10.33x咀嚼力Chewiness95.61±8.3090.96±4.5892.15±4.7592.91±3.40y100.74±11.64109.36±11.75148.3±21.86119.46±9.54x回弹力Resilience0.10±0.000.19±0.100.10±0.000.13±0.030.09±0.000.08±0.000.09±0.010.08±0.00
对于生鱼片的质构特性,硬度、黏性、咀嚼力及回弹力的结果草鱼及花鲈表现出一致性,即全鱼粉组(CI-FM组与LJ-FM组)显著高于同鱼种的其他2组(P<0.05)。草鱼和花鲈生鱼片的黏附性呈现相反的趋势,草鱼的CI-PPB80组显著高于其他2组(P<0.05),而花鲈的LJ-PPB50组却显著低于LJ-FM组(P<0.05),与LJ-PPB100组无显著差异(P>0.05)。对于内聚力,草鱼的CI-FM组显著高于CI-PPB80组(P<0.05),与CI-PPB100组无显著差异(P>0.05),而花鲈的各组间无显著差异(P>0.05)。对于弹性,草鱼的CI-PPB100组显著高于其他2组(P<0.05),而花鲈则为LJ-PPB50组显著高于其他2组(P<0.05)。
对于熟鱼片的质构特性,草鱼的CI-PPB80组内聚力显著高于其他2组(P<0.05),而对于硬度、黏附性、弹性、黏性、咀嚼力以及回弹力等各项指标,各组间并没有显著差异(P>0.05);花鲈的LJ-PPB100组硬度显著高于其他2组(P<0.05),LJ-FM组黏附性显著低于其他2组(P<0.05),而对于弹性、内聚力、黏性、咀嚼力及回弹力等各项指标,各组间没有出现显著差异(P>0.05)。
2种试验鱼生鱼片的剪切力差异较大,花鲈要远高于草鱼(P<0.05)。花鲈和草鱼生鱼片的剪切力均呈现出全鱼粉组显著高于同鱼种的其他2组(P<0.05)。
对于生鱼片的胶原蛋白含量,草鱼与花鲈之间无显著差异(P>0.05);草鱼的CI-FM组显著高于CI-PPB100组(P<0.05),而与CI-PPB50组无显著性差异(P>0.05),同样的现象也出现在花鲈上。
对于生鱼片的滴水损失,草鱼与花鲈之间无显著差异(P>0.05);草鱼的CI-FM组显著高于其他2组(P<0.05),而花鲈的LJ-FM组仅显著高于LJ-PPB50组(P<0.05),与LJ-PPB100组无显著差异(P>0.05)。
3讨论
3.1不同蛋白质源对草鱼和花鲈体成分的影响
对于草鱼,饲喂蛋白质源不同的饲料,鱼体粗脂肪和粗灰分含量均发生了显著改变;而对于花鲈,仅全鱼粗脂肪含量有显著变化。De Francesco等[2]用75%的混合植物蛋白质替代鱼粉后饲喂真鲷,结果发现鱼体粗脂肪及粗蛋白质的含量并未发生显著变化;刘运正[7]用混合植物蛋白质(小麦粉、豆粕、玉米蛋白粉等)分别替代40%、50%及60%的鱼粉,对大菱鲆鱼体水分、粗灰分、粗蛋白质及粗脂肪含量均未产生显著影响。Gómez-Requeni等[8]在真鲷的研究中发现,混合植物蛋白质替代鱼粉后,其全鱼的粗脂肪含量显著下降,粗灰分含量呈上升趋势,这一结果与本试验中草鱼体成分的变化相一致,说明鱼体成分可能受到品种、规格和饲料组成等多种因素的影响,本试验中草鱼和花鲈的末体重差异较大,鱼类在不同生长阶段的体成分,特别是体脂肪的沉积效率有所不同。此外,草鱼饲料中以大豆油作为脂肪来源平衡饲料能量,而考虑到海水鱼对n-3高不饱和脂肪酸(HUFA)的需求,花鲈饲料中则是以适量的鱼油满足其需求量[9]后以大豆油平衡饲料能量。当鱼粉被混合植物蛋白质替代后,饲料中脂肪酸结构也发生了较大变化,不同脂肪源对鱼体脂肪沉积的影响也十分显著[10]。LJ-PPB50组在末体重与LJ-FM组没有显著差异的前提下,其鱼体粗脂肪含量与LJ-FM组也没有显著差异,但LJ-PPB100组的鱼体粗脂肪含量则较LJ-FM组显著下降,其原因与其显著下降的生长性能有关。
3.2不同蛋白质源对草鱼和花鲈肌肉中游离氨基酸组成的影响
饲料中的蛋白质在动物体内的消化过程是小肽和氨基酸释放与吸收同时进行的动态变化过程[10]。大多数小肽可被肠上皮细胞水解为游离氨基酸,与吸收的氨基酸一同转运进入血液循环[11]。从肠道吸收而来的氨基酸与体内组织降解蛋白质产生的氨基酸在一起组成氨基酸代谢库,作为蛋白质合成与氨基酸代谢的储备。草鱼是典型的草食性鱼类,而花鲈则是典型的肉食性鱼类,二者由于食性的分化,其消化道对不同蛋白质源的消化能力不同[NRC(2011)][12]。Gómez-Requeni等[8]用混合植物蛋白质替代鱼粉后饲喂真鲷,使其肌肉中总游离氨基酸含量极显著升高。当非鱼粉蛋白质源替代饲料中45%鱼粉蛋白质后,无论添加外源氨基酸与否,肌肉中总氨基酸及必需氨基酸含量均较全鱼粉组显著降低[13]。本试验中,以混合植物蛋白质替代鱼粉后饲喂花鲈,其肌肉总游离氨基酸含量随替代水平的升高呈现先上升后下降的趋势,与前人研究结果[6]存在差异。而不同蛋白质源对草食性鱼类肌肉中游离氨基酸含量影响的研究尚为空白阶段。
鱼片的风味主要取决于肌肉游离氨基酸中具有鲜味的呈味氨基酸的含量,主要包括丙氨酸、谷氨酸、天冬氨酸及甘氨酸[14]。其中,甘氨酸和丙氨酸是呈甘味的特征氨基酸,谷氨酸和天冬氨酸是呈鲜味的特征氨基酸,普遍认为谷氨酸对风味起到的作用最大,甘氨酸次之[15]。膨化饲料中豆粕100%替代鱼粉后,建鲤肌肉中呈味氨基酸——谷氨酸和甘氨酸的含量降低[4]。张志勇等[6]在混合植物蛋白质替代鱼粉对花鲈肉质影响的研究中发现,随着替代水平的上升,花鲈肌肉中总游离氨基酸和呈味氨基酸的含量均呈现先上升后下降的趋势。在草鱼上,肌肉中呈味氨基酸含量随植物蛋白质替代鱼粉水平的上升出现先下降后上升的现象,而花鲈肌肉中呈味氨基酸含量随植物蛋白质替代鱼粉的上升而下降,这一结果与末体重的结果并没有表现出一致性,说明肌肉游离氨基酸中呈味氨基酸的含量并不完全受生长性能的影响。从饲料氨基酸含量结果来看,草鱼和花鲈全鱼粉饲料中呈味氨基酸含量是低于其他2组的,但肌肉中呈味氨基酸含量并没有与饲料表现出相同的趋势,反而皆为全鱼粉组最高,说明草鱼和花鲈对于鱼粉中与呈味相关氨基酸的转运效率较高。本试验发现,花鲈肌肉游离氨基酸中甘氨酸的含量远远高于草鱼,使得花鲈鱼肉的甘味较之于草鱼有极大的提高,口感更佳。以鱼粉作为唯一蛋白质源可以提高草鱼肌肉中谷氨酸和甘氨酸的含量,从而提高鱼片风味;对于花鲈,甘氨酸对肉品风味有较大贡献。此外,牛磺酸也是一种重要的呈味氨基酸。牛磺酸在海生动物体内含量十分丰富,而植物来源的蛋白质中却尤为缺乏。不论草鱼抑或花鲈,2个混合植物蛋白质组肌肉游离氨基酸中牛磺酸含量均低于全鱼粉组,说明饲料中牛磺酸的含量对鱼体肌肉游离氨基酸中牛磺酸的含量有一定影响。综上所述,无论是对于肉食性鱼类还是对于草食性鱼类,鱼粉均保证了肉品的良好风味。
生物胺是鱼、贝类死亡后由游离氨基酸转化而来的一类含氮低分子质量的有机化合物,主要包括组胺、酪胺、尸胺、腐胺、精胺、亚精胺、色胺等,它们的前体物分别为组氨酸、酪氨酸、赖氨酸、鸟氨酸、精氨酸及色氨酸[16]。过量生物胺对人类健康会造成危害[17],引起食品安全问题,其中组胺的危害性最大[18]。有试验表明,豆粕100%替代鱼粉可降低建鲤肌肉中游离组氨酸的含量[4]。本试验中,草鱼肌肉游离氨基酸中组氨酸的含量远高于花鲈,说明长期储存的草鱼食用风险相对较高。2种试验鱼肌肉中组氨酸的含量均随替代水平的升高而显著增加,表明高植物蛋白质饲料会缩短草鱼和花鲈的货架期,这一结果与张志勇等[6]得出的结果一致。
非鱼粉蛋白质源中最受限的2种氨基酸是蛋氨酸和赖氨酸。有研究表明,肉食性鱼类如欧洲鳗鱼(Anguillaanguilla)[19]、樱鳟(Oncorhynchusmasu)[20]、虹鳟(Oncorhynchusmykiss)[21]等,随植物蛋白质源饲料摄入量的升高,肌肉游离氨基酸中蛋氨酸和赖氨酸等必需氨基酸的含量显著降低。本试验中,2个混合植物蛋白质组的草鱼肌肉游离氨基酸中蛋氨酸和赖氨酸的含量均显著降低,其原因:一方面,植物蛋白质源的生物学价值低于鱼粉,豆粕中严重缺乏蛋氨酸,且赖氨酸为第二限制性氨基酸。以豆粕为外源氨基酸替代鱼粉后,即使饲料中添加晶体氨基酸,也不能有效转运入肌肉中;另一方面,混合植物蛋白质源本身存在氨基酸不平衡的问题,研究表明,中枢神经系统通过氨基酸应答(AAR),应对氨基酸摄入不平衡时,机体趋向于分解代谢。而花鲈肌肉游离氨基酸中赖氨酸的含量则与草鱼相反,以全混合植物蛋白质组的赖氨酸含量最高,说明不同物种间的氨基酸转运机制存在差异,有待进一步研究。
草鱼和花鲈肌肉中均存在特异性氨基酸。在花鲈肌肉中检出了天冬氨酸、γ-氨基丁酸及色氨酸,而在草鱼肌肉中检出了肌肽和酪氨酸,此外,花鲈肌肉中还含有一定量的尿素。经分析,海水鱼的渗透压是通过保留尿素和少量其他含氮化合物来调节的,而淡水鱼则多通过排泄氨将体内的含氮废物排出[22],因此在花鲈肌肉中检出了尿素。草鱼和花鲈分别为典型的淡水草食性鱼类和海水肉食性鱼类,由于品种、食性和原始生存环境的差异使得二者肌肉游离氨基酸及含氮化合物的组成存在特异性差异,但尚未发现与此现象相关的报道,有待进一步研究。
3.3不同蛋白质源对草鱼和花鲈鱼片质构特性、剪切力、胶原蛋白含量及滴水损失的影响
质构分析的检测原理是利用力学测试模拟人的2次咀嚼动作,记录力和时间的关系,从中找出与人的感官评价相对应的参数,主要参数包括,硬度、咀嚼力、内聚力、弹性、黏附性、黏性以及回弹力[6]。生鱼片与熟肉片相比,草鱼和花鲈肉的硬度均显著降低。这是由于肌原纤维蛋白、肌浆蛋白受热后变形,肌肉组织中维持内部结构的氢键、疏水键等被打断,蛋白质二级结构被破坏,肌纤维变得松散而使硬度下降。草鱼和花鲈生鱼片质构特性差异较大,草鱼生鱼片的硬度、黏性、咀嚼力均显著低于花鲈生鱼片,二者间熟肉片差异较小。由于鱼肉的硬度和咀嚼力越高,鱼肉的口感越好[23],因此花鲈生鱼片口感要优于草鱼。本研究结果表明,以鱼粉为蛋白质源使草鱼和花鲈肌肉的硬度和咀嚼力均得到显著提高,使口感更佳。
内聚力和黏附性反映相反的物理性质,内聚力增强则黏附性降低[24]。草鱼摄食全鱼粉饲料后,肌肉的内聚力、回弹力显著增强,而弹性和黏附性则显著降低,说明全鱼粉饲料可使草鱼肌肉细胞间结合能力增强,鱼肉抵抗受损保持完整性的能力增强,使得鱼肉在被咀嚼时更加弹牙,口感更佳。花鲈摄食全混合植物蛋白质源饲料后,回弹力、弹性、黏附性均显著降低,说明对于草食性鱼类和肉食性鱼类,鱼粉均能有效改善肉质。
胶原蛋白是一种重要的肌肉组织成分,在维持肌肉结构、柔韧性、强度、质地等方面起着重要作用[25]。有研究表明胶原蛋白含量与肉的嫩度呈负相关[26]。胶原蛋白中羟脯氨酸含量相对稳定,占胶原蛋白的13%~14%,所以一般用羟脯氨酸的含量来反映胶原蛋白的含量[27]。Zhang等[28]研究发现,大菱鲆肌肉中胶原蛋白含量随饲料中羟脯氨酸含量的升高而升高;Albrektsen等[29]研究表明,饲料中添加羟脯氨酸可以使大西洋鲑肌肉硬度显著提高5%~10%。同样,Periago等[30]研究发现,鲈鱼肌肉胶原蛋白含量与肌肉硬度、咀嚼力及弹性均成正比。本试验中,随替代水平的升高,草鱼和花鲈全鱼粉组生鱼片中胶原蛋白含量显著高于其他2组,同时硬度、咀嚼力、回弹力也体现为全鱼粉组显著高于其他2组。鱼类本身合成羟脯氨酸的能力不足,而鱼粉中含有植物蛋白质源缺少的羟脯氨酸,以混合植物蛋白质为蛋白质源会造成肌肉中羟脯氨酸的含量显著降低,从而使草鱼和花鲈肉的硬度降低。
剪切力是最通用的借助仪器来客观衡量肉品硬度的方法[31]。剪切力主要是模拟牙齿切割肌纤维的方式对样品进行一次切割,然后通过电脑输出测试曲线进行分析[32]。本试验中,混合植物蛋白质源替代鱼粉后,使草鱼和花鲈生鱼片的剪切力显著降低,从而表现出鱼肉的硬度降低,口感下降。
滴水损失用来表示肌肉系水力,可反映肌肉中水分的保持程度,高系水力可保持肌肉中水分含量,减少肉品水分过多散失,防止肉品失去鲜度和固有风味[33]。滴水损失与鱼肉的货架期相关,Jonsson等[34]报道,滴水损失升高预示着货架期缩短,滴水损失越高,水产品经济价值流失越大。本试验中,草鱼和花鲈生鱼片滴水损失最高组均出现在全鱼粉组,预示以鱼粉为蛋白质源有缩短货架期,增加经济损失的风险。
4结论
① 草鱼和花鲈在体成分、肌肉游离氨基酸组成及肉质指标方面均有较大差异。2种试验鱼肌肉中均检出特异性成分,草鱼相对于花鲈为肌肽和酪氨酸,而花鲈相对于草鱼则为天冬氨酸、γ-氨基丁酸、色氨酸以及尿素。
② 以混合植物蛋白质为蛋白质源对草鱼和花鲈体成分中的粗脂肪含量产生了显著影响,降低了鱼体脂肪的蓄积。
③ 从肌肉中游离氨基酸含量评价,植物蛋白质源替代鱼粉后草鱼肌肉中总游离氨基酸含量未发生显著变化,但使花鲈肌肉中呈味氨基酸含量下降,必需氨基酸含量减少,生物胺前体含量升高,货架期缩短。
④ 从肉质方面评价,植物蛋白质源替代鱼粉后草鱼和花鲈的肉质均出现明显下降,可以在上市前以高鱼粉饲料改善肉质,提高产品价值。
参考文献:
[1]CABRAL E M,FERNANDES T J R,CAMPOS S D,et al.Replacement of fish meal by plant protein sources up to 75% induces good growth performance without affecting flesh quality in ongrowingSenegalesesole[J].Aquaculture,2013,380-383:130-138.
[2]DE FRANCESCO M,PARISI G,PÉREZ-SNCHEZ J,et al.Effect of high-level fish meal replacement by plant proteins in gilthead sea bream (Sparusaurata) on growth and body/fillet quality traits[J].Aquaculture Nutrition,2007,13(5):361-372.

[4]姜俊,胡肄,周小秋,等.膨化饲料中豆粕替代鱼粉比例对建鲤肌肉品质的影响[J].动物营养学报,2015,27(2):623-630.
[5]MATOS E,GONÇALVES A,BANDARRA N,et al.Plant proteins and vegetable oil do not have detrimental effects on post-mortem muscle instrumental texture,sensory properties and nutritional value of gilthead seabream[J].Aquaculture,2012,358/359:205-212.
[6]张志勇,薛敏,王嘉,等.混合植物蛋白质替代鱼粉对花鲈和西伯利亚鲟生长和肉质影响的比较研究[J].动物营养学报,2013,25(6):1260-1275.
[7]刘运正.高植物蛋白替代饲料不同水平鱼粉后添加羟脯氨酸对大菱鲆(ScophthalmusmaximusL.)幼鱼生长性能的影响[D].硕士学位论文.青岛:中国海洋大学,2014:30-31.
[9]XUE M,LUO L,WU X F,et al.Effects of six alternative lipid sources on growth and tissue fatty acid composition in Japanese sea bass (Lateolabraxjaponicus)[J].Aquaculture,2006,260(1/2/3/4):206-214.
[10]HU L,YUN B,XUE M,et al.Effects of fish meal quality and fish meal substitution by animal protein blend on growth performance,flesh quality and liver histology of Japanese seabass (Lateolabraxjaponicus)[J].Aquaculture,2013,372-375:52-61.
[11]TEN HAVE G A,ENGELEN M P,LUIKING Y C,et al.Absorption kinetics of amino acids,peptides,and intact proteins[J].International Journal of Sport Nutrition and Exercise Metabolism,2007,17(Suppl.):S23-S36.
[12]NRC.Nutrient requirements of fish and shrimp[S].Washington,D.C.:National Academies Press,2011.
[13]许丹丹.大菱鲆幼鱼对不同蛋白源营养感知与应答机制的初步研究[D].博士学位论文.青岛:中国海洋大学,2014:32-37.
[14]RUIZ-CAPILLAS C,MORAL A.Free amino acids in the muscle of Norway lobster (Nephropsnorvegicus(L.)) in controlled and modified atmospheres during chilled storage[J].Food Chemistry,2004,86(1):85-91.
[15]陈寅山,戴聪杰.红罗非鱼肌肉的营养成分分析[J].福建师范大学学报:自然科学版,2003,19(4):62-66.
[16]RAWLES D D,FLICK G J,MARTIN R E.Biogenic amines in fish and shellfish[J].Advances in Food and Nutrition Research,1996,39:329-365.
[17]BODMER S,IMARK C,KNEUBÜHL M.Biogenic amines in foods:histamine and food processing[J].Inflammation Research,1999,48(6):296-300.
[19]OGATA H,ARAI S,ALVAREZ B M.Effect of dietary protein levels on free amino acid contents of juvenile European eelAnguillaAnguilla[J].Nippon Suisan Gakkaishi,1985,51(4):573-578.
[20]OGATA H,MURAI T.White muscle of masu salmon,Oncorhynchusmasoumasou,smolts possesses a strong buffering capacity due to a high level of anserine[J].Fish Physiology and Biochemistry,1994,13(4):285-293.
[21]YOKOYAMA M,UDAGAWA M,NAKAZOE J,et al.Influence of dietary protein levels on hepatic cysteine dioxygenase activity in rainbow trout[J].Fisheries Science,1994,60(2):229-233.
[22]谢志浩.鱼类的渗透压调节[J].生物学通报,2002,37(5):22-23.
[23]JOHNSTON I A,MANTHRI S,BICHERDIKE R,et al.Growth performance,muscle structure and flesh quality in out-of-season Atlantic salmon (Salmosalar) smolts reared under two different photoperiod regimes[J].Aquaculture,2004,237(1/2/3/4):281-300.
[24]HYLDIG G,NIELSEN D.A review of sensory and instrumental methods used to evaluate the texture of fish muscle[J].Journal of Texture Studies,2001,32(3):219-242.
[25]SATO K,YOSHINAKA R,SATO M,et al.Collagen content in the muscle of fishes in association with their swimming movement and meat texture[J].Nippon Suisan Gakkaishi,1986,52(9):1595-1600.
[26]马汉军,潘润淑,周光宏.不同温度下高压处理牛肉TBARS值得变化及抗氧化剂和螯合剂的抑制作用研究[J].食品科技,2006(9):126-130.
[27]JUNG S,GHOUL M,DE LAMBALLERIE-ANTON M.Influence of high pressure on the color and microbial quality of beef meat[J].LWT-Food Science and Technology,2003,36(6):625-631.
[28]ZHANG K K,AI Q H,MAI K S,et al.Effects of dietary hydroxyproline on growth performance,body composition,hydrocyproline and collagen concentrations in tissues in relation to prolyl 4-hydrocylase α(I) gene expression of juvenile turbot,ScophthalmusmaximusL. fed high plant protein diets[J].Aquaculture,2013,404/405:77-84.
[29]ALBREKTSEN S,SIRNES E,AKSNES A,et al.Impacts of dietary hydroxyproline on growth,muscle firmness,collagen avd PYD cross-links formation in Atlantic salmon (Salmosalar)[C]//Proceedings of the 14th International Symposium on Fish Nutrition and Feeding.Qingdao:[s.n.],2010:79.
[30]PERIAGO M J,AYALA M D,LPEZ-ALBORS O,et al.Muscle cellularity and flesh quality of wild and farmed sea bass,DicentrarchuslabraxL.[J].Aquaculture,2005,249(1/2/3/4):175-188.
[31]王晓宇,周光宏,徐幸莲,等.猪肉剪切力的测定方法[J].食品科学,2012,33(21):64-67.
[32]VELAND J O,TORRISSEN O J.The texture of Atlantic salmon (Salmosalar) muscle as measured instrumentally using TPA and Warner-Brazler shear test[J].Journal of the Science of Food and Agriculture,1999,79(12):1737-1746.
[33]李玉娥.影响肉品含水量的因素[J].肉类工业,2004(7):6-8.
[34]JONSSON A,SIGURGISLADOTTIR S,Hafsteinsson H,et al.Textural properties of raw Atlantic salmon (Salmosalar) fillets measured by different methods in comparison to expressible moisture[J].Aquaculture Nutrition,2001,7(2):81-89.
(责任编辑菅景颖)
doi:10.3969/j.issn.1006-267x.2016.07.010
收稿日期:2016-01-25
基金项目:国家重点基础研究发展计划(973计划,2014CB138600);国家自然科学基金项目(31372539,31572631);公益性行业(农业)专项经费项目(201203015,201203023);北京市现代农业产业技术体系(SCGWZJ201600031-1)
作者简介:于晓彤(1990—),女,辽宁大连人,硕士研究生,研究方向为水产动物营养与饲料科学。E-mail: 963065897@qq.com *通信作者:王嘉,副研究员,硕士生导师,E-mail: wangjia02@cass.cn
中图分类号:S963
文献标识码:A
文章编号:1006-267X(2016)07-2055-14
*Corresponding author, associate professor, E-mail: wangjia02@cass.cn
A Comparative Study: Effects of Different Protein Sources on Flesh Quality of Grass Carp (Ctenopharyngodonidellus) and Japanese Seabass (Lateolabraxjaponicas)
YU Xiaotong1LIANG Xiaofang2WANG Jia1*HAN Fang1LI Junguo1ZHENG Yinhua1WU Xiufeng1WANG Xin1LIANG Xufang3XUE Min1,4,5
(1. National Aquatic Feed Safety Assessment Center, Feed Institute Research, Chinese Academy of Agricultural Sciences, Beijing 100081, China; 2. Institute of Food and Nutrition Development, Ministry of Agriculture, Beijing 100081, China; 3. College of Fisheries, Huazhong Agricultural University,Wuhan 430070, China; 4. Key Laboratory of Feed Biotechnology, Ministry of Agriculture,Beijing 100081, China; 5. Freshwater Aquaculture Collaborative Innovation Center of Hubei Province,Wuhan 430070, China)
Abstract:This study aimed to compare the effects of different protein sources on body composition, free amino acid composition in muscle and fillet texture characteristics of grass carp (Ctenopharyngodon idellus) and Japanese seabass (Lateolabrax japonicas). Three isoenergetic and isonitrogenous experimental diets were designed for grass carp and Japanese seabass, respectively. The control group diet for grass carp used low temperature steam-dried fish meal as sole protein source, and used blended plant protein (soybean meal and soybean protein concentrate) to replace 80% and 100% fish meal, respectively, which were named as CI-FM, CI-PPB80 and CI-PPB100 groups, respectively. The control group diet for Japanese seabass used Peru fish meal as sole protein source, and used blended plant protein (cottonseed protein concentrate and soybean protein concentrate) to replace 50% and 100% fish meal, respectively, which were named as LJ-FM, LJ-PPB50 and LJ-PPB100 groups, respectively. Each grass carp diet was fed to 3 replicates with 20 grass carp [initial body weight of (153.40±0.30) g], and each Japanese seabass diet was fed to 4 replicates with 25 Japanese seabass [(initial body weight of (12.97±0.03) g]. After an 8-week experiment, body composition, free amino acid composition in muscle and fillet texture characteristics, drop loss, shear force and collagen content were investigated. The results showed that muscle ether extract content of grass carp in CI-PPB100 group were significantly decreased (P<0.05), while ash content was significantly increased compared with CI-FM group (P<0.05). However, the muscle ether extract content of Japanese seabass was firstly increased and then down with the replacement level increasing, and showed LJ-PPB100 group was significantly higher than LJ-PPB50 group (P<0.05). No differences were observed in the muscle total free amino acid (TFAA) and biogenic precursor contents among all groups of grass carp (P>0.05). With the replacement level increasing, the muscle TFAA and flavor amino acid (FAA) contents of Japanese seabass were significantly decreased (P<0.05) and biogenic precursor content was significantly increased (P<0.05). We found several specific components in both species. Furthermore, the texture characteristics of raw and cooked fillets showed much more significant difference between the two species. For both of fish, the raw fillets in full fish meal groups showed significantly higher hardness, gumminess, chewiness, resilience and shear force than those of blended plant protein groups (P<0.05). The cohesiveness of cooked fillets of CI-PPB80 group was significantly higher than that of other two groups (P<0.05), but no significant differences were observed in the other indexes (P>0.05). The hardness and adhesive of cooked fillets of LJ-PPB100 group were significantly higher than those of LJ-FM group (P<0.05), but no significant differences were observed in the other indexes (P>0.05). In conclusion, using blended plant protein to replace fish meal can reduce fillet lipopexia for two species, and has no effect on muscle TFAA content of grass carp, but can reduce the muscle FAA, biogenic precursor and essential amino acid contents, and shorten the shelf life of Japanese seabass. High plant protein diet can reduce flesh quality, while high fish meal diet can ensure a better flesh quality of grass carp and Japanese seabass.[Chinese Journal of Animal Nutrition, 2016, 28(7):2055-2068]
Key words:grass carp (Ctenopharyngodon idellus); Japanese seabass (Lateolabrax japonicas); protein source; fish meal; blended plant protein; free amino acid; flesh quality
