防御素基因在乌金猪与约大乌猪组织中的表达及东亚飞蝗抗菌活性物质对防御素基因表达的调节作用
2016-08-03李美荃张春勇安清聪陈克嶙郭荣富
李美荃 刘 红 张春勇 安清聪 骆 雪 陈克嶙 郭荣富
(云南农业大学,云南省动物营养与饲料重点实验室,昆明650201)
*同等贡献作者
防御素基因在乌金猪与约大乌猪组织中的表达及东亚飞蝗抗菌活性物质对防御素基因表达的调节作用
李美荃刘红*张春勇安清聪骆雪陈克嶙郭荣富**
(云南农业大学,云南省动物营养与饲料重点实验室,昆明650201)
摘要:本试验旨在检测β防御素-1(pBD-1)、β防御素-2(pBD-2)和β防御素-3(pBD-3)基因在乌金猪和具有乌金猪血缘的约大乌猪不同组织中的表达,并探讨东亚飞蝗抗菌活性物质(LAAS)对猪胎儿皮肤成纤维细胞(PFSF)免疫应激参数和防御素(pBDs)基因表达的调节作用。采用实时荧光定量PCR方法检测2月龄乌金猪与约大乌猪心脏、肝脏、肺脏、肾脏、空肠、回肠、十二指肠、皮肤、肌肉、胰腺、睾丸或卵巢这12种组织中pBD-1、pBD-2和pBD-3基因的表达差异;采用培养至第4~5代的PFSF,通过脂多糖(LPS)诱导建立免疫应激模型,在DMEM/F12培养液中添加不同浓度(0、75、150、300、600和1 200 μg/mL)的LAAS,考察LAAS对PFSF免疫应激参数和pBD-1、pBD-2、pBD-3基因表达的影响。结果表明:1)乌金猪血清溶菌酶(LSZ)活性、免疫球蛋白G(IgG)含量显著高于约大乌猪(P<0.05),血清一氧化氮(NO)含量极显著低于约大乌猪(P<0.01)。2)约大乌猪大多数组织中pBD-1、pBD-2和pBD-3基因的表达量高于乌金猪;2个品种猪的pBD-1和pBD-3基因均在皮肤和卵巢中表达量较高,pBD-2基因在肝脏和肾脏中表达量较高。3)300 μg/mL LAAS极显著降低了培养液中乳酸脱氢酶(LDH)活性(P<0.01);LAAS极显著增加了培养液中NO含量(除75 μg/mL组正常细胞外)(P<0.01),正常细胞和应激细胞均在LAAS浓度为600 μg/mL时达到最高;LAAS浓度为0、75和150 μg/mL时应激细胞一氧化氮合酶(NOS)活性显著或极显著高于正常细胞(P<0.05或P<0.01);添加1 200 μg/mL LAAS可极显著降低培养液中的LSZ活性(P<0.01),LAAS浓度为150、300、600和1 200 μg/mL时应激细胞与正常细胞中LSZ活性差异显著或极显著(P<0.05或P<0.01)。4)应激细胞pBD-1、pBD-2和pBD-3基因的表达量均高于正常细胞;当LAAS浓度为150 μg/mL时,pBD-1、pBD-2和pBD-3基因的表达量最高。结果提示,乌金猪和约大乌猪防御素基因的表达存在明显的品种差异性和组织特异性,适宜浓度的LAAS能够降低PFSF中LDH活性,提高NO含量及NOS、LSZ活性,上调应激细胞与正常细胞防御素的表达量。
关键词:乌金猪;约大乌猪;β-防御素;免疫应激;东亚飞蝗抗菌活性物质
目前猪的疾病越来越趋向于复杂化,寻找新型、安全、高效的抗生素替代品已成为猪营养研究和生猪健康养殖的重要研究课题。动物健康是保障其生存、种属繁衍和发挥遗传生产潜力的重要生物学基础。营养与免疫是动物健康的重要研究课题。抗病基因与动物健康密切相关,营养可通过改善免疫力和影响抗病基因进而提高机体抗病力,从而增强动物健康和改善其生产性能。抗菌肽作为一种无毒副作用、无残留的抗微生物添加剂具有广阔的开发应用前景。防御素(pBDs)是动物体内防御系统中最大的成员,它是一类富含半胱氨酸的阳离子活性肽,可形成3对分子内二硫键,分子质量为2~6 ku。根据防御素二硫键的连接位置及形成的空间结构,可将其分为α-防御素、β-防御素和θ-防御素,其中在猪体内仅发现了β-防御素,且研究较多的为β防御素-1(pBD-1)、β防御素-2(pBD-2)和β防御素-3(pBD-3)[1]。防御素具有广谱抗菌、抗病毒活性和非特异性细胞毒性作用,可以调节体内适应性免疫及其他抗微生物免疫。Diamond等[2]首次在牛的气管黏膜上皮细胞中发现了防御素,由38~42个氨基酸残基组成,且主要存在于哺乳动物的皮肤、黏膜等上皮细胞中。Herrera等[3]研究报道,人类pBD-2和pBD-3与成人口腔上皮细胞的抗艾滋病病毒耐药性的机制密切相关。Kallóo等[4]研究报道,新型方法选择反应监测(SRM)可以快速分析防御素与生物样本的相关性。昆虫具有其独特的免疫机制,在免疫防御体系中主要由一系列抗菌肽发挥作用。骆雪等[5]研究报道,东亚飞蝗虫体内含有抗菌活性物质可被诱导表达。温刘发等[6]以蚕抗菌肽饲喂猪和禽的试验证明,蚕抗菌肽具有代替传统饲用抗生素应用的潜力。由此提示,昆虫抗菌肽作为一种免疫调节剂是否对动物防御素基因的表达具有调节作用。云南本地乌金猪生活在云南高原生态条件下,长期的生物进化形成耐粗饲、生长速度缓慢、抗逆性即抗病和抗氧化性强等生物学特性和遗传特点。约大乌猪是利用现代遗传育种技术,经过多代选育而成的含有25%乌金猪血缘的杂交猪种,其瘦肉率和生长速度明显提高,抗逆性也可能会发生改变。本研究检测了具有抗菌活性的pBD-1、pBD-2和pBD-3基因在乌金猪和约大乌猪不同组织中的表达,同时探讨了东亚飞蝗抗菌活性物质(locust antibacterial active substances,LAAS)对猪免疫应激细胞pBD-1、pBD-2和pBD-3基因表达的调节作用。
1材料与方法
1.1试验动物和血清生化指标测定
随机选取来源一致、健康、饲养方式相同、体重相近的2月龄乌金猪和约大乌猪各12头(公母各占1/2),所有仔猪空腹前腔静脉采血5 mL,制备血清备用,测定溶菌酶(LSZ)、免疫球蛋白G(IgG)、一氧化氮合酶(NOS)、乳酸脱氢酶(LDH)、一氧化氮(NO)活性或含量。IgG含量采用全自动生化分析仪测定,NO含量及NOS、LDH、LSZ活性采用比色法测定,试剂盒均由南京建成生物工程研究所提供。
1.2组织采集
试验仔猪07:30空腹称重后屠宰,收集心脏、肝脏、肺脏、肾脏、空肠、回肠、十二指肠、皮肤、肌肉、胰腺、睾丸或卵巢共12种组织,剔除脂肪组织,迅速剪碎,液氮速冻,-80 ℃保存备用。
1.3细胞培养
选用培养至第4~5代的皮肤成纤维细胞(porcine fetal skin fibroblasts,PFSF),以DMEM/F12(1∶1)含血清培养液(10%的胎牛血清,1%的青霉素、链霉素双抗,1%的谷氨酰胺)为细胞的基础培养液,在37 ℃、5% CO2培养箱内进行培养。
1.4试验材料
东亚飞蝗成虫提取物由云南农业大学云南省动物营养与饲料单胃动物营养研究室提供(抗菌活性物质提取率8.62%,抗菌活性物质浓度11.78 mg/mL),选用东亚飞蝗针刺蘸大肠杆菌法诱导其产生抗菌活性物质,抗菌活性物质主要为防御素。具体方法为:东亚飞蝗成虫针刺腹部,浸泡于处于对数生长的大肠杆菌菌悬液中10 min,作用24 h,收集虫体,-80 ℃过夜,匀浆离心取上清[5]。
1.5脂多糖(LPS)诱导猪细胞免疫应激模型的建立
在基础培养液中分别加入0(对照)、0.1、1.0、10.0、100.0 μg/mL的LPS,诱导细胞产生免疫应激,每组24个重复(1个24孔板),每孔为1个重复。于培养后0、9、18、36 h观察细胞状态(图1),从中选择10 μg/mL和培养18 h分别为试验LPS浓度和考察时间点。在应激的细胞培养皿中移去培养液,用磷酸盐缓冲液(PBS)冲洗,添加600 μg/mL的LAAS,0、3、6、12、24、48 h后检测培养液中细胞的pBD-1、pBD-2、pBD-3基因的表达情况,从中选择3个基因表达量均较高的24 h时间点作为试验考察时间点;然后在此时间点上,分别考察0、75、150、300、600、1 200 μg/mL 6个浓度的LAAS对PFSFpBD-1、pBD-2、pBD-3基因的表达的影响。

A:无任何处理的细胞;B:10 μg/mL脂多糖诱导的免疫应激状态细胞;C:应激后换用含有LAAS的培养液培养24 h后的细胞;D:100 μg/mL脂多糖诱导的过度应激死亡细胞。
A: cells without any treatment; B: immune stress cells induced by 10 μg/mL LPS; C: cells cultured in culture medium containing LAAS for 24 h after stress; D: dead cells of excessive stress induced by 100 μg/mL LPS.
图1不同形态的PFSF
Fig.1PFSF in different modality
1.6细胞培养液中LDH、NOS、LSZ活性及NO含量的测定
细胞培养液中LDH活性采用比色法测定;NO含量采用硝酸还原酶法测定;NOS活性采用比色法测定;LSZ活性采用比浊法测定。所有测定试剂盒均购自南京建成生物工程研究所。
1.7总RNA提取
各组织及细胞总RNA提取按照RNAsimple Total RNA Kit(北京天根)试剂盒说明书进行,每50~100 mg组织加1 mL裂解液。各组织经过研磨粉碎匀浆后,加入氯仿萃取。最后得到的总RNA溶解于超纯水中,总RNA的纯度与浓度分别用分光光度计在260与280 nm下检测,OD260 nm/OD280 nm在1.8~2.0之间方可采用。
1.8反转录
采用相同浓度的总RNA样品按试剂盒(TaKaRa,日本)说明书要求配制反转录反应液,总体系10 μL。用于实时荧光定量的反转录产物(cDNA)于-20 ℃保存。
1.9常规PCR反应结果
以提取的RNA反转录产物作为模板进行常规PCR反应,用2%琼脂糖凝胶电泳检测PCR产物,结果如图2所示,基因PCR扩增产物条带清晰、明亮、无杂带,说明引物可以特异性扩增出目的产物。

Marker:100 bp DNA分子量标准;1:pBD-1基因;2:pBD-2基因;3:pBD-3基因;4:β-肌动蛋白;5:甘油醛-3-磷酸脱氢酶基因;6:18S rRNA。
Marker:100 bp DNA ladder marker;1:pBD-1 gene;2:pBD-2 gene;3:pBD-3 gene;4:ACTBgene;5:GAPDHgene;6:18S rRNA.
图2PCR产物2%琼脂糖凝胶电泳结果
Fig.2Results of 2% agarose gel electrophoresis of PCR product
1.10实时荧光定量PCR


表1 实时荧光定量PCR引物参数Table 1 Parameters of primers for RT-qPCR
1.11数据分析
所有组织的防御素表达量均以GAPDH、18SrRNA、ACTB为内参基因,最终以mRNA相对表达量来表示,相对荧光定量计算方法采用Pfaffl[7]方法计算。所有数据均采用Excel进行整理,采用SPSS 19.0统计软件进行统计处理,结果用平均值±标准差表示,各组织间的基因表达采用Duncan氏法进行多重比较。P<0.05为差异显著,P<0.01为差异极显著。
2结果
2.1乌金猪与约大乌猪的血清生化指标
如表2所示,乌金猪血清LSZ活性和IgG含量显著高于约大乌猪(P<0.05),血清NO含量极显著低于约大乌猪(P<0.01)。乌金猪血清LDH和NOS活性低于约大乌猪,但差异不显著(P>0.05)。

表2 乌金猪与约大乌猪的血清生化指标Table 2 The serum biochemical indices of Wujin pigs and Yuedawu pigs
同行数据肩标小写字母不同者表示差异显著(P<0.05),肩标大写字母不同者表示差异极显著(P<0.01),肩标无字母或相同字母表示差异不显著(P>0.05)。
In the same row, values with different small letter superscripts mean significant difference (P<0.05), and with different capital letter superscripts mean significant difference (P<0.01), while with no letter or the same letter superscripts mean no significant difference (P>0.05).
2.2乌金猪与约大乌猪不同组织间pBD-1、pBD-2、pBD-3基因的表达差异
2.2.1不同组织间pBD-1基因的表达规律
如图3-a所示,乌金猪和约大乌猪各个组织中均用实时荧光定量PCR方法检测到pBD-1基因的表达。在乌金猪不同组织间pBD-1基因表达量较高的组织为皮肤和卵巢,表达量较低的组织为心脏和肾脏。在约大乌猪不同组织间pBD-1基因表达量较高的组织为皮肤和卵巢,表达量较低的组织为心脏和肌肉。
2.2.2不同组织间pBD-2基因的表达规律
如图3-b所示,乌金猪和约大乌猪各个组织中均用实时荧光定量PCR方法检测到pBD-2基因的表达。在乌金猪不同组织间pBD-2基因表达量较高的组织为肝脏和肾脏,表达量较低的组织是心脏和肌肉。在约大乌猪不同组织间pBD-2基因表达量较高的组织为肝脏和肾脏,表达量较低的组织为肌肉和胰腺。
2.2.3不同组织间pBD-3基因的表达规律
如图3-c所示,乌金猪和约大乌猪各个组织中均用实时荧光定量PCR方法检测到pBD-3基因的表达。在乌金猪不同组织间pBD-3基因表达量较高的组织为皮肤和睾丸,表达量较低的组织为心脏和十二指肠。在约大乌猪不同组织间pBD-3基因表达量较高的组织为皮肤和卵巢,表达量较低的组织为肌肉和空肠。

1:心脏 heart;2:肝脏 liver;3:肺脏 lung;4:肾脏 kidney;5:皮肤 skin;6:肌肉 muscle;7:卵巢 ovary;8:睾丸 testis;9:胰腺 pancreas;10:十二指肠 duodenum;11:空肠 jejunum;12:回肠 ileum
同一品种猪数据柱形标注小写字母不同者表示差异显著(P<0.05),大写字母不同者表示差异极显著(P<0.01)。同一组织数据柱形标注*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。图4同。
Data columns of the same breed of pigs with different small letter superscripts mean significant difference (P<0.05), and with different capital letter superscripts mean significant difference (P<0.01). Data columns of the same tissue with * mean significant difference (P<0.05), and with ** mean significant difference (P<0.01). The same as Fig.4.
图3乌金猪与约大乌猪不同组织间pBD-1,pBD-2,pBD-3基因的表达差异
Fig.3Difference ofpBD-1,pBD-2,pBD-3 genes expression in different tissues ofWujinpigs andYuedawupig
2.3LAAS对PFSF培养液应激参数的影响
如表3所示,正常细胞:与对照组比较,300 μg/mL LAAS极显著降低了培养液中LDH活性(P<0.01),再增加LAAS浓度LDH活性继续增加。应激细胞:与对照组相比,300 μg/mL LAAS极显著降低了培养液中LDH活性(P<0.01),再增加LAAS浓度LDH活性继续增加。
不论是正常细胞还是LPS应激细胞,各LAAS组培养液中NO含量均极显著高于对照组(除75 μg/mL组正常细胞外)(P<0.01),正常细胞和应激细胞培养液中NO含量均以600 μg/mL LAAS组最高,分别为(16.50±3.76) μg/mL和(20.39±2.81) μg/mL。
正常细胞:随着LAAS浓度的增加,培养液NOS活性呈上升趋势。应激细胞:随着LAAS浓度的增加,培养液中NOS活性呈下降趋势。应激细胞与正常细胞相比,0、75和150 μg/mL LAAS组NOS活性显著或极显著增加(P<0.05或P<0.01)。
正常细胞:添加600、1 200 μg/mL LAAS时LSZ活性极显著低于对照组(P<0.01)。应激细胞:添加300、1 200 μg/mL LAAS时LSZ活性极显著低于对照组(P<0.01)。添加150、300、600和1 200 μg/mL LAAS时应激细胞与正常细胞LSZ活性差异显著或极显著(P<0.05或P<0.01)。

表3 LAAS对PFSF培养液应激参数的影响Table 3 Effect of LAAS on stress parameters of culture medium of PFSF
同行数据肩标小写字母不同者表示差异显著(P<0.05),肩标大写字母不同者表示差异极显著(P<0.01);同一指标、同列数据肩标*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。
In the same row, values with different small letter superscripts mean significant difference(P<0.05),and with different capital letter superscripts mean significant difference(P<0.01). In the same column, values of the same index with * mean significant difference(P<0.05), and with ** means significant difference.
2.4LAAS对PFSFpBD-1、pBD-2和pBD-3基因表达的影响
如图4-a所示,应激细胞pBD-1基因的表达量均高于正常细胞,LAAS浓度为0、75、300 μg/mL时差异极显著(P<0.01),LAAS浓度为150 μg/mL时差异显著(P<0.05)。随着LAAS浓度的增加,应激细胞和正常细胞pBD-1基因的表达量均增加,当LAAS浓度为150 μg/mL时,pBD-1基因的表达量最高,随后呈降低趋势。
由图4-b所示,应激细胞pBD-2基因的表达量均高于正常细胞,LAAS浓度为0、75、150、300 μg/mL时差异极显著(P<0.01),LAAS浓度为600 μg/mL时差异显著(P<0.05)。随着LAAS浓度的增加,应激细胞和正常细胞pBD-2基因的表达量均增加,当LAAS浓度为150 μg/mL时,pBD-2基因表达量最高,随后呈降低趋势。
由图4-c所示,应激细胞pBD-3基因的表达量均高于正常细胞,LAAS浓度为0、75 μg/mL时
差异极显著(P<0.01),LAAS浓度为150、1 200 μg/mL时差异显著(P<0.05)。随着LAAS浓度的增加,应激细胞和正常细胞pBD-3基因的表达量均增加,当LAAS浓度为150 μg/mL时,pBD-3基因表达量最高,随后呈降低趋势。
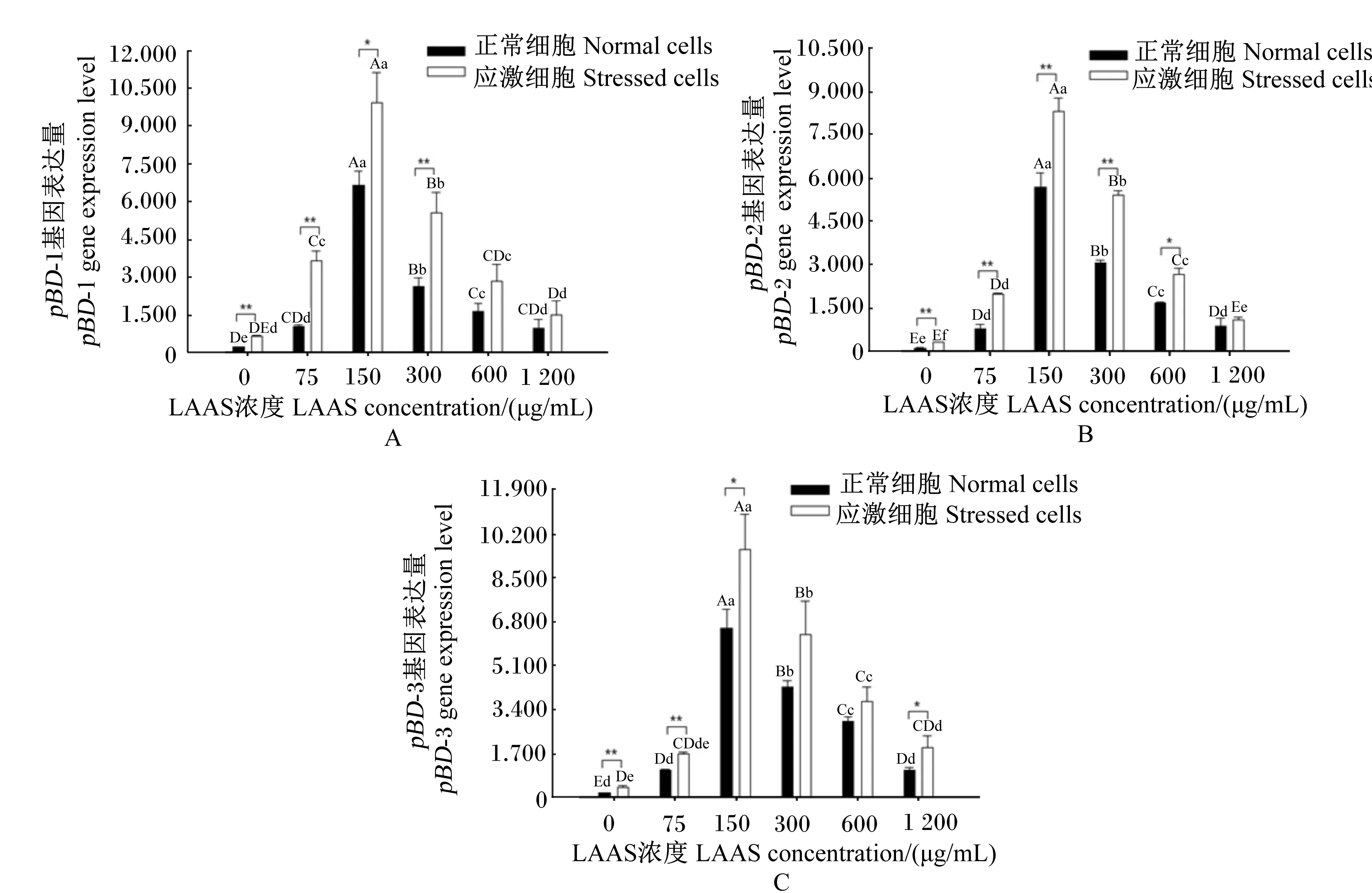
图4 LAAS对PFSF pBD-1, pBD-2, pBD-3基因表达的影响Fig.4 Effect of LAAS on expression of pBD-1, pBD-2 and pBD-3 genes of PFSF
3讨论
3.1血清生化指标的变化
血液免疫球蛋白浓度是仔猪免疫功能和健康的重要标识之一。IgG具有免疫替代和免疫调节的双重治疗效果[8]。本试验结果显示,乌金猪血清IgG含量显著高于约大乌猪,血清NO含量、LDH和NOS活性低于约大乌猪。NO在免疫反应中具有重要作用,通过非特异性杀伤细菌、真菌、寄生虫和肿瘤细胞而增强非特异性免疫功能,适量的NO含量有助于宿主增强免疫能力。乌金猪血清LSZ活性显著高于约大乌猪,在畜禽养殖中,应用LSZ可以提高仔猪的生产性能、降低腹泻率、增强免疫力[9]。结果提示,培育猪种约大乌猪的免疫功能发生了适应性变化。
3.2品种差异和组织特异性
本研究发现,乌金猪与约大乌猪不同组织中pBD-1基因表达量较高的组织为皮肤和卵巢,pBD-2基因表达量较高的组织为肝脏和肾脏,与Veldhuizen等[10]检测的杂交猪(约克夏×荷兰长白猪)防御素表达结果类似。pBD-3基因表达模式与pBD-1相似,在皮肤、睾丸和卵巢中表达量较高,这与Sang等[11]报道的远亲杂交猪pBD-3基因在十二指肠、肝脏、皮肤、睾丸及附睾上表达较高的试验研究结果不完全一致,原因可能与猪种及日龄有关。已有研究证明,不同日龄、不同健康状况的试验动物具有不同的防御素基因表达模式[12-13]。迄今为止,有关云南高原本地乌金猪和约大乌猪不同组织间防御素基因表达差异的研究报道尚未见到。
皮肤作为机体和环境间的第1道屏障,它的破坏易使病原菌直接入侵机体,导致炎症甚至发生疾病。本试验结果表明,乌金猪和约大乌猪pBD-1、pBD-3基因在皮肤的表达量最高,皮肤表面防御素的大量存在有利于增强猪机体的抗病能力。
小肠不仅是动物消化吸收的主要场所,也是机体重要的免疫器官。安沙等[14]研究报道,初生到60日龄,pBD-1和pBD-3基因在猪肠道中的表达呈上升趋势。约大乌猪小肠中pBD-1、pBD-3基因的表达量高于乌金猪。结果提示,含有乌金猪血缘的约大乌猪小肠免疫功能发生了适应性改变。
在心脏、肾脏和肌肉等组织器官中,均检测到防御素基因的表达。防御素基因在肝脏、肾脏中表达趋势一致,均为约大乌猪高于乌金猪,pBD-2基因在肝脏和肾脏的表达量极显著高于其他组织,为所检测12个组织中表达量最高的2个组织,结果与Veldhuizen等[10]报道的杂交猪(约克夏×荷兰长白猪)防御素表达结果一致。
胰腺中,pBD-1基因在约大乌猪的表达量低于乌金猪,而pBD-2、pBD-3基因在约大乌猪的表达量则高于乌金猪,有关胰腺中防御素基因表达差异与胰腺功能间的联系有待于进一步研究。
本试验结果表明,绝大多数约大乌猪组织中防御素基因的表达量高于乌金猪。
3.3细胞免疫应激参数变化
试验研究选择本试验团队提供的东亚飞蝗为试验材料,选用东亚飞蝗针刺蘸大肠杆菌法诱导其产生抗菌活性物质。邹峰[15]通过对各种家蝇幼虫抗菌肽诱导表达方式进行筛选,以抗菌活性为指标,确定了猪粪饲养诱导法。索相敏等[16]以黄粉虫幼虫和甜菜夜蛾幼虫为材料,发现以针刺蘸大肠杆菌法诱导得到的抗菌肽的抑菌活性最强。LDH存在于猪体内各组织器官中,是国际上常用的评价细胞存活状态、生长状态和损伤状态的检测指标,用于检测细胞整体损伤,损伤细胞因胞溶作用而使LDH释放于细胞外。骆雪等[17]研究报道,L-精氨酸能够降低猪胎儿PFSF培养液中LDH活性,提高NO含量以及NOS、LSZ活性。本试验结果表明,以LPS刺激PFSF产生免疫应激时,NO含量及LDH、NOS、LSZ活性免疫应激参数均发生不同程度的升高,添加适宜浓度的LAAS有利于维持细胞形态和正常生长。有研究表明,通过减少白细胞来促进诱导型NOS产生,能保护肠道免受炎症损伤[18]。
3.4LAAS对PFSF防御素基因的诱导表达
细胞培养结果显示,LAAS可诱导猪防御素基因的表达,LPS诱导猪免疫应激细胞防御素基因表达量均明显高于正常细胞。虽然目前关于防御素产生的分子机制还不十分清楚,但当细菌微生物侵袭时,LPS、细菌鞭毛等可被模式识别受体识别和结合,启动机体免疫防御反应[19],从而产生大量防御素。研究表明,LPS可以诱导上皮细胞产生防御素[20],与本试验结果一致。
在本试验所设计的LAAS浓度范围之内,LAAS对防御素基因具有诱导表达作用,当LAAS浓度为150 μg/mL时,均能显著提高pBD-1、pBD-1和pBD-3基因的表达量。有研究表明,昆虫抗菌肽不仅对细菌有杀伤作用,而且对真菌、病毒、肿瘤细胞和病原虫具有广泛的抑制作用[21],与本试验结果一致。LAAS浓度与猪不同组织β-防御素表达量之间的适宜剂量效应仍需要进一步研究。本试验猪不同组织和LAAS浓度对免疫应激细胞防御素基因表达的调节作用及其细胞免疫应激参数研究结果提示,有关LAAS提高猪的免疫力和机体抗病能力的机制值得进一步深入研究。
4结论
① 乌金猪血清LSZ活性、IgG含量显著高于约大乌猪,血清NO活性极显著低于约大乌猪。
② 乌金猪和约大乌猪防御素基因的表达存在明显的品种差异性和组织特异性。2个品种猪的pBD-1、pBD-3基因均在皮肤和卵巢表达量较高,pBD-2基因在肝脏和肾脏表达量较高。
③ 适宜浓度的LAAS能够降低细胞LDH活性,增加NO含量及NOS、LSZ活性。
④ 适宜浓度的LAAS能够上调应激细胞与正常细胞防御素的表达量,且LAAS浓度为150 μg/mL时,pBD-1、pBD-1和pBD-3基因的表达量最高。
参考文献:
[1]YANG D,BIRAGYN A,KWAK L W,et al.Mammalian defensins in immunity:more than just microbicidal[J].Trends in Immunology,2002,23(6):291-296.
[2]DIAMOND G,ZASLOFF M,ECK H,et al.Tracheal antimicrobial peptide,a cysteine-rich peptide from mammalian tracheal mucosa:peptide isolation and cloning of a cDNA[J].Proceedings of the National Academy of Sciences of the United States of America,1991,88(9):3952-3956.
[3]HERRERA R,MORRIS M,ROSBE K,et al.Human beta-defensins 2 and -3 cointernalize with human immunodeficiency virus via heparan sulfate proteoglycans and reduce infectivity of intracellular virions in tonsil epithelial cells[J].Virology,2016,487:172-187.
[5]骆雪,张春勇,陈克嶙,等.东亚飞蝗抗菌活性物质的萃取及抗菌效应研究[J].家畜生态学报,2013,34(2):53-57.
[6]温刘发,张常明,付林,等.抗菌肽制剂代替抗生素在断奶仔猪饲粮中的应用效果[J].中国饲料,2001(18):13-14.
[7]PFAFFL M W.A new mathematical model for relative quantification in real-time RT-PCR[J].Nucleic Acids Research,2001,29(9):e45.
[8]何万涛,舒永霞.人免疫球蛋白外敷治疗皮肤过敏的疗效观察[J].内蒙古中医药,2011,30(18):103-104.
[9]卢亚萍,潘宏涛,纪孙瑞.溶菌酶对仔猪生长性能及血清生化指标的影响[J].养猪,2010(4):30-31.
[10]VELDHUIZEN E J,VAN DIJK A,TERSTEEG M H G,et al.Expression of β-defensinspBD-1 andpBD-2 along the small intestinal tract of the pig:lack of upregulationinvivouponSalmonellatyphimuriuminfection[J].Molecular Immunology,2007,44(4):276-283.
[11]SANG Y M,PATIL A A,ZHANG G L,et al.Bioinformatic and expression analysis of novel porcine β-defensins[J].Mammalian Genome,2006,17(4):332-339.
[12]CAVERLY J M,DIAMOND G,GALLUP J M,et al.Coordinated expression of tracheal antimicrobial peptide and inflammatory-response elements in the lungs of neonatal calves with acute bacterial pneumonia[J].Infection and Immunity,2003,71(5):2950-2955.
[13]MEYERHOLZ D K,GALLUP J M,GRUBOR B M,et al.Developmental expression and distribution of sheep β-defensin-2[J].Developmental & Comparative Immunology,2004,28(2):171-178.
[14]安沙,韩菲菲,高彦华,等.β-防御素在金华猪和长白猪肠道中表达规律的研究[J].动物营养学报,2011,23(10):1762-1768.
[15]邹锋.家蝇抗菌肽生产及制剂研究[D].硕士学位论文.长沙:湖南农业大学,2007.
[16]索相敏,陆秀君,董建臻,等.2种昆虫高活性抗菌肽制备方法的优化[J].华北农学报,2007,22(3):119-122.
[17]骆雪,张春勇,安清聪,等.L-精氨酸对猪胎儿皮肤成纤维细胞免疫应激参数和β防御素基因mRNA表达的影响[J].动物营养学报,2013,25(5):1037-1044.
[18]MCCAFFERTY D M,MUDGETT J S,SWAIN M G,et al.Inducible nitric oxide synthase plays a critical role in resolving intestinal inflammation[J].Gastroenterology,1997,112(3):1022-1027.
[19]JANEWAY C A,J.,MEDZHITOV R.Innate immune recognition[J].Annual Review of Immunology,2002,20:197-216.
[20]RUSSELL J P,BEVINS C L.Inducible expression of an antibiotic peptide gene in lipopolysaccharide-challenged tracheal epithelial cells[J].Proceedings of the National Academy of Sciences of the United States of America,1996,93(10):5156-5160.
[21]RATHINAKUMAR R,WIMLEY W C.High-throughput discovery of broad-spectrum peptide antibiotics[J].The FASEB Journal,2010,24(9):3232-3238.
*Contributed equally
**Corresponding author, professor, E-mail: rongfug@163.com
(责任编辑李慧英)
doi:10.3969/j.issn.1006-267x.2016.07.014
收稿日期:2016-1-29
基金项目:云南省重大科技专项基金(2012ZA018);云南现代农业生猪产业技术体系2014[云财教]105#、2015[云财教]90#、2016[云财教]112#
作者简介:李美荃(1986—),女,黑龙江哈尔滨人,博士研究生,从事猪的营养与免疫基础研究。E-mail: limeiquan2010@163.com **通信作者:郭荣富,教授,博士生导师,E-mail: rongfug@163.com
中图分类号:S828
文献标识码:A
文章编号:1006-267X(2016)07-2096-10
The Expression of β-Defensins Genes in Tissues ofWujinandYuedawuPigs and Effect of Locust Antibacterial Active Substances on Expression of β-Defensins Genes
LI MeiquanLIU Hong*ZHANG ChunyongAN QingcongLUO XueCHEN KelinGUO Rongfu**
(Key Laboratory of Animal Nutrition and Feed Science of Yunnan Province, Yunnan Agricultural University, Kunming 650201, China)
Abstract:This experiment was aimed to investigate the expression of β-defensin-1 (pBD-1), β-defensin-2 (pBD-2) and β-defensin-3 (pBD-3) genes in different tissues of Wujin pigs and Yuedawu pigs with the blood of Wujin pigs, and also investigate the effect of locust antibacterial active substances (LAAS) on the immune stress parameters and expression of β-defensins (pBDs) in procine fetal skin fibroblasts (PFSF). The expression differences of pBD-1, pBD-2 and pBD-3 genes were determined by real-time PCR in 12 tissues such as heart, liver, lung, kidney, jejunum, ileum, duodenum, skin, muscle, pancreas, testis and ovary of 2-month-old Wujin and Yuedawu pigs. The cultured 4th to 5th generations of PFSF were used, and immune stress model was induced by lipopolysaccharides (LPS). Adding different concentrations (0, 75, 150, 300, 600 and 1 200 μg/mL) of LAAS in DMEM/F12 culture medium, and the effect of LAAS on the immune stress parameters and expression of pBD-1, pBD-2 and pBD-3 genes in PFSF were studied. The results showed as follows: 1) the serum lysozyme (LSZ) activity and immunoglobulin G (IgG) content of Wujin pigs were significantly higher than those of Yuedawu pigs (P<0.05), and serum nitric oxide (NO) content of Wujin pigs was extremely significantly lower than that of Yuedawu pigs (P<0.01). 2) The expression of pBD-1, pBD-2 and pBD-3 genes in most tissues of Yuedawu pigs were higher than those of Wujin pigs. The expression of pBD-1 and pBD-3 genes in skin and ovary of two breeds pigs were higher than those in other tissues, and the expression of pBD-2 gene in liver and kidney of two breeds pigs was higher than that in other tissues. 3) The supplementation of 300 μg/mL LAAS extremely significantly decreased lactate dehydrogenase (LDH) activity in culture medium (P<0.01). LAAS could extremely significantly increased NO content in culture medium except for the 75 μg/mL LAAS group in normal cells (P<0.01), and that in normal cells and stressed cells both reached the highest when LAAS concentration was 600 μg/mL. When LAAS concentrations were 0, 75 and 150 μg/mL, nitric oxide synthase (NOS) activity in stressed cells was significantly higher than that in normal cells (P<0.05 or P<0.01). The supplementation of 1 200 μg/mL LAAS extremely significantly decreased LSZ activity in culture medium (P<0.01). When LAAS concentrations were 150, 300, 600 and 1 200 μg/mL, LSZ activity had significant differences in normal cells and stressed cells (P<0.05 or P<0.01). 4) The expression of pBD-1, pBD-2 and pBD-3 genes in stressed cells were higher than those in normal cells. When LAAS concentration was 150 μg/mL, the expression of pBD-1, pBD-2 and pBD-3 genes all reached the highest. The results indicate that there are significant differences in species and tissues specificity of the expression of pBDs genes in Wujin and Yuedawu pigs. The proper concentration of LAAS can decrease LDH activity, but increase NO content and the activities of NOS and LSZ in PFSF, and up-regulate the expression of pBDs in both stressed cells and normal cells.[Chinese Journal of Animal Nutrition, 2016, 28(7):2096-2105]
Key words:Wujin pigs; Yuedawu pigs; β-defensins; immune stress; locust antibacterial active substances
