壳寡糖对脂多糖诱导猪空肠上皮细胞氧化损伤的作用
2016-08-03肖定福刘进辉李文平
肖定福 钟 佳 刘进辉 李文平*
(1.湖南农业大学动物科学技术学院,长沙410128;2.湖南农业大学动物医学院,长沙410128)
*同等贡献作者
壳寡糖对脂多糖诱导猪空肠上皮细胞氧化损伤的作用
肖定福1钟佳2*刘进辉2李文平2**
(1.湖南农业大学动物科学技术学院,长沙410128;2.湖南农业大学动物医学院,长沙410128)
摘要:本试验旨在通过脂多糖(LPS)诱导猪空肠上皮细胞(IPEC-J2)来建立氧化应激模型,探讨壳寡糖(COS)的抗氧化作用效果。采用噻唑蓝(MTT)法检测LPS和COS对IPEC-J2作用12、24、48 h后细胞增殖活性的变化;选择适宜浓度LPS(1.0 μg/mL)和COS(200 μg/mL)作用于IPEC-J2,分为对照组、LPS组、COS组、LPS+COS组。采用Western Blot法检测核因子E2相关因子2(Nrf2)、血红素氧合酶-1(HO-1)蛋白的表达;试剂盒检测超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性及丙二醛(MDA)的含量。结果表明: 1.0 μg/mL的LPS对IPEC-J2作用24 h,细胞增殖的抑制率为41.6%,为造模的最适浓度和作用时间;COS在一定浓度范围内对IPEC-J2有增殖作用,其浓度为200 μg/mL时效果最佳,作用时间为24 h时,细胞增殖率达到126.3%。LPS+COS组较对照组的SOD、CAT活性和MDA含量差异不显著(P>0.05),Nrf2和HO-1蛋白相对表达量显著升高(P<0.05);LPS+COS组较LPS组的Nrf2蛋白相对表达量显著升高(P<0.05),HO-1有升高趋势,但差异不显著(P>0.05),SOD、CAT活性显著升高(P<0.05),MDA含量显著降低(P<0.05)。由此可见,LPS诱导IPEC-J2氧化应激,而COS可进一步促进Nrf2和HO-1蛋白的高表达,并提高抗氧化酶的活性,降低氧化产物含量,从而增强细胞对氧化应激的抵抗力,起到保护作用。
关键词:壳寡糖;脂多糖;猪空肠上皮细胞;氧化应激;抗氧化作用
氧化应激是机体自由基生成增加或(和)清除能力降低,导致机体氧化和抗氧化两者失衡,自由基大量累积造成机体损伤[1]。肠道黏膜是宿主防御病原微生物的第1道防线,而肠上皮细胞是肠道黏膜屏障的重要组成部分,肠上皮细胞的损伤是肠功能障碍的重要病理基础。在多种生理、病理、饮食或环境不当等情况下,肠上皮细胞都能产生严重的氧化应激,过多的自由基的累积可导致肠上皮细胞受损,从而发生肠功能障碍[2]。壳寡糖(chitooligosaccharide,COS)是壳聚糖(chitosan,CTS)生物降解后的产物,水溶性好,具有多种生物功效,如抗癌[3]、增强免疫[4-5]、抗氧化[6-8]、促生长[9]和抑菌[10]等,是一种具有广阔前景的天然产品。本项目研究通过建立猪空肠上皮细胞氧化应激模型,来探讨COS的抗氧化活性及作用机理,为其临床应用提供理论基础。
1材料与方法
1.1试剂
猪空肠上皮细胞(IPEC-J2)由中科院亚热带农业生态研究所提供;COS(90%脱乙酰度,平均分子质量<5 000 u)由中国科学院大连化学物理研究所提供;脂多糖(lipopolysaccharide,LPS)[大肠杆菌(Escherichiacoli)O55∶B5]购于Sigma公司,10 mg/支;核因子E2相关因子2(Nrf2)抗体(C-20)、血红素氧合酶-1(HO-1)抗体(C-105)均购自圣克鲁斯生物技术有限公司。
1.2细胞培养
IPEC-J2于含10%胎牛血清和1%双抗的DMEM basic(1×)培养基中,在37 ℃、5% CO2、90%相对湿度的培养箱中培养,隔天换液,待细胞贴壁生长到80%~90%时进行传代。
1.3噻唑蓝(MTT)法检测细胞活率
取对数生长期的IPEC-J2调整至5×104/孔接种于96孔板中,每孔200 μL,置于培养箱中培养24 h,换无血清培养基,并分别加不同浓度的LPS(0、0.1、1.0、10.0 μg/mL)或COS(0、50、100、200、400 μg/mL)继续培养12、24、48 h,每个处理设置6个复孔,到时间点后分别加5 mg/mL的MTT 20 μL继续置于培养箱中孵育4 h,小心吸弃上清,用磷酸盐缓冲液(PBS)洗2次,每孔加150 μL 二甲基亚砜(DMSO)室温摇晃15 min,使蓝紫色结晶充分溶解,用酶联免疫检测仪测定各孔在490 nm波长处的吸光值。试验重复3次。
1.4细胞样品收集
取对数生长期的IPEC-J2调整至1×106/孔接种于6孔板中,待细胞贴壁生长至80%左右,进行加样作用24 h,试验分为对照组(不加LPS和COS)、1.0 μg/mL LPS组、200 μg/mL COS组、1 μg/mL LPS+200 μg/mL COS组,作用完后,用预冷的PBS洗涤细胞3次,加入细胞裂解液,于冰上裂解30 min,用细胞刮棒刮取细胞,转移至离心管中,4 ℃、12 000 r/min离心15 min,取上清,用二辛可宁酸(BCA)法对蛋白质进行定量,分装于-80 ℃保存备用。
1.5Western Blot检测蛋白表达
取蛋白样品,用十二烷基硫酸钠-聚丙稀酰胺凝胶电泳(SDS-PAGE)法分离蛋白,将电泳分离的蛋白转移到偏二氟乙烯(PVDF)膜上,再用5%的脱脂奶粉室温缓慢摇荡封闭2 h,分别加入兔抗Nrf2、HO-1(1∶1 000稀释)于4 ℃下孵育过夜,经磷酸盐吐温缓冲液(TBST)洗涤3次(5 min/次)后,再用辣根酶标记的山羊抗兔免疫球蛋白G(IgG)(1∶5 000稀释)室温孵育2 h,经TBST洗涤3次(5 min/次),与化学发光剂反应1 min,在Image Quant LAS 4 000 mini化学发光成像仪下显示并记录结果。试验以β微管蛋白(β-tubulin)作为内参,试验重复3次。
1.6抗氧化酶及氧化产物的检测
取细胞样品,采用硫代巴比妥酸比色法检测丙二醛(MDA)含量,钼酸铵比色法检测过氧化氢酶(CAT)活性,黄嘌呤氧化酶比色法检测超氧化物岐化酶(SOD)活性,试剂盒均购自南京建成生物工程研究所,其试验操作均严格按照试剂盒说明书进行。
1.7统计分析
试验数据采用SPSS 19.0统计分析软件的t检验法进行单因素方差分析比较,以P<0.05为差异显著,结果用平均值±标准误表示。
2结果与分析
2.1LPS对IPEC-J2增殖的抑制作用
由表1可见,不同浓度的LPS对IPEC-J2增殖的抑制作用有一定的差异,且具有一定的时间依赖性。LPS浓度在0.1 μg/mL时,对细胞增殖的抑制作用较低,作用12、24 h时与对照组(不加LPS)无显著差异(P>0.05);LPS浓度在1.0 μg/mL时,对细胞增殖有一定的抑制作用,作用24、48 h时与对照组差异分别显著和极显著(P<0.05和P<0.01),作用24 h时,细胞增殖抑制率为41.6%,为造模的最佳作用浓度和时间;LPS浓度为10.0 μg/mL时,对细胞的损伤严重,细胞活率很低,与对照组差异极显著(P<0.01)。
2.2COS对IPEC-J2增殖的促进作用
由表2可见,不同浓度的COS对IPEC-J2增殖活性的促进作用不同,而同一浓度的COS对细胞的增殖作用也具有一定的时间依赖性。与对照组相比,COS浓度为50 μg/mL时,对细胞增殖的影响不显著(P>0.05);COS浓度为100 μg/mL时,作用24、48 h时对细胞增殖的影响显著(P<0.05);COS浓度为200和400 μg/mL时,作用24、48 h时细胞的增殖率显著提高(P<0.05),且在COS浓度为200 μg/mL时相对效果更好。

表1 LPS对IPEC-J2细胞增殖的影响Table 1 Effects of LPS on IPEC-J2 proliferation (n=6)
*表示与对照组比较差异显著(P<0.05);**表示与对照组比较差异极显著(P<0.01)。表2同。
* means significant difference compared with the control group (P<0.05); ** means extremely significant difference compared with the control group (P<0.01). The same as Table 2.

表2 COS对IPEC-J2增殖的影响Table 2 Effects of COS on IPEC-J2 proliferation (n=6)
2.3Nrf2和HO-1蛋白的相对表达量
由表3得知,LPS组的Nrf2和HO-1蛋白的相对表达量较对照组都有显著提高(P<0.05);LPS+COS组的Nrf2和HO-1蛋白的相对表达量较LPS
组进一步提高,且Nrf2蛋白的相对表达量显著高于LPS组(P<0.05),但HO-1蛋白相对表达量与LPS组差异不显著(P>0.05)。

表3 Nrf2和HO-1蛋白在各细胞组中的相对表达量Table 3 The relative expression levels of Nrf2 and HO-1 protein in each cell group (n=5)
a表示与对照组比较差异显著(P<0.05);b表示与LPS组比较差异显著(P<0.05)。下表同。
a means significant difference compared with the control group (P<0.05); b means significant difference compared with the LPS group (P<0.05). The same as below.
2.4SOD、CAT活性和MDA含量
由表4可知,LPS组较对照组的SOD、CAT活性显著降低(P<0.05),MDA含量显著升高(P<0.05);LPS+COS组较LPS组的SOD、CAT活性显著升高(P<0.05),MDA含量显著降低(P<0.05),较对照组各项差异不显著(P>0.05)。
3讨论
如今,天然活性物质越来越受到各行各业的关注,已成为“高效、绿色、安全”的代名词。COS来源丰富,广泛存在于低等动植物中,如甲壳动物外壳、藻类的细胞壁等[11]。在体外和体内的大量研究报道,COS在抗氧化方面发挥着重要的作用,具有清除氧自由基、降低氧化产物含量、提高抗氧化酶活性等功能[12-17]。本研究除了进一步验证COS对抗氧化酶活性及氧化产物含量的影响,也探讨了COS对抗氧化反应信号通路Keap1-Nrf2/抗氧化反应元件(ARE)中的核心成员Nrf2及其下游因子HO-1的作用,从而揭示COS抗氧化作用的可能信号通路或靶点。
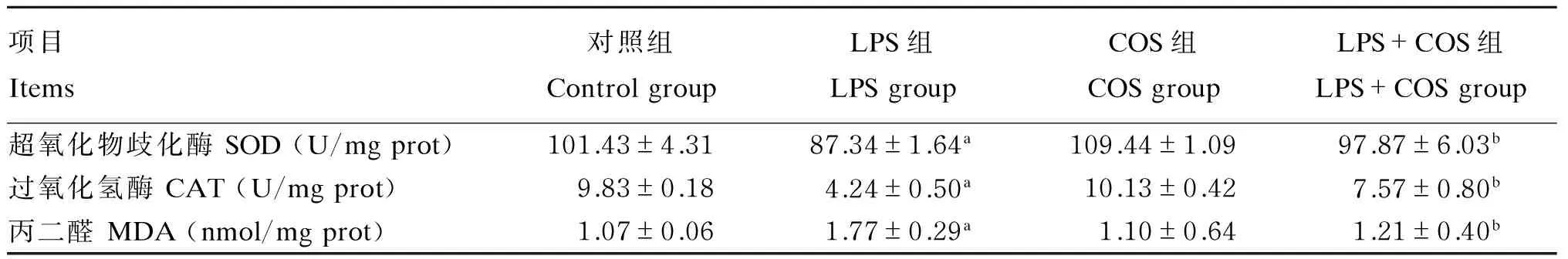
表4 各细胞组中SOD、CAT活性和MDA含量的检测结果Table 4 The test results of SOD, CAT activities and MDA content in each cell group (n=6)
LPS是革兰氏阴性细菌细胞壁中的成分,当细菌细胞壁被破坏而释放出来,是内毒素中的一种,也是一种典型的肠毒素。LPS能刺激机体产生大量的活性氧自由基,从而导致机体氧化应激、炎症等一系列反应。用LPS诱导氧化应激模型具有实际意义,在许多研究中得到应用和探讨,如王晓等[18]用LPS成功建立了大鼠胰岛细胞氧化应激模型,进一步探讨了α-硫辛酸的抗氧化和抗凋亡的作用机制;又如齐策等[19]用LPS诱导小鼠腹腔巨噬细胞氧化应激模型,通过检测细胞的脂质过氧化程度,从而探究了维生素C-磷脂复合物的抗氧化作用。
Nrf2在机体绝大部分组织中表达,是调控机体细胞、组织及器官中氧化还原平衡的主要组成部分,当Nrf2被活化入核后,能与ARE识别并结合,然后启动下游一系列解毒和抗氧化因子的基因表达,如醌氧化还原酶-1(NQO1)、谷胱甘肽硫转移酶(GST)、SOD、CAT、还原性谷胱甘肽(GSH)等,而这些基因的表达都与机体的抗氧化活性有极其重要的关联,对机体的氧化还原平衡有关键性的作用[20-21]。HO-1又称为热休克蛋白32,可以被多种物质或刺激因素诱导表达,如热休克、缺血、辐射、低氧、高氧、重金属盐等,发挥强大的细胞保护作用,HO-1的细胞保护作用主要与它的催化分解产物一氧化碳、胆绿素、胆红素、亚铁离子有关,其中,胆绿素、胆红素、亚铁离子与抗氧化的作用有紧密联系[22],而研究发现,Nrf2是调控HO-1表达的一种重要的蛋白合成信号因子[23-24]。
从试验结果分析,LPS诱导IPEC-J2氧化应激,Nrf2被激活,并进一步诱导下游HO-1的表达,对细胞起到一定的保护作用,但这种保护作用不足以抵抗细胞的氧化损伤,细胞的抗氧化酶(SOD、CAT)活性降低,抗氧化产物(MDA)增多;而COS能进一步促使Nrf2高表达,并诱导下游基因HO-1表达,提高抗氧化酶( SOD、CAT)活性,同时降低抗氧化产物(MDA)含量,增强了细胞对氧化应激的耐受能力,从而对细胞起到保护能力。所以,从试验结果可以推测COS的抗氧化作用与抗氧化反应信号通路Nrf2/ARE及HO-1有一定的关联。
4结论
LPS诱导IPEC-J2细胞氧化应激,而COS可进一步促进Nrf2和HO-1蛋白的高表达,并提高抗氧化酶的活性,降低氧化产物含量,从而增强细胞对氧化应激的抵抗力,起到保护作用。
参考文献:
[1]SOHAL R S,ALLEN R G.Oxidative stress as a causal factor in differentiation and aging:a unifying hypothesis[J].Experimental Gerontology,1990,25(6):499-525.
[2]TANG J,JIANG Y,TANG Y,et al.Effects of propofol on damage of rat intestinal epithelial cells induced by heat stress and lipopolysaccharides[J].Brazilian Journal of Medical and Biological Research,2013,46(6):507-512.
[3]CHUA B Y,KOBAISI M A,ZENG W G,et al.Chitosan microparticles and nanoparticles as biocompatible delivery vehicles for peptide and protein-based immunocontraceptive vaccines[J].Molecular Pharmaceutics,2012,9(1):81-90.
[4]YIN Y L,TANG Z R,SUN Z H,et al.Effect of galacto-mannan-oligosaccharides or chitosan supplementation on cytoimmunity and humoral immunity in early-weaned piglets [J].Asian-Australasian Journal of Animal Sciences,2008,21(5):723-731.
[5]SHARMA S,MUKKUR T K S,BENSON H A E,et al.Enhanced immune response against pertussis toxoid by IgA-loaded chitosan-dextran sulfate nanoparticles[J].Journal of Pharmaceutical Sciences,2012,101(1):233-244.
[6]肖定福,唐志如,印遇龙,等.壳聚糖对大肠杆菌攻毒仔猪生长性能和抗氧化状况的影响[J].激光生物学报,2011,20(6):741-746.
[7]杨艳.壳寡糖,氨基葡萄糖及其衍生物的抗氧化功能研究[D].博士学位论文.青岛:中国海洋大学,2005.
[8]YAO Q,SUN T,ZHOU D X,et al.Antoioxidant activity of carboxymethyl chitosan with different substituted degrees[J].Agricultural Science & Technology,2008,9(1):5-7,59.
[9]TANG Z R,YIN Y L,NYACHOTI C M,et al.Effect of dietary supplementation of chitosan and galacto- mannan-oligosaccharide on serum parameters and the insulin-like growth factor-Ⅰ mRNA expression in early-weaned piglets[J].Domestic Animal Endocrinology,2005,28(4):430-441.
[10]CHERVINETS V M,CHERVINETS I V,BONDARENKO V M,et al.Clinical effect of chitosan in bacterial vaginosis therapy[J].Zhurnal Mikrobiologii, Epidemiologii, Immunobiologii,2011(5):76-79.
[11]SHEPHERD R,READER S,FALSHAW A.Chitosan functional properties[J]. Glycoconjugate Journal,1997,14(4):535-542.
[12]XIE W M, XU P X, LIU Q. Antioxidant activity of water-soluble chitosan derivatives[J].Bioorganic & Medicinal Chemistry Letters,2001,11(13):1699-1701.
[13]AHN B N, KIM J A, HIMAYA S W A,et al.Chitooligosaccharides attenuate UVB-induced damages in human dermal fibroblasts[J].Naunyn-Schmiedeberg’s Archives of Pharmacology,2012,385(1):95-102.
[14]QIAO Y,BAI X F,DU Y G.Chitosan oligosaccharides protect mice from LPS challenge by attenuation of inflammation and oxidative stress[J].International Immunopharmacology, 2011,11(1):121-127.
[15]张吉,刘洪涛,李秀英,等.壳寡糖对自由基的清除及对N9小胶质细胞的保护作用[J].食品科学,2010,31(7):81-85.
[16]FENG T,DU Y M,LI J,et al.Antioxidant activity of halfN-acetylated water-soluble chitosaninvitro[J].European Food Research and Technology,2006,225(1):133-138.
[17]XU W,HUANG H C, LIN C J,et al.Chitooligosaccharides protect rat cortical neurons against copper induced damage by attenuating intracellular level of reactive oxygen species[J].Bioorganic & Medicinal Chemistry Letters,2010,20(10):3084-3088.
[18]王晓,葛勤敏.α-硫辛酸对脂多糖诱导的大鼠胰岛细胞氧化应激和凋亡的影响[J].上海医学,2014,37(9):751-754,823.
[19]齐策,金青哲,王兴国.维生素C-磷脂复合体抑制LPS诱导小鼠腹腔巨噬细胞氧化应激的研究[J].科技导报,2011,29(15):35-38.
[20]NIOI P,MCMAHON M,ITOH K,et al.Identification of a novel Nrf2-regulated antioxidant response element (ARE) in the mouse NAD(P)H:quinone oxidoreductase 1 gene:reassessment of the ARE consensus sequence[J].Biochemical Journal,2003,374(2): 337-348.
[21]林谦,邱磊,云龙,等.核因子E2相关因子2调控机体抗氧化途径特性及其与畜禽的健康和肉品质的关系[J].动物营养学报,2014,26(6):1421-1429.
[22]RYTER S W,OTTERBEIN L E,MORSE D,et al.Heme oxygenase/carbon monoxide signaling pathways:regulation and functional significance[J].Molecular and Cellular Biochemistry, 2002,234-235(1):249-263.
[23]ALAM J,STEWART D,TOUCHARD C,et al.Nrf2,a Cap ‘n’ Collar transcription factor,regulates induction of the heme oxygenase-1 gene[J].The Journal of Biological Chemistry,1999,274(37):26071-26078.
[24]PAE H O,OH G S,JEONG S O,et al.l,2,3,4,6-penta-O-galloyl-β-D-glucose up-regulates heme oxygenase-1 expression by stimulating Nrf2 nuclear translocation in an extracellular signal-regulated kinase-dependent manner in HePG2 cells[J].World Journal of Gastroenterology,2006,12(2):214-221.
*Contributed equally
**Corresponding author, professor, E-mail: liwenping7222@163.com
(责任编辑武海龙)
doi:10.3969/j.issn.1006-267x.2016.07.013
收稿日期:2016-01-07
基金项目:国家自然科学基金青年项目(31301985);中国博士后科学基金项目(2014M562111,2015T80871);湖南省科技厅项目(2015RS4035)
作者简介:肖定福(1977—),女,湖南娄底人,副教授,博士,研究方向为单胃动物营养。E-mail: xiaodingfu2001@163.com **通信作者:李文平,教授,硕士生导师,E-mail: liwenping7222@163.com
中图分类号:S811.3
文献标识码:A
文章编号:1006-267X(2016)07-2090-06
Effects of Chitooligosaccharide on Lipopolysaccharide Induced Oxidative Damage in Epithelial Cells of Pig Jejunum
XIAO Dingfu1ZHONG Jia2*LIU Jinhui2LI Wenping2**
(1. College of Animal Science and Technology, Hunan Agricultural University, Changsha 410128, China;2. College of Veterinary Medicine, Hunan Agricultural University, Changsha 410128, China)
Abstract:This study was designed to investigate the effect of chitooligosaccharide (COS) on oxidative stress and used lipopolysaccharide (LPS) induced epithelial cells of pig jejunum (IPEC-J2) as an in vitro model of oxidative stress. The IPEC-J2 were incubated with LPS and COS for 12, 24 and 48 h,and then used methylthiazolyldiphenyl-tetrazolium bromide (MTT) method to detect the activity of cell proliferation; the appropriate concentrations of LPS (1.0 μg/mL) and COS (200 μg/mL) were chosen in the IPEC-J2 cells, divided into control group, LPS group, COS group and LPS+COS group, and then detected the expression of NF-E2-related factor 2 (Nrf2)and heme oxygenase 1 (HO-1) by Western Blot; and detected superoxide dismutase (SOD), catalase (CAT) activities and malonaldehyde (MDA) content by the kit. The results showed that the optimum concentration of LPS and incubated time for model was 1.0 μg/mL and 24 h, the inhibition of cell proliferation was 41.6%; COS promoted the proliferation of IPEC-J2, worked the best when its concentration was 200 μg/mL and incubated 24 h, the cell proliferation rate was 126.3%. Compared with the control group, LPS+COS group was not significantly different in SOD, CAT activities and MDA content (P>0.05), but Nrf2 and HO-1 protein expression was significantly increased (P<0.05); compared with LPS group, Nrf2 protein expression of LPS+COS group was significantly higher (P<0.05), and there was an increasing trend of HO-1 protein expression, but the difference was not significant (P>0.05), moreover, SOD, CAT activities were significantly increased and MDA content was significantly reduced (P<0.05). It is concluded that LPS induce oxidative stress of IPEC-J2, but COS can induce high expression of Nrf2 and HO-1 protein, and improve the activity of antioxidant enzymes, reduce the content of oxidative products, so increase cellular resistance to oxidative stress, and play a protective role.[Chinese Journal of Animal Nutrition, 2016, 28(7):2090-2095]
Key words:chitooligosaccharide; lipopolysaccharide; IPEC-J2; oxidative stress; antioxidant
