巨大囊性肾外型成人肾母细胞瘤破裂并肾周积液1例诊治分析
2016-08-03王启飞李泉林张志伟汤奇祯
曾 光, 王启飞, 仲 林, 李泉林, 姜 涛, 张志伟,汤奇祯,陈 峰
(1.大连医科大学研究生院培养办公室;2.大连医科大学附属第一医院泌尿外科;3.大连医科大学附属第一医院病理科,辽宁大连 116000)
·临床研究·
巨大囊性肾外型成人肾母细胞瘤破裂并肾周积液1例诊治分析
曾光1, 王启飞2, 仲林3, 李泉林2, 姜涛2, 张志伟2,汤奇祯2,陈峰2
(1.大连医科大学研究生院培养办公室;2.大连医科大学附属第一医院泌尿外科;3.大连医科大学附属第一医院病理科,辽宁大连116000)
摘要:目的报告1例巨大囊性肾外型成人肾母细胞瘤破裂合并大量肾周积液病例,结合文献复习探讨该病的病理及临床特点。方法回顾性分析1例巨大囊性肾外型成人肾母细胞瘤破裂合并大量肾周积液病例的诊治经过。结果开放手术行左侧泌尿系切除术,术后辅助放化疗,随访5个月,未见肿瘤复发。结论成人肾母细胞瘤发病率低,预后较差,巨大囊性肾外型成人肾母细胞瘤极为罕见,手术治疗结合术后放化疗的综合治疗可有一定疗效。肿瘤分期、组织学分型对判断预后有一定指导价值。
关键词:巨大囊性肾外型成人肾母细胞瘤;肿瘤破裂;肾周积液
肾母细胞瘤(nepnroblastoma)又名Wilms瘤(wilms’tumor,WT),主要发生于婴幼儿,约占儿童肾脏肿瘤的95%,90%出现于6岁以前,极少见于成人。15岁以上者称为成人肾母细胞瘤(adult Wilms tumor,AWT),是一种临床罕见、恶性程度高的肾脏恶性肿瘤,发病率低,欧美国家年发病率< 2/10万,国内尚无准确统计数字[1]。巨大囊性肾外型成人肾母细胞瘤则更为罕见,我院于近日收治1例巨大囊性肾外型成人肾母细胞瘤破裂合并肾周积液患者,现报告如下,并结合文献分析其临床及病理学特点。
1病例报告
患者女性,58岁,发现左肾周积液1年,未行特殊治疗,1个月前出现左腰部疼痛,无外伤史。体检:左腰腹部膨隆,左肾区叩痛阳性。B超示左肾周积液。CTU检查示左肾位置抬高,肾轴前倾,肾脏下方占位病变,有造影剂填充,肾周大量积液,未见其他脏器及淋巴结转移(图1A、1B),临床初步诊断为左肾恶性肿瘤合并肾脏破裂。于2015年5月20日行手术治疗。术中见左侧腹膜后囊性占位,范围约20 cm×10 cm×15 cm,囊壁为部分肾周筋膜及部分假包膜,引出淡黄色略浑浊液体约1 500 mL,左肾位置明显抬高,肾轴前倾,肾脏下方囊性占位,主体位于肾脏轮廓之外,与肾下极相连,可见小破口通向肾外(图2),剖开见充满烂肉样肿瘤组织,送术中病理报为间叶组织来源恶性肿瘤,行左侧泌尿系切除术,左输尿管未见异常。切除标本后剖开检查,见近肾下极处外生性囊性占位,主体位于肾脏轮廓之外,与肾下极相连,其内充满肿瘤组织,囊壁内面布满肿瘤。术后应用长春新碱、阿霉素和放线菌素D化疗方案,随访5个月未见肿瘤复发。病理诊断:左肾Wilms瘤,免疫组化(图3):CD10(+),Vimentin(+),34βE12(-),CD15(-),CK(-),CK20(-),CK5/6(-),CK7(-),CK8/18(-),CR(-),EMA(-),WT-1(+),P63(+),Ki-67(+30%),S-100(-)。
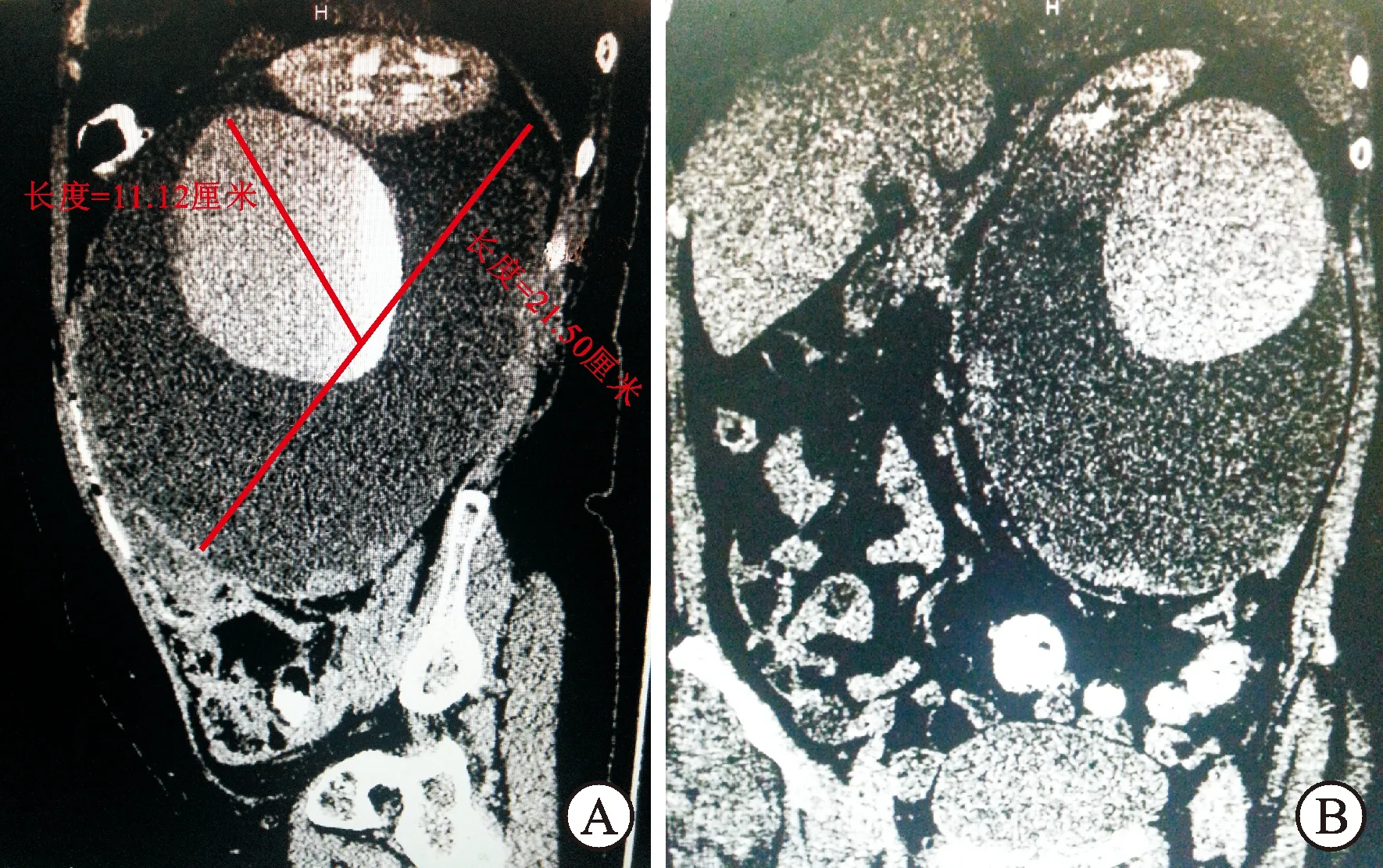
图1 患者CTU检查结果

图2 WT患者术中所见

图3 WT病理特征
2讨论
2.1相关背景WT为小儿最常见的恶性实体瘤,约占小儿全部实体肿瘤的8%,多见于6岁以前儿童,98%小于15岁,80%以上小于5岁,发病平均年龄为3.5岁[2]。肾母细胞瘤多为实性,完全囊性者罕见,肿瘤大多边界清楚,被假包膜包绕,假包膜由受压的肾组织和肾周组织形成。肾母细胞瘤是由胚胎性肾组织发生的,由分化不等的未分化胚芽组织、上皮和间质组成的恶性混合瘤,间质可向任何类型的软组织分化[3]。该病的分子生物学形成机制尚不清楚,可能是未分化形成小管和小球的后肾胚芽异常增生所致,也可能与肿瘤抑制基因WT1突变有关。AWT十分罕见,每千万人中少于2例,其5年总生存率62.4%,可见于任何年龄,但30岁以内的患者约占75%,男女及左右肾脏发生率没有差别,至今欧美文献报道的成人肾母细胞瘤不足400例,国内资料比较零散,尚缺乏比较可靠的完整数据[4]。冯宁翰等报告3例巨大AWT,临床罕见,而完全囊性肾外型AWT则更为罕见,国内外文献仅见个案报告[5]。按组织上是否出现弥漫的间变细胞可分为预后良好型(favorablehistology,FH) 和预后不良型(unfavorablehistology,UH)。UH型患者发病年龄较轻,发病时病变多为晚期,预后较差。本病例为T3期,即治疗前单侧肿瘤破裂。根据美国国家肾母细胞瘤研究组(American National Kidney Mother Cell Tumor Research Group,NWTS)制定的临床分期标准,本病例为Ⅲ期,即肾外有肿瘤种植。
2.2表现及诊断AWT的典型症状是腰腹部出现快速增大的肿块,可伴或不伴血尿及疼痛,少数因肿瘤分泌肾素而出现高血压。侵入下腔静脉可伴下肢水肿,出现肾小球疾病时,可有蛋白尿,也可见肿瘤破裂引起急性疼痛症状者。影像学检查是诊断 AWT的重要手段,B超检查可见边界清楚的实性占位,部分病例表现为囊实性占位,可表现为高回声或低回声团块,CT可见腰腹部包块,增强显示肿块呈不均匀强化,内部可出现出血及坏死,IVP可见肾内占位性病变,核磁共振对本病的诊断价值与CT相同。AWT术前准确诊断比较困难,最后确诊需术后病理,其病理表现多样,在3种特征性成分中(未分化的胚芽组织、间胚叶间质和上皮性细胞及肉瘤样细胞),后肾胚芽细胞为Wilms瘤的基本成分,间质组织占肿瘤的绝大部分,上皮细胞形成发育不全的肾小管,大部分组织学特征是发育不全或胚胎性的肾小球、肾小管结构伴有不成熟肉瘤样间质,也有部分病例主要表现为不成熟的母细胞成分,无典型的胚胎性肾小管与肾小球结构[6]。AWT病理表现多样,因此,必须综合年龄、性别、临床表现、影像学检查及术后病理结果才能降低AWT的误诊率。AWT多为实性或囊实性改变,肿瘤主体位于肾脏轮廓之内,称为“肾内型”,肿瘤边界清楚,呈灰白色或红色,表面有“蔓藤状”肿瘤血管的典型表现,质地软而细腻,鱼肉状,可有出血坏死或囊性变[7]。而本例患者完全呈囊性改变,临床罕见,并且但大部分瘤体突出于肾脏,主体位于肾脏轮廓之外,仅少部分与肾下极相连,称为“肾外型”,临床极为罕见,术前诊断困难。AWT诊断须符合以下标准:肾脏原发肿瘤;具有原始母细胞样梭形或圆形细胞成分;有不成熟或胚胎样肾小管或小球样结构形成;没有肾细胞癌组织;组织学图像明确;年龄大于15岁。临床分期较晚及UH型AWT多发生血行转移,以肺转移最为常见,其次为肝、骨、脑等器官[8]。
2.3治疗及预后由于病例较少,没有大样本研究统计,故AWT没有一个统一标准的治疗方案。当前多数学者推荐采用手术、放疗和化疗三者联合的综合治疗,根治性肾切除术是目前首选的治疗方法,并以NWTS针对儿童肾母细胞瘤制定的方案为依据,根据肿瘤分期辅以化疗或(和)放疗。AWT因其预后较儿童差,无论分期如何,应尽早、尽可能切除原发病灶,术后辅助治疗也应尽早进行。对于肿瘤较大、瘤体粘连较重、手术难度大者,术前行肾动脉化疗栓塞与常规术前静脉化疗,缩小肿瘤体积,可增加手术的安全性,对中晚期肾母细胞瘤均有一定疗效。本例患者因术前未诊断为肾母细胞瘤,故未行术前化疗。术后正确的放疗、化疗对提高患者的生存率至关重要,目前普遍采用的术后综合辅助治疗方法是依据NWTS推荐的术后联合化疗方案:对于Ⅰ~Ⅱ期的患者,建议更生霉素(actinomycin,ACTD)或放线菌素D与长春新碱(vin-cristine,VCR) 2种药物联合化疗,对于Ⅲ~Ⅳ期的患者,需在以上治疗的基础上加用阿霉素(adriamycin,ADR)的三联治疗,并辅以肾区放疗。其他常用化疗药物有环磷酰胺(cyclophosphamide,CTX)、吉西他滨、 顺铂(cisplatin,DDP) 及足叶乙甙(etoposide,VP-16)等[9]。对于放疗,已经证实肾母细胞瘤对放射线敏感,一般认为各期患者均应接受肾区及转移灶的放疗,常规放疗剂量20~50Gy,对于晚期及UH型患者,JOANNA等[10]提出术后即采用化疗、肾区及转移灶的放疗、双肺预防性放疗联合治疗方案。手术治疗联合术后化疗及瘤床放疗的综合治疗,可以有效延长患者术后的生存期。在本病例中,采用长春新碱,阿霉素、放线菌素D的三联化疗加肾区放疗,术后生存质量满意。另外,RACHEL SUKRUN等[11]提出以肿瘤干细胞为目标的靶向治疗也尝试应用于AWT的治疗,并取得一定进展。
AWT的预后与肿瘤临床分期、组织学分型、术后辅助治疗方案与时机等因素密切相关,韩秀娟等总结AWT 预后相关因素包括:①临床分期:肿瘤包膜受侵、肿瘤破裂、肿瘤组织浸润周围组织、淋巴结及远隔转移、双肾发生等,为预后不好的指标;②组织学分型:肿瘤细胞间变是预后不好的指标;肾小球和肾小管分化良好是预后好的指标;大量横纹肌分化时,预后好;③体积:肿瘤的体积越大,预后越差;④大体:呈囊状结构者,预后良好;产生黏液,预后不好[12]。AWT比儿童型Wilms瘤的预后差,部分原因是目前AWT的治疗方法不统一,研究表明UH患者发病年龄较轻,发病时多为晚期,预后更差,因而较早的肿瘤分期及手术联合放化疗的综合治疗是改善患者预后的关键因素[13]。目前文献报告的AWT资料比较零散,对预后评估方面没有大样本资料。1990年NWTSG报道了采用儿童组综合方案治疗的27例AWT结果,总生存期(overall survival,OS)3年者为67%(18例),除外预后不良型后3年OS为79%。1994年法国研究组报道22例AWT治疗结果,中位随访110个月,55%患者存活,45%患者无病生存。SIOP 根据SIOP93-01试验治疗30例成人WT,认为按照儿童WT治疗原则治疗AWT预后较好,4年总生存率(overall survival rate,OS)和无病生存率(disease free survival,DFS)分别为83%和57%[8]。许涛等[8]回顾性分析12例成人肾母细胞瘤患者1年2年和3年总生存率分别为91.7% 76.4%和61.1%;1年和2年无病生存率为54.9%和36.6%,中位无病生存期14个月;1年和2年无复发生存率分别为66.7%和50.0%。赵俊峰等[14]随访146例AWT患者,平均随访36.2个月,1、2、3、5、10年生存率分别为65%(95/146)、 44%(64/146)、33%(48/146)、 20%(29/146)、6%(9/146);各期的3年生存率为:1期 62%,2期32%,3期21%,4期0%,各期3年生存率之间有明显差异(P<0.01)。
综上所述,AWT是一种非常罕见的恶性肾实体瘤,与儿童型Wilms瘤差别较大,预后较差,超声、CT和MRI等影像学检查无法确诊,术前诊断比较困难,确诊依靠病理诊断。由于AWT发病率较低,目前尚不能进行大规模的临床研究,故尚无公认的最佳治疗模式,手术治疗并辅以放疗、化疗是改善其预后的有效措施,加强对疾病早期诊断、早期治疗及术后根据病理分型和分期进行规范化治疗,可明显提高治愈率并改善其预后。
参考文献:
[1] ANDREW M.Davidoff.Wilms Tumor[J].Adv Pediatr, 2012,59(1): 247-267.
[2] MORABITO V, GUGLIELMOG N, BERLOCO PB,et al.Adult Wilms tumor: Case report[J].Int J Surg Case Rep,2015,6:273-276.
[3] 那彦群,李鸣.泌尿外科学高级教程[M].北京:人民军医出版社,2014:109.
[4] KATHLEEN KIERAN, PETER MSA, EHRLICH F,et al.Current surgical standards of care in Wilms tumor [J].Urol Oncol: Seminars and Original Investigations,2015,1:11.
[5] 冯宁翰,王增军,王小宁,等.巨大成人型肾母细胞瘤3例报告并文献复习[J].现代泌尿外科杂志,2011,16(2):106-107,122.
[6] RAM NARAYAN DAS, UTTARA CHATTERJEE,SUGATO BANERJEE,et al.Study of histopathological features and proliferation markers in cases of Wilms’ tumor[J].Indian J Med Paediatric Oncol,2012,33(2):102-106.
[7] YI WU, XUEMING ZHU, XINGDONG WANG, et al.Extra-renal nephroblastomatosis in children: a report of two cases[J].BMC Pediatrics,2014,14:255.
[8] 许涛,高远红,李林均,等.成人肾母细胞瘤12例临床分析[J].广东医学,2014,35(23):3673-3675.
[9] GLEASON JM, LORENZO AJ, BOWLIN PR,et al.Innovations in the management of Wilms’ tumor[J].Therap Adv Urol,2014,6(4):165-176.
[10] JOANNA HUSZNO, DANUTA STARZYCZNY SLOTA, MAGDALENA JAWORSKA, et al.Adult Wilms’ tumor - diagnosis and current therapy[J].Cen Eur J Urol,2013,1:39-44.
[11] RACHEL SHUKRUN, NAOMI PODE SHAKKED, BENJAMIN DEKEL,et al.Targeted therapy aimed at cancer stem cells: Wilms’ tumoras an example[J].Ped Nephr,2014,29:815-823.
[12] 韩秀娟,巩丽,薛力,等.成人肾母细胞瘤1例及文献复习[J].现代泌尿外科杂志,2010,15(1):17-19.
[13] MIRIAM HAREL, JOHN H, MAKARI,et al.Oncology: The Role of Partial Nephrectomy in Wilms Tumor [J].Curr Urol Rep,2013,14:350-358.
[14] 赵俊峰,郑少斌,赵善超,等.成人肾母细胞瘤的预后因素分析[J].中国老年学杂志,2012,32:1163-1164.
(编辑何宏灵)
收稿日期:2015-07-22修回日期:2015-10-09
通讯作者:王启飞,副教授.E-mail:frog080619@163.com
作者简介:曾光(1986-),女(汉族),助教.研究方向:肿瘤基础与临床.E-mail:68831960@qq.com
中图分类号:R737.11
文献标志码:A
DOI:10.3969/j.issn.1009-8291.2016.02.012
Diagnosis and treatment of giant cystic extra-renal adult Wilms’ tumor complicated with rupture and perinephric hydrops(report of 1 case and literature review)
ZENG Guang1, WANG Qi-fei2, ZHONG Lin3, LI Quan-lin2, JIANG Tao2, ZHANG Zhi-wei2, TANG Qi-zhen2, CHENG Feng2
(1.Training Office of Graduate School; 2.Department of Urology; 3.Department of Pathology, the First Afflicted Hospital, Dalian Medical University, Dalian 116000, China)
ABSTRACT:ObjectiveTo report one case of giant cystic extra-renal adult Wilms’ tumor complicated with rupture and perinephric hydrops, investigate its pathological and clinical features and review the literature.MethodsClinical date of the case were retrospectively analyzed.ResultsNephrectomy was performed, and postoperative chemotherapy and radiotherapy were conducted.During the follow-up of 5 months, no relapse was observed.ConclusionAdult Wilms’ tumor is rare, malignant, with poor prognosis.Giant cystic extra-renal adult Wilms’ tumor is especially rarely seen.Nephrectomy combined with radical chemotherapy could improve the outcomes and prognosis.
KEY WORDS:giant cystic extra-renal adult Wilms’ tumor; tumor rupture;perinephric hydrops
