敲除iclR基因对大肠杆菌发酵L-色氨酸的影响
2016-08-02陈胜杰谢希贤徐庆阳代谢控制发酵技术国家地方联合工程实验室天津市氨基酸高效绿色制造工程实验室天津科技大学生物工程学院天津300457
陈胜杰,刘 辉,谢希贤,徐庆阳,陈 宁(代谢控制发酵技术国家地方联合工程实验室,天津市氨基酸高效绿色制造工程实验室,天津科技大学生物工程学院,天津 300457)
敲除iclR基因对大肠杆菌发酵L-色氨酸的影响
陈胜杰,刘 辉,谢希贤,徐庆阳,陈 宁
(代谢控制发酵技术国家地方联合工程实验室,天津市氨基酸高效绿色制造工程实验室,天津科技大学生物工程学院,天津 300457)
为了研究敲除iclR基因对大肠杆菌(Escherichia coli)发酵L-色氨酸的影响,以L-色氨酸工程菌大肠杆菌TRTH为出发菌株,利用Red重组技术构建了iclR基因(编码乙醛酸操纵子阻遏蛋白)缺失菌株TRTHΔiclR.摇瓶发酵实验结果显示:TRTH?iclR的L-色氨酸产量和糖酸转化率分别达到(6.52±0.46)g/L和13.17%,比原菌的分别提高了21.86%,和22.85%,;乙酸累积量为6.82,g/L,比原菌的降低了37.63%. 30,L发酵罐发酵实验结果显示:TRTH?iclR的L-色氨酸产量及糖酸转化率分别达到(13.01±1.05)g/L和6.51%,比原菌的下降了60.34%,和68.27%,;乙酸累积量为18.21,g/L,比原菌的增加了33.42%. 结果表明:在摇瓶条件下,重组菌株生物量较出发菌株高,代谢流分配适合L-色氨酸积累;但在发酵罐条件下,乙醛酸循环的增强导致重组菌株供能不足和乙酸的过多积累,最终使得生物量不足以及L-色氨酸产量下降.
L-色氨酸;大肠杆菌;乙醛酸循环;iclR;发酵
L-色氨酸(L-tryptophan,L-trp)是人和动物的必需氨基酸之一[1-2].目前,发酵法工业生产L-色氨酸存在的主要问题是L-色氨酸转化率偏低(低于23%,),其主要原因是较多的碳源在TCA循环中消耗.以往的菌株改造主要集中在修饰与合成L-色氨酸直接相关的途径(如莽草酸途径)或过表达关键基因(如tktA、ppsA、aroG等[3]),但鲜有改变TCA循环等中心代谢途径和L-色氨酸积累的研究报道.Rezaei等[4]在酵母菌株S288C中同时敲除TCA循环的关键酶基因aco1(编码顺乌头酸酶)和基因icl1(编码异柠檬酸裂合酶),重组菌的产琥珀酸的能力明显下降.借鉴此思路,若对TCA循环的支路代谢(乙醛酸循环)作适当修饰,可能会增加草酰乙酸的合成,通过丙酮酸更多地转化成合成L-色氨酸的重要前体物——磷酸烯醇式丙酮酸;另外也可能会降低TCA中间代谢物的生成,减少因生成能量而消耗的碳源.作为乙醛酸循环的抑制子IclR,能和编码乙醛酸循环关键酶(异柠檬酸裂合酶、苹果酸合成酶和异柠檬酸脱氢酶/磷酸化酶)的aceBAK操纵子结合[5-6],关闭乙醛酸循环.抑制子IclR的缺失会导致乙醛酸循环关键酶的组成型表达,强化乙醛酸循环,有利于减少TCA循环的CO2损失,可能是一种更经济的代谢方式[7].Lee等[8]发现大肠杆菌(E.coli)iclR敲除菌株的苏氨酸产量显著提高.本文基于此,改变乙醛酸循环代谢流分布,构建iclR缺失的工程菌TRTH ΔiclR,研究了iclR缺失对L-色氨酸积累的影响.
1 材料与方法
1.1 菌株和质粒
所用菌株和质粒均为本实验室保存,见表1.

表1 菌株和质粒Tab. 1 Bacterial strains and plasmids
1.2 培养基
LB培养基:用于大肠杆菌的培养.根据需要添加抗生素,氨苄青霉素100,μg/mL,氯霉素25,μg/mL.
用于大肠杆菌发酵培养的种子培养基(g/L):葡萄糖40,酵母粉1,柠檬酸钠1.6,硫酸铵1.2,磷酸氢二钾5.6,硫酸镁1.6,维生素B10.001,3,硫酸亚铁0.002,8,硫酸锰0.001,2,生物素0.000,3,微量元素混合液0.004.
发酵培养基(g/L):葡萄糖7.5,硫酸铵1.6,酵母粉1,柠檬酸钠2,磷酸氢二钾7.5,硫酸镁2,微量元素混合液0.001.
1.3 试剂
引物合成由金唯智生物科技公司完成.PCR所用试剂以及限制酶、T4,DNA连接酶均购于TaKaRa公司.其他化学试剂均为分析纯.
1.4 产L-色氨酸大肠杆菌TRTH?iclR的构建
质粒和基因组提取、DNA片段回收、大肠杆菌的电转化等常规技术的操作参照文献[9]进行.根据大肠杆菌的转录抑制子基因iclR 的序列设计引物.分别扩增iclR上游同源臂、下游同源臂和Cmr抗性基因盒,对应的扩增上、下游引物分别为iclR-1∶5'-TTGCGTAACCTTTTCCCTGG-3',iclR-2∶5'-CTCC AGCCTACAAATCGCTCAAGCTAACATCTCTTCA GATTCGGTT-3',iclR-3∶5'-GCTAATTCCCATGTC AGCCGTTATACCGAGCGGCACTACTAACAC-3',iclR-4∶5'-CAGCAGAGTAGAACCCAGGATTAC-3',pKD 3-up:5'-TTGAGCGATTGTGTAGGCTGGAG-3',pKD 3-down:5'-TAACGGCTGACATGGGAATT AGC-3'(其中标注下划线的引物为用于同源重组的具有同源碱基的引物).再采用重叠PCR,以iclR-1和iclR-4扩增连接3个片段,得到片段?iclR.其中PCR条件为:95,℃预变性5,min;94,℃变性30,s,55,℃退火30,s,72,℃延伸,时间依各片段大小设定,1,kbp对应1,min,循环25次.22,℃保温,PCR体系为EXTaq(10,U/mL)0.25,μL,dNTP mixture(10,mmol/L)4,μL,PCR buffer(10×)5,μL,上、下游引物 1,μL,模板10~100,ng,ddH2O补齐至50,μL.将片段?iclR电转化入感受态细胞,击穿电压为1,800,V,时间为5.8,s.利用Red同源重组技术[9],用Cmr抗性基因盒替换iclR基因.基因替换成功的阳性克隆子通过转化入pCP20质粒,消除染色体上Cmr抗性基因.
1.5 发酵实验
摇瓶发酵:将保存菌株接种到四环素抗性斜面活化,37,℃培养12,h,活化两代后接种于含30,mL的种子培养基的500,mL挡板摇瓶中,培养至A600为4~6时,以10%,接种量接种于含30,mL发酵培养基的500,mL挡板摇瓶中.用2%,的苯酚红溶液作为pH指示剂,并用氨水调节并维持pH在6.7~7.0.发酵周期为32,h,期间补加质量分数为60%,的葡萄糖溶液.
30,L发酵罐发酵:用接种环刮取斜面菌苔接种至含3,L种子培养基的5,L发酵罐中,培养至A600为14~16时,以13%,接种量接种于含16,L发酵培养基的30,L发酵罐中.发酵周期为36,h,通过溶氧反馈控制葡萄糖质量浓度小于1,g/L,流加氨水调节并维持pH在6.7~7.0,溶氧控制在30%~40%,流加质量分数为80%,的葡萄糖溶液进行分批补料发酵.
1.6 检测方法
菌体生物量检测:菌体生物量以菌体干质量表示.取10,mL发酵液,13,000,r/min离心20,min,弃上清液,菌体用去离子水洗涤3次后置于55,℃恒温干燥箱中干燥至质量恒定.将发酵液稀释不同倍数,使其在600,nm波长下的吸光度为0.2~0.8,绘制吸光度(x)与干质量(y)曲线并测定菌体生物量,y=0.39x+0.01,R2=0.991.
发酵液中葡萄糖浓度和谷氨酸浓度均采用SBA-40C型生物传感仪(山东科学院生物研究所)测定.
采用高效液相色谱仪测定L-色氨酸含量.色谱条件:色谱柱为Agilent C18(4.6,mm×150,mm,5,μm),采用纯乙腈和质量分数0.3%,的磷酸二氢钾缓冲液(乙腈与磷酸二氢钾体积比为1﹕9)恒梯度洗脱,柱温39,℃,流量1,mL/min,检测波长 278,nm.
胞内ATP浓度采用ATP快速检测试剂盒(Promega公司)测定.
采用高效液相色谱仪检测发酵液中乙酸的含量.色谱条件:色谱柱为Bio-Rad Aminex HPX-87H(300,mm×7.8,mm,9,μm),0.05,mol/L硫酸缓冲液洗脱,柱温30,℃,流量0.5,mL/min,检测波长215,nm.
1.7 数据分析
摇瓶发酵实验每组实验均设3个平行并重复3次,利用Origin 8.0和SPSS 13.0统计软件对实验数据进行分析和处理.30,L发酵罐实验共重复3次.
2 结果与分析
2.1 iclR基因缺失突变株构建
本研究采用Red同源重组技术构建iclR基因缺失突变株TRTH?iclR.先将378,bp、388,bp和1,024 bp的iclR基因的上、下游同源臂片段和氯霉素抗性Cmr片段通过重叠PCR扩增得到大小为1,790,bp的?iclR片段,如图1(a)所示;然后将?iclR片段电转化到含有pKD46质粒的TRTH感受态中,复苏2,h后涂布于氨苄青霉素培养基上,挑取阳性菌进行PCR验证,iclR敲除阳性菌PCR产物大小为1,790,bp,原菌PCR产物大小为1,207,bp,如图1(b)所示.选取pCP20质粒转化的阳性菌,切除基因组上的氯霉素抗性基因,成功构建TRTH?iclR.

图1 TRTH?iclR敲除菌PCR验证图谱Fig. 1PCR identification map of TRTH?iclR knock-out mutant strains
2.2 iclR基因缺失突变株发酵测试
2.2.1 摇瓶分批补料发酵
将TRTH?iclR接种于 30,mL发酵培养基中,接种量10%,.定时取样,经 32,h发酵,结果如图2所示.重组菌TRTH?iclR的细胞生物量(以干质量计)最大为(10.52±0.42)g/L;L-色氨酸产量达到(6.52± 0.46)g/L,相比原菌提高了21.86%,.由此可见,在摇瓶上分批补料培养,敲除基因iclR能明显提高菌体生物量和L-色氨酸积累量.摇瓶水平分批补料培养,重组菌 TRTH?iclR和原菌的耗糖速率几乎同时在17,h达到峰值,之后的耗糖趋势基本一致,说明敲除基因iclR对菌体耗糖能力影响很小,甚至有微弱促进,因为前者峰值略高于后者;与原菌相比,重组菌胞内ATP浓度更高,16,h时为(4,210±450)pmol/L,与原菌的差值达到最大,是原菌的2.1倍,这说明在发酵过程中重组菌的能量供给更充足.这可能是重组菌TRTH?iclR的生物量高于原菌的主要原因.
摇瓶分批补料培养下,重组菌 TRTH?iclR发酵过程乙酸积累更低,最大值为(6.82±0.58)g/L(图3a),比原菌降低了37.63%.这说明在摇瓶条件下,重组菌不会增加乙酸的积累,一定程度上降低了乙酸对菌体的毒害作用.作为中间代谢物,发酵液中谷氨酸的含量对菌体的生长代谢也具有重要影响,相较于原菌株,谷氨酸浓度更低,在15,h后保持在1.01,g/L,而原菌则保持在2.03,g/L(图3,b).虽然谷氨酸浓度略低,但摇瓶内菌体量有限,对谷氨酸的需求并不高,故影响不大.
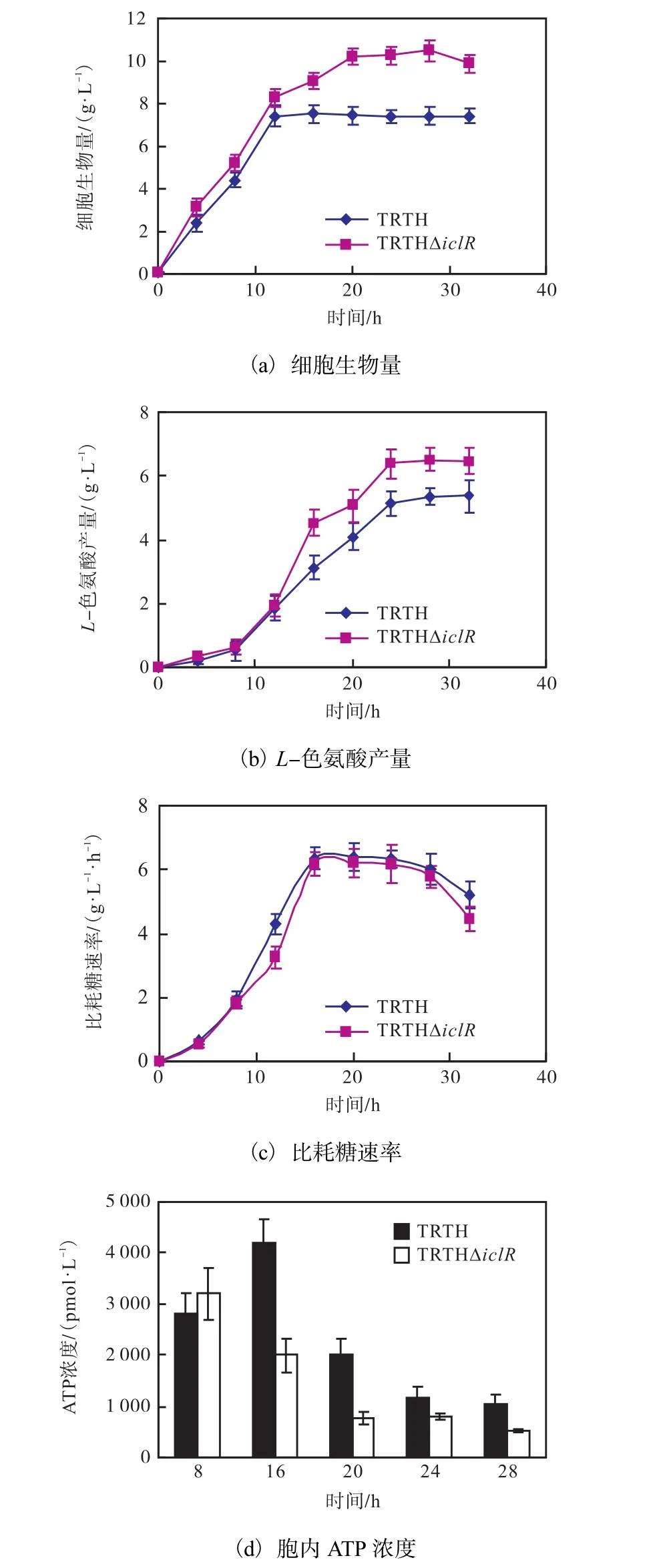
图2 大肠杆菌TRTHΔiclR摇瓶分批补料发酵过程曲线Fig. 2 The shake flask fed-batch fermentation process curve of E. coli TRTHΔiclR
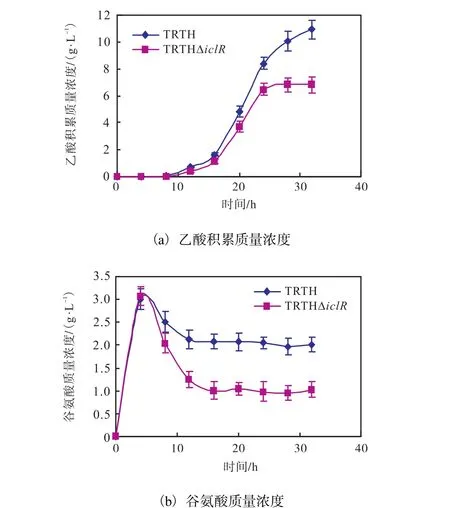
图3 摇瓶条件下的大肠杆菌TRTHΔiclR发酵液中乙酸积累浓度和谷氨酸浓度过程曲线Fig. 3Acetaic acid concentrations and glutamic acid concentrations in E. coli TRTHΔiclRshake flask fermentation broth
2.2.2 30,L发酵罐分批补料发酵
将种子液以13%,接种量接种于16,L发酵培养基中(30,L发酵罐).发酵周期为36,h,每4,h取样测细胞生物量和残糖量并记录,剩余部分离心留样用于后续发酵液分析,结果如图4和图5所示.
重组菌TRTH?iclR细胞生物量(以干质量计)为(30.36±2.10)g/L,相比原菌(42.52±2.50)g/L降低了28.59%,并且在培养16,h时进入稳定期,比原菌提前了4,h;L-色氨酸产量为(13.01±1.00)g/L,比原菌(32.81±2.20)g/L降低了60.34%.重组菌TRTH?iclR比耗糖速率先于原菌在11,h时就达到峰值,比原菌提前了7,h,并在22,h后比耗糖速率急剧下降,相比原菌耗糖明显缓慢.胞内ATP浓度在发酵前期与原菌的相差不大,但在发酵16,h时即降到(110±20)pmol/L,远低于原菌的(5,760±590)pmol/L,且此后几乎检测不到ATP含量,这可能是TRTH?iclR生物量低的原因.
30,L发酵罐发酵中,重组菌发酵液中的乙酸积累量略高于原菌,达到了(18.21±1.10)g/L,相比原菌增加了33.42%,.其原因可能是TRTH?iclR过多、过快的摄糖使菌体无法消耗,多余的糖则易转化为乙酸.乙酸积累量的增多,加重了菌体的负担,导致菌体裂解死亡、生物量减少、活力下降.谷氨酸含量低于原菌,在20,h后保持在2,g/L,而原菌在24,h达到最高值4,g/L,并最终保持在3,g/L.
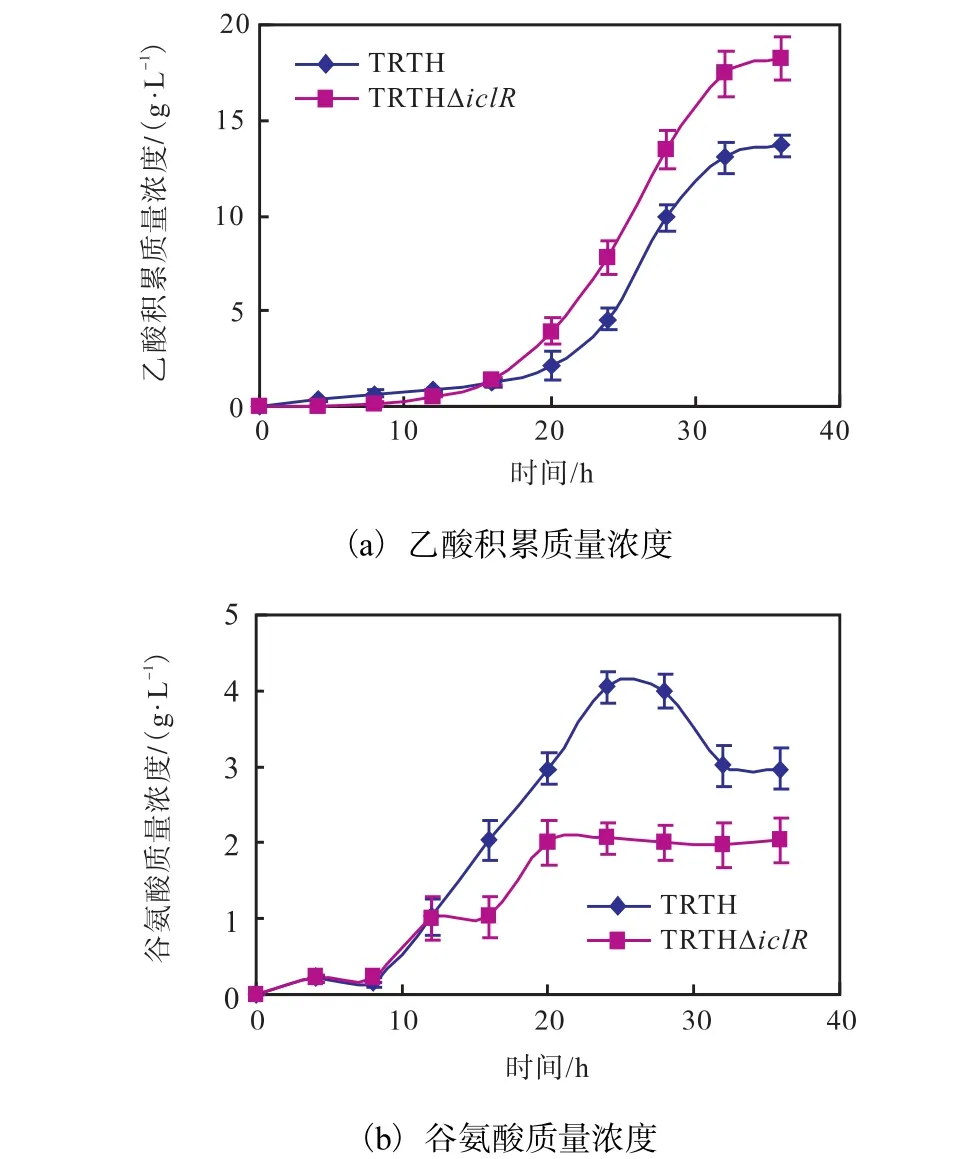
图5 30,L发酵罐条件下的大肠杆菌TRTHΔiclR发酵液中乙酸积累浓度和谷氨酸浓度Fig. 5Acetaic acid concentrations and glutamic acid concentrations in E. coli TRTHΔiclR 30,L fermenter fermentation broth
3 讨 论
通过敲除基因iclR,强化乙醛酸循环,并研究了TCA代谢流量改变对L-色氨酸合成的影响.基因iclR的缺失对菌体在摇瓶上L-色氨酸的积累有一定的促进作用,但在30,L发酵罐上效果却不明显.在摇瓶上L-色氨酸产量高于原菌,可能是摇瓶的溶氧和pH条件等欠佳,在低生物量下,由于能量代谢相对较弱,敲除基因iclR的结果是通过TCA循环损失的CO2量减少,有利于提高L-色氨酸的产量和转化率.对比Lee等[8]的研究发现,缺失了基因iclR后的改造菌较出发菌有更高的L-苏氨酸积累,可以推测增强乙醛酸循环敲除iclR会对下游的氨基酸代谢产生明显影响,包括L-色氨酸合成(莽草酸途径和分支途径等)和L-苏氨酸合成(苏氨酸合成途径)等.而在30,L发酵罐上,溶氧和pH等条件适宜时,菌体前期快速生长,能量需求量大,而重组菌缺失iclR 基因,在促进乙醛酸循环的同时,间接削弱TCA循环的进行.同样的结果出现在了周茜等[10]的实验中,可以推测作为TCA循环的支路——乙醛酸的加强一定程度上抑制了TCA循环.作为中心代谢途径,TCA循环一旦被削弱,则会从多方面影响菌体的生长,例如使谷氨酸的合成量减少,而谷氨酸又是许多重要氨基酸的合成前体,可能影响菌体生长和L-色氨酸的积累(图4);又如减少重要中间产物α-酮戊二酸的合成[10],作为碳-氮代谢的关键节点,其供应量不足势必会影响菌体的生长;同时也会导致能量供应不足,胞内ATP浓度的降低(图5).供能不足会产生大量的乙酸(图5),而乙酸对菌体生长和各种酶的活性都有毒害和抑制作用,导致生物量偏低和L-色氨酸积累不足.根据相关研究[5,11-12],在接下来可以尝试对乙醛酸循环的强度进行适时、准确的调整,使其不会干扰菌体正常生长,做到这点不易,需要更深刻地认识乙醛酸循环和与其相关的代谢网络;在强化能量代谢方面作进一步研究,例如增加细胞生长阶段的ATP合成等;通过基因手段去除或减弱合成乙酸途径,降低乙酸的积累等.
[1] Liu Qian,Cheng Yongsong,Xie Xixian,et al. Modification of tryptophan transport system and its impact on production of L-tryptophan in Escherichia coli[J]. Bioresource Technology,2012,114:549-554.
[2] Wakasa K,Ishihara A. Metabolic engineering of the tryptophan and phenylalanine biosynthetic pathways in rice[J]. The Japanese Society for Plant Cell and Moleular Biology,2009,26(5):523-533.
[3] Ikeda M. Towards bacterial strains overproducing L-tryptophan and other aromatics by metabolic engineering[J]. Applied Microbiology and Biotechnology,2006, 69(6):615-626.
[4] Rezaei M N,Aslankoohi E,Verstrepen K J. Contribution of the tricarboxylic acid(TCA)cycle and the glyoxylate shunt in Saccharomyces cerevisiaeto succinic acid production during dough fermentation[J]. International Journal of Food Microbiology,2015,204:24-32.
[5] Wang Zhengxiang,Brämer C O,Steinbüchel A. The glyoxylate bypass of Ralstonia eutropha[J]. FEMS Microbiology Letters,2003,228(1):63-67.
[6] Yamamoto K,Lshihama A. Two different modes of transcription repression of the Escherichia coli acetate operon by iclR[J]. Molecular Microbiology,2003,47(1):183-194.
[7] 刘子鹤,王庆昭. iclR基因敲除对大肠杆菌产琥珀酸的影响[EB/OL]. (2011-01-03)[2015-09-09]. 中国科技论文在线. http://www.paper.edu.cn/releasepaper/ content/ 201101-13.
[8] Lee K H,Park J H,Kim T Y,et al. Systems metabolic engineering of Escherichia coli for L-threonine production[J]. Molecular Systems Biology,2007,3:1-8.
[9] 朱玉贤,李毅,郑晓峰. 现代分子生物学[M]. 北京:高等教育出版社,2013:166-218.
[10] 周茜,郑会明,陈宁,等. 增强乙醛酸循环对大肠杆菌合成L-苏氨酸的影响[J]. 现代食品科技,2015,31(10):111-114.
[11] 丁起龙,李锡明. 能够产生L-氨基酸的微生物及使用其产生L-氨基酸的方法:中国,201380008312.0[P]. 2013-01-07.
[12] Eiteman M A,Altman E. Overcoming acetate in Escherichia coli recombinant protein fermentations[J]. Trends in Biotechnology,2006,24(11):530-536.
责任编辑:郎婧
Effects of Knockout of Gene iclR on L-tryptophan Fermentation in Escherichia coli
CHEN Shengjie,LIU Hui,XIE Xixian,XU Qingyang,CHEN Ning
(National and Local United Engineering Lab of Metabolic Control Fermentation Technology,Tianjin Engineering Lab of Efficient and Green Amino Acid Manufacture,College of Biotechnology,Tianjin University of Science & Technology,Tianjin 300457,China)
Escherichia coli TRTH ΔiclR was constructed via knockout of iclR,the key gene of the glyoxylate shunt in E.coli TRTH through Red recombination to study the effects of iclR knockout on E.coli TRTH L-tryptophan accumulation.The results of shake flask fermentation indicated that the yield of L-tryptophan and the titer of L-tryptophan from glucose of E.coli TRTH ΔiclR reached(6.52±0.46)g/L and 13.17%,which were 21.86%, and 22.85%, higher than those obtained from E.coli TRTH,respectively;6.82,g/L of acetic acid accumulated in the culture of E.coli TRTH ΔiclR,which was 37.63%, lower than that of the control strain.In the fermentation of 30,L fermenter,the titer and yield of L-tryptophan of E.coli TRTH ΔiclR were(13.01±1.05)g/L and 6.51%,which were 60.34%, and 68.27%, lower than those of the control,respectively;18.21,g/L acetic acid,33.42%, times higher than that of the control,accumulated in the broth.In conclusion,in shake flask fermentation assays,the metabolic flux of the recombined strain was beneficial for L-tryptophan accumulation although the biomass was lower than E.coli TRTH.On the contrary,enhancement of glyoxylate shunt resulted in the shortage of energy supply and higher acetic acid accumulation,which can lead to lower biomass and L-tryptophan titer in 30,L fermentation.
L-tryptophan;Escherichia coli;glyoxylate shunt;iclR;fermentation
Q816
A
1672-6510(2016)03-0025-06
10.13364/j.issn.1672-6510.20150159
2015-10-14;
2015-12-11
国家高技术研究发展计划资助项目(2012AA022102,2012AA02A703);天津市科技支撑计划重点资助项目(14ZCZDSY00015)
陈胜杰(1991—),男,河南新乡人,硕士研究生;通信作者:陈 宁,教授,ningch@tust.edu.cn.
