大鼠Hes1腺病毒干扰载体构建及功能鉴定*
2016-07-31周学亮方义湖吴起才刘季春
周学亮,方义湖,赵 勇,邹 斌,徐 华,吴起才,刘季春
(南昌大学第一附属医院心脏大血管外科,南昌 330006)
论著·基础研究
大鼠Hes1腺病毒干扰载体构建及功能鉴定*
周学亮,方义湖#,赵 勇,邹 斌,徐 华,吴起才,刘季春△
(南昌大学第一附属医院心脏大血管外科,南昌 330006)
目的 构建高滴度大鼠Hes1腺病毒干扰载体(Ad-Hes1-shRNA)。方法 设计3对Hes1-shRNA寡核苷酸序列,通过定向克隆构建pHBAd-U6-CMV-Hes1-shRNA干扰质粒,将pHBAd-U6-CMV-Hes1-shRNA和pHBAd-BHG共转染293T细胞,以包装Ad-Hes1-shRNA,利用改进TCID50法进行病毒滴度测定。Ad-Hes1感染H9c2心肌细胞,Western blot检测Hes1表达。结果 pHBAd-U6-CMV-Hes1-shRNA构建成功,Ad-Hes1-shRNA包装顺利,滴度为1.0×1011PFU/mL,并可在H9c2心肌细胞内发挥干扰效应。结论 Ad-Hes1-shRNA包装成功,在心肌细胞中具有Hes1的干扰效应。
腺病毒科;RNA干扰;寡核苷酸序列分析;Hes1;质粒构建;病毒包装
发状分裂相关增强子-1(hairy and enhancer of split 1,Hes1)作为经典的抑制型碱性螺旋-环-螺旋(basic helix loop helix,bHIJH)基因,激活后可有效拮抗激活型bHLH基因的表达水平[1];同时作为Notch信号通路靶基因,在减轻心肌缺血再灌注损伤中发挥了重要调节作用[2]。本研究拟采用腺病毒载体系统,通过设计针对大鼠Hes1基因干扰序列,构建Hes1腺病毒干扰载体(Ad-Hes1-shRNA),并感染H9c2心肌细胞,筛选干扰大鼠Hes1基因最佳的Ad-Hes1-shRNA,为进一步观察Hes1信号通路在心肌细胞的作用奠定实验基础。
1 材料与方法
1.1 材料
1.1.1 细胞及菌株 293T细胞购于中科院上海生命科学院细胞库,DH5α超级化学感受态细胞购于Invitrogen公司。
1.1.2 大鼠cDNA文库及腺病毒载体系统 大鼠cDNA文库来购于大连TaKaRa公司;pHBAd-U6-CMV载体、pHBAd-BHG骨架质粒购于汉恒生物科技有限公司。
1.1.3 主要试剂 限制性内切酶(BamHⅠ、EcoRⅠ)购于New England Biolabs公司,T4 DNA Ligase购于Fermentas公司,质粒小/中量提取纯化试剂盒、DNA纯化试剂盒、DNA凝胶回收与纯化试剂盒购于康为世纪有限公司,LipofiterTM购于为汉恒生物科技有限公司,细胞裂解液购于碧云天生物技术研究所,Hes1单克隆鼠抗购于Abcam公司,β-actin单克隆鼠抗购于Anbo公司,HRP标记的羊抗兔IgG购于北京中杉金桥生物技术有限公司,增强化学发光底物购于Pierce Biotechnology公司。
1.1.4 引物设计与合成 针对大鼠Hes1基因,设计3对Hes1-shRNA寡核苷酸序列(Hes1:5′-CCG GGC AAG AAT AAA TGA AAG TTT G-3′;N1ICD-shRNA-2:5′-CAG ACA TTC TGG AAA TGA CAG TGA A-3′;N1ICD-shRNA-3:5′-CCT CTG AGC ACA GAA AGT CAT CAA A-3′),分别插入BamHⅠ与EcoRⅠ酶切位点,交上海桑尼生物技术有限公司合成3对寡核苷酸,规格为2A。
1.2 方法
1.2.1 pHBAd-U6-CMV-Hes1-shRNA干扰质粒构建及筛选 将3对寡核苷酸退火形成双链,T4 DNA Ligase连接BamHⅠ与EcoRⅠ双酶切后的双链Oligonucleotide、pHBAd-U6-CMV。将3组连接产物转化DH5α化学感受态细胞,接种于Amp+(氨苄西林)的LB培养基平板,次日随机挑选阳性单克隆菌落,摇菌过夜,菌液送上海桑尼生物技术有限公司基因测序,序列无误后分别命名为pHBAd-U6-CMV-Hes1-shRNA-1、pHBAd-U6-CMV-Hes1-shRNA-2、pHBAd-U6-CMV-Hes1-shRNA-3。
1.2.2 Ad-Hes1-shRNA包装、收毒、扩增及滴度测定 将pHBAd-U6-CMV-Hes1-shRNA 2 μg、pHBAd-BHG 4 μg共转染293细胞,6 h后更换新鲜细胞培养液。每天观察细胞出毒迹象,出毒完毕后收集所有细胞及培养液,于-80 ℃和37 ℃间冻融3次,3 000 r/min离心5 min,上清液即为Ad-Hes1第一代毒种(P1),作为毒种-80 ℃保存。取P1代毒种感染293细胞,待所有细胞脱落底面开始收毒,2 000 r/min离心5 min,弃上清液,加入1 mL ST buffer(培养液+10%血清+2.5%甘油),Votex混匀,于-80 ℃和37 ℃间冻融3次,3 000 r/min离心5 min,取上清液(P2)-80 ℃保存。依前法利用P2代病毒大量扩增病毒,纯化后利用改良TCID50法行病毒滴度测定。
1.2.3 Ad-Hes1-shRNA功能鉴定 H9c2细胞传代107至6孔板,每孔分别加入约Ad-NC、Ad-Hes1-shRNA-1、Ad-Hes1-shRNA-2、Ad-Hes1-shRNA-3,4 h更换培养液,36 h后收集细胞蛋白,Western blot 检测Hes1表达。
2 结 果
2.1 pHBAd-U6-CMV-Hes1-shRNA干扰质粒成功构建 DNAMAN比对分析pHBAd-U6-CMV-Hes1-shRNA阳性转化子菌液基因测序结果,与Hes1-shRNA基因序列完全一致(图1)。
2.2 Ad-Hes1-shRNA包装、收毒、扩增及滴度测定 HBAd-U6-CMV-Hes1-shRNA、pHBAd-BHG 共转293细胞后,每天显微镜下观察细胞出毒迹象,出毒现象为细胞变大变圆,呈葡萄状,并开始出现明显噬斑,待细胞大部分病变并从底部脱落进行收毒,待细胞大部分病变并从底部脱落进行收毒(图2)。利用改进TCID50法测定Ad-Hes1-shRNA滴度,结果为1.0×1011PFU/mL,体积1 mL,总滴度为1.0×1011PFU。
图1 Hes1-shRNA基因测序图
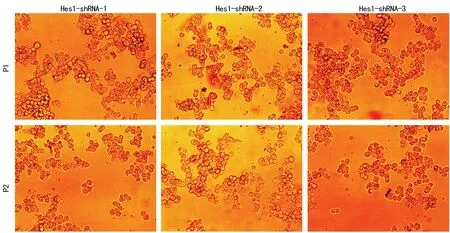
图2 显微镜下Ad-Hes1-shRNA细胞出毒情况(×20)

A:Hes1蛋白Western blot;B:Hes1蛋白灰度值。1:模拟感染组;2:Ad-Hes1-shRNA-1;3:Ad-Hes1-shRNA2;4:Ad-Hes1-shRNA-3。
图3 Ad-Hes1-shRNA在H9c2心肌细胞内的干扰效应
2.3 Ad-Hes1功能鉴定 构建成功的Ad-Hes1-shRNA干扰质粒转染293T细胞,48 h后提总蛋白,Western blot显示Ad-Hes1-shRNA-2、Ad-Hes1-shRNA-3均可达到满意的干扰效果,以Ad-Hes1-shRNA-2干扰效果最强,见图3。
3 讨 论
Hes1的功能研究目前大多集中在神经发育、体节形成、骨骼发育、T 淋巴细胞发育等四个方面[3]。最近研究证明Hes1在心脏发育中具有重要调节作用,积极影响心室流出道的发育成熟[4]。Bhoopathi等[5]发现Hes1基因表达可以显著促进内源性Stat3的酪氨酸磷酸化水平,并且在表皮生长因子诱导下,Hes1基因的表达使得Stat3更易转运进入细胞核,增加DNA与Stat3的结合活性。在作者前期研究中,同样发现作为Notch1信号通路靶基因,Hes1通过类似途径促进Stat3磷酸化,从而激活SAFE信号通路,发挥强大的心肌保护作用。Hes1无特异性抑制剂,特异性抑制Hes1并非易事,因此利用RNAi技术,针对特定Hes1蛋白构建相应干扰载体,可达到特异性抑制Hes1的作用。
RNA干扰技术是一种由内源性或者外源性双链DNA介导的转录后水平的基因沉默技术[6-7]。短发卡RNA(shorthairpin RNA,shRNA)是根据siRNA设计的类似双链结构的RNA,相比于siRNA,其在随载体进入细胞时具有更高的内在稳定性,并且shRNA在细胞内可以由单个模板快速合成大量的shRNA,其沉默作用更加持久[8]。目前,用于目的基因转移的病毒载体主要包括腺病毒、腺相关病毒、反转录病毒和慢病毒载体[9]。与其他基因载体系统相比,腺病毒载体具有宿主范围广、可感染静止及分裂期细胞、感染率高,靶细胞内多拷贝高效表达,理化性质稳定,遗传毒性较低,包装容量大及不整合等优点,已在基因载体领域应用广泛[10]。因考虑后期研究涉及细胞及动物实验,对病毒感染效率要求高,因此作者采用腺病毒载体系统构建Hes1干扰载体。
在Ad-Hes1-shRNA构建过程中,作者先用合成3对Hes1-shRNA的寡核苷酸,退火形成双链后利用定向克隆技术,构建HBAd-U6-CMV-Hes1-shRNA,再与pHBAd-BHG共转染293T细胞进行病毒包装,细胞出毒后收集第一代(P1)毒液,并以此为毒种进行第二代(P2)出毒及大量病毒扩增,病毒滴度测定后,再感染H9c2心肌细胞,以筛选干扰效果最佳的Ad-Hes1-shRNA,从而为Hes1对缺血心肌细胞保护作用的机制研究奠定了实验基础。
[1]Tian C,Tang YJ,Wang TT,et al.HES1 is an Independent prognostic factor for acute myeloid leukemia[J].Onco Targets Ther,2015,8(10):899-904.
[2]Zhou XL,Wan L,Xu QR,et al.Notch signaling activation contributes to cardioprotection provided by ischemic preconditioning and postconditioning[J].J Transl Med,2013,11(1):251.
[3]Liu ZH,Dai XM,Du B.Hes1:a key role in stemness,metastasis and multidrug resistance[J].Cancer Biol Ther,2015,16(3):353-359.
[4]Rochais F,Dandonneau M,Mesbah K,et al.Hes1 is expressed in the second heart field and is required for outflow tract development[J].PLoS One,2009,4(7):e6267.
[5]Bhoopathi P,Chetty C,Dontula RA,et al.SPARC stimulates neuronal differentiation of medulloblastoma cells via the notch1/STAT3 pathway[J].Cancer Res,2011,71(14):4908-4919.
[6]Sarisozen C,Salzano G,Torchilin VP.Recent advances in sirna delivery[J].Biomol Concepts,2015,6(4):321-341.
[7]Karlsson C,Rak J,Larsson J.RNA interference screening to detect targetable molecules in hematopoietic stem cells[J].Curr Opin Hematol,2014,21(4):283-288.
[8]Tan PH,Yu SW,Lin VC,et al.RNA interference-mediated gene silence of the NR1 subunit of the NMDA receptor by subcutaneous injection of vector-encoding short hairpin RNA reduces formalin-induced nociception in the rat[J].Pain,2011,152(3):573-581.
[9]Liu YP,Berkhout B.miRNA cassettes in viral vectors:problems and solutions[J].Biochim Biophys Acta,2011,1809(11/12):732-745.
[10]Janssen JM,Liu J,Skokan J,et al.Development of an AdEasy-based system to produce first- and second-generation adenoviral vectors with tropism for CAR- or CD46-positive cells[J].J Gene Med,2013,15(1):1-11.
Construction and functional identification of rat Hes1 adenovirus interference vector*
ZhouXueliang,FangYihu#,ZhaoYong,ZouBin,XuHua,WuQicai,LiuJichun△
(DepartmentofCardiovascularSurgery,TheFirstAffiliatedHospitalofNanchangUniversity,Nanchang,Jiangxi330006,China)
Objective To construct the high titers rat Hes1 adenovirus interference vector (Ad-Hes1-shRNA).Methods 3 pairs of Hes1-shRNA oligonucleotide sequences were synthesized to construct the pHBAd-U6-CMV-Hes1-shRNA interference plasmid by directly clone.pHBAd-U6-CMV-Hes1-shRNA and pHBAd-BHG plasmids were co-transfected into 293 cells to Ad-Hes1-shRNA,virus titer are determined by modified TCID50.Hes1 was detected by Western blot after Ad-Hes1-shRNA infected with H9c2 myocardial cells.Results pHBAd-U6-CMV-Hes1-shRNA was constructed successfully,Ad-Hes1-shRNA packaging smoothly with 1.0×1011PFU/mL titer,which can play the interference effect in the H9c2 myocardial cells.Conclusion The Ad-Hes1-shRNA is successfully packaged and has the interference effect of Hes1 in myocardial cells.
adenoviridae;RNA interference;oligonucleotide array sequence analysis;Hes1;plasmid construction;virus packaging
10.3969/j.issn.1671-8348.2016.34.002
国家自然科学基金资助项目(81570262);赣鄱555领军人才计划(赣组字[2013]58号);江西省自然科学基金重大项目(20152ACB20026)。作者简介:周学亮(1980-),副主任医师,博士,主要从事心肌疾病的信号通路研究#共同第一作者:方义湖(1971-),教授,博士,主要从事心脏病理方面研究。△
,E-mail:liujichun999@163.com。
R654.2
A
1671-8348(2016)34-4757-03
2016-07-20
2016-09-08)
