pGH和IGF-Ⅰ双基因共表达载体的构建及转双基因猪的获得与检测
2016-07-28姚延珠吴明明孙金海
姚延珠,吴明明,孙金海
(1.青岛农业大学动物科技学院,山东青岛 266109;2.中国农业大学动物科技学院,北京 100193)
pGH和IGF-Ⅰ双基因共表达载体的构建及转双基因猪的获得与检测
姚延珠1,吴明明2,孙金海1
(1.青岛农业大学动物科技学院,山东青岛 266109;2.中国农业大学动物科技学院,北京 100193)
旨在构建可高效表达pGH基因和IGF-Ⅰ基因的双基因共表达载体,制备转双基因(pGH+IGF-Ⅰ)猪,以期探索pGH基因和IGF-Ⅰ基因对猪生长发育的影响,为节粮型高瘦肉率新品种猪的培育奠定理论基础。从长白猪耳样中提取总RNA,经反转录RT-PCR获得pGH基因不含终止密码子的编码序列和IGF-Ⅰ基因完整的编码序列,经酶切连接克隆至pcDNA3.1(+)真核表达载体上,构建pcDNA3.1(+)-pGH-IGF-Ⅰ双基因共表达载体。将其转染PK15细胞,Q-PCR检测2个目的基因在PK15细胞中的表达情况。将构建的双基因共表达载体用纳米材料包裹后转染长白猪精子,采用精子载体法制备转双基因猪。PCR及测序鉴定转双基因阳性个体,Q-PCR检测2个目的基因在转双基因猪体内的表达情况。PCR及测序鉴定追踪检测转双基因猪体内pGH基因和IGF-Ⅰ基因的稳定情况。RT-PCR及测序结果表明,成功克隆了长白猪的pGH基因和IGF-Ⅰ基因的编码序列。酶切和测序分析表明成功构建了双基因真核共表达载体,转染PK15细胞后,Q-PCR检测表明,pGH基因和IGF-Ⅰ基因均在mRNA水平成功表达。母猪妊娠获得13头仔猪,经PCR及测序检测,其中4头仔猪为转双基因阳性,转双基因阳性率为30.76%。Q-PCR检测外源pGH基因与IGF-Ⅰ基因在转双基因猪体内成功表达。1~7月龄均可检测到外源pGH基因与IGF-Ⅰ基因,证明2个外源基因在转双基因猪体内稳定存在,并未随着生长而丢失。在转双基因公猪的精液中均能检测到2个外源基因,证明外源基因存在稳定传代的可能。
pGH基因;IGF-Ⅰ基因;共表达;转基因;长白猪
动物生长激素轴在动物的生长发育中有重要作用,其中下丘脑-GH-IGF-Ⅰ轴对动物的生长发育和各种机能的调控起重要作用。GH-IGF-Ⅰ轴与动物的生长和营养有密切关系,GH和IGF-Ⅰ均可独立亦可共同促进动物的生长发育,对神经系统、骨骼的发育以及肌肉的生长和脂肪的沉积有密切的调控作用[1-2]。有研究表明,下丘脑-GH-IGF-Ⅰ轴与疾病恢复和机体的长寿保健有关[3]。猪生长激素(Porcine grow th hormone,pGH)是由猪脑垂体前叶嗜酸性细胞分泌的一种单一肽链的蛋白质激素,能够促进机体生长,并调节体内物质代谢[4-5]。胰岛素样生长因子-Ⅰ(Insulin-like growth factor-Ⅰ,简称IGF-Ⅰ),是一类多功能细胞增殖调控因子,具有类似胰岛素的作用,可促进细胞增殖和分化,刺激骨基质的合成,调节骨骼和肌纤维的发育[6-8]。本试验选取下丘脑-GH-IGF-Ⅰ轴的2个关键基因进行克隆,构建pGH和IGF-Ⅰ双基因共表达载体,转染PK15细胞进行细胞水平的表达验证后,采用精子介导纳米载体法制备转双基因猪,获得了转双基因阳性个体,并进行了一系列分子水平的检测。
1 材料和方法
1.1 试验动物
试验所用5袋新鲜长白猪精液(每袋容量80 mL)购自北京浩邦猪人工授精服务有限责任公司,所用1头健康体况良好的经产长白母猪来自青岛农业大学实习基地。
1.2 试验材料
pcDNA3.1(+)载体和PK15细胞由青岛农业大学动物科技学院动物遗传育种实验室保存。健康长白猪(60日龄)耳组织由青岛农业大学实验基地提供。RNA isoPlus、Taq DNA聚合酶、大肠杆菌感受态DH5α、PMD19-T载体、T4连接酶、内切酶Eco RⅠ、XhoⅠ、Hin dⅢ和Bam HⅠ均购自TaKaRa公司;RNA提取试剂盒(Total RNA Miniprep Purification Kit)购自GeneMark公司;反转录试剂盒(RevertAidTMFirst Strand cDNA Synthesis Kit)购自Thermo公司;无内毒素质粒大提试剂盒(EndoFree Maxi Plasm id Kit)购自TIANGEN公司;SanPrep柱式DNA胶回收试剂盒购自上海生工生物工程有限公司;SYBR GreenⅠMix购自ABI公司;试验中所用其他试剂为进口或国产分析纯产品。
1.3 试验方法
1.3.1 pGH基因和猪IGF-Ⅰ基因的克隆及序列鉴定 参照GenBank中pGH基因(序列号:M17704.1)的CDS序列和IGF-Ⅰ基因(序列号:NM214256.1)的CDS序列,应用Primer 5.0软件分别设计2个基因的上、下游引物。引物设计时去掉pGH基因CDS序列的终止密码子,IGF-Ⅰ基因则设计可扩增完整CDS序列的引物,并分别引入2对酶切位点。所设计2对引物及引入的酶切位点信息如表1所示。

表1 克隆pGH基因和IGF-Ⅰ基因所用引物序列及其酶切位点Tab.1 Prim er sequences and restriction enzym e sites in cloning of pGH gene and IGF-Ⅰgene
取健康长白猪(60日龄)耳组织后液氮低温保存,总RNA的提取按照RNAisoPlus说明书进行。根据RevertAid First Strand cDNA Synthesis Kit使用步骤获得2个目的基因cDNA,RT-PCR反应条件如下:pGH基因:95℃变性5 min;94℃40 s,58℃40 s,72℃40 s,共35个循环;最后72℃终延伸10 min;IGFⅠ-基因:95℃变性5 min;94℃30 s,56℃30 s,72℃30 s,共35个循环;72℃终延伸10 min。1%琼脂糖凝胶电泳鉴定扩增产物,并用SanPrep柱式DNA胶回收试剂盒纯化两目的基因片段,连接于PMD19-T载体,获得重组质粒PMD19-T-pGH和PMD19-T-IGF-Ⅰ,分别将其转化入大肠杆菌感受态DH5α,经氨苄青霉素抗性筛选后,挑选经PCR鉴定正确的菌液提取质粒,送于北京六合华大基因科技有限公司测序。
1.3.2 pcDNA3.1(+)-pGH-IGFⅠ-双基因重组载体的构建及鉴定 采用限制性内切酶Hin dⅢ和Bam HⅠ分别消化重组质粒PMD19-T-pGH和pcDNA3.1(+)载体质粒,酶切产物经1%琼脂糖凝胶电泳检测,胶回收试剂盒回收pGH片段和pcDNA3.1(+)载体片段,T4连接酶连接获得pcDNA3.1(+)-pGH重组质粒。连接产物经转化、克隆后提取pcDNA3.1(+)-pGH重组质粒,内切酶Hin dⅢ和Bam HⅠ对其进行双酶切鉴定。经酶切和测序鉴定正确后,将pcDNA3.1(+)-pGH重组质粒和PMD19-T-IGF-Ⅰ重组质粒分别用内切酶Eco RⅠ和XhoⅠ酶切消化,产物经1%琼脂糖凝胶电泳检测,胶回收试剂盒回收pcDNA3.1(+)-pGH重组载体片段和IGF-Ⅰ片段,T4连接酶连接后得到pcDNA3.1(+)-pGHIGF-Ⅰ双基因重组载体。双基因重组质粒图谱见图1。

图1 pcDNA3.1(+)-pGH-IGF-Ⅰ双基因重组载体图谱Fig.1 pcDNA3.1(+)-pGH-IGF-Ⅰdoub le genes recom binan t vector p rofile
将pcDNA3.1(+)-pGH-IGF-Ⅰ双基因重组质粒转化入大肠杆菌感受态DH5α,经氨苄青霉素抗性筛选,挑选阳性单克隆菌落在含有氨苄的LB液体培养基中扩繁,EndoFree Maxi Plasmid Kit提取质粒。所提质粒送于北京六合华大基因科技有限公司测序。参照pcDNA3.1(+)载体图谱多克隆位点的顺序和所连接2个目的基因的先后顺序,将上述提取的双基因重组质粒分3组,分别进行双酶切鉴定,内切酶组合及对应所得预期片段大小见表2。

表2 三组双酶切鉴定pcDNA3.1(+)-pGH-IGF-Ⅰ双基因重组质粒Tab.2 Th ree groups of doub le enzym e digestion of pcDNA3.1(+)-pGH-IGF-Ⅰrecom binant p lasm id
1.3.3 双基因重组载体在PK15细胞中mRNA水平的表达检测 将培养的PK15细胞分3个转染组:只加DMEM培养基的A组(空白对照组),LipofectamineTM2000转染pcDNA3.1(+)空载体的B组(阴性对照组),Lipofectam ineTM2000转染pcDNA3.1(+)-pGH-IGF-Ⅰ双基因重组载体的C组(试验组)。按照Lipofectam ineTM2000使用说明进行细胞转染,每组均在相同培养条件下做3个重复,转染后细胞传一代,总RNA提取使用Total RNA Miniprep Purification Kit试剂盒,RevertAid First Strand cDNA Synthesis Kit反转录试剂盒获得cDNA,应用两步法Q-PCR对各组pGH mRNA和IGF-ⅠmRNA的表达量进行检测,引物见表3。2-ΔΔCt法分析各组pGH mRNA和IGF-ⅠmRNA的相对表达量,用SPSS 17.0软件对各组表达量进行方差分析和显著性检验。

表3 pGH基因、IGF-Ⅰ基因和内参β-Actin基因的Q-PCR引物Tab.3 17 prim er sequences of pGH gene,IGF-Ⅰgene andβ-Actin gene
1.3.4 转双基因(pGH+IGF-Ⅰ)猪的制备 随机挑选1头体况良好的经产母猪,发情后对其进行人工授精。精子与纳米载体及双基因载体的处理方法参照吴明明[9]的步骤。
1.3.5 转双基因(pGH+IGF-Ⅰ)猪的检测 转双基因(pGH+IGF-Ⅰ)猪的PCR及测序鉴定:采取初生仔猪的耳组织,酚-氯仿抽提法提取DNA,以抽提的DNA为模板进行pGH基因和IGF-Ⅰ基因的PCR检测,检测的引物及扩增条件与1.3.1中的一致。
Q-PCR检测转双基因猪体内pGH基因和IGF-Ⅰ基因的表达情况:采取2月龄试验猪的耳组织样,液氮低温保存。提取RNA,反转录为cDNA后,进行Q-PCR检测,具体方法和结果已经发表[10]。
转双基因猪1~7月龄pGH基因和IGF-Ⅰ基因的检测:采取转双基因猪1~7月龄的耳样,分别进行PCR检测,PCR引物及扩增条件见1.3.1。将扩增产物送于六合华大基因科技有限公司进行测序鉴定。
转双基因公猪精液中pGH基因和IGF-Ⅰ基因的检测:待转双基因公猪性成熟后,采集其精液,提取DNA,进行pGH基因和IGF-Ⅰ基因的PCR检测,PCR引物及扩增条件见1.3.1。将扩增产物送于六合华大基因科技有限公司进行测序鉴定。
2 结果与分析
2.1 pGH基因和猪IGF-Ⅰ基因的克隆及鉴定
从长白猪耳组织中提取RNA反转录为cDNA后,用所设计的pGH基因和IGF-Ⅰ基因引物进行PCR扩增,1%琼脂糖凝胶电泳鉴定,扩增片段的大小分别为648,393 bp(图2),与预期的两基因片段大小相符。将其回收纯化后分别克隆至PMD19-T载体上,测序结果分别与GenBank中pGH基因CDS序列(不含终止密码子)和IGF-Ⅰ基因CDS序列完全一致。

图2 pGH基因和IGF-Ⅰ基因RT-PCR产物电泳图Fig.2 RT-PCR products of pGH gene and IGF-Ⅰgene
2.2 pcDNA3.1(+)-pGH-IGF-Ⅰ双基因重组载体的鉴定
将pcDNA3.1(+)-pGH-IGF-Ⅰ双基因重组载体分别酶切(表2),酶切结果与表2中预期大小相符(图3),其中C组的1 077 bp处为pGH基因和IGF-Ⅰ基因在双基因重组载体上所对应的融合长度。
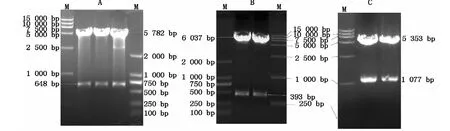
图3 酶切鉴定pcDNA3.1(+)-pGH-IGF-Ⅰ双基因重组载体Fig.3 Restriction enzym es d igestion of recom binant vector of pcDNA3.1(+)-pGH-IGF-Ⅰ
将pcDNA3.1(+)-pGH-IGF-Ⅰ双基因重组载体转化至大肠杆菌感受态细胞DH5α,扩繁后提取质粒,送于北京六合华大基因科技有限公司测序,测序结果经DNAMAN软件与对应重组载体序列比对一致。
2.3 Q-PCR检测pGH基因和IGF-Ⅰ基因的转录结果
应用两步法Q-PCR对各组细胞中pGH基因和IGFⅠ-基因的转录水平进行检测,结果显示,试验组(C组)pGH mRNA表达量分别是空白对照组(A组)和空载体组(B组)的146,98倍,均明显高于空白对照组(A组)和空载体组(B组),差异极显著(P<0.01),IGF-ⅠmRNA的表达量分别是空白对照组(A组)和空载体组(B组)的145,98倍,差异极显著(P<0.01)(图4)。证明pcDNA3.1(+)-pGH-IGFⅠ-双基因重组载体在PK15细胞中成功转录,pcDNA3.1(+)-pGH-IGF-Ⅰ双基因重组载体构建成功。

图4 Q-PCR检测PK 15细胞中pGH m RNA和IGF-Ⅰm RNA的相对表达量Fig.4 Relative expression of pGH m RNA and IGF-Ⅰm RNA in PK 15 cells detected by Q-PCR
2.4 转双基因猪PCR检测及测序结果
母猪妊娠获得13头仔猪,经PCR及测序检测,其中4头仔猪为转双基因阳性,转双基因阳性率为30.76%。pGH基因与IGFⅠ-基因的PCR检测结果如图5所示,均获得与目的基因大小相符合的条带,扩增产物经测序后的序列与GenBank中pGH基因(序列号:M17704.1)的序列和IGF-Ⅰ基因(序列号:NM214256.1)的序列相符合。对转双基因阳性猪1~7月龄的PCR检测结果均为阳性,证明2个外源基因在转双基因猪体内稳定存在,并未随着生长而丢失。

图5 pGH基因和IGF-Ⅰ基因的PCR检测结果Fig.5 PCR resu lts of pGH gene and IGFⅠ-gene
2.5 Q-PCR检测pGH基因和IGF-Ⅰ基因在转双基因猪体内的表达结果
以β-Actin作为内参基因,通过荧光定量PCR对转双基因猪和非转基因猪体内pGH基因和IGF-Ⅰ基因的表达进行检测,对同时期转双基因猪和非转基因猪体内pGH基因和IGF-Ⅰ基因表达量的差异进行分析比较,转双基因猪pGH mRNA平均表达水平是同期非转基因猪的1.2倍,IGF-ⅠmRNA平均表达水平是同期非转基因猪的1.53倍,而且并非每头转双基因猪体内pGH与IGF-Ⅰ基因的表达量均高于非转基因猪[10]。
2.6 转双基因猪公猪精液中pGH基因和IGF-Ⅰ基因的检测结果
待转双基因阳性公猪个体达到性成熟和体成熟之后,采集其精液,提取精子DNA,进行pGH基因和IGF-Ⅰ基因的PCR检测及测序鉴定。PCR扩增产物经1.0%琼脂糖凝胶电泳检测结果如图6所示,均得到与pGH基因(648 bp)和IGF-Ⅰ基因(393 bp)片段大小相符的目的条带。扩增的PCR产物的测序结果均与pGH基因和IGF-Ⅰ基因序列完全一致。证明所转外源pGH基因和IGF-Ⅰ基因存在稳定传代的可能。

图6 精液中pGH基因和IGF-Ⅰ基因的PCR检测Fig.6 PCR detection of pGH gene and IGF-Ⅰgene in sem en
3 讨论
3.1 关于双基因载体的讨论
目前制备转双基因或多基因动物的方法主要有2种:一是将2种或多种单基因载体混合转染,几种单基因载体的比例可以调节,但需分别构建单基因载体,操作繁琐,试验周期较长;二是通过调节启动子、融合蛋白或插入IRES序列等方法直接构建双基因或多基因共表达载体,可一次性获得可同时表达2个或多个基因的载体。就mRNA水平的表达验证来看,2013年鞠辉明等[11]构建整合型诱导表达猪生长激素(pGH)载体,添加DOX后36 h的细胞组中pGH表达活性较对照组高70多倍,而安磊等[12]于2013年构建小鼠Fyn及其多种突变体的载体,Q-PCR检测试验组目的基因不同突变体的表达量较对照组高出300~400倍。本试验构建的猪pcDNA3.1(+)-pGH-IGF-Ⅰ双基因真核表达载体转染PK15细胞后,2个目的基因均成功转录,pGH基因和IGF-Ⅰ基因mRNA的表达量分别是空白对照组的146,145倍,2个目的基因mRNA的表达量接近于1∶1,这与2个目的基因融合表达,共用一个启动子有关。
3.2 对所用转基因方法及所得转基因率的分析讨论
转基因技术发展的近30年来,人们尝试的方法有近10余种,但成熟的技术并不多。目前,用于制备转基因动物的转基因技术主要有:DNA显微注射法、胚胎干细胞介导法、体细胞核移植技术、逆转录病毒载体法和精子载体法等。目前,较为成熟和公认的方法仍然是受精卵原核的显微注射法。但是应用在大动物方面,其成功率较低,一般认为不超过2%。胚胎干细胞介导法可获得较好的整合率,可使基因整合率在受体动物体细胞中达到50%,在生殖细胞中的整合率也能达到30%[13]。但该技术在大动物上的应用较晚,技术难度较大。体细胞核移植法,理论上基因整合率可达100%,但该技术应用于猪上的克隆效率较低[14]。反转录病毒感染法能有效地将目的基因导入宿主细胞内,且易整合到宿主染色体上,可获得较高的基因表达效率[15]。但该法的成功率较低,且通过该方法制备的转基因动物一般表现为嵌合体形式。
精子载体法利用受精的自然过程避免了人为机械操作对胚胎造成的损伤,转基因效率较高。虽然存在一定的不稳定性,但较以上其他几种转基因方法相比,其成本低廉,技术操作简单,且转基因率较高,比较适合应用于大型哺乳动物的转基因研究,在大型哺乳动物转基因遗传育种方面有重要的研究意义和广阔的应用前景。精子载体法的稳定性和重复性较差,但从目前的诸多报道来看,其转基因率是较高的。且较其他方法相比,其操作技术相对简单,无需高昂精密的特殊操作仪器和复杂繁琐的操作技术,成本较低,比较适用于猪等大型转基因哺乳动物的制备研究。目前已经成功的制备出了多种转基因动物,其转基因阳性率波动范围较大,但大部分都较高。这可能也与具体的介导材料或对精子的处理方法不一样也有关。
纳米材料一般是物理结构上达到纳米级的结构材料,尺寸通常在1~100 nm,由于其特定的大小使纳米粒子表现出特殊的光学、热学、力学和磁学等特性。因纳米基因载体对外源基因具有保护作用、穿透性强、转染效率高及安全低毒无免疫原性等优点,近年来在动植物育种领域引起了越来越多的关注[16]。
本试验用纳米材料包裹精子,成功地用精子载体法制备出转双基因猪,转双基因阳性率为30.76%,证明该方法处理精子可获得较高的阳性率。王守栋等[17]同样使用纳米材料介导的精子载体法成功制备出转CuZnSOD基因猪,PCR检测阳性率为30.23%,与本试验的结果相接近,同时也证明了该方法的可行性和高效性。
3.3 本研究的意义
我国地方品种猪生长缓慢,饲料转化效率较低,背膘较厚,胴体中瘦肉少而肥肉多[18],培育瘦肉率高、节粮型猪品种是猪遗传育种领域的目标之一。而生长是一个复杂的过程,它受到各种激素、主动因子、辅助因子之间相互作用的影响,也受到营养条件和环境因素的影响,其中生长激素轴(生长激素释放激素、生长抑素、生长激素、生长激素受体、胰岛素样生长因子等)起着主要的作用[19]。下丘脑-GHIGF-Ⅰ轴是一个重要的体内分泌代谢轴,对生长发育的调控贯穿动物的整个生命过程[20]。本研究针对生长轴的激素分泌特点,以期探索下丘脑-GH-IGF-Ⅰ轴中的关键基因pGH基因和IGF-Ⅰ基因共同对猪生长发育的生物学影响,通过RT-PCR法获得以上2个目的基因的CDS序列,构建pcDNA3.1(+)-pGH-IGF-Ⅰ双基因真核表达载体,应用精子介导纳米载体法成功制备出转双基因(pGH+IGF-Ⅰ)猪,为pGH基因和IGF-Ⅰ基因的生物学功能研究及节粮型高瘦肉率新品种猪的培育奠定理论基础。
[1] Aberg D.Role of the grow th hormone/insulin-like growth factor 1 axis in neurogenesis[J].Endocrine Development,2010,17:63-76.
[2] Berryman D E,Christiansen JS,Johannsson G,et al.Role of the GH/IGF-Ⅰaxis in lifespan and healthspan:lessons from animal models[J].Growth Hormone&IGF Research,2008,18(6):455-471.
[3] Sherlock M,Toogood A A.Aging and the growth hormone/ insulin like growth factor-I axis[J].Pituitary,2007,10(2):189-203.
[4] Arbona J R,Marple D N,Russell R W,et al.Secretory patterns and metabolic clearance rate of porcine growth hormone in swine selected for grow th[J].Journal of Animal Science,1988,66(12):3068-3072.
[5] Gopinath R,Etherton T D.Effects of porcine growth hormone on glucose metabolism of pigs:Ⅱ.Glucose tolerance,peripheral tissue insulin sensitivity and glucose kinetics[J].Journal of Animal Science,1989,67(3):689-697.
[6] Webster H D.Growth factors and myelin regeneration in multiple sclerosis[J].Multiple Sclerosis:Clinical and Laboratory Research,1997,3(2):113-120.
[7] Mohan S,Kesavan C.Role of insulin-like grow th factor-1 in the regulation of skeletal growth[J].Current Osteoporosis Reports,2012,10(2):178-186.
[8] Oksbjerg N,Gondret F,Vestergaard M.Basic principles of muscle development and growth in meat-producing mammals as affected by the insulin-like grow th factor(IGF)system[J].Domestic Animal Endocrinology,2004,27(3):219-240.
[9] 吴明明.精子介导纳米基因载体法制备转基因猪的研究[D].青岛:青岛农业大学,2010.
[10] 胡义洁,吴明明,朱艳菲,等.SYBR GreenⅠ荧光定量PCR法检测转双基因猪pGH基因与IGF-Ⅰ基因的表达[J].中国畜牧杂志,2014,50(13):16-21.
[11] 鞠辉明,白立景,姜 星,等.整合型诱导表达猪生长激素(pGH)载体的构建及表达研究[J].畜牧兽医学报,2013,44(7):1008-1013.
[12] 安 磊,黄映雪,胡新德,等.小鼠Fyn及其多种突变体的载体构建和蛋白生物活性预测分析[J].畜牧兽医学报,2013,44(4):635-641.
[13] 刘中华,王华岩,乔宪凤,等.转基因技术在动物遗传改良上的应用进展[J].湖北农业科学,2009,48(2):481-486.
[14] 崔文涛,单同领,李 奎.转基因猪的研究现状及应用前景[J].中国畜牧兽医,2007,34(4):58-62.
[15] 王 会,潘登奎.哺乳动物转基因技术研究[J].现代农业科技,2009(6):196-198,207.
[16] 孙长娇,崔海信,王 琰,等.纳米材料与技术在农业上的应用研究进展[J].中国农业科技导报,2016,18(1):22.
[17] 王守栋,房国锋,曾勇庆,等.F_1代转CuZnSOD基因猪的制备与研究[J].畜牧兽医学报,2016,47(1):16-24.
[18] 国家畜禽遗传资源委员会.中国畜禽遗传资源志-猪志[M].北京:中国农业出版社,2011:11-13.
[19] Hammon H,Blum JW.The somatotropic axis in neonatal calves can be modulated by nutrition,growth hormone,and Long-R3-IGF-I[J].The American Journal of Physiology,1997,273(1 Pt 1):E130-E138.
[20] Butler A A,Le roith D.Control of growth by the somatropic axis:growth hormone and the insulin-like growth factors have related and Independent roles[J].Annual Review of Physiology,2001,63:141-164.
Construction of Eukaryotic Co-exp ression Plasm id Carrying pGH and IGF-ⅠGene and It′s Transform ation in Land race
YAO Yanzhu1,WU Mingming2,SUN Jinhai1
(1.College of Animal Science and Technology,Qingdao Agricultural University,Qingdao 266109,China;2.College of Animal Science and Technology,China Agricultural University,Beijing 100193,China)
In order to explore the effects of pGH and IGF-Ⅰon the growth and development of Landrace,eukaryotic co-expression plasmid containing pGH and IGF-Ⅰwas constructed and transfected into Landrace,which will lay the foundation for the cultivation of new breed of feed-saving grain pigs.Total RNA was extracted from the ear tissue of Landrace pig,and the coding sequence of pGH without term ination codon and complete coding sequence of IGF-Ⅰwere amp lified by RT-PCR and cloned into the pcDNA3.1(+)eukaryotic expression vector after verified by sequencing.The recombinant p lasmid was verified by sequencing and enzyme digestion and then transfected into PK15 cells.Expression of the two genes in PK15 cells was detected by Q-PCR.Transgenic pigs were prepared with sperm-mediated transformation after the sperm were encapsulated by nanometermaterial.Transgenic pigs were identified by PCR and sequencing.The expression of the two target geneswere detected by Q-PCR.Stability of transgene was detected by PCR and sequencing aged from 1 month to 7 month.RT-PCR and sequencing results showed thatthe coding sequences of pGH and IGF-Ⅰof Landrace were successfully cloned.Digestion and sequencing analysis showed the eukaryotic co-expression vector containing pGH and IGF-Ⅰwas successfully constructed,and Q-PCR analysis showed that pGH and IGF-Ⅰwere successfully expressed at the mRNA level after transfected into PK15 cells.As a result,13 young piglets were born,and 4 of them were positive for both two genes detected by PCR and sequencing.As a result,the positive rate was 30.76%.Q-PCR results showed that exogenous pGH and IGF-Ⅰwere successful expressed in transgenic pigs.Exogenous pGH and IGF-Ⅰcould be detected in transgenic positive individuals from aged 1 month to 7 month,which proved the two exogenous genes were stable in transgenic pigs and were not lost in growth process.Exogenous pGH and IGF-Ⅰcould be detected in sperm of transgenic boars showed that exogenous pGH and IGF-Ⅰmay be passaged stable.
pGH;IGF-Ⅰ;Co-expression;Transgene;Landrace
Q78;S828 文献标识码:A 文章编号:1000-7091(2016)03-0094-07
10.7668/hbnxb.2016.03.014
2016-03-09
转基因生物新品种培育科技重大专项(2014ZX08006-003);山东省现代农业产业技术体系生猪创新团队建设项目
姚延珠(1987-),女,山东昌邑人,硕士,主要从事动物分子遗传研究。
孙金海(1959-),男,山东潍坊人,教授,博士,主要从事细胞遗传和分子遗传学研究。
