漾濞大泡核桃JsWRKY1过表达增强转基因烟草对胶孢炭疽菌的抗性
2016-07-28王国东陈朝银李金晶普丽梅关瑞攀刘迪秋
王国东,陈朝银,李金晶,普丽梅,关瑞攀,葛 锋,刘迪秋
(昆明理工大学生命科学与技术学院,云南昆明 650500)
漾濞大泡核桃JsWRKY1过表达增强转基因烟草对胶孢炭疽菌的抗性
王国东,陈朝银,李金晶,普丽梅,关瑞攀,葛 锋,刘迪秋
(昆明理工大学生命科学与技术学院,云南昆明 650500)
为进一步研究JsWRKY1的生物学功能,构建JsWRKY1的植物超表达载体并转入烟草中过表达。再生的JsWRKY1转基因烟草与野生型烟草在表型上无明显差异。JsWRKY1过表达上调了转基因烟草体内几个防卫相关基因MnSOD、Cu/ZnSOD、CN、NADPH oxidase和PR1的转录水平。与野生型烟草相比,JsWRKY1转基因烟草体内的超氧化物歧化酶、过氧化物酶和抗坏血酸过氧化物酶活性在正常生长以及胶孢炭疽菌接种后均显著增强。平板抑菌试验结果显示,JsWRKY1转基因烟草叶片总蛋白对病原真菌葡萄座腔菌、串珠状赤霉菌、胶孢炭疽菌和尖孢镰刀菌的菌丝生长具有不同程度的抑制作用。此外,用胶孢炭疽菌接种烟草叶片,转基因烟草对胶孢炭疽菌的抗性明显增强。显然,JsWRKY1是漾濞大泡核桃中正调控病害防卫反应的转录因子。
漾濞大泡核桃;WRKY转录因子;防卫相关基因;抗氧化酶类;胶孢炭疽菌
WRKY转录因子是植物特有的转录因子超家族,主要参与植物体内的转录调控及信号转导过程[1]。WRKY转录因子通过调控植物体内抗病相关基因的表达提高植物体的抗性。WRKY转录因子中包含一个或更多高度保守的WRKY结构域,WRKY结构域由大约60个氨基酸残基组成,其中在N末端有高度保守的7个氨基酸残基WRKYGQK。多数WRKY转录因子的DNA结合域中还含有一个锌指结构,C2H2型(C-X4-5-C-X22-23-H-X1-H)或C2HC型(C-X7-C-X23-H-X1-C)锌指结构[2]。根据WRKY结构域的数量及所含锌指结构的特征可以将WRKY转录因子分为三大类,第Ⅰ类含有2个WRKY结构域以及C2H2型锌指结构,第Ⅱ类含有1个WRKY结构域和C2H2型锌指结构,第Ⅲ类也含有1个WRKY结构域和一个C2HC型锌指结构[2]。
WRKY基因最早于1994年从甘薯(Impoea batatas)中分离出来[3]。至今为止,已经在很多种植物中发现了WRKY基因的存在。WRKY转录因子是植物对病原体防卫反应的关键组成部分,在植物防卫反应中起重要作用。水稻(Oryza sativa)Os-WRKY13的超表达无论在苗期还是成株期都增强了转基因植株对白叶枯病(Xanthomonas campestris pv. Oryzae)和稻瘟病(Magnaporthe oryzae)的抗性[4]。OsWRKY22缺失的水稻突变体对稻瘟病的敏感性增强,而超表达OsWRKY22则可以提高转基因水稻对稻瘟病的抗性[5]。在水稻中过表达OsWRKY53也增强了对稻瘟病的抗性[6]。在拟南芥(Arabidopsis thaliana)中过表达AtWRKY28增强对甘蓝链格孢菌(Alternaria brassicicola)的抗性[7]。过表达Pt-WRKY23的转基因杨树(Populus tremula)对Melampsora spp.的抵抗能力显著增加[8]。PtWRKY14超表达则可增强烟草(Nicotiana tabacum)对TMV侵染的抵抗能力[9]。研究表明,一些WRKY转录因子负调控植物对生物和非生物胁迫有防卫反应。拟南芥AtWRKY38和AtWRKY62与组蛋白去乙酰化酶19共同作用负调控拟南芥的基本防御[10]。
核桃(Juglans)是世界重要的坚果类果树和木本油料树种,我国核桃栽培历史已有2 000多年,现出口量居世界第2位。漾濞大泡核桃(J.sigillata Dode),原产云南省漾濞县,现广泛分布于云南10余个县,以及贵州、四川等省份的部分地区,为云南的早期无性优良品种。漾濞大泡核桃具有果大、壳薄、仁厚、味香、含油率高等优点,是云南省重要的经济林树种之一,对云南的核桃产业发展起着重要的作用[11]。然而,随着核桃产业的快速发展,病虫害问题日益凸显,尤其是真菌病害。常见的核桃病害主要有灰斑病、黑斑病、炭疽病等。前期研究中,从漾濞大泡核桃中克隆获得一个Ⅱc类WRKY基因JsWRKY1,水杨酸、茉莉酸、H2O2和乙烯等几种逆境胁迫相关信号分子处理均上调JsWRKY1在漾濞大泡核桃叶片中的表达量,同时JsWRKY1快速响应胶孢炭疽菌(Colletotrichum gloeosporioides)的侵染,胶孢炭疽菌接种后4 h,转录物在叶片中大量富集[12]。为进一步研究JsWRKY1的生物学功能,构建了JsWRKY1的植物超表达载体将其转入烟草中超表达,并对转基因烟草中几个防卫相关基因的表达以及抗氧化酶活性进行分析,还检测了JsWRKY1转基因烟草在体外对几种病原真菌的抗性,尤其是JsWRKY1转基因烟草对胶孢炭疽菌的抗性。
1 材料和方法
1.1 试验材料
遗传转化所用无菌烟草苗由生物资源开发与利用实验室培养。将烟草(N.tabacum L.cv Xanthi)种子表面消毒后播种于1/2 MS培养基上,萌发的幼苗继代培养8周后用于转基因。所用病原真菌葡萄座腔菌(Botrosphaeria dothidea)、串珠状赤霉菌(Gibberella moniliformis)、胶孢炭疽菌(Colletotrichum gloeosporioides)和尖孢镰刀菌(Fusarium oxysporum)均由本实验室分离鉴定并保存,使用前接种于PDA培养基上进行活化。
1.2 JsWRKY1植物超表达载体构建
本试验采用pCAMBIA2300S作为植物超表达载体,其T-DNA区含有2个花椰菜花叶病毒(CaMV)的35S启动子,并具有卡那霉素抗性基因NPTⅡ。在扩增JsWRKY1 ORF的特异引物的5′端分别添加限制性内切酶Eco RⅠ和Bam HⅠ的识别位点,并合成特异性引物5′-GGATCCTGTAAAAC CTATTCGGACATTCTTC-3′和5′-GAATTCACCGAG GAGGGAGGCAGGT-3′扩增JsWRKY1的ORF。扩增产物首先连接到pMD-18T载体(TaKaRa,Japan)中。重组载体pMD-18T-JsWRKY1经限制性内切酶Bam HⅠ和Eco RⅠ双酶切后获得JsWRKY1的ORF,并与用同样的限制性内切酶消化后的pCAMBIA2300S空载体进行连接。将连接产物pCAMBIA2300S-JsWRKY1(图1)转入大肠杆菌(Escherichia coli)DH5α菌株中,并通过PCR筛选获得阳性克隆。
1.3 烟草遗传转化
采用冻融法将重组载体pCAMBIA2300SJsWRKY1转入根癌农杆菌(Agrobacterium tumefaciens)LBA4404菌株中,通过PCR筛选阳性克隆。用含重组载体pCAMBIA2300S-JsWRKY1的农杆菌LBA4404菌液浸染烟草无菌苗的叶盘。在无菌条件下将幼嫩的烟草叶片剪成约1 cm2的叶盘,将叶盘浸入农杆菌菌液中,浸染15 min后用无菌滤纸将叶盘表面的菌液吸干,把叶盘平铺于共培养培养基上,22℃暗培养48 h。暗培养结束后,将叶盘转至烟草筛选培养基上并放入光照培养箱中培养(25℃,光照16 h/d)。分化再生的幼苗转入含有50 mg/L卡那霉素和100 mg/L头孢霉素的烟草生根培养基上培养。
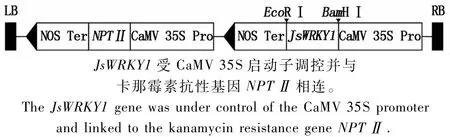
图1 JsWRKY1基因表达框Fig.1 The exp ression cassette of JsWRKY1
1.4 阳性转基因烟草筛选
采用CTAB法提取再生烟草植株的基因组DNA,取1μL所提取的基因组DNA进行琼脂糖凝胶电泳检测其完整性并测其浓度。并以再生烟草植株的基因组DNA为模板用JsWRKY1的特异引物进行PCR反应。分别以pMD-18T-JsWRKY1质粒和野生型烟草(W ild type,WT)的基因组DNA为阳性对照和阴性对照。PCR反应结束后,取8μL PCR产物进行琼脂糖凝胶电泳检测,并挑选阳性转基因烟草植株。T0阳性转基因烟草于温室中培养,获得T1转基因烟草。
1.5 烟草叶片RNA提取及qRT-PCR(Quan tita-tive reverse transcrip tion-PCR)
采用异硫氰酸胍一步法提取T1转基因烟草叶片的总RNA,并采用GoScriptTMReverse试剂盒(Promega)将总RNA逆转录成第一链cDNA。接着采用Real-time PCR分析JsWRKY1在T1烟草叶片中的表达水平。此外,还通过qRT-PCR分析7个防卫相关基因(MnSOD、CN、NADPH oxidase、Cu/ZnSOD、MYC、PR1和Osmotin)在T1转基因烟草植株和WT烟草叶片中的转录水平。反应条件为:50℃2 min,95℃10 min;95℃15 s,60℃1 min,40个循环,之后进行熔解曲线分析。以烟草Actin基因作为内参基因,qRT-PCR中每个反应均设置3次重复,并采用2-ΔΔCT法计算得出相对表达水平。基因的引物序列见表1。
1.6 酶活性测定
取正常生长及胶孢炭疽菌接种后10 d的烟草叶片,提取粗酶液,酶液中的蛋白含量测定采用考马斯亮蓝法。烟草叶片内超氧化物歧化酶(Superoxide dismutase,SOD)活性测定参照Gay和Tuzun[13]的方法。试管中依次加入50 mmol/L PBS(pH值7.8) 0.8 mL、26 mmol/L L-蛋氨酸(L-methionine)1.5 mL、0.75 mmoL/L四唑氮蓝(NBT)0.3 m L、粗酶液0.1 m L,20μmol/L核黄素(Riboflavin)0.3 m L,充分摇匀,以25℃暗反应作为空白对照,在25℃、光强为45 000 lux的培养箱内光照15 m in后迅速取出在560 nm波长下测定OD值,以抑制NBT光化还原的50%为1个酶活单位。抗坏血酸过氧化物酶(Ascorbateperoxidase,APX)活性的测定参照Nakano和Asada[14]的方法。取1.5 m L 50 mmol/L(pH值7.0)磷酸钠缓冲液加入50μL粗酶液,混匀,作为控制参照。最后在其他比色皿中加入1.5 m L 50 mmol/L反应液,并加入100μL 1 mmol/L H2O2启动反应,在290 nm处每20 s测定一次OD值。过氧化物酶(Peroxidase,POD)酶活测定采用愈创木酚法[15],取试管加入3 mL反应液以及30μL酶液,以PBS为对照调零,在波长为470 nm处每隔40 s测一次OD值。以每1 m in OD值变化0.01为1个酶活单位(U)。

表1 qRT-PCR所用引物序列Tab.1 The prim er sequences used in qRT-PCR
1.7 转基因烟草粗蛋白的体外平板抑菌试验
参照Li等[16]的方法提取4个T1转基因烟草和WT植株叶片的总蛋白。几种供试病原真菌活化培养后取适量菌丝接种于新鲜的PDA固体培养基上,待真菌菌落直径生长至大约2~3 cm时,在菌落周围均匀放置直径约为0.8 mm的无菌滤纸片,并将所提取的烟草粗蛋白浓度分别稀释到5 mg/m L,分别取20μL蛋白溶液滴到滤纸片上,以蛋白提取缓冲液为空白对照。置于28℃培养箱培养3~5 d,培养期间观察转基因及野生型烟草叶片总蛋白对几种真菌生长的抑制情况。
1.8 转基因烟草对胶孢炭疽菌的抗性分析
将胶孢炭疽菌接种在PDA培养基上,置于28℃培养5~7 d,用无菌水洗脱分生孢子,并制成孢子悬液。以温室栽培的JsWRKY1转基因烟草和野生型烟草为试材,用砂纸在叶片上轻轻摩擦出同等规格的伤口,接上200μL的孢子悬液,然后用保鲜膜包裹叶片保持湿度。10 d后,收集接种叶片,观察JsWRKY1转基因烟草叶片和野生型烟草叶片受胶孢炭疽菌侵染的发病情况。
2 结果与分析
2.1 JsWRKY1转基因烟草产生与筛选
在前期研究中,基于转录组测序结果从漾濞大泡核桃中分离克隆了一个WRKY转录因子基因JsWRKY1,本试验成功构建了JsWRKY1的植物表达载体pCAMBIA2300S-JsWRKY1,并采用冻融法转入根癌农杆菌LBA4404中。利用携带有JsWRKY1表达框的根癌农杆菌LBA4404分12次浸染200多个烟草叶盘。挑选生长良好的具有卡那霉素抗性的转基因烟草再生植株49株,经PCR分析检测获得具有目的基因JsWRKY1的阳性转基因烟草35株,即为JsWRKY1的T0转基因烟草,部分烟草转基因植株的PCR检测结果如图2所示。将JsWRKY1的T0转基因烟草种于温室中培养并获得 T1植株。JsWRKY1超表达的阳性转基因烟草植株与WT烟草的生长发育及形态未发现明显的差异。随后,随机选取8个转基因株系W 8、W 11、W 14、W 15、W 17、W 18、W 33和W 43进行基因表达分析。

图2 转基因烟草的PCR检测Fig.2 PCR analysis of som e JsWRKY1 transgenic tobacco p lantlets w ith resistance to K anam ycin
2.2 JsWRKY1在T1转基因烟草中大量表达
利用qRT-PCR检测8个转基因烟草株系中JsWRKY1的表达水平,试验结果表明,JsWRKY1在8个阳性转基因烟草株系中均检测到JsWRKY1转录物的积累,而在WT中未检测出JsWRKY1(图3)。就相对表达水平而言,JsWRKY1在W 43株系中的表达量最高,在W15株系中的表达量最低,在W 17和W 18株系中也大量表达。可见受CaMV 35S启动子控制的JsWRKY1基因在T1转基因烟草中稳定表达。挑选JsWRKY1表达水平相对较高的4个转基因株系W 8、W 17、W18、W 43进行后续试验。2.3 几个防卫相关基因在JsWRKY1转基因烟草中的表达

图3 JsWRKY1在转基因T1植株中的表达水平分析Fig.3 qRT-PCR analysis for JsWRKY1 expression levels in several transgenic T1 tobacco lines
利用qRT-PCR分析7个抗逆相关基因(Mn-SOD、C N、Cu/ZnSOD、NADPH oxidase、MYC、PR1和Osmotin)在JsWRKY1转基因烟草中表达水平的变化,试验如图4所示。与野生型烟草(WT)相比,Osmotin在4个JsWRKY1转基因烟草株系中的表达量明显降低。然而其他6个基因在JsWRKY1转基因烟草中的表达水平均表现出不同程度地上调。而且,不同转基因烟草株系中同一个基因的表达水平也不尽相同。MYC和Cu/ZnSOD在各转基因烟草株系中表达水平的上调幅度较为一致,分别约为WT的3.5~4.5,11.0~13.5倍;另外4个抗逆相关基因在几个JsWRKY1转基因烟草株系中表达水平差异较大,尤其是PR1,PR1在转基因烟草株系W 17中的表达水平约为WT的10.3倍,而在转基因烟草株系W 18中的表达水平约为WT的86.5倍。上述结果表明,JsWRKY1在转基因烟草中的过量表达提高了MnSOD、C N、NADPH oxidasec、Cu/ZnSOD、MYC和PR1等防卫相关基因的转录水平。
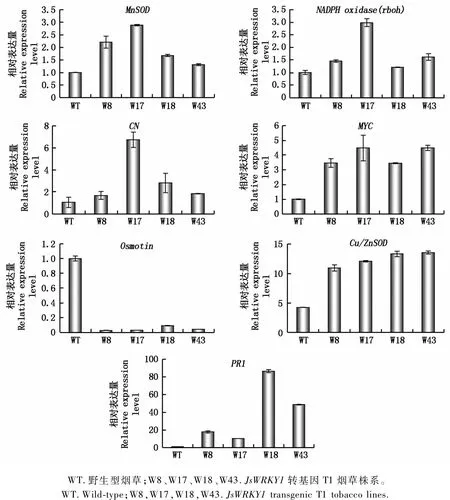
图4 几个抗病相关基因在JsWRKY1转基因烟草中的表达水平分析Fig.4 qRT-PCR analysis of several disease resistance-related genes in the JsWRKY1 transgenic tobacco lines
2.4 JsWRKY1过表达增强转基因烟草中3种抗氧化酶的酶活性
活性氧(Reactive oxygen species,ROS)是细胞正常氧代谢的副产物,并在细胞信号传递和保护机体方面起到重要作用,但是在遭受逆境胁迫后,植物细胞中会积累大量ROS。当ROS的积累量超出活性氧清除系统的能力时,植物体内蛋白质、膜脂以及其他细胞组分受到氧化损伤,从而使植物产生各种不良的生理反应,严重者甚至会造成植株死亡。细胞表达的POD、SOD和APX等抗氧化酶类,他们协同作用可以将植物体内的活性氧维持在稳定水平,从而保证植物的正常生长代谢。为了研究转基因株系中JsWRKY1是否调控这些抗氧化酶的活性,笔者测定了转基因株系W8、W17、W18、W 43和WT烟草中的POD、SOD和APX酶活(图5)。正常生长情况下,与野生型烟草相比,几个JsWRKY1转基因烟草株系中POD、SOD、APX显著提高,尤其是POD,在所有供试JsWRKY1转基因烟草株系中均极显著上调。接种胶孢炭疽菌后,转基因烟草及野生型烟草中POD、SOD、APX均明显增强,但所有转基因株系中3种抗氧化酶的活力远高于野生型烟草。上述结果无疑表明,POD、SOD和APX活性在转基因烟草株系中的显著增强与JsWRKY1的超表达紧密相关。
2.5 JsWRKY1转基因烟草叶片总蛋白在体外抑菌活性
提取4个JsWRKY1 T1转基因烟草叶片及WT烟草叶片的总蛋白进行体外平板抑菌试验,结果如图6所示,蛋白提取缓冲液(空白对照)对病原真菌葡萄座腔菌、串珠状赤霉菌、胶孢炭疽菌和尖孢镰刀菌的生长没有抑制作用。WT烟草的叶片总蛋白对4种病原真菌的菌丝生长具有较弱的抑制作用。尽管各个株系对不同病原菌的抑菌作用不尽相同,但是4个JsWRKY1转基因烟草叶片总蛋白对这4种病原真菌菌丝的生长均表现出明显的抑制活性。

图5 W T及JsWRKY转基因烟草中POD、SOD和APX的酶活Fig.5 The antioxidant enzym e activity of W T and JsWRKY1 transgenic tobacco lines

图6 JsWRKY1转基因烟草株系叶片总蛋白的体外抑菌活性Fig.6 Antifungal activity of the crude p rotein extract of JsWRKY1 transgenic tobacco lines

图7 JsWRKY1转基因烟草株系增强对胶孢炭疽菌的抗性Fig.7 Resistance of JsWRKY1 transgenic tobacco lines against C.gloeosporioides in vivo inoculation assay
2.6 JsWRKY1转基因烟草增强对胶孢炭疽菌的抗性
用胶孢炭疽菌侵染JsWRKY1转基因烟草叶片和野生型烟草叶片,接种10 d后,野生型烟草叶片出现了严重的褪绿黄化,接种部位腐烂,而4个JsWRKY1转基因烟草叶片接种后褪绿黄化现象并不明显,接种部位只表现出轻微的腐烂,可见JsWRKY1转基因烟草增强了对胶孢炭疽菌的抗性(图7)。
3 讨论与结论
在与病原微生物的长期斗争过程中植物形成了复杂的防卫反应网络以应对病原菌的攻击。植物防卫反应由相互联系的2个分支组成,一是病原相关分子模式(Pathogen-associated molecular pattern,PAMP)激发的免疫(PAMP-triggered immunity,PTI),二是效应物激发的免疫(Effector-triggered immunity,ETI)[17]。PTI以及ETI激活局部抗性及系统获得抗性(System ic acquired resistance,SAR)。WRKY转录因子是植物防卫反应相关转录因子网络中的一个调控蛋白基因家族,主要参与植物免疫系统应对多种不同的生物和非生物胁迫[18-19]。WRKY蛋白与靶基因启动子区的顺式作用元件核心结构是TTGAC(C/T)的W-box特异结合,即所有启动子中含W-box的基因都可能是WRKY的靶基因,包括WRKY本身[20]。WRKY结构域由4股β折叠构成,保守的WRKYGQK残基对应于N端的β折叠(Strandβ-1),能够进入DNA沟并与DNA上的W盒发生作用[21]。
已经明确WRKY转录因子家族是PTI以及ETI的关键调控因子,正向或负向调控植物的防卫反应和信号转导途径[18,22-23]。OsWRKY13通过激活水杨酸(SA)的生物合成以及SA反应相关基因的表达同时抑制茉莉酸(JA)信号途径调控水稻对细菌病害白叶枯病以及真菌病害稻瘟病的抗性[4,24]。Os-WRKY30超表达的转基因水稻提高了对稻瘟病以及纹枯病菌的抗性,抗性的提高与JA生物合成相关基因、PRs基因的表达激活以及内源JA积累的增强相关[25]。本试验对漾濞大泡核桃的一个WRKY转录因子基因JsWRKY1的功能进行分析,JsWRKY1超表达的转基因烟草株系中,几个逆境胁迫相关基因C N、NADPH oxidasec、MYC和PR1的转录水平明显上调,暗示JsWRKY1正调控这些防卫相关基因的表达。
植物受病原物侵染过程中,活性氧是一类很重要的信号分子,活性氧分子可以诱导植物对病原物的抗性。但是,氧爆发时植物体内将会产生大量的活性氧,过多的活性氧积累将会对植物产生毒害,并可破坏植物细胞的正常代谢。本试验中,qRT-PCR结果显示2个编码SOD的基因MnSOD以及Cu/Zn-SOD在几个JsWRKY1转基因烟草株系中的表达水平较野生型而言明显上升。此外,转基因株系的3种抗氧化酶酶活,即SOD、APX、POD在正常生长情况下及接种胶孢炭疽菌接种后显著增强。显然,JsWRKY1在烟草中过量表达不仅调控几个SOD基因的转录水平,还激活了体内的SOD、APX、POD酶活性。
目前已从模式植物拟南芥(Arabidopsis thaliana)和水稻(Oryza sativa)中分离了大量WRKY转录因子。AtWRKY3、AtWRKY4、AtWRKY33作为正调控因子对死体营养型真菌Alternaria brassicicola以及Botrytis cinerea具有抗性[26-27]。WRKY转录因子基因家族的多个成员正调控水稻对稻瘟病菌、纹枯病菌等的抗性[4,24-25,28]。在非模式植物中关于WRKY转录因子调控植物抗病防卫反应的研究也越来越多,如毛白杨(Populus tomentosa)PtoWRKY60、毛果杨(P.trichocarpa)PtrWRKY73、麝香葡萄(Muscadinia rotundifolia)M rWRKY30等WRKY转录因子均正调控植物的抗病防卫反应[29-31]。本试验中,JsWRKY转基因烟草叶片粗蛋白在体外能够抑制病原真菌葡萄座腔菌、串珠状赤霉菌、胶孢炭疽菌和尖孢镰刀菌的菌丝生长,并且叶片接种试验结果也显示JsWRKY转基因烟草对胶孢炭疽病的抗性明显增强。上述试验无疑表明JsWRKY1是漾濞大泡核桃中参与应对胶孢炭疽菌防卫反应的重要调控因子。
[1] Rushton P J,Somssich IE,Ringler P,et al.WRKY transcription factors[J].Trends in Plant Science,2010,15(5):247-258.
[2] Eulgem T,Rushton P J,Robatzek S,et al.The WRKY superfamily of plant transcription factors[J].Trends in Plant Science,2000,5(5):199-206.
[3] Ishiguro S,Nakamura K.Characterization of a cDNA encoding a novel DNA-binding protein,SPF1,that recognizes SP8 sequences in the 5′upstream regions of genes coding for sporamin and beta-amylase from sweet potato[J].Molecular&General Genetics,1994,244(6):563-571.
[4] Qiu D,Xiao J,Xie W,et al.Rice gene network inferred from expression profiling of p lants overexpressing Os-WRKY13,a positive regulator of disease resistance[J]. Molecular Plant,2008,1(3):538-551.
[5] Abbruscato P,Nepusz T,Mizzi L,et al.OsWRKY22,a monocot WRKY gene,plays a role in the resistance response to blast[J].Molecular Plant Pathology,2012,13(8):828-841.
[6] Chujo T,Takai R,Akimoto-Tomiyama C,et al.Involvement of the elicitor-induced gene OsWRKY53 in the expression of defense-related genes in rice[J].Biochimica et Biophysica acta,2007,1769(7/8):497-505.
[7] 伍林涛,钟贵买,王健美,等.转录因子AtWRKY28在拟南芥与甘蓝链格孢菌(Alternaria brassicicola)亲和性互作中的功能分析[J].中国农业科技导报,2012,14(1):65-71.
[8] Levée V,Major I,Levasseur C,et al.Expression profiling and functional analysis of PopulusWRKY23 reveals a regulatory role in defense[J].The New Phytologist,2009,184(1):48-70.
[9] 王 兴,林善枝.PtWRKY14基因转化烟草及对TMV的抗性影响研究[J].广东农业科学,2014,41(7):130-133,141,封2.
[10] Kim K C,Lai Z,Fan B,et al.Arabidopsis WRKY38 and WRKY62 transcription factors interact with histone deacetylase 19 in basal defense[J].The Plant Cell,2008,20(9):2357-2371.
[11] 杨 恩,陈少瑜,张 雨,等.漾濞核桃叶片基因组DNA的两种提取方法效果比较[J].西部林业科学,2005,34(4):72-75.
[12] 张南南,陈朝银,季 博,等.漾濞大泡核桃WRKY转录因子基因JsWRKY1的克隆及表达特性分析[J].植物生理学报,2014(7):960-966.
[13] Gay P A,Tuzun S.Temporal and spatial assessment of defense responses in resistant susceptible cabbage varieties during infection with Xanthomonas campestris pv. Campestris[J].Physiological and Molecular Plant Pathology,2000,57(5):201-210.
[14] Nakano Y,Asada K.Hydrogen-peroxide is scavenged by ascorbate-specific peroxidase in spinach-chloroplasts[J].Plant and Cell Physiology,1981,22(5):867-880.
[15] 李合生.植物生理化实验原理和技术[M].北京:高等教育出版社,2000:164-165.
[16] Li H L,Liu D Q,He H,et al.Molecular cloning of a 14-3-3 protein gene from Lilium regale Wilson and overexpression of this gene in tobacco increased resistance to pathogenic fungi[J].Scientia Horticulturae,2014,168(3):9-16.
[17] Chisholm S T,Coaker G,Day B,et al.Host-microbe interactions:shaping the evolution of the plant immune response[J].Cell,2006,124(4):803-814.
[18] Pandey S P,Somssich IE.The role of WRKY transcription factors in plant immunity[J].Plant Physiology,2009,150(4):1648-1655.
[19] Bakshi M,Oelmüller R.WRKY transcription factors:Jack ofmany trades in plants[J].Plant Signaling&Behavior,2014,9(2):e27700.
[20] Dong J,Chen C,Chen Z.Expression profiles of the ArabidopsisWRKY gene superfamily during plant defense response[J].Plant Molecular Biology,2003,51(1):21-37.
[21] Ciolkowski I,Wanke D,Birkenbihl R P,et al.Studies on DNA-binding selectivity of WRKY transcription factors lend structural clues into WRKY-domain function[J]. Plant Molecular Biology,2008,68(1/2):81-92.
[22] Peng Y,Bartley L E,Canlas P,et al.OsWRKY IIa transcription factors modulate rice innate immunity[J]. Rice,2010,3(1):36-42.
[23] Hu Y,Dong Q,Yu D.Arabidopsis WRKY46 coordinates with WRKY70 and WRKY53 in basal resistance against pathogen Pseudomonas syringae[J].Plant Science,2012,185-186:288-297.
[24] Qiu D Y,Xiao J,Ding X H,et al.OsWRKY13 mediates rice disease resistance by regulating defense-related genes in salicylate-and jasmonate-dependent signaling[J].Molecular Plant-M icrobe Interactions,2007,20(5):492-499.
[25] Peng X,Hu Y,Tang X,et al.Constitutive expression of rice WRKY30 gene increases the endogenous jasmonic acid accumulation,PR gene expression and resistance to fungal pathogens in rice[J].Planta,2012,236(5):1485-1498.
[26] Zheng Z,Qamar S A,Chen Z,et al.Arabidopsis WRKY33 transcription factor is required for resistance to necrotrophic fungal pathogens[J].The Plant Journal,2006,48(4):592-605.
[27] Lai Z,Vinod K,Zheng Z,et al.Roles of Arabidopsis WRKY3 and WRKY4 transcription factors in plant responses to pathogens[J].BMC Plant Biology,2008,8:68.
[28] Wei T,Ou B,Li J,et al.Transcriptional profiling of rice early response to Magnaporthe oryzae identified Os-WRKYs as important regulators in rice blast resistance[J].PLoSOne,2013,8(3):e59720.
[29] Ye S,Jiang Y,Duan Y,et al.Constitutive expression of the pop lar WRKY transcription factor PtoWRKY60 enhances resistance to Dothiorella gregaria Sacc.in transgenic p lants[J].Tree Physiology,2014,34(10):1118-1129.
[30] Duan Y,Jiang Y,Ye S,et al.PtrWRKY73,a salicylic acid-inducible poplar WRKY transcription factor,is involved in disease resistance in Arabidopsis thaliana[J]. Plant Cell Reports,2015,34(5):831-841.
[31] Jiang W,Wu J,Zhang Y,et al.Isolation of a WRKY30 gene from Muscadinia rotundifolia(M ichx)and validation of its function under biotic and abiotic stresses[J]. Protoplasma,2015,252(5):1361-1374.
Overexpression of a WRKY Transcription Factor Gene from Juglans sigillata Dode Confers Resistance to Colletotrichum gloeosporioides in Transgenic Tobacco Plants
WANG Guodong,CHEN Chaoyin,LI Jinjing,PU Limei,GUAN Ruipan,GE Feng,LIU Diqiu
(Faculty of Life Science and Technology,Kunming University of Science and Technology,Kunming 650500,China)
To investigate the function of JsWRKY1,a constitutive expression vector of JsWRKY1 was constructed and transferred into Nicotiana tabacum L.cv Xanthi.There were no visible differences between the positive transgenic plants and WT.The expression levels of several defense-related genes MnSOD,Cu/ZnSOD,CN,NADPH oxidase,and PR1 resistance gene were up-regulated in the transgenic tobacco lines,and the SOD,APX and POD showed significantly higher activities in the transgenic lines than in wild type under normal conditions or after inoculation with C.gloeosporioides.The crude protein extract of transgenic tobacco lines inhibited the hyphal growth of the following four fungi,Botrosphaeria dothidea,Gibberella moniliformis,C.gloeosporioides and Fusarium oxysporum at different degrees.The antifungal activity in vitro plates demonstrated that the activities of SOD in the transgenic tobacco lines were significantly higher than those in WT.Moreover,the transgenic tobacco plants showed strong resistance after inoculation with C.gloeosporioides in the leaves.In conclusion,the JsWRKY1 is a positive transcription factor of J.sigiuata regulating the defense response to pathogens.
Juglans sigillata dode;WRKY transcription factor;Defense-related genes;Antioxidant enzyme;Colletotrichum gloeosporioides
Q78;S436.62 文献标识码:A 文章编号:1000-7091(2016)03-0155-08
10.7668/hbnxb.2016.03.023
2016-03-11
科技部支撑计划项目(2011BAD46B00)
王国东(1993-),男,云南普洱人,主要从事生物工程研究。
刘迪秋(1979-),女,湖北建始人,教授,博士,主要从事植物抗病基因工程研究。
