MlNAC2基因的克隆及其在南荻根部的表达模式
2016-07-28吉璐陈智勇肖亮易自力
吉璐,陈智勇,肖亮,易自力*
(1.湖南第一师范学院基础生物实验室,湖南 长沙 410205;2.湖南农业大学生物科学技术学院,湖南 长沙 410128)
MlNAC2基因的克隆及其在南荻根部的表达模式
吉璐1,2,陈智勇2,肖亮2,易自力2*
(1.湖南第一师范学院基础生物实验室,湖南 长沙 410205;2.湖南农业大学生物科学技术学院,湖南 长沙 410128)
摘 要:克隆南荻MINAC2基因的cDNA序列,该序列全长为933 bp,编码产物含310个氨基酸残基,其蛋白质理论相对分子质量为34 427.8,等电点(pI)为5.85,不稳定系数为34.84,为稳定蛋白,具有保守的NAM基序,无信号肽和跨膜结构域,可推测其为亲水性蛋白。亚细胞定位试验结果表明,MlNAC2定位于细胞核,可能在细胞核内行使功能。转录激活试验结果表明,MlNAC2是一个转录因子蛋白,且转录激活域位于C端。荧光实时定量PCR分析结果表明,高盐、干旱、脱落酸、茉莉酸甲酯和机械伤害均能诱导MlNAC2基因在南荻根部的表达上调,而低温处理时表达下调。
关 键 词:南荻;NAC转录因子;基因表达;亚细胞定位;转录激活
投稿网址:http://xb.ijournal.cn
转录因子(transcription factor)也称反式作用因子,是一类能与真核基因启动子中的顺式作用元件发生特异性相互作用的DNA结合蛋白,通过蛋白之间的相互作用来激活或抑制基因的转录。NAC (NAM,ATAF and CUC2)转录因子是植物中特有的转录因子,全基因转录组分析结果表明,约 20%~25%的 NAC转录因子参与了至少一种胁迫应答过程[1]。Mao等[2]发现在拟南芥中过表达小麦TaNAC2和 TaNAC67基因,能显著提高转基因拟南芥对干旱、高盐、低温等多种非生物逆境胁迫的抗逆性。过表达水稻OsNAC5能提高转基因植株的抗旱性[3]。GmNAC20受干旱胁迫诱导,过表达植物的抗盐和抗低温能力得到提高[4]。AhNAC2和 AhNAC3在ABA诱导、干旱和低温条件下的表达上调[5]。茄子SmNAC1受低温、高盐和GA诱导表达,且优先在根部表达[6]。
南荻(Miscanthus lutarioriparius)是中国特有的C4类多年生草本能源植物,主要分布在长江中下游流域,具有生物质产量高、适应性广等特点,近年已成为生物质能源领域的研究热点[7]。提高南荻的抗逆性,使其能在荒草地、滩涂盐碱地等边际性土地中生长,是南荻作为能源植物开发利用的关键环节。在干旱、高盐、低温和ABA等处理下,南荻叶片中多个NAC基因的表达上调[8],在拟南芥中过表达南荻MlNAC2和MlNAC5基因能提高转基因植株的抗逆性[8-9]。笔者研究MlNAC2基因的克隆及其在南荻根部的表达模式,旨在为芒草抗逆性的遗传改良提供参考依据。
1 材料与方法
1.1 材料
南荻材料为二倍体(2n=2x=38),采用根状茎无性繁殖。烟草(Nicotiana benthamiana)品种为Wisconsin 38。2种材料的培养条件均为温度25~28 °C,光合强度80~200 μmol/(m2·s),空气相对湿度为65%,光照周期16 h(光照)/8 h(黑暗)。大肠杆菌DH5α、农杆菌GV3101、酵母菌AH109、pGWC-T载体、pEarlyGate104载体及pGBKT7由湖南农业大学芒属植物研究所保存。
1.2 方法
1.2.1 MlNAC2基因的克隆
将南荻幼根样品在液氮中研磨成粉末状,用Trizol试剂盒(购自Invitrogen公司)提取总RNA,并用DNase I进行消化,去除基因组DNA污染,cDNA第一链的合成参照反转录试剂盒(购自TaKaRa公司)说明书进行。
根据已得到的MlNAC2基因(GenBank登录号KM017002)序列设计特异性引物,获得MlNAC2基因正向引物序列5′-ATGGGATTGCCGGTGAGGA GGG-3′和反向引物序列5′-TCAGAATGGTCCCA ACCCGGCG-3′。扩增得到目的片段,经回收,连接到入门载体pGWC-T,并转化到感受态大肠杆菌DH5α中,在含有25 μg/mL氯霉素的LB平板上进行转化子筛选,将PCR鉴定为阳性的克隆送北京华大基因公司测序,将测序正确的重组入门载体命名为pGWC-MLNAC2。
1.2.2 生物信息学分析
编码蛋白氨基酸序列的基本理化性质由ProtParam 软件分析;蛋白的保守结构域由Consevered Domains工具预测;信号肽、跨膜结构域、序列的亲/疏水性和二级结构分别用 SingalP 4.1、TMHMM Server v. 2.0、Protscale和SOPMA软件进行预测与分析;利用NCBI中的Blastp在线工具进行其他物种的同源氨基酸序列搜索;利用Clustal X(version 2.0)和DNAMan (version 8.0)进行氨基酸序列同源比对,用MEGA 6.0软件构建系统进化树。
1.2.3 亚细胞定位分析
将重组入门载体pGWC-MlNAC2与表达载体pEarlyGate104通过LR反应构建N端YFP融合表达载体。LR反应体系为5 μL,其中包括pEarlyGate104 30~50 ng、pGWC-MlNAC2 30~50 ng和1×LR clonase Enzyme Mix。混合反应液在25 ºC下反应4~6 h。转化到感受态大肠杆菌 DH5α中,筛选阳性克隆进行测序,将测序正确的重组表达载体命名为 p35S:YFP-MlNAC2。
将重组表达载体p35S:YFP-MlNAC2转化根癌农杆菌(GV3101),在含 50 μg/mL壮观霉素和 50 μg/mL利福平的LB平板上进行转化子筛选,PCR鉴定阳性克隆,并将阳性克隆农杆菌振荡培养至OD600 nm为0.6左右,室温下6 000×g离心20 min,收集菌体,用侵染缓冲液(150 μmol/L乙酰丁香酮,10 mmol/L MES,10 mmol/L MS,pH 5.6)重悬菌体至OD600 nm为0.5~0.6。将重悬菌液注射在烟草叶片背面,避光放置2~5 d后,取约1 cm2的叶片材料,在激光共聚焦显微镜(OLYMPUS FV300)下观察。
1.2.4 转录激活试验
分别用引物MlNAC2-NF和MlNAC2-CR扩增MlNAC2基因的全长;用引物 MlNAC2- NF和MlNAC2-NR扩增 N端片段;用 MlNAC2-CF和MlNAC2-CR扩增C端片段。PCR产物均经酶切分别连接入酵母表达载体pGBKT7中,PCR筛选阳性克隆并测序验证。转录激活引物序列见表1。
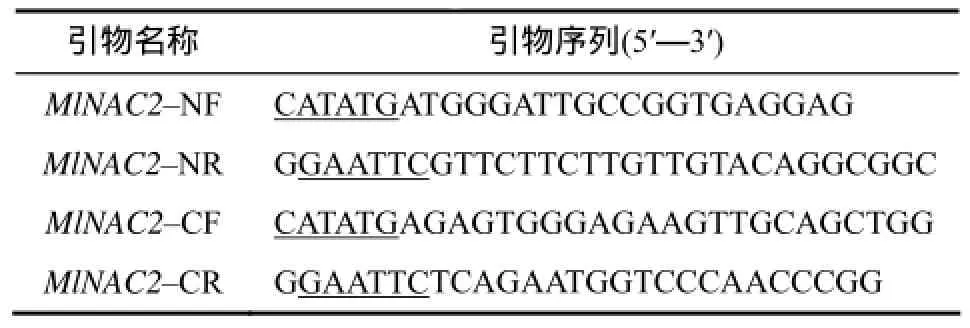
表1 转录激活引物序列Table 1 Primer sequences of transactivation
根据 Clontech公司的操作手册,将构建好的转录激活表达载体pGBKT7-MlNAC2、pGBKT7-MlNAC2ΔC(N端)和 pGBKT7-MlNAC2ΔN(C端)转入酵母AH109中,以pGBKT7载体作为阴性对照。菌株将在 SD/-Trp和 SD/-Trp/-His/30 mM 3-AT培养基上进行双重筛选。将2次筛选均为阳性的克隆转至显色培养基上(X-α-gal (20 mg/mL)按1∶1 000加入)倒置避光培养,直至显色,显蓝色的为阳性克隆。
1.2.5 不同胁迫及激素处理下MlNAC2基因在南荻根部的表达模式分析
在南荻生长到6叶期时进行不同处理:1) 盐胁迫处理,将植株根部泥沙轻轻洗净,浸入 150 mmol/L NaCl溶液中;2) 干旱胁迫处理,将植株根部泥沙轻轻洗净,吸干表面水分,并用吸水纸包裹,放置于培养箱中;3) 低温胁迫处理,将植株放入4 °C光照培养箱中;4) 激素处理,将脱落酸(ABA,100 μmol/L)、茉莉酸甲酯(MeJA,100 μmol/L) 和水杨酸(SA,1 mol/L)溶液分别均匀喷洒于叶面;5) 机械伤害胁迫处理,用干净的剪刀剪去每个叶片的顶端约5 cm。所有处理的光照度、光照周期和空气相对湿度都与正常条件保持一致。以上处理分别在0、1、3、6、12、24 h时间点取相同部位的根部,液氮速冻后于-80 °C冰箱保存。RNA提取及cDNA第一链的合成同1.2.1。
实时荧光定量 PCR反应系统为 LightCycler○R 480(Roche)。用于MlNAC2基因荧光实时定量分析的引物序列为5′-CCGGCGTCGGCACAACCA-3′和 5′-GCCGGGAACGAGTCCAGCTC-3′。芒草ACTIN11基因用作内参基因,其扩增引物序列为5′-CTCGTCTTCCTCACCGTTATCAC-3′和5′-GCG TCATCTCCAGCGAA CC-3′。荧光实时定量 PCR (RT-qPCR)反应体系20 µL:2×SYBR预混液10 µL,cDNA模板1 µL,正向及反向引物各0.4 µL,ddH2O 8.2 µL。反应条件为95 °C预变性30 s;95 °C变性5 s,58 °C退火20 s,72 °C延伸10 s,45个循环。溶解曲线测定温度为65~95 °C。基线与循环阈值(Ct值)使用LightCycler®480软件自动生成。按照相对定量法2-ΔΔCt计算目标基因的相对表达量[10]。本研究中不同胁迫处理下,在同一时间点的表达量与对照相比差别至少在3倍以上时才被认为是受到了该胁迫或植物激素的影响。
2 结果与分析
2.1 MlNAC2基因的克隆与鉴定结果
扩增出的 MlNAC2基因片段大小约为 930 bp(图1)。将PCR产物连接到pGWC-T载体上转化大肠杆菌DH5α,将阳性菌落经PCR检测后筛选出3个阳性克隆进行测序,测得克隆片段的大小均为933 bp。该结果与湖南农业大学芒属植物生态应用技术湖南省工程实验室先前所得数据 (GenBank登录号为KM017002)[8]一致。
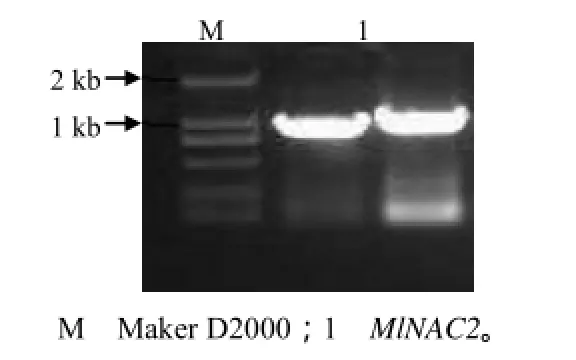
图1 MlNAC2基因的PCR检测结果Fig.1 Cloning of MlNAC2
2.2 MlNAC2蛋白的生物信息学分析结果
MlNAC2基因全长933 bp,可以编码310个氨基酸。Protparam预测该蛋白的相对分子质量为34 427.8,理论等电点(pI)为5.85;有45个氨基酸残基(Asp + Glu)带负电荷,41个氨基酸残基(Arg + Lys)带正电荷;不稳定系数为34.84,属于稳定型蛋白质(<40,蛋白稳定),脂肪族系数为 65.26,总亲水系数为-0.583。保守结构域预测显示,该蛋白具有保守的NAM基序。该蛋白无信号肽或跨膜结构域。Protscale软件预测结果表明,该蛋白的亲水氨基酸比例大于疏水氨基酸比例,可推测其为亲水性蛋白。
二级结构预测结果显示,该蛋白由88个α螺旋(H)、45个延伸链(E)、19个β转角(T)和158个无规则卷曲(HC)构成,占总蛋白的比例分别为28.39%、14.52%、6.13%和50.97%。
将MlNAC2与南荻(MlNAC5),水稻(SNAC1、OsNAC3、OsNAC4、OsNAC5、OsNAC6、ONAC045),拟南芥(ATAF1、ATAF2、ANAC022、ANAC087、ANAC102),小麦(TaNAC2a、TaNAC67、TaNAC6),大豆(GmNAC2)、玉米(ZmNAC1)和高粱(SbNAC1)的 18个 NAC蛋白进行多序列比对的结果表明,MlNAC2蛋白N端具有完整的NAM特征结构域。该结构域包含5个子结构域(A-E),C端则是序列呈高度多样性的转录调控结构域(图2)。

图2 MlNAC2与其他NAC家族的蛋白多序列比对Fig.2 Multiple sequence alignment between MlNAC2 and other NAC proteins
将 MlNAC2蛋白与这些同源蛋白进行聚类分析构建的系统进化树如图3。由图3可见,MlNAC2 与SbNAC1、ZmNAC1和SNAC1的亲缘关系都较近,已有研究[11]表明这3种同源NAC蛋白都受多种逆境胁迫和激素的诱导,而过表达SNAC1能提高水稻的抗旱性和耐盐性。

图3 用邻接法构建MlNAC2蛋白与其他植物NAC蛋白的系统进化树Fig.3 Constructed phylogenetic tree of MlNAC2 protein and NAC proteins from other plants using neighbor joining method
2.3 MlNAC2的亚细胞定位
为了进一步明确MlNAC2的亚细胞定位,构建了MlNAC2的N端融合YFP表达载体p35S:YFPMlNAC2,采用农杆菌侵染法使其在烟草细胞中瞬时表达。从图4可看出,MlNAC2在细胞核中的信号最为明显,说明MlNAC2是一个核定位蛋白,可能在细胞核内行使功能。
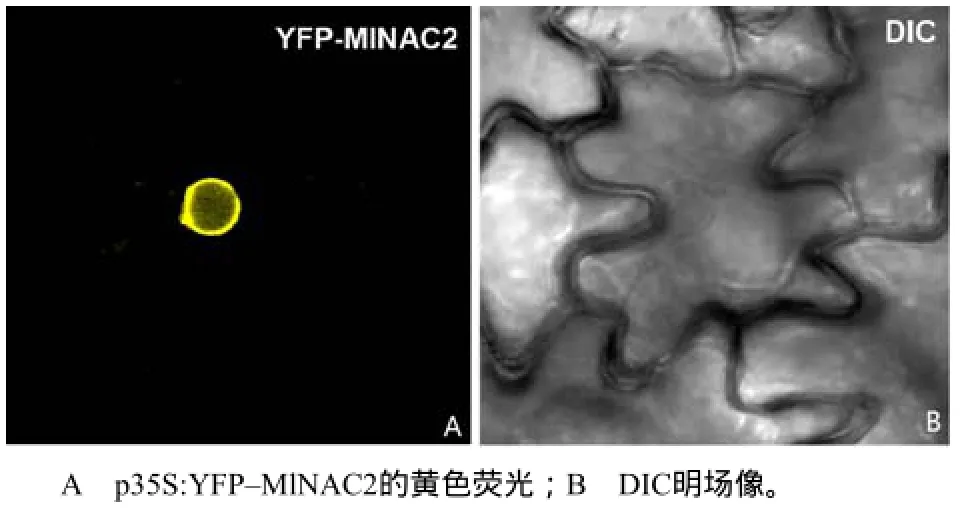
图4 MlNAC2的亚细胞定位Fig.4 Subcellular localization of MlNAC2
2.4 MlNAC2的转录激活试验结果
将 PCR筛选鉴定为阳性的重组酵母菌株以及只含有 pGBKT7的对照酵母菌株分别涂在 SD/-Trp、SD/-Trp/-His/30 mM 3-AT和SD/-Trp/-His/X-α-gal平板上,30 °C条件下培养3~6 d,结果表明,含有MlNAC2蛋白的C端及全长序列的酵母表达菌株能够在 SD/-Trp和 SD/-Trp/-His/30 mmol/L 3-AT平板上正常生长,并在X-α-gal存在的情况下(SD/-Trp/-His/X-α-gal)显示蓝色,而只含有pGBKT7的对照酵母菌株以及MlNAC2的N端的酵母表达菌株能在SD/-Trp正常生长,但是不能在SD/-Trp/- His/30 mM 3-AT和平板上正常生长,说明MlNAC2蛋白具有转录激活活性,且其转录激活区域位于C端(图 5)。

图5 MlNAC2蛋白在酵母体内的转录活性分析结果Fig. 5 Transactivation analysis of MlNAC2 protein in yeast
2.5 MlNAC2基因在南荻根部的表达模式
对长势一致的南荻进行不同的胁迫和激素处理后,实时定量PCR结果显示,在根部,MlNAC2在高盐、干旱、MeJA和机械伤害诱导下的表达量逐渐升高,并且在处理12 h时达到最大(表 2)。机械伤害处理12 h后,表达量比对照组提高了约30倍,说明MlNAC2受机械伤害强烈诱导表达。由于干旱处理24 h后根部失水过多,无法提取RNA,所以只在0~12 h内取样。低温处理1 h后,MlNAC2表达量下调了73%,随后恢复,与对照的差异无统计学意义。用100 μmol/L ABA处理南荻,MlNAC2在处理后1 h的表达丰度迅速达到峰值,随后降低。MlNAC2在根部的表达不受SA处理影响。

表 2 各处理MlNAC2基因在根部的相对表达量Table 2 Relative expression intensity of MlNAC2 gene in roots revealed under stress treatments
3 结论与讨论
植物不同器官都能够响应逆境胁迫,根部作为最先感受到土壤条件变化的器官,在胁迫响应中起着重要作用[12]。在PEG胁迫下,TaSNAC1在叶片中的响应比在根部慢,且受诱导的程度比在根部的弱[13]。在高盐、MeJA和机械伤害诱导下,叶片和根部中MlNAC2基因表达量的变化较为一致,都在处理后12 h达到峰值[8]。在MeJA处理下,MlNAC2在叶片中的表达峰值约为对照的136倍,在根部仅为叶片中的6.7倍。干旱胁迫0~12 h,MlNAC2在叶片和根部的表达都随处理时间的延长而逐渐升高。在低温条件下,MlNAC2在根部和叶片中表达的变化趋势也较为一致,在处理1 h后下调至对照水平。用100 μmol/L ABA处理1 h,MlNAC2在根部被迅速诱导,而在叶片中的诱导较慢。在SA处理下,MlNAC2在根部不被诱导,而在叶片中可以被诱导上调。推测MlNAC2在根部和叶片中参与高盐、干旱、低温、MeJA的响应机制可能一致,而参与SA和ABA处理的响应机制存在差异。
全基因组转录分析结果表明,有20%~25%的NAC基因至少响应一种胁迫[14-15]。干旱、高盐和ABA能诱导ANAC019、ANAC055和ANAC072在拟南芥中表达,过表达这3个基因能提高植株对高盐和干旱的耐受力[16]。Hu等[17]发现SNAC1基因参与了水稻的非生物胁迫,过表达植株的抗盐和抗旱性显著提高,并且没有出现矮化。在高盐胁迫下,TaNAC2a表达量先降低后升高;在干旱条件下该基因的表达量逐渐升高;在ABA诱导下逐渐降低。在烟草中过表达 TaNAC2a能显著提高植株的抗旱性[20]。MlNAC2与SNAC1、TaNAC2a为同源基因,推测该基因可能在提高植物抗旱性方面具有重要作用。
本研究中通过对转录因子MlNAC2进行生物信息学分析,鉴定该蛋白定位于细胞核,且具有转录激活活性,转录激活区域位于蛋白的C端。根据不同胁迫和激素处理下该基因在根部的表达模式,可推测该基因可能在南荻的胁迫响应中起重要作用。
参考文献:
[1] Puranik S,Sahu P P,Srivastava P S,et al.NAC proteins:regulation and role in stress tolerance[J].Trends in Plant Science,2012,17(6):369-381.
[2] Mao X G,Chen S S,Li A,et al.Novel NAC transcription factor TaNAC67 confers enhanced multiabiotic stress tolerance in Arabidopsis[J].Plos One,2014,9(1):1-15.
[3] Jeong J S,Kim Y S,Redilas M C F R,et al.OsNAC5 overexpression enlarges root diameter in rice plants leading to enhanced drought tolerance and increased grain yield in the field[J].Plant Biotechnology Journal,2013,11(1):101-114.
[4] Hao Y J,Wei w,Song Q X,et al.Soybean NAC transcription factors promote abiotic stress tolerance and lateral root formation in transgenic plants[J].The Plant Journal,2011,68(2):302-313.
[5] 刘旭,李玲.花生NAC转录因子AhNAC2和AhNAC3的克隆及转录特征[J].作物学报,2009,35(3):541-545.
[6] 邵帅,徐玲贤,王绍辉,等.茄子SmNAC1基因的克隆与表达分析[J].园艺学报,2014,41(5):975-984.
[7] 易自力.芒属能源植物资源的开发与利用[J].湖南农业大学学报(自然科学版),2012,38(5):455-463.
[8] Ji L,Hu R B,Jiang J X,et al.Molecular cloning and expression analysis of 13 NAC transcription factors in Miscanthus lutarioriparius[J].Plant Cell Reports,2014,33(12):2077-2092.
[9] Yang X W,Wang X Y,Ji L,et al.Overexpression of a Miscanthus lutarioriparius NAC gene MlNAC5 confers enhanced drought and cold tolerance in Arabidopsis[J]. Plant Cell Reports,2015,34(6):943-958.
[10] Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J].Methods,2001,25(4):402-408.
[11] Hu H H,Dai M Q,Yao J L,et al.Overexpressing a NAM,ATAF,and CUC (NAC) transcription factor enhances drought resistance and salt tolerance in rice[J]. Proceedings of the National Academy of Sciences,2006,103(35):12987-12992.
[12] Ghosh D,Xu J.Abiotic stress responses in plant roots:aproteomics perspective[J].Frontiers in Plant Science,2014,5:6.
[13] 单丽伟,宋鹏,刘夏燕,等.小麦胁迫响应转录因子TaSNAC1的克隆与表达分析[J].农业生物技术学报,2012,20(5):489-496.
[14] Nuruzzaman M,Manimekalai R,Sharoni A M,et al. Genome-wide analysis of NAC transcription factor family in rice[J].Gene,2010,465(1/2):30-44.
[15] Fujita M,Fujita Y,Maruyama K,et al.A dehydrationinduced NAC protein,RD26,is involved in a novel ABA-dependent stress-signaling pathway[J].Plant Journal,2004,39(6):863-876.
[16] Tran L S P,Nakashima K,Sakuma Y,et al.Isolation and functional analysis of Arabidopsis stress-inducible NAC transcription factore that bind to a drought-responsive cis-element in the early responsive to dehydration stress 1 promoter[J].Plant Cell,2004,16(9):2481-2498.
[17] Hu H H,Dai M Q,Yao J L,et al.Overexpressing a NAM,ATAF,and CUC (NAC) transcription factor enhances drought resistance and salt tolerance in rice[J].Proceedings of the National Academy of Sciences of the United States of America,2006,103(35):12987-12992.
[18] Tang Y M,Liu M Y,Gao S Q,et al.Molecular characterization of novel TaNAC genes in wheat and overexpression of TaNAC2a confers drought tolerance in tobacco[J].Physiologia Plantarum,2012,144(3):210-214.
责任编辑:王赛群
英文编辑:王 库
中图分类号:Q943.2
文献标志码:A
文章编号:1007-1032(2016)01-0027-06
收稿日期:2015-06-02 修回日期:2016-01-05
基金项目:国家科技支撑计划项目(2013BAD22B01,2013BAD22B02)
作者简介:吉璐(1989—),女,湖南蓝山人,硕士研究生,主要从事芒属植物分子生物学研究,kobejilu@163.com;*通信作者,易自力,博士,教授,主要从事能源植物资源研究,yizili889@163.com
Cloning MlNAC2 gene from Miscanthus lutarioriparius (Poaceae) and its expression profile in roots
Ji Lu1,2, Chen Zhiyong2, Xiao Liang2, Yi Zili2*
(1.Laboratory of Basic Biology, Hunan First Normal University, Changsha 410205, China; 2.College of Bioscience and Biotechnology, Hunan Agricultural University, Changsha 410128, China)
Abstract:A full length of 933 bp cDNA sequence encoded with 310 amino acid residues of MlNAC2 was cloned from Miscanthus lutarioriparius. The theoretical molecular weight and isoelectric point of this protein were 34 427.8 and 5.85,respectively, and it could be classified to stable proteins with an instability index about 34.84. MlNAC2 was assumed as a hydrophilic protein for its protein sequence contained a conservative NAM motif and no signal peptide or transmembrane structure. The subcellular localization assay confirmed that MlNAC2 was located in the nucleus and therefore might function in this subcellular. Transactivation assay indicated that MlNAC2 was a transcription factor protein and the transactivation region located at its C-terminus. Result from real-time quantitative PCR test suggested that the transcript of MlNAC2 at the roots of Miscanthus lutarioriparius was up-regulated at high salt, drought, ABA, MeJA or mechanical injuries, on the contrary, it was down-regulated at cold, but did not give response to SA.
Keywords:Miscanthus lutarioriparius; NAC transcription factor; gene expression; subcellular localization; transactivation
