云杉叶疫病根球壳孢菌的分子检测
2016-07-28许秀兰张岩杨春琳袁川刘应高
许秀兰,张岩,杨春琳,袁川,刘应高*
(1.四川农业大学林学院,四川 成都 611130;2.西藏林业调查规划研究院,西藏 拉萨850032;3.四川省广安市林业局,四川 广安 638550)
云杉叶疫病根球壳孢菌的分子检测
许秀兰1,张岩2,杨春琳1,袁川3,刘应高1*
(1.四川农业大学林学院,四川 成都 611130;2.西藏林业调查规划研究院,西藏 拉萨850032;3.四川省广安市林业局,四川 广安 638550)
投稿网址:http://xb.ijournal.cn
摘 要:从四川二郎山人工云杉林分离得到云杉叶疫病病原菌,采用真菌通用引物ITS1和ITS4扩增得到的序列与NCBI中的根球壳孢菌(Rhizosphaera kalkhoffi)相似度达99%。比较分析了NCBI及四川二郎山分离到的根球壳孢菌ITS区序列,采用软件primer5.0设计20个引物。通过对32株菌株DNA进行PCR扩增及产物测序,筛选得到3个特异性引物对ZYZ6、ZYZ7、ZYZ8。改变DNA模板浓度进行扩增检测,在25 μL PCR反应体系中,引物对ZYZ6F/ZYZ6R检测灵敏度最高,可达到0.1 pg/μL。利用ZYZ6F/ZYZ6R对四川二郎山人工云杉针叶DNA进行检测,扩增得到310 bp左右的条带,测序结果与GenBank中根球壳孢菌相似度达99%。
关 键 词:云杉叶疫病;根球壳孢菌;分子检测
云杉(Picea asperata Mast)属于松科(Pinaceae)云杉属(Picea)植物。中国云杉林主要分布在东北、华北、西北、西南及台湾省的高山地带[1-2]。云杉的落针现象主要由云杉散斑壳菌(Lophodermium piceae)[3-4]和根球壳孢菌(Rhizosphaera kalkhoffii Bubak)[5-6]引起。云杉叶疫病是一种广泛分布[3-5]的病害。云杉叶疫病病原菌(Rhizosphaera kalkhoffii)可在多种云杉属、冷杉属、松属植物针叶中寄生[6],在挪
1 材料与方法
1.1 材料
云杉叶疫病病原菌和球壳孢目真菌以及从2年生感病云杉针叶中分离得到的内生真菌,共32株,其中2株根球壳孢菌分离自二郎山云杉病株,1株分离自二郎山华山松针叶,23株云杉针叶内生真菌,由四川农业大学森林保护实验室提供。6株球壳孢目真菌由中国林科院森环森保所提供。
植物样品为二郎山云杉发病区域的发病针叶与疑似发病针叶,以健康林区的云杉针叶作对照。植物基因组DNA提取试剂盒(Plant Genomic DNA Extraction Kit,DP305)购自天根生化科技(北京)有限公司。
1.2 方法
1.2.1 病原菌DNA的提取与扩增
将供试菌株转至 PDA固体培养基[10](马铃薯200 g,葡萄糖20 g,琼脂15~20 g,加水定容至1 L)平板上,25 ℃培养5 d后,从菌落边缘切取5块2 mm×2 mm菌落块,转至PD液体培养基,25 ℃振荡培养5~7 d,过滤收集菌丝,-20 ℃保存备用。
PCR反应均在杭州朗基科学仪器有限公司的A200仪器上完成。反应参数设置如下:95 ℃预变性4 min,95 ℃变性30 s,56 ℃复性30 s,72 ℃延伸1 min,共35个循环;72 ℃延伸7 min,4 ℃永久保存。PCR 扩增采用 25 μL体系:DNA模板3 μL,10 μmol/L浓度上、下游引物每对各取0.5 μL混合于一管,Premix 12.5 μL,加ddH2O 8.5 μL。PCR反应结束后取5 μL扩增产物于1%琼脂糖凝胶电泳(含EB),凝胶自动成像仪上检测拍照。最后选取条带清晰的琼脂糖电泳的PCR产物,送英潍捷基(上海)贸易有限公司进行测序。
1.2.2 特异引物的设计与筛选
用真菌通用引物ITS1和ITS4扩增测序得到根球壳孢菌的ITS序列。根据测序所得的病原菌DNA序列和在GeneBank中登录的病原菌的DNA序列进行比对,找出根球壳孢菌rDNA-ITS区的一段特异基因序列,用软件Primer 5.0针对这段序列设计引物,用Oligo 6进行分析。筛选出20个引物(表1),由上海生工生物工程有限公司完成合成。
以供试菌株的DNA为模板,用20个特异引物进行PCR扩增,以双蒸水为对照。反应产物用1%琼脂糖凝胶进行电泳检测。
采用浓度梯度稀释法,将病原菌DNA分别稀释为8×105、4×105、1×105、1×104、1×103、1×102、10、1、1×10-1、1×10-2pg/µL,以双蒸水为对照,将特异性引物进行PCR扩增,扩增产物进行1%琼脂糖凝胶电泳检测并测序。

表1 筛选出的20个根球壳孢菌特异性引物Table 1 Twenty pairs of the primers specific for Rhizosphaera kalkhoffii

表1(续)
1.2.3 云杉针叶的病原菌检测
分别称取0.3 g植物针叶样品,无菌条件下剪碎放入研钵中,按照植物基因组DNA提取试剂盒的步骤提取植物基因组DNA,-20 ℃中保存备用。采用筛选出的特异引物对提取的云杉DNA样品进行PCR扩增,以双蒸水作对照。最终反应产物进行1%琼脂糖凝胶电泳检测。
2 结果与分析
2.1 特异引物的筛选结果
用设计的 20个特异引物扩增所有参试菌株的基因组DNA,其中只有引物ZYZ6、ZYZ7和ZYZ8可以从致病菌 Rhizosphaera kalkhoffii中扩增出稳定、清晰的条带,扩增出的基因组大小分别约为310、384、334 bp。其他参试菌株基因组DNA和双蒸水对照均不能扩增出此条带(图1)。引物ZYZ6、YSY2和ZYZ8即为检测云杉落针病病菌的特异引物,将扩增产物的序列在NCBI中进行BLAST比对,结果显示与库中Rhizosphaera kalkhoffii的相似性达到99%。

图1 特异引物ZYZ6、YSY2、ZYZ8扩增所有菌株PCR图谱Fig. 1 PCR profiles of the products amplified from all strains with specific primers ZYZ6F/ZYZ6R, YSY2F/YSY2R and ZYZ8F/ZYZ8R
2.2 引物灵敏度的检测结果
用特异性引物ZYZ6、YSY2和ZYZ8对不同浓度的云杉叶疫病菌基因组DNA进行PCR扩增。结果显示,只有引物ZYZ6能从质量浓度为0.1 pg/µL以上的模板中扩增出1条约310 bp的特异性条带,未能在稀释至100 fg/µL及以下的模板DNA及对照中扩增到特异性条带(图2)。YSY2和ZYZ8灵敏度较ZYZ6差,只能从质量浓度为10 pg/µL以上的模板中扩增出特异性条带来,所以选用灵敏度最高的引物ZYZ6作为最终的特异性引物。
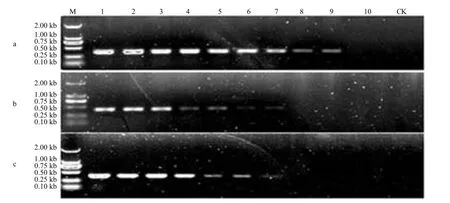
图2 特异引物ZYZ6F/ZYZ6R、YSY2F/YSY2R、ZYZ8F/ZYZ8R的灵敏度检测结果Fig. 2 Sensitivity of the PCR with specific primers ZYZ6F/ZYZ6R, YSY2F/YSY2R and ZYZ8F/ZYZ8R
2.3 云杉针叶中病原菌的检测结果
选取最佳引物对ZYZ6F/ZYZ6R对四川二郎山人工云杉针叶进行分子检测,结果显示,从发病区云杉针叶中能扩增出1条约310 bp的特异性条带,该特异条带经回收测序,进行BLAST比对,显示二者相似性达到99%,健康针叶及双蒸水对照均无特异性条带产生(图3),表明引物对ZYZ6F/ZYZ6R能有效检测出云杉针叶中寄生的病原菌,同时对于疑似发病的植物组织也有很好的检测效果。

图3 特异引物ZYZ6F/ZYZ6R对样品的扩增结果Fig.3 Results of PCR amplification from samples with specific primer ZYZ6F/ZYZ6R
3 讨论
云杉叶疫病和云杉落针病为云杉叶部病害[11-13],均可导致云杉针叶枯死脱落。Livsey等[14]认为,云杉叶疫病菌是一种普遍的针叶真菌,相比云杉散斑壳菌(L. piceae)对挪威云杉更具有致病力;Diamandis[4]则认为,云杉叶疫病菌只有当针叶受到非生物损伤后才从伤口侵入。许秀兰等[15]前期研究发现,云杉叶疫病菌在二郎山活体针叶中存在。笔者通过野外观察,在土壤潮湿的环境下,二郎山云杉凋落针叶长出大量子囊果,后鉴定为云杉散斑壳菌,说明这2种病原菌在该地区人工云杉林中并存。
Müller等[16]利用SCAR标记对芬兰云杉散斑壳菌进行了遗传多样性研究,筛选出可专一扩增云杉散斑壳菌的引物LP2,实现了对病原菌云杉散斑壳的快速分子检测。Diamandis[17]早期对云杉叶疫病菌的最适生长条件作了研究。Kumi等[6]描述了该病原菌的室内培养特性。为了从分子生物学水平对云杉叶疫病菌进行研究,笔者设计并筛选出一对特异引物 ZYZ6F/ZYZ6R,它可以有效地检测出云杉叶疫病病原菌。改变病原菌浓度梯度,云杉叶疫病病原菌DNA基因组浓度最低达到100 fg/µL水平时仍能检测。
病原菌在活体植物中常具有潜伏性,一定时间内对寄主可能不会产生伤害。通过对二郎山林区的云杉叶疫病菌进行分子检测,发现该地区部分云杉林受到该菌的侵染,未表现病症的针叶中也可检测到病原菌。近年来发展起来的实时荧光定量PCR已经应用于寄主抗性评价[19]。结合该技术的应用,将有利于云杉抗病品种的筛选。
参考文献:
[1] 罗建勋,左林.云杉人工林材性变异的初步研究[J].西北农林科技大学学报(自然科学版),2001,29(2):129-134.
[2] 罗建勋,李晓清,孙鹏,等.云杉天然群体表型变异研究[J].东北林业大学学报,2003,31(1):9-11.
[3] Diamandis S.“Top-dying” of Norway spruce,Piceaabies(L.) Karst. with special reference to Rbizosphaera kalkhoffii Bubák I.Development of foliar symptoms[J].Eur J Forest Pathol,1978,8(5/6):337-345.
[4] Diamandis S.“Top-dying” of Norway spruce,Piceaabies (L.) Karst.with special reference to Rhizosphaerakalkhoffii Buhák II.Status of R.kalkhoffii in “Top-dying” of Norway spruce[J].Eur J Forest Pathol,1978,8(5/6):345-356.
[5] Juzwik J.Morphology,cultural-characteristics,and pathogenicity of Rhizosphaera kalkhoffii on picea spp. in northern minnesota and Wisconsin[J].Plant Dis,1993,77(6):630-634.
[6] Kumi J,Lang K J.The susceptibility of various spruce species to Rhiosphaera kalkhoffii and some cultural characteristics of the fungus in vitro[J].Eur J Forest Pathol,1979,9(1):35-46.
[7] 任玮.云杉叶疫病的研究[J].西南林学院院报,1990,10(2):176-179.
[8] You C J,Tian C M,Liang Y M,et al.First report of pitch canker disease caused by Rhizosphaera kalkhoffii on Pinussylvestris in China [J].Plant Dis,2013,97(2):283-284.
[9] 杨腊英,黄华平,唐复润,等.香蕉炭疽菌rDNA ITS 区的分子鉴定与检测[J].植物病理学报,2006,36(3):219-225.
[10] 方中达.植病研究方法[M].北京:中国农业出版社,1979.
[11] Scattolin L,Montecchio L.Lophodermium piceae and Rhizosphaera kalkhoffii in Norway spruce:correlations with host age and climatic features[J].Phytopathol Mediterr,2009,48(2):226-239.
[12] Diamandis S.“Top-dying” of Norway spruce,Piceaabies(L.) Kast., with special reference to Rhizosphaera kalkhffii Bubák[J].Eur J Forest Pathol,1979,9(2):78-88.
[13] 邱书志.云杉落针病发病规律的研究[J].西北林学院学报,1998,13(4):76-81.
[14] Livsey S,Barklund P.Lophodermium piceae and Rhizosphaera kalkhoffii in fallen needles of Norway spruce(Piceaabies)[J].Eur J Forest Pathol,1992,22(4):204-216.
[15] 许秀兰,张翅,黄晓丽,等.云杉叶栖真菌的群落结构与多样性[J].东北林业大学学报,2014,42(3):122-125.
[16] Müller M M,Valjakka R,Hantula J.Genetic diversity of Lophodermium piceae in South Finland[J].For Path,2007,37(5):329-337.
[17] Diamandis S.“Top-dying” of Norway spruce,Piceaabies (L.) Karst.,with special reference to Rhizosphaera kalkhoffii BubákV.Optimum conditions for diameter growth of Rhizosphaera kalkhoffii[J].Eur J Forest Pathol,1979,9(3/4):175-183.
[18] Wang Y C,Zhang W L,Wang Y,et al.Rapid and sensitive detection of Phytophthorasojae in soil and infected soybeans by species-specific polymerase chain reaction assays[J].Phytopathology,2006,96(12):1315-1321.
[19] Min Q,Yi Y.Quantification of Magnaporthegrisea during infection of rice plants using real-time polymerase chain reaction and northern blot phosphoimaging analyses [J].Phytopathology,2002,92(8):870-876.
责任编辑:罗慧敏
英文编辑:罗 维
中图分类号:S763.11
文献标志码:A
文章编号:1007-1032(2016)01-0070-05
收稿日期:2015-10-15 修回日期:2015-11-30
基金项目:四川省教育厅项目(09ZA068)
作者简介:许秀兰(1986—),女,四川内江人,博士研究生,主要从事林木病理学研究,xuxiulanxxl@126.com;*通信作者,刘应高,博士,教授,主要从事林木病理学研究,lyg927@263.com威云杉(Picea abies (Linn.)H. Karsten)上报道较多。中国云杉叶疫病首次在云南西北部和四川西部的丽江云杉(Picealikiangensis (Franch) Pritz)上被发现[7]。2013年,由该病原菌引起的樟子松病害在中国大兴安岭林区被发现[8]。在四川泸定二郎山地区约有 1 334 hm2人工云杉幼林,笔者在近年的野外观察和室内试验中发现,二郎山云杉针叶凋落后,在潮湿的环境下后期会出现云杉散斑壳菌的子囊果,同时,活体针叶的组织分离试验得到了根球壳孢菌。说明这2种病原菌在该地区人工云杉林中并存。利用云杉叶疫病病原菌ITS[9]区序列设计引物,采集二郎山云杉针叶作为检测对象,建立了云杉叶疫病病原菌的快速分子检测体系,并利用该体系对四川二郎山云杉林进行云杉叶疫病的检测。
Rapid molecular detection of spruce needle blight caused by Rhizosphaera kalkhoffii
Xu Xiulan1, Zhang Yan2, Yang Chunlin1, Yuan Chuan3, Liu Yinggao1*
(1.College of Forestry, Sichuan Agricultural University, Chengdu 611130, China; 2.Institute of Forestry Investigation and Planning in Tibet Autonomous Region, Lasha 850032, China; 3.Forestry Bureau of Guang'an City Sichuan Province,Guang'an, Sichuan, 638550, China)
Abstract:Pathogen causing spruce needle blight was isolated from the artificial spruce forest on Erlang Moutain, and the amplification sequence from the pathogen using fungus general primers ITS1 and ITS4 showed 99% similarity with the Rhizosphaera kalkhoffii in NCBI. Internal transcribed spacer (ITS) sequences of the isolated pathogen and Rhizosphaera kalkhoffii (R. kalkhoffii) in NCBI were compared and analyzed, and 20 pairs of primers were designed with softwareprimer5.0. The amplification results for 32 strains combined with sequencing results showed that 3 primer pairs ZYZ6, ZYZ7 and ZYZ8 specific for R. kalkhoffii were obtained. The sensitivity of the 3 specific primers was tested by changing their concentration. The results showed primer pair ZYZ6F/ZYZ6R had the highest sensitivity which can detect the pathogen at genomic DNA concentration of 0.1 pg/μL in 25 µL PCR reaction system. Primer pair ZYZ6F/ZYZ6R was used to detect the pathogen from the DNA of the plant leaves of spruce. Sequencing results showed the sequence of the 310 bp amplified bands showed 99% similarity with the recorded sequence of strain Rhizosphaera kalkhoffii in GenBank.
Keywords:spruce needle blight; Rhizosphaera kalkhoffii; molecular detection
