斑马鱼性腺组织的原代细胞培养技术的建立
2016-07-27董丹丹孙燕侠郭华荣
董丹丹, 孙燕侠, 郭华荣
(中国海洋大学海洋生命学院,山东青岛 266003)
斑马鱼性腺组织的原代细胞培养技术的建立
董丹丹, 孙燕侠, 郭华荣*
(中国海洋大学海洋生命学院,山东青岛 266003)
摘要[目的]建立斑马鱼卵巢和精巢组织的原代细胞培养技术,获得原代和传代培养细胞单层。[方法]采用组织块贴壁法进行斑马鱼卵巢和精巢组织的原代细胞培养,采用0.25%胰蛋白酶消化法进行传代培养。[结果]斑马鱼性腺组织的原代细胞培养条件为:最适培养基为DMEM/F12(pH 7.0~7.2),培养温度为24 ℃,在添加20 ng/mL 表皮生长因子(EGF)、20 ng/mL 碱性成纤维细胞生长因子(bFGF)、0.5 mmol/L β-巯基乙醇和15%胎牛血清时更有利于细胞的存活。其中,卵巢的组织块接种3~4 d后,上皮样细胞首先开始迁出,迁出的上皮样细胞生长5 d后,逐渐凋亡;此后,成纤维样细胞和另一种上皮样细胞开始大量迁出, 10 d后可生长汇合成80%的原代细胞单层;可成功传代培养1次,但传代后的上皮样细胞不贴壁,很快死亡,而传代后的成纤维样细胞可贴壁生长,但基本不分裂,健康存活7 d后开始逐渐凋亡。精巢组织接种5 d后,上皮样细胞和成纤维样细胞同时开始迁出,培养16 d后逐渐凋亡,仅得到60%原代培养细胞单层。[结论]初步建立了斑马鱼性腺组织的原代细胞培养条件,并将卵巢组织块迁出的成纤维样细胞成功传代1次。
关键词斑马鱼;性腺组织;原代细胞培养;传代培养
斑马鱼是原产于印度和巴基斯坦淡水河流中的一种热带硬骨鱼,具有易于饲养、繁殖周期短、多次产卵和胚胎透明等优点,是功能基因组时代生命科学研究中最重要的一种水生模式脊椎动物[1-2]。斑马鱼作为研究模型,可用于揭示胚胎和组织器官发育的分子机理,研究和解决环境科学中的重大问题。近年来,由于环境中内分泌干扰物含量的持续增加,导致许多鱼类发生性逆转。因此,斑马鱼常被用于研究鱼类的性别分化与决定以及环境内分泌干扰物的毒性机制等[3],然而这些研究主要是基于对斑马鱼发育过程异常的观察,过程相对繁琐,重复性差。体外培养的斑马鱼细胞系可为此研究提供更简便的试验材料和手段,简化研究过程,试验结果重复性好。
目前,斑马鱼的肝脏细胞系[4]、胚胎细胞系[5]和脾脏细胞系[6]已成功建立,但关于建立斑马鱼性腺细胞系的研究则鲜见报道。笔者建立和优化斑马鱼生殖腺组织包括卵巢和精巢的原代和传代细胞培养技术,旨在为今后斑马鱼性腺细胞系的建立与应用奠定基础。
1材料与方法
1.1试验鱼4~5月龄的性成熟斑马鱼(Daniorerio),体长约3 cm,购自青岛市南山水产品市场,雌雄分开后,分别于15 L的玻璃缸中充气暂养至少7 d,光照周期为14 h L/10 h D,水温为25 ℃。1.2试剂胰蛋白酶(1∶250),为Wolsen公司产品;表皮生长因子(EGF)和碱性成纤维细胞生长因子(bFGF)均为北京义翘神州公司产品;基础培养基L-15和DMEM均为Gibco公司产品;基础培养基DMEM/F12和胎牛血清(FBS)均为Hyclone公司产品;其他药品均为分析纯。
PBS配方为:8 g/L NaCl、0.2 g/L KCl、3 g/L Na2HPO4·12H2O、0.2 g KH2PO4。
完全培养基配方为:在基础培养基中加入10%~20%FBS、20 ng/mL EGF、20 ng/mL bFGF、0.5 mmol/L β-巯基乙醇(β-ME)、100 IU/mL青霉素和100 μg/mL硫酸链霉素。
1.3原代培养方法取健康斑马鱼置于煮沸消毒的自来水中暂养4 h后,转移至含1 000 IU/mL青霉素和1 000 μg/mL硫酸链霉素的煮沸消毒自来水中继续暂养12~16 h。捞出斑马鱼后,用0.2%碘伏溶液擦拭消毒斑马鱼全身,尤其是腹部,然后,将其置于75%酒精中浸泡30 s。然后,于超净工作台内无菌取出卵巢或精巢组织,并将性腺组织在75%酒精中快速漂洗一下,然后转移至含200 IU/mL青霉素和200 μg/mL硫酸链霉素的PBS缓冲液和基础培养基中分别漂洗至少2遍,最后置于含10%FBS、100 IU/mL青霉素和100 μg/mL硫酸链霉素的基础培养基中暂存。
当所有卵巢或精巢组织取完后,分别剪碎成约1 mm×1 mm×1 mm的组织小块,漂洗干净后,均匀接种于25 cm2细胞培养瓶(Corning公司)中,分别于20~28 ℃培养箱中密闭薄层培养18 h,然后加入3 mL含有10%~20%FBS、20 ng/mL EGF、 20 ng/mL bFGF、0.5 mmol/L β-ME、100 IU/mL青霉素和100 μg/mL硫酸链霉素的完全培养基中进行培养,隔天补加至5 mL,此后每隔3~4 d更换50%培养液,继续培养。每天于倒置显微镜(Nikon)下观察和记录细胞的迁出和生长状况。
1.4传代培养方法吸出旧培养基,然后用PE(含0.02% EDTA的PBS)缓冲液洗涤细胞,待细胞有收缩趋势时去除PE缓冲液,加入300 μL 0.25%的胰蛋白酶溶液消化至细胞开始脱落,立即加入完全培养基终止消化,用移液管吹打6~8次,然后将细胞悬液离心洗涤1次(800 r/min,离心3 min),最后加入5 mL完全培养基重悬,平均接种到2个25 cm2细胞培养瓶中,并补加培养基至5 mL,最适温度下继续培养。
1.5最适培养条件的筛选
1.5.1最适培养基的筛选。比较和观察卵巢组织小块在3 种不同培养基(1.5×L-15、DMEM 和DMEM/F12 培养基)(pH 7.0~7.2)中的细胞迁出和增殖情况。以上3种基础培养基中均分别添加10%FBS、20 ng/mL EGF、 20 ng/mL bFGF、0.5 mmol/L β-巯基乙醇、100 IU/mL青霉素和100 μg/mL硫酸链霉素。分别于24 ℃下进行原代培养,以确定最适培养基。
1.5.2最适血清浓度的筛选。以最适培养基(DMEM/F12)为基础培养基,于24 ℃下观察卵巢或精巢组织小块在3种血清浓度(10%、15%和20% FBS)的完全培养基中的细胞迁出和增殖情况,确定最适血清浓度。完全培养基中的其他添加成分相同,为20 ng/mL EGF、 20 ng/mL bFGF、0.5 mmol/L β-巯基乙醇、100 IU/mL青霉素和100 μg/mL硫酸链霉素。
1.5.3最适培养温度的筛选。以最适培养基(DMEM/F12)为基础培养基,以添加最适浓度的FBS(15%)、20 ng/mL EGF、 20 ng/mL bFGF、0.5 mmol/L β-巯基乙醇、100 IU/mL青霉素和100 μg/mL硫酸链霉素的完全培养基,比较和观察卵巢或精巢组织小块在3种温度(20、24和28 ℃) 下的细胞迁出和增殖情况,确定最适培养温度。
2结果与分析
2.1斑马鱼卵巢组织的原代细胞培养结果由表1可知,在选用的3种基础培养基中,1.5×L-15和DMEM培养基所培养的卵巢组织块的贴壁率和形成细胞单层的能力均明显低于DMEM/F12培养基,且细胞于接种5 d后才开始从组织块中迁出;DMEM/F12培养基所培养的组织块的贴壁率高达80%,接种3 d后即可见到细胞迁出。因此,DMEM/F12培养基更适于斑马鱼卵巢组织的原代细胞培养。
由表2可知,斑马鱼卵巢组织分别于含3种不同血清浓度(10%、15%和20% FBS)的DMEM/F12培养基中培养。当血清添加浓度为15% 时,组织块的贴壁率和形成细胞单层的能力最高。因此,DMEM/F12培养基的最适血清浓度为15%。
表1斑马鱼卵巢组织原代细胞培养中最适培养基的筛选
Table 1Screening results of the optimal medium for primary cell culture of the ovary tissues of zebrafish
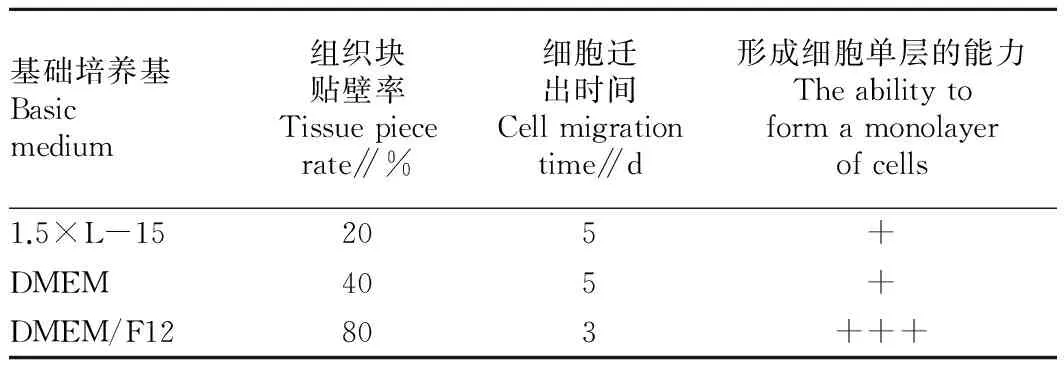
基础培养基Basicmedium组织块贴壁率Tissuepiecerate∥%细胞迁出时间Cellmigrationtime∥d形成细胞单层的能力Theabilitytoformamonolayerofcells1.5×L-15205+DMEM405+DMEM/F12803+++
注:“+” 表示少量组织块有细胞迁出,细胞铺板率约25%;“++” 表示很多组织有细胞迁出,细胞铺板率约50%;“+++” 表示较多组织有细胞迁出,细胞铺板率约75%。
Note: “+” indicated a small amount of tissue blocks have cells to move out,cells plating efficiency rate was 25%; “++” indicated that many tissues have cells to move out,cells plating efficiency rate was 50%; “+++” indicated more tissues have cells to move out,cells plating efficiency rate was 75%.
表2斑马鱼卵巢组织原代细胞培养中最适血清浓度的筛选
Table 2Screening results of the optimal percentage of FBS for primary cell culture of the ovary tissues of zebrafish
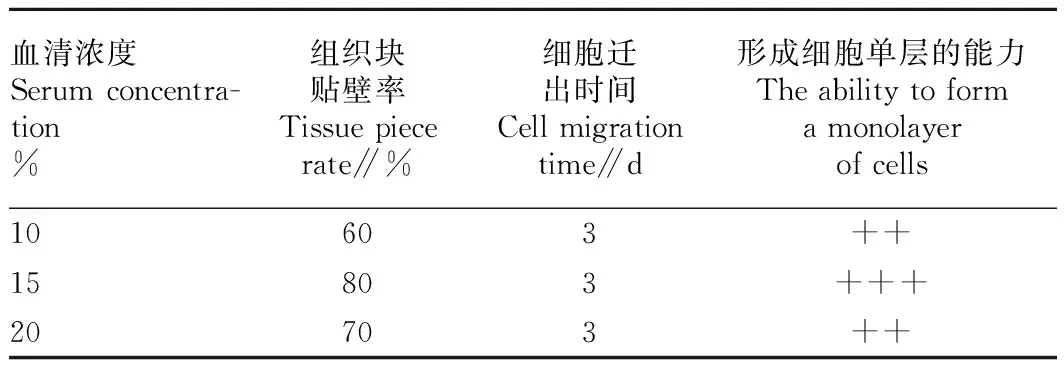
血清浓度Serumconcentra-tion%组织块贴壁率Tissuepiecerate∥%细胞迁出时间Cellmigrationtime∥d形成细胞单层的能力Theabilitytoformamonolayerofcells10603++15803+++20703++
注:“+” 表示少量组织块有细胞迁出,细胞铺板率约25%;“++” 表示很多组织有细胞迁出,细胞铺板率约50%;“+++” 表示较多组织有细胞迁出,细胞铺板率约75%。
Note: “+” indicated a small amount of tissue blocks have cells to move out,cells plating efficiency rate was 25%; “++” indicated that many tissues have cells to move out,cells plating efficiency rate was 50%; “+++” indicated more tissues have cells to move out,cells plating efficiency rate was 75%.
由表3可知,斑马鱼卵巢组织分别于不同温度(20、24和28 ℃)下培养,24 ℃下组织块的贴壁率最高(80%),细胞迁出时间最短(3 d),形成细胞单层能力最强;20 ℃下组织块的贴壁率与24 ℃下一样高(80%),但细胞迁出时间最长(7 d),形成细胞单层的能力介于24 ℃和28 ℃之间;28 ℃下,组织块的贴壁率最低(40%),细胞迁出用时5 d,形成单层的能力最差。由此可见,斑马鱼卵巢组织原代细胞培养的最适温度为24 ℃。
在最适培养条件下,于添加15%FBS、20 ng/mL EGF、20 ng/mL bFGF、0.5 mmol/L β-巯基乙醇、100 IU/mL青霉素和100 μg/mL硫酸链霉素的DMEM/F12 完全培养基中,24 ℃下斑马鱼卵巢组织块贴壁情况良好,只有极少数组织块脱落,悬浮于培养液中。细胞于组织块接种3 d后开始迁出,最先迁出的是1种上皮样细胞(图1A),该细胞生长5 d后开始变圆并空泡化,逐渐凋亡(图1B)。此时,长梭形的成纤维样细胞和多角形上皮样细胞开始大量迁出,且可持续13天左右。其中,长梭形的成纤维样细胞很快长成致密单层(图1C),但仅能健康存活20天左右;随后,长梭形的成纤维细胞变大变薄,边界模糊,部分细胞出现空泡化(图1E);后期,长梭形的成纤维细胞极度铺展,形状极不规则,空泡化严重,最终凋亡(图1G)。多角形上皮样细胞也在接种后20天内形成细胞单层(图 1D),相比之下,迁出的多角形上皮样细胞可健康存活更长时间,在不传代条件下,可健康存活40天左右(图1F),随后,细胞逐渐变圆脱落,最终死亡(图1H)。2.2精巢组织的原代细胞培养结果采用与卵巢组织相同的最适培养条件,斑马鱼精巢组织的原代细胞培养启动4~5 d后,可观察到2类细胞同时迁出,即成纤维样细胞(图2A)和上皮样细胞(图2A和图2B),这2类细胞均可健康存活15 d左右。接种21 d后,成纤维样细胞开始空泡化,边界模糊(图 2C);上皮细胞逐渐变圆脱落(图2D),在培养25 d左右时全部死亡。
表3斑马鱼卵巢组织原代细胞培养中最适培养温度的筛选
Table 3Screening results of the optimal temperature for primary cell culture of the ovary tissues of zebrafish
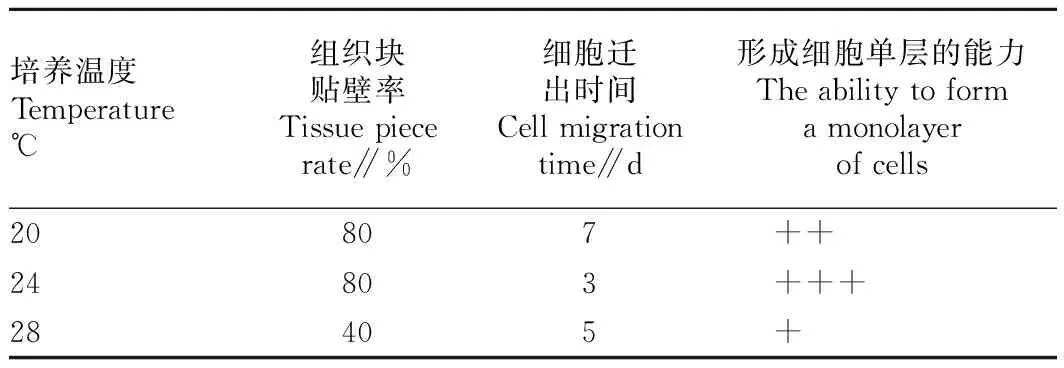
培养温度Temperature℃组织块贴壁率Tissuepiecerate∥%细胞迁出时间Cellmigrationtime∥d形成细胞单层的能力Theabilitytoformamonolayerofcells20807++24803+++28405+
注:“+” 表示少量组织块有细胞迁出,细胞铺板率约25%;“++” 表示很多组织有细胞迁出,细胞铺板率约50%;“+++” 表示较多组织有细胞迁出,细胞铺板率约75%。
Note: “+” indicated a small amount of tissue blocks have cells to move out,cells plating efficiency rate was 25%; “++” indicated that many tissues have cells to move out,cells plating efficiency rate was 50%; “+++” indicated more tissues have cells to move out,cells plating efficiency rate was 75%.
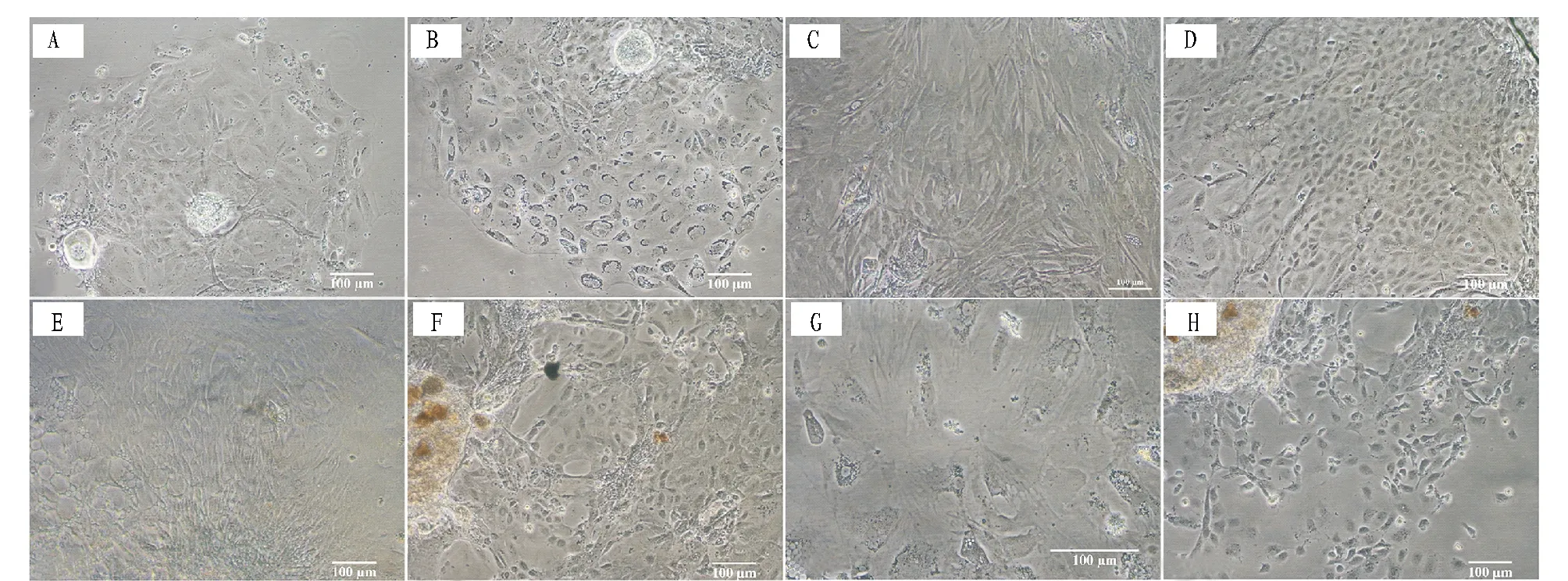
注:A.接种3 d后迁出的多角形上皮样细胞;B.接种8 d后,迁出的上皮样细胞开始变圆并空泡化,逐渐凋亡;C.接种20 d后,迁出的长梭形的成纤维细胞;D.接种20 d后,迁出的多角形上皮样细胞;E.接种27 d后,部分成纤维细胞出现空泡化;F.接种30 d后,部分上皮样细胞脱落;G.接种35 d后,长梭形的成纤维细胞极度铺展,细胞变大变薄,边界模糊,形状极不规则,空泡化严重;H.接种46 d后,大部分上皮样细胞变圆,脱落死亡。 Note:A.The epithelium-like cells migrated from the ovary explants at 3 d post seeding.B.The migrated epithelium-like cells tends to shrink and vacuolate at 8 d post seeding.C.The fibroblast-like cells migrated from the ovary explants at 20 d post seeding.D.The epithelium-like cells migrated from the ovary explants at 20 d post seeding.E.Partial fibroblast-like cells shown in panel C showed vacolation at 27 d post seeding. F.Partial epithelium-like cells shown in panel D detached at 30 d post seeding.G.The fibroblast-like cells shown in panel C tend to over-spread out and become big,thin,irregular and vacuolated seriously at 35 d post seeding.H.Most epithelium-like cells shown in panel D begin to shrink,detach and die at 46 d post seeding.图 1 斑马鱼卵巢组织的原代细胞培养结果Fig.1 Light micrographs of the primary culture cells derived from the ovary tissues of zebrafish
2.3传代培养结果斑马鱼精巢组织的原代培养细胞传代后,细胞不贴壁,未能成功传代。卵巢组织的原代细胞培养15 d后,细胞状态良好(图3A),可进行传代。传代后的初期阶段,细胞能够正常贴壁和生存,呈长梭形(图3B);中期,细胞伸展,仍可见长梭轮廓,生长缓慢,难以形成单层(图3C);后期,胞质内逐渐出现空泡化,最后凋亡(图3D)。
3讨论与结论
鱼类细胞系可为在细胞水平上研究鱼类的生理生化特性以及鱼类的病毒学、免疫学、遗传学、营养学、毒理学和内分泌学等提供有力的研究工具和手段,而性腺细胞系对研究生殖干细胞的自我更新以及配子形成具有重要意义。Wolf等[7]于1962 年建立了世界上第1个鱼类性腺组织细胞系——虹鳟鱼性腺细胞系(RTG-2)。性腺组织的有丝分裂水平较高,已报道的鱼类性腺细胞系已有20余种[8-9],但迄今为止尚未见到斑马鱼性腺组织细胞系的成功报道。笔者首次优化和建立了斑马鱼卵巢和精巢组织的原代和传代培养技术,为今后成功建立斑马鱼性腺组织细胞系奠定了基础。
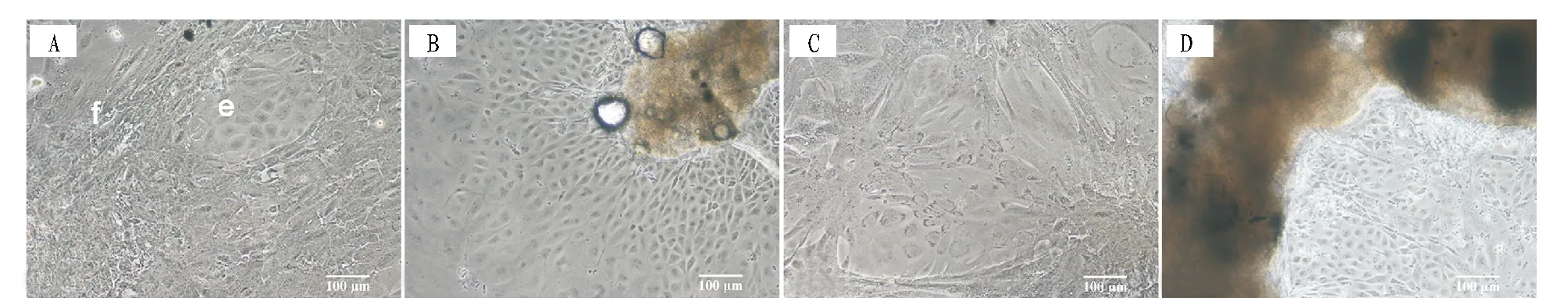
注:A.接种5 d后,迁出的上皮样细胞(e)和成纤维样细胞(f);B.接种5 d后,迁出的上皮样细胞;C.接种21 d后,空泡化的成纤维样细胞;D.接种21 d后,开始脱落死亡的上皮样细胞。 Note:A.The migrated epithelium-like cells (e) and fibroblast-like cells (f) at 5 d post seeding; B.The migrated epithelium-like cells at 5 d post seeding; C.The fibroblast-like cells shown in panel A demonstrated vacuolation at 21 d post seeding; D.The epithelium-like cells shown in panel B began to detach and die at 21 d post seeding.图2 斑马鱼精巢组织的原代细胞培养结果Fig.2 Light micrographs of the primary culture cells derived from the testis tissues of zebrafish

注:A.传代前的原代细胞单层;B.传代3 d后的细胞;C.传代7 d后的细胞;D.传代10 d后的成纤维样细胞。 Note:A.Primary ovary cells before subculture; B.Cells at 3 d after subculture; C.Cells at 7 d after subculture; D.Cells at 10 d after subculture.图3 斑马鱼卵巢组织原代培养细胞的传代Fig.3 Subculture of primary ovary cells of zebrafish
鱼类原代细胞培养过程中的消毒处理和无菌取材是培养能否成功的关键。笔者通过以下措施成功实现了试验材料的完全无菌:①试验前24 h停止喂食,并转移到煮沸消毒过的自来水中暂养4 h,然后再将斑马鱼转移至含双抗(1 000 IU/mL青霉素和1 000 μg/mL硫酸链霉素)的煮沸消毒的自来水中暂养12~16 h,这样就在极大程度上控制了微生物和原生动物的污染;②解剖前用碘伏擦拭斑马鱼体表,然后再用75%的酒精浸泡约30 s,进一步去除体表的微生物和原生动物,并使其麻醉;③取出的生殖腺再用75%的酒精漂洗2~3 s,然后再依次用含200 IU/mL青霉素和200 μg/mL硫酸链霉素的PBS及基础培养基漂洗,以除去组织块表面残留的酒精成分,避免由于酒精损伤组织而降低细胞的贴壁能力和存活率。
组织块贴壁培养法是一种常用的简便易行的原代细胞培养方法,因其组织块未受太大的破坏,所以与体内环境比较接近,可在短期内保持贴壁能力和增殖能力,并形成生长晕。此外,这种方法操作步骤简单、一般不会造成污染[10]。笔者采用组织块贴壁法成功启动了斑马鱼卵巢组织的原代细胞培养,细胞一般在原代培养启动后3~4 d内即可见到上皮样细胞开始迁出,5 d后该上皮样细胞停止迁出,并开始空泡化;与此同时,长梭形的成纤维样细胞和另一种上皮样细胞开始迁出,10 d后可形成细胞单层,并可以成功传代1次。传代后的细胞不生长分裂,这可能与培养基中某种生长因子的缺乏有关,尚需进一步研究。
笔者通过比较斑马鱼卵巢组织细胞在1.5×L-15、DMEM 和DMEM/F12 3种培养基中组织块的迁出、贴壁及增殖情况,发现DMEM/F12(pH7.0~7.2)是适宜斑马鱼卵巢组织细胞体外培养的培养基,这与斑马鱼胚胎细胞系(ZF4)[5]的最适培养基相同,可能与DMEM/F12培养基的营养成分比较丰富有关。
血清中含有各种生长因子和激素等有助于细胞贴壁和生长的物质,其添加浓度是体外细胞培养能否成功的重要因素。该研究发现含15% FBS的培养基最适合斑马鱼性腺细胞的体外培养,而含10% 和20%FBS的的培养基均不适合斑马鱼生殖腺细胞的培养,可能与血清中的某些生长因子的浓度过低和过高,抑制细胞的增殖有关[11]。
该研究还发现斑马鱼性腺细胞体外培养的最适温度为24 ℃,而斑马鱼肝脏细胞系(ZFL)[4]和ZF4细胞系[5]的最适培养温度分别为26和28.5 ℃。这说明鱼类作为变温动物,不同组织来源的细胞的培养条件可能有所差异。
任国诚等[12]在培养漠斑牙鲆胚胎细胞和樊廷俊[13]等在培养褐点石斑鱼细胞时均添加了一定浓度的bFGF,有效促进了细胞的有丝分裂,这是由于bFGF与酪氨酸激酶受体结合后激活了Ras蛋白,从而激活MAP酶级联反应,最终使细胞进入分裂期,引起细胞增殖[14];EGF也能够促进细胞有丝分裂[15]。此外,有研究证实EGF和bFGF能够促进斑马鱼细胞的有丝分裂[16-18]。笔者在培养基中添加了20 ng/mL EGF和20 ng/mL bFGF,发现这2种生长因子也有效促进了斑马鱼性腺细胞的体外培养。该研究结果还表明年幼的斑马鱼的性腺组织细胞的迁出量远远高于年长斑马鱼,这是因为年幼组织的细胞具有较强的增殖能力。因此,试验材料的来源对于斑马鱼性腺组织的原代细胞培养顺利与否也很重要。
总之,该研究所建立的斑马鱼性腺组织原代和传代培养条件,为今后斑马鱼性腺组织细胞系的建立、斑马鱼生殖干细胞的培养、基因功能研究以及环境内分泌干扰物的毒性检测等奠定了良好基础。
参考文献
[1] 李忻林,董洪坪,王婷,等.温度对斑马鱼胚胎发育的影响[J].四川动物,2014(6):829-835.
[2] WESTERFIELD M.The zebrafish book:A guide for the laboratory use of zebrafish (Daniorerio)[M].Eugene,OR:University of Oregon Press,2000.
[3] HOLBECH H,KINNBERG K L,PETERSEN G.Validation report (phase 2) for the fish sexual development test for the detection of endocrine active substances[J].Organisation for economic cooporation and development,2011,142:85.
[4] GHOSH C,ZHOU Y,COLLODI P.Derivation and characterization of a zebrafish liver cell line[J].Cell biology and toxicology,1994,10(3):167-176.
[5] DRIEVER W,RANGINI Z.Characterization of a cell line derived from zebrafish (Brachydaniorerio) embryos[J].In vitro cellular & developmental biology-animal,1993,29(9):749-754.
[6] XING J G,EL-SWEISI W,LEE L,et al.Development of a zebrafish spleen cell line,ZSSJ,and its growth arrest by gamma irradiation and capacity to act as feeder cells[J].In vitro cellular & developmental biology-animal,2009,45(3/4):163-174.
[7] WOLF K,QUIMBEY M C.Established eurythermic line of fish cells in vitro[J].Science,1962,135(3508):1065-1066.
[8] FRYER J L,LANNAN C.Three decades of fish cell culture:A current listing of cell lines derived from fishes [J].Journal of tissue culture methods,1994,16(2):87-94.
[9] LAKRA W,SWAMINATHAN T R,JOY K.Development,characterization,conservation and storage of fish cell lines:A review [J].Fish physiology and biochemistry,2011,37(1):1-20.
[10] 司徒镇强,吴军正.细胞培养[M].2版.西安:世界图书出版公司,2007:58.
[11] FRESHNEY I R.Culture of animal cells,a manual of basic technique[M].Hoboken,NJ:John Wiley and Sons,Inc,2005.
[12] 任国诚, 陈松林,沙珍霞.漠斑牙鲆胚胎细胞系的建立与鉴定[J].中国水产科学,2007,14(4):579-583.
[13] 樊廷俊,魏云波, 徐晓辉,等.褐点石斑鱼三种组织细胞系的建立[J].中国海洋大学学报 (自然科学版),2009,39(5):961-964.
[14] HRZENJAK M,SHAIN S A.Protein kinase C-dependent and independent pathways of signal transduction in prostate cancer cells:Fibroblast growth factor utilization of a protein kinase C-independent pathway[J].Cell growth and differentiation-publication American association for cancer research,1995,6(9):1129-1142.
[15] COHEN S,ELLIOTT G A.The stimulation of epidermal keratinization by a protein isolated from the submaxillary gland of the mouse[J].Journal of investigative dermatology,1963,40(1):1-5.
[16] BOONSTRA J,RIJKEN P,HUMBEL B,et al.The epidermal growth factor[J].Cell biology international,1995,19(5):413-430.
[17] BRADFORD C,SUN L,BARNES D.Basic fibroblast growth factor stimulates proliferation and suppresses melanogenesis in cell cultures derived from early zebrafish embryos[J].Molecular marine biology and biotechnology,1994,3(2):78-86.
[18] HEIMLICH A,BARNES D.Zebrafish embryonal cell culture[J].Methods Cell Biol,1999,59:29-37.
基金项目国家自然科学基金项目(31472274,31172391);海洋经济创新发展区域示范项目(12PYY001SF08);中国海洋大学本科生SRDP项目。
作者简介董丹丹(1991- ),女,山东荷泽人,硕士研究生,研究方向:细胞生物学。*通讯作者,教授,博士,硕士生导师,从事海洋生物分子细胞生物学研究。
收稿日期2016-04-27
中图分类号S 917
文献标识码A
文章编号0517-6611(2016)15-130-05
Development of Primary Cell Culture from the Gonad Tissues of Zebrafish
DONG Dan-dan,SUN Yan-xia,GUO Hua-rong*
(College of Marine Life,Ocean University of China,Qingdao,Shandong 266003 )
Abstract[Objective] To develop a primary cell culture system for the cells from ovary and testis tissues of zebrafish and to obtain the corresponding cell monolayer of both primary culture and subculture.[Method] Primary cell cultures were derived using the explants culture method.The primary cells were sub-cultured by 0.25% trypsin digestion.[Result] The zebrafish gonad-derived cells were cultured in DMEM/F12 (pH 7.0-7.2) at an optimal temperature of 24 ℃.The cells had better growth and survivor when the medium mentioned above was supplemented with 20 ng/mL epidermal growth factor (EGF),20 ng/mL basic fibroblast factor (bFGF),0.5 mmol/L β-mercaptoethanol and 15% fetal bovine serum (FBS).For ovary tissues,epithelium-like cells first migrated from the explants at 3~4 days after seeding.These epithelium-like cells could only survive for about 5 days in vitro,and then tended to apoptosis.However,active migration of fibroblast-like cells and another kind of epithelium-like cells were then observed and a primary cell monolayer with 80% confluence could be formed within 10 days.Then the primary cell monolayer could be successfully sub-cultured once.The epithelium-like cells can’t re-attach and die soon after subculture.However,the re-attached fibroblast-like cells could healthily survive for another 7 days and then tend to apoptosis.No obvious cell division was observed in both the primary and subculture cells.For testis tissues,both epithelium-like cells and fibroblast-like cells migrated from the explants at 5 days after seeding.At 16 days after seeding,a primary cell monolayer with 60% confluence was obtained and then tended to apoptosis.[Conclusion] This study has established a primary cell culture system suitable for the gonad tissues of zebrafish,and the fibroblast-like cell monolayer derived from the ovary tissues has been successfully sub-cultured for one time.
Key wordsZebrafish; Gonad tissue; Primary cell culture; Subculture
