新生儿缺氧缺血脑损伤大鼠模型的制备
2016-07-27曹帅帅李树祎田雨光顾为望
庞 炜,曹帅帅,李树祎,田雨光,顾为望
(1.南方医科大学实验动物中心,广州 510515;2.广州医科大学口腔教研室,广州 510182)
新生儿缺氧缺血脑损伤大鼠模型的制备
庞 炜1,曹帅帅2,李树祎2,田雨光1,顾为望1
(1.南方医科大学实验动物中心,广州 510515;2.广州医科大学口腔教研室,广州 510182)
【摘要】目的 在高原低压环境模拟仓内,模拟新生儿在高原环境下缺氧缺血脑损伤的过程,制备不同海拔高度下高原脑损伤大鼠模型。方法 10日龄的SD新生大鼠32只,随机分为4组,即A组(对照组)和3个实验组:B组(2 000 m组)、C组(4 000 m组)、D组(6 000 m组)。对照组大鼠在屏障环境中饲养,实验组大鼠置于高原低压环境模拟仓结合运动的方法制作新生儿高原脑缺氧缺血模型,运动方式为在舱内游泳槽进行60 min/d的游泳运动,且在高原低压环境模拟仓内生活时间每天不得少于20 h。每组大鼠分别在第3、7、11、15天用Zea Longa 5分制评分标准进行行为学评分并且于第15天采集静脉血,在扫描电镜下观察红细胞形态。每组处死后取脑组织进行HE染色和TTC染色。结果 (1)神经病学评分:实验组B组、C组、D组行为学评分与对照组大鼠相比,行为学评分差异显著(P<0.05),D组与对照组相比差异非常显著(P<0.01)。(2)HE染色结果显示:与对照组大鼠相比,实验组大鼠均有炎症细胞浸润,且炎症细胞浸润程度与海拔高度成正相关。(3)TTC染色表明:在高原环境下大鼠的大脑皮质缺血明显。(4)电镜下观察红细胞形态显示:实验组B组呈帽状结构;C组呈不规则形;D组呈锯齿状。结论 本研究采用高原低压环境模拟仓结合运动模拟高原环境制作新生儿缺氧缺血性脑病(HIE)的模型,该模型稳定、可靠,比其他方法更符合缺血缺氧脑损伤的发病机理,与临床贴近,可用于相关研究。
【关键词】新生儿脑缺氧缺血性脑病;TTC染色;扫描电镜;大鼠
缺氧缺血性脑损伤(hypoxic-ischemic brain damage.HIBD)是因脑组织部分或完全缺氧、脑血流量减少或暂停导致的脑损伤,最终可造成神经细胞的凋亡和坏死。其中一种高发病人群为新生儿,称为新生儿缺氧缺血性脑病 (hypoxic-ischemic encephalopathy,HIE)[1-3]。是指围产期窒息缺氧所引起的脑损伤,严重者可造成永久性神经功能损害,是儿童神经系统损伤的常见原因之一。重度HIE患儿即使存活下来,也常患有脑瘫、智力障碍、癫痫等严重的中枢神经系统后遗症[4,5]。目前临床上对于HIE的治疗主要局限于护理及支持疗法。长期以来,研究和开发有效的治疗HIE药物,是新生儿科医学研究的重要任务。近年来,神经干细胞在胚胎和成年个体神经系统中的发现以及体外培养成功为缺氧缺血性脑病的细胞移植治疗和基因治疗,提供了新的方法[6,7]。在了解这些治疗方案疗效及其作用机制的研究中,HIE动物模型起到了非常重要的作用。在高原地区,大气氧分压较低,由于高原低氧的影响,新生儿缺氧缺血性脑病(HIE)在高原地区发病率比较高[8]。本实验采用高原低压环境模拟仓结合大鼠游泳运动的方法建立在高原地区新生儿缺氧缺血性脑病模型,观察其行为学、脑组织病理变化、脑TTC染色和红细胞,为HIE在高原地区的临床研究做基础实验准备。
1 材料和方法
1.1 材料
1.1.1 实验动物:10日龄的SPF级SD新生大鼠32只,体重为30~50 g,雄性,购自南方医科大学实验动物中心【SCXK(粤)2011-0015】,使用许可证号:【SYXK(粤)2011-0074】,饲养条件为屏障环境,室温(20~26)℃,光照控制12 h(7:00 a.m.~7:00 p.m.),自由采食饮水。
1.1.2 试剂与设备:高原低压环境模拟仓 LT/ ACR-2002(北京易盛泰和科技有限公司);扫描电镜Hitachi型号 S-3400N(日本日立公司);TTC染料(南京奥多福尼生物科技有限公司)
1.2 方法
1.2.1 动物分组:32只10日龄SD大鼠,编号后,随机分成4组,即:对照组(A组)、2 000 m海拔高原组(B组)、4 000 m海拔高原组(C组)和6 000 m海拔高原组(D组),每组8只。对照组(A组)大鼠在屏障环境正常饲养,实验组大鼠在高原低压环境模拟仓生活和运动15 d(温度:(26±2)℃;湿度:45%±5%RH;正常昼夜节律)运动方式为在舱内游泳槽进行60 min/d的游泳运动,大鼠不能以尾部支持底部得到休息,水温为 30℃,水深为鼠尾长1.5倍。实验组大鼠在高原低压环境模拟仓内生活时间每天不得少于20 h(其余时间为换水、加饲料、清洁)[9-11]。
1.2.2 神经病学评分:依次在第3、7、11、15天取出对照组和实验组大鼠,进行Zea Longa 5分制行为学评分,具体评分标准如下:0分,无神经损伤症状;1分,对侧前爪不能完全伸展;2分,行走时向瘫痪侧转圈;3分,走路不稳,向对侧倾倒;4分,不能自发行走,意识丧失[12]。
1.2.3 HE染色:在第15天从对照组和实验组分别取出4只新生鼠,以3%戊巴比妥钠(1.5 mL/kg)腹腔注射麻醉,仰卧位固定于鼠板上,剪开胸腔,暴露出心脏,先用手术剪剪开右心耳,再用1 mL注射器进入左心室插进主动脉,先灌注生理盐水150 mL左右,再灌注10%多聚甲醛400 mL左右,断头取出全脑。置于40 g/L多聚甲醛固定,脱水、透明、浸蜡、包埋、冠状切片,厚4 μm,制作常规病理切片,进行苏木精-伊红染色后用光学显微镜观察。HE染色切片制作流程如下:(1)切片入二甲苯2次,每次20 min,以脱去石蜡;(2)入100%、95%、85%的酒精,每次10~15 min;(3)入苏木精染液染色5min:(4)用自来水洗去多余的染液;(5)入盐酸酒精约10 s分色,至细胞核着色较深,其它结构无色时为宜;(6)自来水缓洗10 min,使苏木精“蓝化”,胞核呈蓝色;(7)入1%伊红染液染色约2 min;(8)用蒸馏水洗去多余的伊红;(9)经浓度递增的酒精脱水;(10)入100%酒精脱水2次,每次约 l0 min;(11)入二甲苯透明2次,每次约15min;(12)擦去载玻片上多余的二甲苯,在切片上滴中性树胶1 ~2滴,加盖玻片封片,干燥环境保存,镜下观察、拍照[13]。
1.2.4 TTC染色:在第15天从A、B、C、D 4组中各取出剩余4只新生大鼠,采用颈椎脱臼发处死,小心快速取出全脑,置-20℃冰箱冷冻20 min,取出用刀片切片,第1刀在脑前极与视交叉连线中点处;第2刀在视交叉部位;第3刀在漏斗柄部位;第4刀在漏斗柄与后叶尾极之间,切成五六片,每隔2 mm切一片。将切片置于1%2,3,5-氯化三苯基四氮唑(TTC)用锡箔纸盖住后,放入37℃水浴锅中避光染色10~30 min,不时翻动脑片,使均匀接触到染色液,染色后进行拍照,观察脑组织[14]:未缺血坏死区颜色呈淡红色,已缺血坏死组织呈白色。
1.2.5 扫描电镜:在第15天取对照组和模拟组共32只大鼠,采静脉血1~2滴直接滴5 mL新鲜配制的质量分数2.5%戊二醛固定液中,轻轻振荡后静置于4℃冰箱中半小时以上,取适量已固定好血样于1.5 mL离心管,低速离心(1 500 r/min)去上清液,0.1 mol/L PBS缓冲液漂洗3次,每次5 min;体积分数50%、70%、80%、90%、100%酒精(2次)脱水,每次都需低速离心(1 500 r/min),最后滴于预先覆有 Formvar膜的洁净盖玻片上,室温自然干燥[15]。3 d后用双面胶带将干燥后的盖玻片粘贴在样品台上,SUPER CT-2000离子溅射仪喷金,Hitachi S-3400N扫描电镜下观察并拍照。
2 结果
2.1 神经病学评分
对照组行为学均正常,在行为学评分中为0分,而实验组大鼠行为学异常,主要表现为一侧肢体感觉和运动功能障碍和平衡功能的异常。实验组大鼠评分随海拔升高而升高,行为异常程度与海拔高度呈正相关。并且实验组大鼠在第3、7、11、15天行为学评分逐渐升高(表1),这一数据表明在高原环境下缺氧时间越长脑损害越严重,实验表明对照组与各实验组差异有显著性意义(P<0.05)海拔6000 m组与对照组比较差异非常显著(P<0.01)(图1)。

图1 不同海拔高度下新生大鼠神经病学评分Fig.1 Neurological scores of the neonatal rats treated by different altitude hypoxia
2.2 脑组织病理学改变
对照组脑组织神经细胞、神经胶质细胞大小、外形正常,未出现脑水肿;在海拔2 000 m大脑皮质轻度萎缩,神经元细胞轻度水肿,胶质细胞轻度增生;在海拔4 000 m大脑皮质中度萎缩,神经元细胞中度水肿,胶质细胞中度增生;在海拔6 000 m室管膜细胞重度水肿(图2)。
2.3 TTC染色结果
TTC(2,3,5-氯化三苯基四氮唑)是脂溶性光敏感复合物,它是呼吸链中吡啶—核苷结构酶系统的质子受体,与正常组织中的脱氢酶反应而呈红色,而缺血组织内脱氢酶活性下降,不能反应,故不会产生变化呈苍白[16]。对照组TTC染色结果为红色,未出现缺血缺氧表现;海拔2 000 m出现轻度改变,大脑皮质出现小片苍白;海拔4 000 m大脑皮质区可明显看见苍白区域;海拔6000 m接近一半出现苍白区(图3)。利用Image-Pro Plus做出海拔2 000 m组脑缺氧面积为26.6%,海拔4 000 m组脑缺氧面积为 34.3%,海拔 6 000 m组脑缺氧面积为56.6%,而对照组则为正常。
2.4 电镜下红细胞
在扫描电镜下可以看见对照组红细胞呈双凹圆盘状,在海拔2 000 m下电镜表现为轻度改变呈帽状结构;在海拔4 000 m下表现为不规则形;在海拔6 000 m下表现为锯齿状,部分红细胞会出现空洞,崩解(图4)。
3 讨论

表1 不同海拔高度下新生大鼠神经病学评分Tab.1 Neurological scores of the neonatal rats treated by different altitude hypoxia

A组为对照组;B组为2 000 m组,胶质细胞轻度增生;C组为4 000 m组,胶质细胞中度增生;D组为6 000 m组,室管膜细胞重度水肿图2 不同海拔下新生大鼠脑病理HE染色切片(×400)Note.A is the control group.B is the 2 000 m group,showing mild hyperplasia of glial cells.C is the 4 000 m group,showing moderate hyperplasia of glial cells.D is the 6 000 m group,showing severe edema of ependymal cells.Fig.2 Histological changes of the neonatal rat brain tissues treated by different altitude hypoxia.HE staining.×400
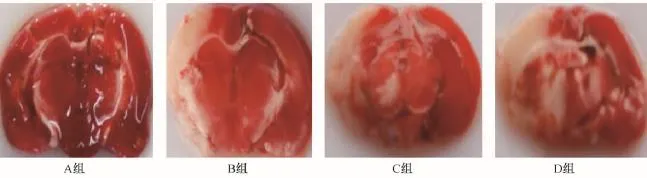
A组为对照组;B组为2 000 m组,大脑皮质出现小片苍白;C组为4 000 m组,大脑皮质苍白区明显;D组为6 000 m组,大脑皮质近一半出现苍白图3 不同海拔下新生大鼠脑切片TTC染色Note.A is the control group.B is the 2 000 m group,showing small pale areas of cerebral cortex.C is the 4 000 m group,showing more distinct pale area of cerebral cortex.D is the 6 000 m group,showing nearly half of the cerebral cortex became pale.Fig.3 Gross appearance of the brains of neonatal rats,treated by different altitude hypoxia.TTC staining

A组为对照组;B组为2 000 m组呈帽状结构;C组为4 000 m组呈不规则形;D组为6 000 m组呈锯齿状图4 不同海拔下新生大鼠电镜下红细胞(×10 000)Note.A is the control group.B is the 2 000 m group,showing cap-like shape.C is the 4 000 m group,showing irregular shape.D is the 6 000 m group showing zigzag shape.Fig.4 Scanning electron microscopic appearance of erythrocytes of the neonatal rats treated by different altitude hypoxia.×10 000
新生儿缺氧缺血性脑病(HIE)是指围产期窒息缺氧所引起的脑损伤,严重者可造成永久性神经功能损害,是儿童神经系统损伤的常见原因之一。重度HIE患儿即使存活下来,也常患有脑瘫、智力障碍、癫痫等严重的中枢神经系统后遗症在临床多见,死亡率高。而在高原地区,大气氧分压较低,由于高原低氧的影响,新生儿缺氧缺血性脑病(HIE)在高原地区发病率比平原地区更高。所以建立高原环境下的缺氧缺血动物模型是了解HIE在高原环境下的发病机制,评估各治疗方法疗效的重要研究基础。本实验在模型制备上不同于近年来常见的缺氧缺血模型制作方法:比如孕鼠腹腔感染、大脑中动脉阻塞、结扎双侧颈动脉等,孕鼠腹腔感染的致死率比较高;大脑中动脉阻塞的方法制作模型虽然更贴近新生儿缺氧缺血临床病因,但是线栓法结扎大脑中动脉操作复杂有难度,不易成功;结扎双侧颈动脉的方法虽然比大脑中动脉阻塞操作简单,但是手术后温度要保证在36℃~37℃,不然术后动物死亡率高。[17]上述三种造模方法会造成损伤,难以量化。本实验采取的是模拟高原情况下缺氧缺血合并运动的模型制作方法,因为这种方法容易操作,可以量化,并且结合游泳运动的方法,模拟人在高原环境中运动下的脑缺氧缺血,更加接近高原环境临床疾病的发生的条件,故选取此方法。
行为学测试结果表明,实验组大鼠评分为明显高于对照组,差异有显著性意义(P<0.05),实验组大鼠评分随海拔升高而升高,行为异常程度与海拔高度呈正相关,并且通过实验组大鼠在第3、7、11、15 d行为学评分可以看出高原环境下缺氧时间越长脑损害越严重。病理结果表明,随着海拔高度从2 000 m、4 000 m到6 000 m上升,脑组织的病理变化逐渐加重,在海拔2 000 m、4 000 m以胶质细胞增生为主,而在6 000 m以室管膜细胞重度水肿为明显改变。TTC染色结果表明在模拟高原环境下新生大鼠在不同海拔高度显示出不同程度的缺血表现,并且随着海拔高度的增高,脑缺血逐渐加重,主要以大脑皮质的缺血为主。扫描电镜的结果表明对照组红细胞的形态为正常双凹圆盘状,实验组在不同海拔高度下缺氧时红细胞的形态有不同程度的改变。以上实验结果均可说明由于在高原环境的缺氧可导致新生大鼠的脑缺氧缺血的形成[18],则造模成功。
在模型制作中,由于在高原环境下海拔2 000 m的高原居民多见,所以2 000 m做为实验组的最低海拔组,在此海拔高度上做出的模型更贴近实际情况。为了让实验有比较与对比,更符合高原环境,实验组还加入了4 000 m组和6 000 m组。而海拔6 000 m以上几乎无人居住,为模型分组的最高极限值,所以以海拔6 000 m组为实验组的海拔最高组,未选入8 000 m组。标准大气压为:1.013×105Pa,等于760 mmHg且每升高12 m,大气压约下降133 Pa。由于在不同海拔高度的高原地区,大气压在低于平原地区的情况下新生儿的健康就成为一个迫切的问题。目前应该对高原地区有神经系统异常表现的新生儿进行头颅超声或者头颅CT的检查,确诊后及时治疗,而非当地居民的孕妇最好在平原地区待产,以确保新生儿的健康。综上所述,本实验建立了比较理想的高原新生儿缺氧缺血脑损伤模型。
参考文献:
[1] 才仁卓玛.高原地区新生儿缺血缺氧性脑病的病历分析[J].中国保健营养,2014,(5):2776.
[2] 吴世政.高原神经医学研究新进展 [J].中华医学信息导报,2014,29(17):19.
[3] 韩玉昆.新生儿缺血缺氧性脑病诊断依据和临床表现[J].中华儿科杂志,l997,35(2):99-100.
[4] Vannucci RC.Hypoxic-ischemic encephalopathy[M].Am J Perinatol.2000,17(3):113-120.
[5] 周丛乐,姜毅,冯琪,等.围产期缺氧性脑损伤患儿神经系统后遗症的早期预测探讨 [J].中华儿科杂志,2000,38:302-305.
[6] 余勤,王艳,连俊兰,等.大鼠骨髓问质干细胞修复缺氧/缺血性脑损伤的研究 [J].中国中西医结合急救杂志,2009,16(1):34-37.
[7] 余勤,李佩佩,周丽萍,等.黄芪联合鞘内移植问充质干细胞对大鼠缺氧缺血性脑损伤修复作用的研究[J].中华中医药学刊,2011,29(7):1455-1458.
[8] 刘彩霞.舒爱兰.神经生长因子联合高压氧治疗高原地区新生儿缺血缺氧性脑病的疗效观察 [J].中国卫生产业,2011,8(7):74-75.
[9] 杨涛,黄庆愿.低压舱内大鼠游泳运动模型的建立 [J].高原医学杂志,2012,22(1):1-4.
[10] Kramer K,Dijkstra H,Bast A,et al.Control of physical exercise of rats in a swimming basin[J].Physiol Behav,1993,53(2):27l-276.
[11] 刘晔,刘桂华,陈珑.模拟海拔2000 m和3000 m高原训练的不同时程对大鼠骨骼肌蛋白质代谢的影响[J].北京体育大学学报,2002,25(2):191-193.
[12] Carter RJ,Morton J,Dunnett SB.Motor coordination and balance in rodents[M].Curr Protoc Neurosci,2001,Chapter 8:Unit 8.12.
[13] 王年丑.余香梅.苏木精-伊红染色法的改进[J].山西医药杂志,2001,30(2):106-107.
[14] 张振强,宋军营,贾亚泉,等.脑缺血合并高脂血症模型大鼠脑组织的病理改变[J].中国组织工程研究,2013,17(33):5981-5987.
[15] 樊小军,陈明霞,刘衍晟,等.红细胞扫描电镜样品的快速制作法[J].电子显微学报,2005,24(4):438.
[16] 王燕,胡慧媛,赵美眯,等.TTC染色评价豚鼠离体心脏缺血/再灌注损伤梗死面积的适宜观察时间及计算方法 [J].中国医科大学学报,2013,42(2):160-164.
[17] 马杰,杨敏,杨建华,等.新生小鼠脑缺氧缺血性脑病模型的制作[J].中华神经外科杂志,2007,23(9):713-715.
[18] 段涛,陈超.新生儿缺血缺氧性脑病(II)[J].中华医学杂志,2005,85(18):1292-1294.
〔修回日期〕2016-02-22
调查与观察
【中图分类号】R-33
【文献标识码】A
【文章编号】1671-7856(2016)06-0061-06
doi:10.3969.j.issn.1671-7856.2016.06.012
[基金项目]高新区发展引导专项(2012B011000004);广东省科技基础条件建设项目(2012B060300003);高新区发展引导专项(2010A011200003);广东省科技基础条件建设项目(2013B030300040);广东省科技基础条件建设项目(2013B060300001);广东省科技基础条件建设项目(2010B060500001);国家国际科技合作专项项目(2011DFA33290)。
[作者简介]庞炜(1989-),女,硕士,南方医科大学,主要从事实验动物的研究。E-mail:1583281060@qq.com。
[通讯作者]田雨光(1987-),男,博士,南方医科大学,主要从事实验动物的研究。邮箱471977663@qq.com;顾为望(1956-),男,教授,博士研究生导师,南方医科大学,主要从事实验动物与比较医学的研究。E-mail:guww100@163.com。environment.Zea Longa 5 point scale standard was used to determine the behavioral scores at the 3 th 7 th 11 th 15 th days,and samples were collected on the 15thday to observe red blood cell morphology using HE and 2,3,5-triphenyltetrazolium chloride(TTC)staining and ultrastructure by scanning electron microscopy.Result (1)The neurological scores of the test groups A,B,C were significantly different from that of the control group(P<0.05),and the scores of test group D and control group were very significantly different(P<0.01).(2)The histopathological examination using HE staining showed inflammatory cell infiltration in all rats of the test groups,and the extent of inflammatory cell infiltration was positively correlated with the increase of altitude.(3)The histopathology with TTC staining revealed prominent ischemia in the cerebral cortex of rats in the plateau hypoxic environment.(4)Scanning electron microscopy showed that the rat erythrocytes were cap-like in the group B,irregular in the group C,and zigzag shape in the group D.Conclusions In this study,a rat model of neonatal hypoxic-ischemic encephalopathy(HIE)is successfully established by hypoxic cabin combined with sport activity.This model is stable,reliable,more closely mimicking the pathogenesis and clinical manifestation of neonatal HIE than models prepared with other methods,therefore,may be used in related research.
Preparation of a rat model of neonatal hypoxic-ischemic encephalopathy
PANG Wei1,CAO Shuai-shuai2,LI Shu-yi2,TIAN Yu-guang1,GU Wei-wang1
(1.Experimental Animal Center,Southern Medical University,Guangzhou 510515,China;2.Department of Stomatology,Guangzhou Medical University,Guangzhou 510182,China)
【Abstract】Objective To simulate the process of hypoxic-ischemic brain injury at high altitude in a simulated cabin with plateau low pressure environment,and to prepare a rat model of cerebral injuries at different high altitudes. Method Thirty-two 0-day-old neonatal SD rats were divided into four groups,namely group A(control group)and three test groups:group B(2000 m group),group C(4000 m group),and group D(6000 m group).The rats of control group were reared in a barrier environment.The rats of test groups were placed in a simulated cabin with plateau low pressure environment,and to prepare neonatal cerebral ischemia-hypoxia model by sport activities.The sport movements were carried out in the cabin in a swimming groove 60 min/d,and not less than 20 hours a day at high altitude low pressure
【Key words】Neonatal hypoxic-ischemic encephalopathy,Hypoxic-ischemic encephalophathy,HIE;2,3,5-triphenyltetrazolium chloride,TTC;Histopathology;Scanning electron microscopy;Rats
