HBV转基因小鼠尿液中乙肝病毒相关指标的分析
2016-07-27刘光泽李秀梅孔祥平顾为望
杨 阳,刘光泽,李秀梅,孔祥平,顾为望
(1.南方医科大学比较医学研究所暨实验动物中心,广州 510515;2.解放军第458医院全军肝病中心,广州 510602)
HBV转基因小鼠尿液中乙肝病毒相关指标的分析
杨 阳1,2,刘光泽2,李秀梅2,孔祥平2,顾为望1
(1.南方医科大学比较医学研究所暨实验动物中心,广州 510515;2.解放军第458医院全军肝病中心,广州 510602)
【摘要】目的 检测分析HBV转基因小鼠尿液中HBV相关指标表达情况,进一步认识转基因小鼠的生物学特性;并通过多种实验方法确定尿液中HBV相关指标的组织来源。方法 使用酶联免疫吸附法(ELISA)和荧光定量PCR(real-time PCR)检测转基因小鼠尿液中HBV相关指标;并通过水动力转染的小鼠实验、RNA干扰方法抑制HBV表达转基因鼠实验、乙肝患者HBV阳性血清感染正常小鼠实验等多种实验方法确定其复制表达组织来源。结果 HBV转基因小鼠尿液中存在HBsAg、HBeAg、及HBV-DNA表达,其中HBsAg的表达水平较高(6674± 619.8 IU/mL),但低于血清中HBsAg的表达水平(16470±2704 IU/mL),尿液HBsAg雄性小鼠的表达水平高于雌性小鼠;而尿液HBeAg表达水平较低,且尿液中HBeAg的阳性率高于血液,HBeAg的表达水平个体间和性别间有明显差异;尿液中存在HBV-DNA含量达到103~105copy/mL;未检测到相关抗体表达。通过水动力转染等实验表明转基因鼠尿液中的HBV相关指标来源于肾脏的复制表达,而不是由肝脏分泌进入血液循环以尿液排出,肾脏是HBV独立的表达场所。结论 转基因小鼠尿液中存在HBV相关指标的表达,并随月龄长期表达,其中HBsAg及HBV-DNA表达水平较高且比较稳定,雄性小鼠尿液HBsAg的滴度高于雌性小鼠;HBeAg雄性鼠表达水平相对雌性鼠较高且比较稳定;尿液中无各类抗体表达;肾脏也是HBV独立的复制表达场所。
【关键词】肝炎病毒,乙型;转基因小鼠;模型,动物;尿液;生物学特性
目前转基因小鼠在乙型肝炎的研究中得到了广泛地应用,综合国内外相关文献表明[1-5],HBV转基因小鼠体内表达的组织特异性及与病毒元件和细胞内转录活性子的相互作用有关。此外,其它还有许多因素影响转录,包括激素、组织特异性转录子及各种修饰细胞在转录及转录后水平相互作用均影响转基因表达。转基因小鼠出生前就能在内源性HBV启动子的控制下,主要在肝脏内持续转基因表达。康爱君等[6]观察血清HBsAg为阳性的15只小鼠,肝组织有HBsAg的存在,且HBsAg的分布呈胞质型,但不存在于脾、肺、心等组织中。Burk RD也有报道只有在肝和肾有 HBV基因表达[7]。Chisari实验室[8]和我们实验室建立1.3拷贝全基因HBV转基因鼠模型[9],只有在肝和肾组织有HBsAg/HBcAg表达,免疫组化阳性,但对肾组织进行HBV基因表达特性及与肝、外周血乙肝病毒指标关系等缺少相关研究报道。本实验室的HBV转基因小鼠,已广泛应用于HBV的复制、表达及小型实验动物中的免疫发病机制研究,同时也是筛选和评价抗HBV药物理想工具[9,10]。对该转基因小鼠进行更深入生物学特性研究时,我们发现转基因小鼠的尿液也有HBV相关指标的表达复制,为此展开了对转基因小鼠泌尿系统的研究。本研究对进一步深入了解HBV转基因小鼠的生物学特性有重要意义,丰富了转基因小鼠生物学特性研究的内容,为1.3copyD基因型HBV转基因小鼠实际应用于临床前药物评价时提供更多的理论依据,而且目前国内外未见相关方面的研究报道。
1 材料和方法
1.1 实验动物
SPF级血清HBsAg检测阳性的1.3copyD基因型HBV转基因小鼠【SCXK(军)2012-0018】,由本科研室提供。
SPF级C57BL/6小鼠12只(18~20)g,均为雄性鼠【SCXK(粤)2013-0002】,BAL B/c小鼠6只(18~20)g,雌雄各半【SCXK(粤)2013-0002】购于广东省实验动物中心,分别用于1.3.2水动力转染的小鼠实验和1.3.4乙肝患者HBV阳性血清感染正常小鼠实验。
SPF级 1.3copyD基因型 HBV转基因小鼠(HBsAg测定值吸光度相近)10只(18~20)g,均为雄性,用于1.3.3 RNA干扰方法抑制HBV表达转基因鼠实验。
以上实验动物均饲养于解放458医院实验动物中心SPF饲养设施【SYXK(军)2012-0059】。动物自由进食进水,室内温度:(23~25)℃,相对湿度:(55±10)%。维持12 h光照/12 h黑暗的昼夜节奏。购买的实验小鼠适应环境1周进行实验。
1.2 实验试剂
HBsAg、HBeAg、抗HBeAg、抗HBsAg、抗HBcAgELISA检测试剂盒购自上海科华生物公司,HBsAg、HBcAg免疫组化试剂盒购自福州迈新生物技术开发有限公司,Omega组织DNA抽提试剂盒购自广州飞扬生物工程有限公司。
目的质粒PCDNA3.1(+)-1.3 HBVC,由302医院徐东平教授惠赠。目的质粒 pU6-siHBVll (HBV特异性的shRNA表达载体),由本科研室提供。乙肝患者HBV阳性血清,于本院采集。
1.3 动物实验
1.3.1 转基因小鼠尿液、血清ELISA酶联检测及HBV-DNA定量检测:用玻璃采血管通过眼眶后静脉丛采血,5 000 r/min离心10 min。将分离血清收集于0.5 mL无菌EP管内,置于-20℃冻存。行按压膀胱法采集尿液,5 000 r/min离心5 min,置于4℃保存(尿液 4℃存放时间不超过 48 h)。按ELISA试剂盒说明分别进行 HBsAg、HBeAg、抗HBeAg、抗HBsAg、抗HBcAg检测(其中HBsAg血清和尿液样本取原液和1/5 000稀释两种),并进行结果判定。
取保存的尿液和血清样本进行real-time PCR检测HBV-DNA的表达。
1.3.2 水动力转染的小鼠实验:取实验C57BL/6小鼠随机分为实验组(10只)和对照组(2只),将目的质粒PCDNA3.1(+)-1.3HBVC溶于生理盐水中,生理盐水的体积为小鼠体重的10%,通过水动力转染方法初步建立HBV转染C57BL/6小鼠模型[11-17]。在注射结束后7 d采集实验小鼠血清和尿液进行 HBsAg、HBeAg、HBV-DNA检测,方法同前。
1.3.3 RNA干扰方法[18-22]抑制HBV表达转基因鼠实验:取实验1.3copyD基因型HBV转基因小鼠随机分为实验组和对照组(各5只),将目的质粒pU6-siHBVll溶于生理盐水中,生理盐水的体积为小鼠体重的10%,采用水动力转染方法进行质粒注射[11-17]。在注射结束后5 d采集实验小鼠血清和尿液进行HBsAg检测(样本进行1/1 600稀释),方法同前。
1.3.4 乙肝患者HBV阳性血清感染正常小鼠实验:取实验BAL B/c小鼠经尾静脉注射人HBV阳性血清[11-17]。在注射结束后2 d采集实验小鼠血清和尿液进行HBsAg、HBeAg、HBV-DNA定量检测,由本院检验中心完成。
1.3.5 转基因小鼠肾脏、膀胱免疫组化特性及病理观察:断颈处死血清HBsAg阳性的转基因小鼠8只(雌性4只,雄性4只)和正常小鼠2只(雌性1只,雄性1只)取肾脏、膀胱。以10% 中性甲醛固定48 h,石蜡包埋,常规切片,脱蜡,HE染色,二甲苯透明,中性树胶封片,光镜下观察。按免疫组化试剂盒操作说明检测转基因小鼠肾脏、膀胱中HBsAg、HBcAg的表达情况。
1.3.6 转基因小鼠肾脏、肝脏 HBV-DNA定量检测:断颈处死血清HBsAg阳性的转基因小鼠26只取肾脏、肝脏。按组织DNA抽提试剂盒操作说明进行肝脏、肾脏组织DNA提取,并进行real-time PCR检测HBV-DNA,分析肾脏和肝脏HBV-DNA的阳性率及复制水平。
1.4 统计学方法
2 结果
2.1 HBV相关指标检测结果
ELISA检测结果显示转基因小鼠尿液中可检测到HBsAg、HBeAg,以血清HBsAg阳性为基数尿液HBsAg阳性率达100%、HBeAg达66.99%,未检测到相关抗体(HBsAb、HBeAb、HBcAb);血液中可检测到HBcAb,且阳性率达100%。Real-time PCR结果显示尿液和血液中存在HBV-DNA的复制,拷贝数可达103~105(表1)。
2.2 转基因小鼠尿液中HBsAg滴度特点
对血清HBsAg阳性的转基因小鼠120只(雌性60只,雄性60只)尿样进行ELISA分析,样本做1/ 5 000稀释,检测尿液和血清中HBsAg的阳性率的关系及表达水平的高低。结果发现,尿液和血清中HBsAg的阳性率均为100%,但血清比尿液滴度高(表1),具有统计学意义(P<0.001),且主要由于雌鼠尿液HBsAg滴度过低导致(图1)。雌性转基因鼠尿液HBsAg滴度低于血液,具有统计学意义(P <0.0001),雄性转基因鼠尿液与血液滴度相当(图1),不具有统计学意义(P>0.05)。尿液雄性小鼠比雌性小鼠滴度高(图1),具有统计学意义(P<0.0001),血清雄性小鼠比雌性小鼠滴度略高(图1),但不具有统计学意义(P>0.05)。这表明,转基因小鼠尿液中HBsAg的含量与性别有关,雄性高于雌性。
2.3 转基因小鼠尿液中HBeAg表达特点
2.3.1 转基因小鼠尿液中HBeAg阳性率及与性别关系:对血清HBsAg阳性的转基因小鼠541只(雌性291只,雄性250只)进行ELISA分析检测尿液和血清中HBeAg的阳性率及与性别关系。结果发现,尿液 HBeAg阳性率为 66.99%,血清为9.17%。雌鼠尿液和血清阳性率分别为48.17%、8.66%,雄鼠尿液和血清阳性率分别为87.84%、9.8%。(表2)统计学分析表明,尿液和血液阳性率的差别具有统计学意义(P<0.001);雌性小鼠和雄性小鼠血清HBeAg阳性率的差别不具有统计学意义(P>0.05);但雌性小鼠和雄性小鼠尿液HBeAg阳性率的差别具有统计学意义(P<0.0001)。
2.3.2 转基因小鼠尿液中HBeAg表达滴度水平及性别的影响:对尿液HBeAg阳性的转基因小鼠209只(雌性79只,雄性130只)进行A值比较分析,结果发现雄性小鼠比雌性小鼠滴度高(图2),具有统计学意义(P<0.0001)。这表明,转基因小鼠血清中HBeAg的含量与性别有关,雄性鼠HBeAg滴度高于雌性鼠,且可长期稳定表达,随月龄变化滴度水平变化不显著。
2.4 转基因小鼠尿液中HBV-DNA的复制水平
对血清HBsAg阳性的转基因小鼠30只进行real-time PCR检测分析尿液和血清中HBV-DNA的阳性率及复制水平。结果发现,HBV-DNA阳性率尿液和血清阳均为100%,拷贝数达103~105。统计学分析表明,转基因小鼠尿液和血清HBV-DNA复制水平的差别不具有统计学意义(P>0.05)。
为确定HBV转基因鼠尿液中乙肝病毒指标组织来源,我们又进一步进行了下面项目的实验研究。
2.5 水动力转染HBV的小鼠实验结果
对所有实验小鼠进行ELISA分析和real-time PCR检测,结果发现对照组小鼠血清、尿液未检测到HBsAg、HBeAg和HBV-DNA。实验组的小鼠尿液中未检测到HBsAg、HBeAg和HBV-DNA,而血清中则有检测到,且处于高水平。表明HBV质粒经水动力可以转染到正常鼠肝细胞内进行复制表达,并且相关蛋白可以释放进入血液,但血液中的HBV相关指标正常情况下不能通过肾小球滤过进入尿液中。
2.6 RNA干扰方法抑制HBV表达转基因鼠实验结果
对所有实验转基因小鼠于实验前和试验后5 d进行ELISA分析检测血清和尿液HBsAg的表达情况,结果发现,RNAi组血清HBsAg的表达水平变化明显,HBsAg平均A值同对照组相比大幅降低(图3),具有统计学意义(P<0.0001);但尿液中RNAi组和对照组HBsAg的滴度没有明显改变,差别不具有统计学意义(P>0.05)(图3)。表明 RNAi在hydrodynamic肝脏靶向性的作用下能够抑制转基因小鼠肝细胞内HBV的表达,进而影响血液中HBV相关指标的滴度,但影响不了转基因鼠尿液中HBV相关指标的滴度。这表明HBV转基因鼠血液中HBV相关指标的显著变化并没有影响其尿液中HBV相关指标。
2.7 乙肝患者HBV阳性血清感染正常小鼠实验结果

表1 HBV相关指标检测结果Tab.1 Detection of HBV-related indexes in the blood and urine

表2 转基因小鼠血液和尿样中HBeAg阳性率比较Tab.2 Comparison of HBeAg positive rates in the blood and urine of transgenic mice
对所有实验小鼠进行ELISA分析和 real-time PCR检测,结果发现尾静脉注射人HBV阳性血清的小鼠尿液中未检测到HBsAg、HBeAg和HBV-DNA,而血清中则有检测到,且处于较高水平。表明血液中的HBV相关指标不能通过肾小球滤过进入尿液中,进一步表明HBV转基因鼠血液和尿液中HBV相关指标来源于两个独立的复制表达体系。

A:雌性鼠尿液和血清中HBsAg滴度,B:雄性鼠尿液和血清中HBsAg滴度,C:雌雄性转基因小鼠尿液HBsAg表达水平,D:雌雄性转基因小鼠血清HBsAg表达水平图1 转基因小鼠尿液和血清中HBsAg的阳性率和滴度水平比较(均以1/5 000稀释样本)Figure A shows HBsAg titer in urine and serum of female mice;Figure B shows HBsAg titer in urine and serum of male mice;Fig.C shows HBsAg expression level in the urine of female transgenic mice;Fig.D shows HBsAg expression level in the serum of female transgenic mice.Fig.1 Comparison of HBsAg positive rate and titer level in the urine and serum of transgenic mice(1/5 000 diluted samples)

A:不同性别转基因小鼠尿液HBeAg,B:不同性别转基因小鼠尿液HBeAg滴度随月龄的变化。图2 转基因小鼠尿液中HBeAg阳性A值与各月龄HBeAg阳性结果A值Figure A shows the urine HBeAg in the male and female transgenic mice;Figure B shows changes along with age in month of urine HBeAg titer in the male and female transgenic mice.Fig.2 HBeAg positive A value in the urine of transgenic mice at each age in months.

(A:对照组和RNAi组血清HBsAg的A值,B:对照组和RNAi组尿液HBsAg的A值)图3 对照组和RNAi组血清和尿液HBsAg中的A值比较(均以1/1 600稀释样本)Figure A shows HBsAg A values in the urine of control and RNAi groups.Figure B shows HBsAg A values in the urine of control and RNAi groups.Fig.3 Comparison of A values of HBsAg in the serum and urine between control group and RNAi group(1/5 000 diluted samples).
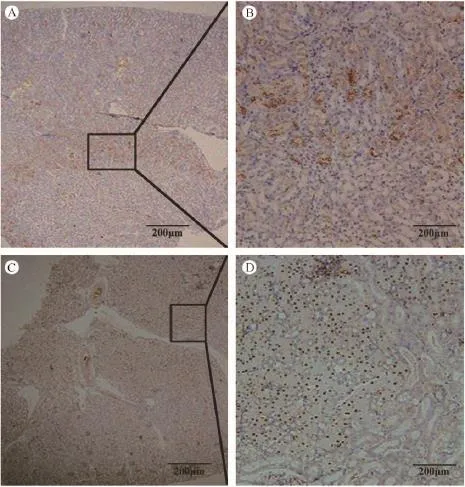
A、B:肾脏HBsAg免疫组化,C、D;肾脏HBcAg免疫组化图4 转基因小鼠肾脏HBsAg、HBcAg免疫组化A,B:Kidney,HBsAg staining.C,D:Kidney,HBcAg staining.Fig.4 The expression of HBsAg and HBcAg in kidney tissues of the transgenic mice.Immunohistochemical staining.
2.8 转基因小鼠肾脏、膀胱组织HE染色及免疫组化结果
血清HBsAg阳性的转基因小鼠和正常小鼠进行肾脏、膀胱组织经HE染色后,在显微镜下观察,发现其肾脏和膀胱组织的形态、结构无明显的病理改变。转基因小鼠肾脏、膀胱组织HBsAg、HBcAg免疫组化检测结果显示肾脏有HBsAg、HBcAg的表达(图4),其中HBsAg的以胞浆型为主分布于靠近肾髓质区的肾皮质区;HBcAg多呈核型分布于肾脏髓质区。膀胱中均未检测到 HBsAg、HBcAg的表达。
2.9 转基因小鼠肾脏中HBV-DNA的复制表达水平
血清HBsAg阳性的转基因小鼠肾脏、肝脏组织HBV-DNA定量PCR检测结果发现,HBV-DNA阳性率尿液和血清阳均为100%,拷贝数达105~107。统计学分析表明,转基因小鼠肾脏和肝脏组织HBV-DNA复制水平的差别不具有统计学意义(P>0.05)。
3 讨论
本研究对该转基因小鼠尿液中HBV相关指标进行了检测分析,发现转基因小鼠尿液中存在HBsAg、HBeAg、及 HBV-DNA,未检测到 HBsAb、HBeAb、HBcAb的存在。其中HBsAg的表达水平较高,血清中HBsAg的表达水平高于尿液中HBsAg的表达水平,尿液HBsAg雄性小鼠的表达水平高于雌性小鼠;而血液HBeAg表达水平低与尿液且尿液中HBeAg的阳性率高于血液,HBeAg的表达水平个体间和性别间有明显差异,雄性小鼠HBeAg的表达水平高于雌性小鼠;尿液中存在HBV-DNA含量达到103~105copy/mL。转基因小鼠年尿液中 HBsAg、HBeAg的含量与性别有关,雄性高于雌性,主要是由于HBV基因的表达受到雌激素和雄激素的共同作用,雌激素能抑制 HBV转录和 HBV-DNA复制[23]。A1omg等[24]发现,雌激素能抑制雄性鼠HBV-DNA的表达,还能抑制HBsAg的合成,补充雌激素可抑制雄性鼠HBeAg的产生,对雌性鼠HBVDNA表达的作用甚微。
肾小球滤过膜具有一定的“有选择性”的通透性,分子半径小于14 nm通过滤过膜不受限制;半径大于20 nm滤过则受到一定限制,半径大42 nm则不能通过。而且滤过膜所带电荷对其通透性有很大影响,带负电荷的分子不易通过。HBsAg的分子大于42 nm且带负电荷,因此不能通过肾小球滤出;HBeAg及其所形成的复合物分子小于14 nm但因其是带负电荷,所以也不能够通过肾小球滤出[25]。本研究通过不同实验方法表明血液中HBV相关指标不能通过肾小球的滤过进入尿液,尿液中HBV相关指标的表达情况不受血液变化的影响,肾脏是HBV的独立的表达复制场所。
本研究使用正常小鼠通过水动力转染方法建立HBV急性转染模型,使目的质粒在肝脏获得高水平的复制表达,分泌HBV相关指标入血,在造模小鼠尿液中未检测到HBsAg、HBeAg和HBV-DNA,而血清中能检测到,且处于高水平表达,表明血液中的HBV相关指标正常情况下不能通过肾小球滤过进入尿液中。接着,选取HBV转基因小鼠采用水动力转染方法将肝脏作为靶器官,使shRNA表达质粒被肝细胞摄取从而对HBV转基因小鼠HBV产生抑制作用,导致血清中HBsAg减少,而不影响尿液中HBsAg,反过来表明血液中HBV相关指标的表达对尿液中的没有影响。最后,我们进行了乙肝患者HBV阳性血清感染正常小鼠实验,也进一步表明血液中的HBV相关指标不能通过肾小球滤过进入尿液中。上述实验结果表明,血液和尿液中HBV相关指标来源于两个独立的复制表达体系。
而且HBV并非严格的嗜肝病毒,目前已有研究证实HBV可以在包括肾脏在内的多种肝外组织复制[26]。在对本研究HBV转基因小鼠前期的生物学特性研究中也表明乙肝病毒基因在HBV转基因小鼠肾脏具有较高水平转录[9]。同时,HBV转基因小鼠的肾组织形态、结构无明显的病理改变,表明转基因小鼠尿液中的出现HBV相关指标并非由于肾脏病变所致;肾组织检测到 HBsAg、HBcAg (HBsAg的以胞浆型为主分布于靠近肾髓质区的肾皮质区,HBcAg多呈核型分布于肾脏髓质区)表明肾脏本身存在HBV相关指标的复制表达,这进一步加深我们对乙型肝炎病毒的认识。
参考文献:
[1] Schweizer J,Valenza-Schaerly P,Goret F,et al.Control of expression and methylation of a hepatitis B virus transgene by strain-specific modifiers[J].DNA Cell Biol.1998,17(5):427-435.
[2] Farza H,Salmon AM,Hadchouel M,et al.Hepatitis B surface antigen geneexpressionisregulatedbysexsteroidsand glucocorticoids in transgenic mice[J].Proc Natl Acad Sci U S A.1987,84(5):1187-1191.
[3] Aragona E,Burk RD,Ott M,et al.Cell type-specific mechanisms regulate hepatitis B virus transgene expression in liver and other organs[J].J Pathol.1996,180(4):441 -449.
[4] Davis HL,Brazolot Millan CL.DNA-based immunization against hepatitis B virus[J].Springer Semin Immunopathol.1997,19 (2):195-209.
[5] 康爱君,董宇红,田枫,等.乙型肝炎病毒转基因小鼠病理学观察[J].中国实验动物学杂志,2002,12(1):8-10.
[6] Burk RD,DeLoia JA,Elawady MK,et al.Tissue preferential expression of the hepatitis B virus(HBV)surface antigen gene in two lines of HBV transgenic mice[J].J Virol.1988,62(2):649-654.
[7] Guidotti LG,Matzke B,Schaller H,et al.High-level hepatitis B virus replication in transgenic mice[J].J Virol.1995,69:6158-6169.
[8] 刘光泽,熊一力,王洪敏,等.近交系高表达HBV转基因小鼠建立及表达传代稳定性 [J].中国兽医学报,2003,23 (6):580-582.
[9] 刘光泽.复制型HBV转基因小鼠的建立、生物学特性、应用及无免疫耐受研究[D].第一军医大学,2007,5.
[10] 孔祥平,刘光泽,易雪瑞.复制型HBV转基因小鼠的建立与应用[J].解放军医学杂志,2011,36(9):954-957.
[11] Liu F,Song Y,Liu D.Hydrodynamics-based transfection in animals by systemic administration of plasmid DNA[J].Gene Ther,1999,6:1258-1266.
[12] 刘恩岐,尹海林,顾为望.医学实验动物学 [M].北京:科学出版社,2008:201-201.
[13] Chisari FV,Pinkert CA,Milich DR,et al.A transgenic mouse model of the chronic hepatitis B surface antigen carrier state[J]. Science,1985,230:1157-11601.
[14] Zhang G,Budker V,Wolff JA.High levels of foreign gene expression in hepatocytes after tail vein injections of naked plasmid DNA[J].Hum Gene Ther,1999,10:735-1737.
[15] 田粉梅,付秋霞,詹林盛.水动力转染技术及其在肝炎病毒实验动物模型研究中的应用[J].军事医学科学院院刊,2008,29(1):91-93.
[16] Sawyer GJ,Rela M,Davenport M,et al.Hydrodynamic gene delivery to the liver;theoretical and practical issues for clinical application[J].Curr Gene Ther,2009,9:128-135.
[17] Bonamassa B,Hai L,Liu D.Hydrodynamic gene delivery and its applications in pharmaceutical research[J].Pharm Res,2011,28:694-701.
[18] 周勇.水动力转染在IFNβ-Luc小鼠模型与HBV树鼩模型研究中的应用[D].解放军军事医学科学院,2011,5.
[19] Kemphues KJ,Guo S.par-1,a gene required for establishing polarity in C.elegans embryos,encodes a putative Ser/Thr kinase that is asymmetrically distributed[J].Cell,1995,81 (4):611-620.
[20] Uprichard SL.The therapeutic potential of RNA interference [J].FEBS Letters,2005,579(26):5996-6007.
[21] 张学智,山长亮,叶丽虹,等.RNA干扰在抗乙肝治疗中的应用及其研究进展[J].生物化学与生物物理进展,2008,35(6):631-636.
[22] 吕娜,武芳,刘素霞.RNA干扰抗乙肝病毒的研究进展[J].河北化工,2013,36(2):35-38.
[23] 朱明明.雌激素代谢相关基因CYP17,COMT多态性与乙型肝炎病毒感染后肝硬化、肝细胞癌的关系 [D].山东大学,2008,5.
[24] Jilma B,EichlerHG,Koppl C,et al.Effects of testosterone on serum levels of hepatitis B surface antigen and HBV-DNA in men [J].Liver,1998,18(3):162-165.
[25] 陈立章.乙型肝炎病毒在肾脏、腮腺、卵巢组织中的存在及其意义[D].中南大学,2004,5.
[26] Chen LB,Chen PL,Wang GL,et al.Ultrastructural study on extrahepatic infection of duck hepatitis B virus in ducks[J]. Chin Med J,1992,105(3):212-216.
〔修回日期〕2016-03-28
【中图分类号】R-33
【文献标识码】A
【文章编号】1671-7856(2016)06-0053-08
doi:10.3969.j.issn.1671-7856.2016.06.011
[基金项目]国家科技重大专项课题—艾滋病和病毒性肝炎等重大传染病防治—HBV细胞和动物模型的建立和应用(课题编号:2012ZX10004503010).
[作者简介]杨阳(1987-),女,硕士,实验动物技术研究。E-mail:yangya726@qq.com。
[通讯作者]顾为望(1656-),男,教授,研究方向:从事比较医学研究。E-mail:guww@163.com;刘光泽(1962-),男,主任技师,研究方向:疾病基因工程动物模型的制备和应用研究,E-mail:lgze68@163.com。lower than that in the serum(16470±2704 IU/mL).The level of HBsAg expression in the urine of male mice was higher than that in female mice.The level of HBeAg expression in the urine was lower and the HBeAg positive rate of urine was higher than that of blood,and the levels of HBeAg expression showed significant inter-individual and inter-sexual differences.HBV-DNA level reached 103-105copy/mL in the urine,but no related antibody expression was detected.The experiments such as hydrodynamic infection test indicated that the HBV-related indexes in the urine are derived from replication in the kidneys rather than secreted from the liver,entered into the blood circulation,and discharged from the urine.The kidneys are an independent expression site of HBV.Conclusions The expression of HBV-related indexes is present in the urine of transgenic mice and it is a long-term expression along with the age in months,of which the expression levels of HBsAg and HBV-DNA are rather high and stable.HBsAg titer in the urine of the male mice is higher than that of female mice.HBeAg expression level in the male mice is more stable compared with that in female mice.No expressions of various kinds of antibodies have been found in the urine.The kidneys are an independent expression site of HBV.
Analysis of hepatitis B virus-related indexes in the urine of HBV transgenic mice
YANG Yang1,2,LIU Guang-ze1,LI Xiu-mei2,KONG Xiang-ping2,GU Wei-wang1
(1.Institute of Comparative Medicine&Center of Experimental Animals,Southern Medical University,Guangzhou 510515,China;2.Liver Disease Center of PLA,No.458 Hospital of PLA,Guangzhou 510602)
【Abstract】Objective To detect and analyze the HBV-related indexes in the urine of HBV transgenic mice and further understand the biological characteristics of transgenic mice,and to clarify the tissue sources of HBV-related indexes.Methods HBV-related indexes in the urine of transgenic mice were tested using enzyme-linked immune sorbent assay(ELISA)and fluorescence quantitative PCR(real-time RCR).The tissue sources were confirmed by several experiments,i.e.hydrodynamic transfection of mice,RNA interference to inhibit HBV-expression in the transgenic mice,and to infect normal mice with HBV-positive serum from patients.Results Expression of HBsAg,HBeAg and HBV-DNA was present in the urine of transgenic mice,of which the HBsAg expression level was high(6674±619.8 IU/mL),but
【Key words】Hepatitis B virus;Transgenic mice;Model,animal;Urine;Biological indexes
