游离SIVmac239病毒与T细胞介导两种方式感染内皮细胞的效果比较
2016-07-27黄丹,丛喆,徐珮,薛婧,魏强
黄 丹,丛 喆,徐 珮,薛 婧,魏 强
(北京协和医学院比较医学中心,中国医学科学院医学实验动物研究所,卫生部人类疾病比较医学重点实验室,国家中医药管理局人类疾病动物模型三级实验室,北京 100021)
研究报告
游离SIVmac239病毒与T细胞介导两种方式感染内皮细胞的效果比较
黄 丹,丛 喆,徐 珮,薛 婧,魏 强
(北京协和医学院比较医学中心,中国医学科学院医学实验动物研究所,卫生部人类疾病比较医学重点实验室,国家中医药管理局人类疾病动物模型三级实验室,北京 100021)
【摘要】目的 比较游离病毒感染与T细胞介导的感染方式对SIV感染内皮细胞的影响,探索SIVmac239感染内皮细胞的主要途径,从而为SIV入侵血脑屏障的机制提供理论基础。方法 采用游离SIV病毒直接感染内皮细胞和SIV感染的CEMx174细胞与内皮细胞共培养的两种方式,通过巢式PCR、间接免疫荧光法、Western blotting以及ELISA检测内皮细胞的感染程度。结果 两种感染方式都能在内皮细胞内检测到前病毒DNA,感染细胞与内皮细胞共培养时,内皮细胞内前病毒DNA含量,SIV P27蛋白表达量和细胞培养上清液中P27含量远高于游离病毒直接感染的方式。结论 细胞介导的感染方式相较于游离病毒直接感染方式对内皮细胞的感染能力更强,可能是SIV病毒入侵血脑屏障的主要途径。
【关键词】SIV;艾滋病脑病;内皮细胞;P27
艾滋病是由人类免疫缺陷病毒(HIV)感染引起的获得性免疫缺陷综合症。病毒进入人体后,除攻击CD4+T细胞造成其耗竭外还伴随有严重的神经侵袭性。HIV入侵中枢神经系统(CNS)导致的认知障碍、行为和运动缺陷称为艾滋病相关的神经认知紊乱(HAND)[1-4]。HIV在感染早期即可穿透血脑屏障(BBB),侵入CNS,但具体的作用机制尚不明确。目前存在几个假说,其中比较公认的是病毒直接侵入假说、单核-巨噬细胞侵入假说、T细胞诱导假说和液相入胞假说[5]。简单来说,即病毒以游离病毒的形式或以感染病毒的细胞为载体,藉由内皮细胞或细胞间紧密连接处进入并感染中枢神经系统。迄今为止,还没有研究对各种假说进行比较,从而阐明HIV/SIV入侵CNS的主要途径。本研究通过比较游离病毒与T细胞介导的感染方式对SIV感染内皮细胞的影响,以期初步验证SIV入侵血脑屏障的主要途径。
1 材料和方法
1.1 材料
猴视网膜脉络丛内皮细胞RF/6A细胞株购自中国科学院上海生科院细胞;人急性淋巴细胞白血病T、B杂交细胞CEMx174细胞株由中国医学科学院医学实验动物研究所保藏;PVDF膜购自美国Millipore公司;Western blotting化学发光试剂盒购自Santa Cruz公司;BCATMProtein Assay Kit购自美国Pierce公司;蛋白预染 marker购自美国NEB公司;甲叉双丙烯酰氨和丙烯酰胺(acrylamide)购自美国BioRad公司;β-巯基乙醇购自美国Biotech公司;辣根酶标记山羊抗小鼠IgG购自北京中杉金桥公司;DNA Blood Mini Kit购自Qiangen公司;小鼠抗SIV P27单克隆抗体由医科院动物所制备;山羊抗小鼠FITC购自中杉金桥公司;SIV P27 ELISA试剂盒购自Life Science公司。
1.2 方法
1.2.1 细胞培养:RF/6A细胞系为贴壁细胞,生长速度较慢。在含10%胎牛血清的1640完全培养基中培养,当细胞长到80% ~90%时,用胰酶消化进行传代。1∶3分瓶置于37℃、5%CO2孵箱中培养。CEMx174细胞为悬浮细胞,生长速度较快。在含10%胎牛血清的1640完全培养基中培养,当细胞浓度较大时进行1∶5传代培养置于37℃、5%CO2孵箱中培养。
1.2.2 不同方式感染RF/6A细胞:将1 mL含5× 104TCID50/mLSIVmac239病毒加到 T25瓶中感染CEMx174细胞,待CEMx174细胞出现细胞病变产生融合泡时,取细胞离心 5 min,将 1 mL 1×107TCID50/mL病毒液和1 mL 1×105个/mL感染细胞分别加入到含RF/6A细胞的6孔板,添加培养基使得终体积为4 mL。2 d后弃上清液和CEMx174细胞,并用无菌PBS漂洗两遍,再加入新鲜的1640维持培养基,培养至感染后7 d,每天收集上清液,7 d收细胞备用。
1.2.3 前病毒检测:
1.2.3.1 感染细胞DNA的提取:收取感染的内皮细胞5×106个,用PBS漂洗两次后用200 μL PBS重悬。加入20 μL蛋白酶k。将200 μL样品加入离心管中,适度混匀。参照DNA Blood Mini Kit操作步骤提取细胞中的 DNA[6]。用100 μL预热至56℃的洗脱液洗脱样品。取5 μL样品用紫外分光光度计检测提取核酸的质量。
1.2.3.2 巢氏PCR扩增病毒gag片段[6]:使用巢式PCR的方法特异性扩增病毒gag基因,扩增片段大小为477 bp。
1.2.3.3 PCR扩增感染细胞的β-actin片段:提取感染细胞的DNA用于PCR反应,特异性扩增感染细胞的β-actin基因。引物由英潍捷基(上海)贸易有限公司合成。β-actin基因的上游引物 5′-CTCCATCCTGGCCTCGCTGT-3′,下 游 引 物5′-GCTGTCACCTTCACCGTTCC-3′,扩增片段长度268 bp,退火温度61℃,每个样品三次重复。
1.2.4 间接免疫荧光法检测内皮细胞内SIVP27的表达:CEMx174感染SIVmac239发生细胞病变后离心,取500 μL 1×107TCID50/mL毒液和500 μL 1× 105个/mL的感染细胞加入含RF/6A细胞爬片的24孔板中。添加培养基使终体积为2 mL,于37℃、5%CO2孵箱中培养。感染2 d后,移除培养基并弃除CEMx174细胞。加入2 mL新鲜的1640培养基培养,每两天换液1次。7 d收细胞爬片,4%多聚甲醛室温固定20 min,吹干备用。
0.1%Triton X-100通透爬片5 min,5%FBS室温封闭30 min,加入小鼠抗P27单克隆抗体100 μL (1∶20)37℃孵育30 min。PBS漂洗后,滴加山羊抗小鼠抗体-FITC(1∶200),37℃孵育30 min。漂洗后,DAPI封片即可在荧光镜下观察结果[7]。
1.2.5 Western blotting检测RF/6A细胞中P27蛋白表达:RIPA蛋白裂解液提取不同感染方式内皮细胞的总蛋白,BCA法测蛋白浓度。取30 μg总蛋白上样,10%SDS-PAGE凝胶电泳,电转移至PVDF膜上,5%脱脂奶粉的TBST封闭,选择一抗为小鼠抗SIV P27单克隆抗体(1∶2 000),二抗为HRP-羊抗小鼠抗 体 (1∶15 000),内 参 选 用HRP-β-actin (1∶15 000)进行ECL发光,凝胶成像分析系统扫描分析。
1.2.6 ELISA试剂盒检测上清中P27蛋白表达:将两种感染方式不同感染天数的上清1∶100稀释后,200 μL稀释液加入20 μL裂解液,与板子孵育具体步骤参照ELISA检测SIV P27盒子说明书[8]。
2 结果
2.1 巢式 PCR检测 SIV感染内皮细胞前病毒DNA水平
SIV感染的CEMx174细胞,做为阳性对照,PCR级水作为阴性对照。PCR产物电泳后,在500 bp、250 bp左右出现清晰条带,与内参β-actin(268 bp)以及前病毒DNA gag477大小相符。在内参β-actin条带灰度大致相当时,SIV直接感染内皮细胞的3个复孔中只有2号泳道出现较浅的大小正确的目的条带,1号泳道和3号泳道均未检出。与SIV感染的CEMx174共培养的内皮细胞三个复孔均在500 bp左右出现目的条带,5号泳道目的片段的亮度较6、7号泳道更强,均与阳性对照的条带位置相同(图1)。
2.2 间接免疫荧光法检测SIV感染内皮细胞中SIV P27蛋白的表达
SIV病毒直接感染内皮细胞,其细胞核内和胞浆内均无绿色荧光(图2A-C),SIV感染的CEMx174细胞与内皮细胞共培养,内皮细胞细胞核外、胞浆内有明显的点状绿色荧光,绿色荧光蛋白的位置为病毒蛋白P27所在位置(图2D-I)。
2.3 Western blotting检测内皮细胞内SIV P27分子的表达
阳性对照为SIV感染的CEMx174细胞,阴性对照为未感染的RF/6A细胞。在1-4泳道内参βactin蛋白条带灰度大致相同的情况下,与感染的CEMx174共培养的RF/6A中,WB检测到与目的蛋白大小相同的特异性蛋白P27的条带,且与阳性对照条带位置相同。而在游离SIV直接感染的内皮细胞总蛋白中没有检出该目的条带(图3)。

注:M:DNA Marker DL2000;1-3:游离SIV病毒直接感染的内皮细胞;4-6:与SIV感染的CEMx174细胞共培养的内皮细胞;8-9:ddH20作为阴性对照图1 巢式PCR检测SIV感染内皮细胞前病毒DNA水平Note.M:DL 2000 DNA marker;1-3:Endothelial cells infected with SIV;4-6:Endothelial cells co-cultured with SIV-infected CEMx174 cells;7:CEMx174 cells infected with SIV as positive control;8-9:Sterile ddH2O as negative control.Fig.1 The results of nested-PCR for detecting proviral DNA levels of SIV-infected endothelial cells
2.4 ELISA方法检测不同感染方式上清中 SIV P27含量变化情况
感染2 d时,无论是SIV直接感染还是与SIV感染的CEMx174细胞共培养的内皮细胞培养上清中P27含量基本相同,都达到20 000 pg/mL以上。2 d弃上清液和感染细胞,用PBS漂洗后两种感染方式培养基残留的病毒含量相当,但随着感染天数的增加,与CEMx174共培养的内皮细胞培养上清液中SIV P27含量增加迅速,到感染7 d上清液中的SIV P27含量达到4 240.9 pg/mL,约为漂洗后病毒含量(1 115.6 pg/mL)的4倍,而游离SIV直接感染内皮细胞的上清中SIV P27的含量变化不明显,仅由漂洗后的1 064.7 pg/mL增至1 563.1pg/mL(图4)。
3 讨论
艾滋病脑病的形成与HIV/SIV病毒进入脑组织密切相关。病毒入侵BBB进入脑实质,使脑内细胞感染,继而产生大量病毒及病毒蛋白,以及多种细胞参与释放的细胞因子(如TNF-a等),引起神经毒效应,最终导致艾滋病脑病的发生[9]。针对HIV/ SIV入侵血脑屏障的分子机制的假说有4种,其中游离病毒直接感染和细胞介导的感染方式最为人接受,那么在这两者中哪个又为HIV/SIV感染内皮细胞的最主要方式呢?

注:A-C:游离SIV病毒直接感染的内皮细胞(×100);D-F:与SIV感染的CEMx174细胞共培养的内皮细胞(×100);G-I:与SIV感染的CEMx174细胞共培养的内皮细胞(×200)图2 两种感染方式内皮细胞内病毒SIV P27的检测(标尺=100 μm)Note.A-C:Endothelial cells infected with SIV(×100);D-F:Endothelial cells co-cultured with SIV infected CEMx174 cells(×100);G-I:Endothelial cells co-cultured with SIV infected CEMx174 cells(×200)Fig.2 IFA showing expression of SIV P27 in SIV-infected endothelial cells
巢式PCR的结果显示,游离病毒直接感染方式只有少量病毒能够吸附并进入内皮细胞内,同时进入细胞的病毒RNA可逆转录为DNA整合于内皮细胞的基因组内。而IFA和Western blotting均不能检出该感染方式的内皮细胞中SIV P27蛋白,说明少量病毒虽进入了内皮细胞但感染复制水平较低,没有产生足够多的病毒P27蛋白。这与培养上清中病毒SIV P27含量增长一直较低的结果一致。进一步说明游离病毒对RF/6A细胞的感染水平较低,这种低水平的感染、复制产生的少量病毒蛋白用WB和IFA的实验方法检测不到。SIV直接感染内皮细胞的感染水平较低,主要由于内皮细胞表面缺乏CD4受体。有一些研究显示HIV对CD4-细胞的感染复制受限的原因是感染时进入细胞效率极低,初始感染的细胞不到1%[10,11]。这与我们发现的低水平感染结果一致。
既然游离SIV直接感染内皮细胞感染能力较低,那么T细胞介导的感染方式是否能造成高水平感染呢?我们使用感染SIV的 CEMx174细胞与RF/6A共培养,利用巢式PCR的方法,三个复孔中均检出内皮细胞基因组 DNA中的前病毒分子gag477。WB和IFA结果也均显示,内皮细胞内可以检测到P27蛋白,对比游离病毒直接感染的方式,T细胞介导的感染方式可以明显促进病毒进入并整合于内皮细胞基因组的效率,产生病毒SIV P27蛋白,并大幅提高感染复制的水平。收集不同感染天数的细胞上清,ELISA的结果提示,游离病毒直接感染方式0 d和1 d上清中的病毒含量都高于细胞共培养的感染方式,由于病毒在CEMx174细胞中的高效复制,感染2 d时两种感染方式的病毒含量基本相同,即总体上在游离病毒直接感染方式比T细胞介导的感染方式病毒含量高的情况下,T细胞介导的感染方式培养上清中病毒SIV P27蛋白显著增加,约为初始病毒蛋白含量的四倍。然而,游离病毒直接感染的方式上清中病毒蛋白含量并没有明显增加。Sato H[12]等人也发现,细胞与细胞之间的直接接触可以促进病毒在胞间的转移,这种转移导致的感染比游离病毒颗粒直接感染效率更高。
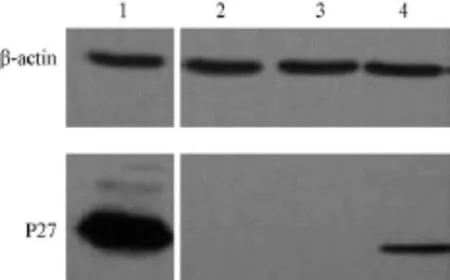
注:1:SIV感染的CEMx174细胞,作为阳性对照;2:未感染的内皮细胞,作为阴性对照;3:游离SIV病毒直接感染的内皮细胞;4:与SIV感染的CEMx174细胞共培养的内皮细胞图3 两种感染方式内皮细胞胞浆内SIV P27蛋白的检测Note:1:CEMx174 cells infected with SIV as positive control;2:Uninfected endothelial cells as negative control;3:Endothelial cells infected with free SIV;4:Endothelial cells co-cultured with SIV-infected CEMx174 cells.Fig.3 Western blot analysis showing expression of SIV P27 in the endothelial cells infected by both ways
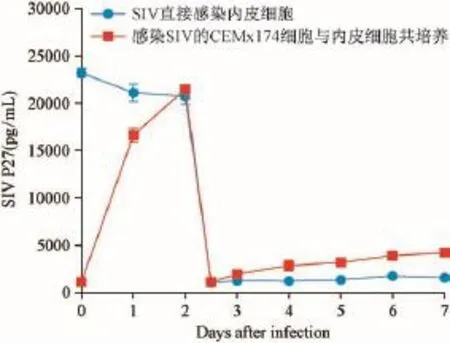
图4 上清液中SIV P27蛋白含量的检测Fig.4 The protein expression of SIV P27 in the supernatant of SIV-infected endothelial cells,detected by ELISA.
综上所述,游离病毒直接感染内皮细胞效率很低。这种低水平的感染,显然不能带来大面积的血脑屏障破坏,导致大量病毒和感染的淋巴细胞[13]、巨噬细胞[14]进入脑中,引发严重的脑部神经病变。T细胞介导的感染方式较之对内皮细胞的感染效率更高,感染能力更强。所以这两种感染方式的不同结果提示我们,在艾滋病脑病形成过程中,游离病毒通过直接感染构成血脑屏障的主要成分—内皮细胞进入脑实质,这一现象虽然存在,但是进入的效率极低,并不是主要的病毒入脑途径。血液中大量的感染细胞(单核巨噬细胞、T细胞等)与内皮细胞接触,可能促进内皮细胞的感染,从而导致血脑屏障的破坏,使得大量病毒和感染细胞入脑。也就是说在艾滋病脑病的形成中,病毒入侵血脑屏障的主要方式并不是血液中游离病毒对内皮细胞的直接感染,而是血液中感染的细胞起到了关键作用。也有一些研究中发现,感染的单核细胞或T细胞与未感染的T细胞接触,可以通过病毒学突触这一结构,将病毒直接转移至未感染的T细胞内[15-18]。但是感染T细胞与内皮细胞的接触,是否也能形成病毒学突触进而促进病毒在胞间高效转移,导致艾滋病脑病的高发病率,还没有确凿证据,需要进一步的研究探讨。
参考文献:
[1] Ances BM,Ellis RJ.Dementia and neurocognitive disorders due to HIV-1 infection[J].Semin Neurol,2007,27(1):86-92.
[2] Valcour V,Chalermchai T,Sailasuta N,et al.Central nervous system viral invasion and inflammation during acute HIV infection [J].J Infect Dis,2012,206(2):275-282.
[3] Mattson MP,Haughey NJ,Nath A,et al.Cell death in HIV dementia[J].Cell Death Differ,2005,12(1):893-904.
[4] Anders KH,Guerra WF,Tomiyasu U,et al.The neuropathology of AIDS[J].Am J Pathol,1986,124(3):537-558.
[5] 黄丹,丛喆,魏强,等.HIV/SIV入侵血脑屏障的分子机制探讨[J].中国比较医学杂志,2015,25(11):84-88.
[6] 丛喆,涂新明,蒋虹,等.PCR技术在猴免疫缺陷病毒SIV感染模型中的应用[J].中国实验动物学报,2005,13(2):84-87.
[7] 孙敏,涂新明,魏强,等.SIV P27单克隆抗体的制备和鉴定[J].中国比较医学杂志,2006,16(1):27-33.
[8] 金光,王卫,丛喆,等.HIV-1 P24和SIV P27两种ELISA试剂盒检测 SIV P27抗原的比较[J].中国比较医学杂志,2011,21(2):26-30.
[9] Levy JA著,邵一鸣译.艾滋病病毒与艾滋病的发病机制[M].北京:科学出版社,2010:183-196.
[10] Brack Werner R,Kleinschmidt A,Ludvigsen A.Infection of human brain cells by HIV-1:restricted virus production in chronically infected human glial cell lines[J].AIDS,1992,6 (3):273-285.
[11] Mellert W,Kleinschmidt A,Schmidt J.Infection of human fibroblasts and osteoblast-like cells with HIV-1[J].AIDS,1990,4(6):527-535.
[12] Sato H,Orenstein J,Dimitrov D,et al.Cell-to-cell spread of HIV-1 occurs within minutes and may not involve the participation of virus particles[J].Virology,1992,186(2):712-724.
[13] Weidenheim KM,Epshteyn I,Lyman WD.Immunocytochemical identification of T-cells in HIV-1 encephalitis:implications for pathogenesis of CNS disease[J].Mod Pathogens,1993,6(2):167-174.
[14] 刘克剑,丛喆,金光,等.表现神经症状的SIVmac251感染猴大脑基底节病毒gp120序列变异分析 [J].中国实验动物学报,2006,14(4):271-275.
[15] Hübner W,McNerney GP,Chen P,et al.Quantitative 3D video microscopy of HIV transfer across T cell virological synapses[J]. Science,2009,323(5922):1743-1747.
[16] Alvarez RA,Barría MI,Chen BK.Unique features of HIV-1 spread through T cell virological synapses[J].PLoS Pathogens,2014,10(12):e1004513..
[17] Dale BM,McNerney GP,Thompson DL,et al.Cell-to-cell transfer of HIV-1 via virological synapses leads to endosomal virion maturation that activates viral membrane fusion[J].Cell Host Microbe,2011,10(6):551-562.
[18] Durham ND,Yewdall AW,Chen P,et al.Neutralization resistance of virological synapse-mediated HIV-1 infection is regulated by the gp41 cytoplasmic tail[J].Virology,2012,86 (14):7484-7495.
〔修回日期〕2016-03-28
【中图分类号】R-33
【文献标识码】A
【文章编号】1671-7856(2016)06-0001-05
doi:10.3969.j.issn.1671-7856.2016.06.001
[基金项目]国家十二五科技重大专项课题(2012ZX10004-501-001和2013ZX10004-608-003)。
[作者简介]黄丹(1991-),女,硕士研究生,专业:比较医学,从事实验动物病毒学研究工作。
[通讯作者]魏强(1964-),男,研究员,博士生导师,研究方向:实验动物病毒学。E-mail:weiqiang0430@cnilas.org。virus.Conclusions The way of T cell-mediated infection substantially enhances the capacity of SIV infection of endothelial cells than the direct infection by cell-free virus.It indicates that the T cell-mediated infection may serve as the principal route of SIV disruption of the blood-brain barrier.
Comparison of the SIV infection in endothelial cells by SIVmac239 directly or mediated by T cells
HUANG Dan,CONG Zhe,XU Pei,XUE Jing,WEI Qiang
(Comparative Medicine Center,Peking Union Medical College(PUMC)&Institute of Medical Laboratory Animal Science,Chinese Academy of Medical Sciences(CAMS);Key Laboratory of Human Disease Comparative Medicine,Ministry of Health;Key Laboratory of Human Diseases Animal Models,State administration of Traditional Chinese Medicine,Beijing 100021,China)
【Abstract】Objective To compare the effects of two approaches of SIVmac239 infection in endothelial cells,directly by cell-free virus or by T cell-mediated infection,to explore the predominant approach of SIVmac239 infection in endothelial cells,and finally lay a theoretical foundation of the molecular mechanism of SIV viral disruption of the bloodbrain barrier.Methods We adopted two distinct ways to infect endothelial cells.One was to directly infect the endothelial cells by cell-free virus,another was by co-culture of infected CEMx174 cells with the endothelial cells.The degree of infection in the endothelial cells was evaluated by nested-PCR,indirect immunofluorescence assay,Western blotting and ELISA assays.Results The provirus DNA was found in the endothelial cells infected in either way. However,the endothelial cells infected by co-culture with CEMx174 cells had a significantly higher amount of provirus DNA and higher expression of SIV P27 in the cells and in the supernatant than those in the ECs directly infected by cell-free
【Key words】Simian immunodeficiency virus;AIDS encephalopathy;Endothelial cells;P27
