microRNA-31转基因小鼠脊髓损伤模型对胃肠动力障碍的修复作用
2016-07-26王德君高渊涛李鹏飞王春芳山西医科大学第一临床医学院山西太原0000南昌大学玛丽女王学院江西南昌00山西医科大学实验动物中心山西太原0000
王德君 闫 军▲ 高渊涛 李鹏飞 王春芳.山西医科大学第一临床医学院,山西太原 0000;.南昌大学玛丽女王学院,江西南昌 00;.山西医科大学实验动物中心,山西太原 0000
microRNA-31转基因小鼠脊髓损伤模型对胃肠动力障碍的修复作用
王德君1闫军1▲高渊涛2李鹏飞3王春芳3
1.山西医科大学第一临床医学院,山西太原030001;2.南昌大学玛丽女王学院,江西南昌330031;3.山西医科大学实验动物中心,山西太原030001
[摘要]目的探讨microRNA-31对脊髓损伤后胃肠动力因素的作用。方法将36只microRNA-31转基因小鼠和36只FVB小鼠分别设为对照组和模型组,用Impactor M-Ⅲ脊髓撞击器建立小鼠脊髓损伤模型。用BBB运动功能评分评估小鼠下肢的恢复情况。HE染色观察脊髓组织的变化。用Real-time PCR法检测生长抑素受体(SSTR2)mRNA的表达,用免疫荧光法检测一氧化氮合酶(iNOS)蛋白和SSTR2蛋白的表达。结果 造模后第3天、第7天和第14天,脊髓组织破坏、坏死、空泡形成,胶原纤维明显增加。造模后第14天,FVB模型组与对照组比较,SSTR2 mRNA的表达明显升高(P<0.05),iNOS蛋白和SSTR2蛋白的表达量明显升高;microRNA-31转基因小鼠模型组与对照组比较,SSTR2 mRNA的表达明显升高(P<0.05),iNOS蛋白和SSTR2蛋白的表达量明显升高;microRNA-31转基因小鼠模型组与FVB模型组比较,SSTR2 mRNA的表达明显降低(P<0.05),iNOS蛋白和SSTR2蛋白的表达量明显降低。结论 脊髓损伤后胃肠动力障碍的发生可能与SSTR2 mRNA的表达上调、SSTR2蛋白和iNOS蛋白的表达增高有关。高表达的microRNA-31可能与脊髓损伤后胃肠动力障碍的恢复有关。
[关键词]脊髓损伤;胃肠动力因素;microRNA-31转基因小鼠;生长抑素受体(SSTR2);一氧化氮合酶(iNOS)
▲通讯作者
外科手术,尤其是腹部手术导致的胃肠道结构和功能的改变,对胃肠动力影响很大,术后常发生不同程度的胃肠动力障碍。胃肠动力障碍大多与胃肠功能蠕动减弱有关,而在调节胃肠运动中,胃肠激素是重要介质[1]。脊髓损伤后胃肠动力障碍与microRNA的调控作用相关,microRNA作为具有调控功能的内源性非编码RNA,在体内广泛参与新陈代谢、细胞分化、细胞凋亡等过程[2-4]。已有文献报道,microRNA-31对脊髓损伤有修复作用[5],在此基础上,本实验进一步研究microRNA-31转基因小鼠脊髓损伤后胃肠动力的变化,目前,国内外尚未见到microRNA-31在脊髓损伤后胃肠动力方面的研究,本文通过研究miRNA-31对胃肠激素生长抑素和一氧化氮合酶的影响,探讨其对胃肠动力障碍的作用。以期为手术创伤后microRNA-31对胃肠动力障碍具有调控作用,为临床上治疗术后胃肠动力障碍提供更好的帮助。
1 材料与方法
1.1实验动物
FVB小鼠(由山西医科大学实验动物中心提供),36只,体重25~30 g,雌雄不限,许可证号为:[SCXK(晋)2015-0001]。microRNA-31转基因小鼠(由山西医科大学实验动物中心提供),36只,体重25~30 g,雌雄不限,许可证号[SCXK(晋)2015-0001]。小鼠级别:清洁级。
1.2试剂
RNA提取试剂(LifeTechnologies),逆转录(Takara),荧光定量PCR试剂(Life Technologies),SSTR2兔抗鼠一抗(北京博奥森),iNOS兔抗鼠一抗(北京博奥森),Cy3标记的羊抗兔二抗(北京博奥森),引物(Takara),HE染色试剂盒(北京索莱宝),DEPC(Sigma)。
1.3方法
1.3.1动物分组及处理 各取36只FVB小鼠和36只microRNA-31 FVB小鼠,分为A、B两组,A组为转基因小鼠,B组为FVB小鼠,每组随机抽取21只作为造模组,剩下的作为对照组。对A、B两组需要造模的小鼠用10%的水合氯醛腹腔注射进行麻醉,麻妥后,背部朝上固定小鼠,根据浮肋连接的是第13胸椎进行定位,常规消毒,用剪刀在小鼠背部正中剪开1.5 cm左右的纵向切口,逐层分离直至暴露棘突,再用剪刀小心剔除T10~T13的椎板,暴露脊髓,用Impactor-3撞击器对准T10~T13的中间进行垂直打击,高度为25 cm,重量为5 g。打击后,小鼠出现尾部痉挛摇摆,双下肢瘫痪,表明造模成功。
1.3.2小鼠运动学评分分别取造模成功的FVB和miRNA-31FVB小鼠各6只,对造模前和造模后第1天、第3天、第7天和第14天的FVB和miRNA-31FVB小鼠采用Basso,Beattie&Bresnahan Locomotor rating scale(BBB)[6]运动功能评分法对其进行后肢运动功能的评分。将小鼠放在宽阔平坦的地方活动,每日6点左右进行双盲评分,并记录评分结果。
1.3.3小鼠脊髓HE染色 分别取3只FVB小鼠、3只miRNA-31 FVB小鼠以及造模后第3天、第7天和第14天的FVB和miRNA-31FVB小鼠各3只,解剖小鼠并取下T10~T13节段脊髓,放入4%的多聚甲醛中固定24 h。常规组织脱水、石蜡包埋,7 μm组织切片,HE染色,镜下观察。
1.3.4免疫荧光检测iNOS和SSTR2蛋白 分别取6只FVB小鼠、6只miRNA-31 FVB小鼠以及造模后第14天的FVB和miRNA-31FVB小鼠各6只。解剖小鼠并取出胃窦及结肠组织各1 cm,放入4%的多聚甲醛固定24 h。常规组织脱水、石蜡包埋,7 μm组织切片,组织脱蜡,微波炉热修复,7%的山羊血清封闭,滴加一抗,4℃过夜,滴加二抗,Hochest复染,抗荧光衰减封片剂封片,荧光显微镜下观察。
1.3.5RT-qPCR检测SSTR2 mRNA分别取6只FVB小鼠、6只miRNA-31 FVB小鼠以及造模后第14天的FVB和miRNA-31FVB小鼠各6只。分别处死,取出结肠组织,Trizol法提取总RNA,作为模板使用逆转录试剂盒进行逆转录,获得cDNA。分别对目的基因和β-actin进行实时定量PCR检测。
SSTR2上游引物5‘TGAGCATCGACCGCTACCT 3‘,下游引物5'CAAAATGACGAGCAGAGACACAC 3‘。β-actin上游引物为5‘CATCCGTAAAGACCTCTATGCCAAC 3‘,下游引物为5‘ATGGAGCCACCGATCCACA 3‘。Real-time PCR反应条件:50℃2 min,95℃10 min,95℃15 sec,60℃1 min,循环40次,95℃15 sec,60℃1 min,95℃15 sec,60℃15 sec。
1.4统计学方法
应用SPSS16.0统计学软件完成统计,计量资料以均数±标准差(±s)表示,多组间计量资料比较先采用单因素方差分析,方差齐时,组间比较采用t检验。α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1BBB运动功能评分
小鼠在术前的评分均为21分,无差异;在7 d和14 d,microRNA-31模型组评分明显高于FVB模型组(P<0.05)。microRNA-31组与FVB组每组各6只小鼠,其中在第1天时,microRNA-31模型组与FVB模型组比较,两组差异无统计学意义(P>0.05),3 d时,两组差异无统计学意义(t=1.81,P>0.05),7 d时,microRNA-31模型组与FVB模型组比较,差异有统计学意义(t=5.48,P<0.05),14 d时,microRNA-31模型组与FVB模型组比较,差异有统计学意义(t=5.89,P<0.05);microRNA-31模型组,3 d、7 d和14 d三个时间点之间比较,差异有统计学意义(F=902.6,P<0.05);第7天与第3天比较,差异有统计学意义(t= 24.0,P<0.05),第14天与第7天比较,差异有统计学意义(t=20.80,P<0.05);FVB模型组,3 d、7 d和14 d三个时间点之间比较,差异有统计学意义(F=777.6,P<0.05),第7天与第3天比较,差异有统计学意义(t=25.70,P<0.05),第14天与第7天比较,差异有统计学意义(t=17.14,P<0.05),见表1。
2.2脊髓打击前后组织形态学改变
正常组脊髓组织结构完整,神经细胞形态正常,分布均匀,尼氏体清晰,细胞膜、细胞核及组织间隙均正常,脊髓损伤后,组织出血、疏松水肿、细胞空泡变性、部分细胞细胞核固缩、神经纤维溶解、消失,胶原纤维增多伴淀粉样变性,灰质增生侵入白质。见图1。
2.3免疫荧光检测
从免疫荧光检测结果可以看出,正常组胃窦组织iNOS和结肠组织SSTR2的阳性细胞数比较少,脊髓损伤后14 d时,胃窦组织iNOS和结肠组织SSTR2的阳性细胞数明显增多,同时可以看出,microRNA-31转基因小鼠与FVB小鼠比较,FVB小鼠的阳性细胞数量比microRNA-31转基因小鼠的阳性细胞数量相对较多。见封三图1。
2.4RT-qPCR检测SSTR2 mRNA
RT-qPCR检测SSTR2 mRNA的表达量,第3组与第1组比较,差异有统计学意义(P<0.05),脊髓损伤后SSTR2 mRNA的表达明显增加;第4组与第2组比较,差异有统计学意义(P<0.05),脊髓损伤后SSTR2 mRNA的表达明显增加;第2组与第1组比较,差异无统计学意义(P>0.05),两个对照组之间无差异;第3组与第4组比较,差异有统计学意义(P<0.05),microRNA-31转基因小鼠SSTR2 mRNA的增加量明显低于FVB小鼠。见图2。
表1 不同时间点各组BBB评分比较(±s,分)

表1 不同时间点各组BBB评分比较(±s,分)
组别 样本数(只)microRNA-31模型组FVB模型组术前评分 术后评分1 d 3 d 7 d 14 d 66 21.00±0.00 21.00±0.00 0.00±0.00 0.00±0.00 0.52±0.02 0.50±0.02 5.80±0.53 4.10±0.35 10.00±0.30 7.70±0.37
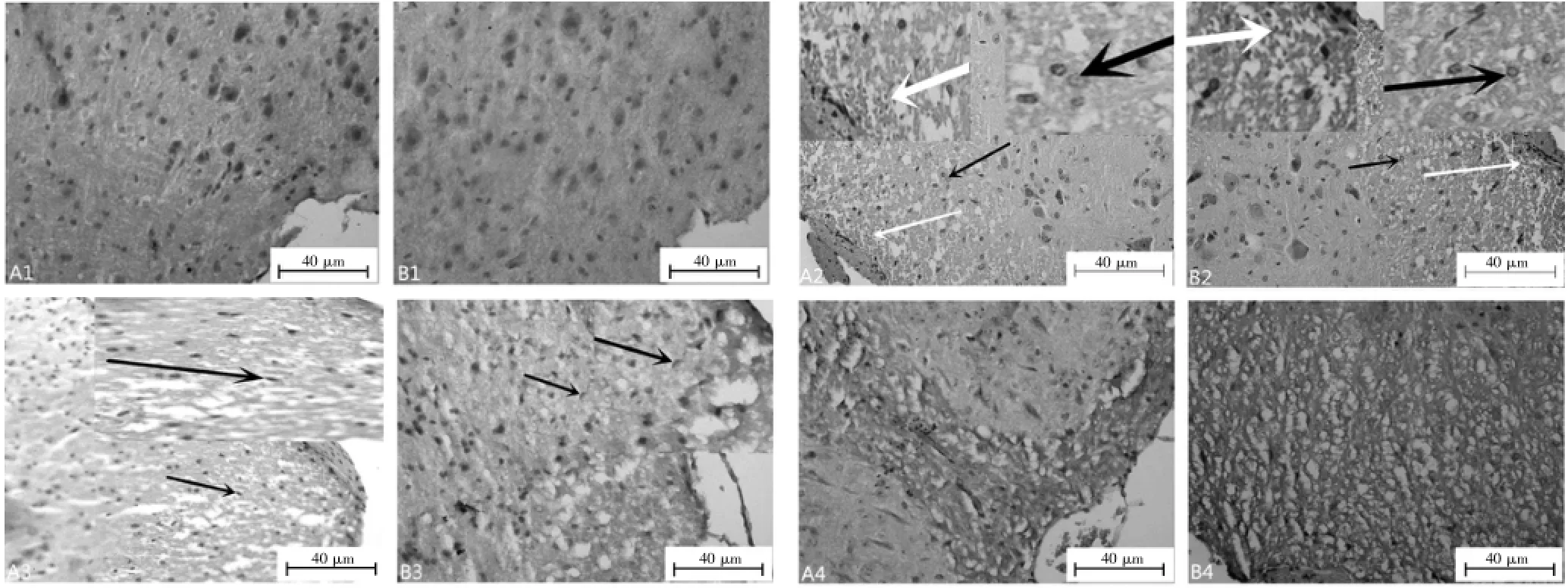
图1 脊髓T10~T13节段横断面各时间点击打处HE染色
3 讨论
microRNA具有基因转录后的负性调节作用,抑制多种蛋白的表达,通过上调和下调microRNA的表达,可以对胃肠动力产生调节作用,新近研究发现,microRNA可以调控胃肠平滑肌细胞合成干细胞因子[7]。有研究[8,9]发现,通过调节相应microRNA的表达,可以影响肠平滑肌及上皮组织的完整性,表明不同microRNA参与调控了消化道黏膜上皮细胞及平滑肌细胞的增生、分化及成熟。近年研究证明,microRNA在炎症反应时骨髓肥大细胞的分化、增殖和功能上起重要作用,调节肠易激综合征的免疫应答过程[10]。目前,microRNA-31对胃肠动力有关的下游基因的调控还未见报道。
小鼠脊髓损伤后,BBB评分由0分逐渐增大,组织学观察损伤初期脊髓组织出现出血、坏死、水肿,符合临床脊髓损伤的病理变化。说明脊髓损伤的模型已成功建立。胃肠运动信息系统由信号分子如胃肠肽、信号接收系统如胃肠肽受体、细胞内信号转导系统共同组成。信号分子如有抑制作用的生长抑素异常,可导致胃肠动力障碍[11]。结肠SSTR2的表达较高,尤其是肌细胞和黏膜上皮细胞[12]。一氧化氮合酶是一氧化氮合成过程中的唯一限速酶,在胃肠道分布广泛,与消化道的生理调控和发病机制关系密切。
有实验发现[13],脊髓损伤后小鼠组织中的生长抑素和一氧化氮合酶均增高,它们均可以调节脊髓损伤后的胃肠运动。本实验结果表明,与对照组比较,模型组结肠组织SSTR2 mRNA明显增高(P<0.05),胃窦组织iNOS和结肠组织SSTR2蛋白表达量明显增高。由此可见,SSTR2基因表达异常以及iNOS和SSTR2蛋白表达异常可能参与了脊髓损伤后胃肠动力障碍的发生。microRNA-31转基因小鼠模型组与FVB模型组比较,SSTR2 mRNA的表达明显降低(P<0.05),iNOS蛋白和SSTR2蛋白的表达量明显降低,由此可以推断出,高表达的microRNA-31对iNOS和SSTR2具有抑制作用,可以促进胃肠动力障碍的恢复。
生长抑素是一种广泛分布的抑制性脑肠肽,可抑制胃固体排空和胃张力性收缩[14],另外生长抑素可参与调节胃肠蠕动,其作用机制包括:①通过D细胞旁分泌效应直接抑制大多数肌间丛神经元的冲动发放,在神经和神经元连接处释放引起肠运动抑制;②通过神经内分泌作用直接抑制胃肠道的运动;③通过抑制乙酰胆碱作用和抑制胃肠道激素起间接作用[15]。胃肠运动是受兴奋性和抑制性神经双重支配,当两者失衡时,就会发生病理生理紊乱。NO是其中一种重要的抑制性递质,当其含量发生改变时,就会打破这种平衡使胃肠动力紊乱。NOS作为NO合成的唯一限速酶,在生理状态下iNOS分布于胃窦肌层的平滑肌细胞的胞浆内,在病理状态下,胃肠内的细胞可由诱导因子作用产生iNOS的表达。由于NOS与胃肠动力障碍的发生机理密切相关,NOS的改变会影响胃肠的运动功能,所以选择了神经递质NOS。从结果中可以推断出,高表达量的microRNA-31通过抑制生长抑素和一氧化氮合酶的表达,促进了神经元对肠运动冲动的发放,促进了胃张力性收缩,维持了胃肠动力的平衡,使胃肠动力障碍得到恢复。
综上所述,手术创伤后结肠组织SSTR2 mRNA的表达上调,SSTR2蛋白iNOS蛋白的表达增高可能参与了胃肠动力障碍的发生,通过microRNA-31转基因小鼠与FVB小鼠的比较,可以推测出高表达的microRNA-31参与了脊髓组织损伤后胃肠动力障碍的恢复。为此,我们可以设计出microRNA-31芯片或者胶囊,为临床上治疗手术创伤后胃肠动力障碍提供一个良好的治疗方案。

图2 SSTR2 mRNA的检测结果
[参考文献]
[1]黄保民,李颖,马仲丽,等.大承气汤对里实热证大鼠胃肠激素GAS、MTL、VIP、NT的影响[J].北京中医药大学学报,2010,335(10):683-687.
[2]Chen X,Xia J,Xia Z,et al.Potential functions of microRNAs in starch metabolism and development revealed by miRNA transcriptome profiling of cassava cultivars and their weild progenitor[J].BMC Plant Biol,2015,15(1):33.
[3]Xie M,Zhang S,Yu B.microRNA biogenesis,degradation and activity in plants[J].Cellul Molecul Life Sci,2015,72 (1):87-99.
[4]Das A,Ganesh K,Khanna S,et al.Engulfment of apoptotic cells by macrophages:A role of microRNA-21 in the resolution of wound inflammation[J].J Immunol,2014,192(3):1120-1129.
[5]田峰.小鼠标准化脊髓损伤模型的建立及miR-31转基因小鼠脊髓损伤机制研究[D].山西医科大学,2015.
[6]Basso DM,Beattie MS,Bresnahan JC.A sensitive and reliable locomotor rating scale for open field testing in rate[J]. J Neurotrauma,1995,12(1):1-21.
[7]Wu B,Liu L,Gao H,et al.Distribution of interstitial cells of cajal in meriones unguiculatus and alterations in the development of incomplete intestinal obstruction[J].Histol Histopathol,2013,28(12):1567-1575.
[8]Zeng L,Carter AD,Childs SJ.miR-145 directs intestinal maturation in zebrafish[J].Proc Natl Acad Sci USA,2009,106(42):17793-17798.
[9]Hino K,Tsuchiya K,Fukao T,et al.Inducible expression of micro-RNA-194 is regulated by HNF-alpha during intestinal epithelial cell differentiation[J].RNA,2008,14(7):1433-1442.
[10]Mayoral RJ,Pipkin ME,Pachkov M,et al.Micro-RNA-221-222 regulate the cell cycle in mast cells[J].J Immunol,2009,182(1):433-445.
[11]刘凯,齐清会.胃肠肽受体及受体后信号传导与胃肠动力[J].世界华人消化杂志,2002,10(12):1445-1449.
[12]Iyo T,Kaneko H,Konagaya T,et al.Effect of intragastric ammonia on gastrin,somatostatin and somatostatin receptor subtype 2 positive-cells in rat antral mucasa[J].Life Sci,1999,64(26):2497-2504.
[13]洪丽莉.脊髓损伤模型大鼠的胃肠动力障碍及其电针调整的研究[D].广州中医药大学,2008.
[14]De Herder WW,Lam berts SW.Somatostatin analog the rapy in treatment of gastro intestinal disorders and tumors[J].Endocrine,2003,20(3):285-290.
[15]Cuomo R,Samelli G,Grasso R,et al.Functional dyspepsia symptoms,gastric emptying and satiety provocative test analysis of relationships[J].Scand Jgasroenterol,2001,36(9):1030-1039.
[中图分类号]R651.2
[文献标识码]A
[文章编号]1673-9701(2016)13-0031-05
[基金项目]国家自然科学基金项目(81371384);山西省实验动物专项资金项目[20(12k01)、2014(k06)、2014(k15)]
收稿日期:(2016-03-15)
Repairing effect of microRNA-31 transgenic mice on gastrointestinal motility disorder in spinal cord injury model
WANG Dejun1YAN Jun1GAO Yuantao2LI Pengfei3WANG Chunfang3
1.Shanxi Medical University First School of Clinical Medicine,Taiyuan030001,China;2.Nanchang University Queen Mary School,Nanchang330031,China;3.Shanxi Medical University Laboratory Animal Center,Taiyuan030001,China
[Abstract]Objective To discuss the effect of microRNA-31 on gastrointestinal motility factors after spinal cord injury. Methods 36 microRNA-31 transgenic mice and 36 FVB mice were divided into control group and model group,respectively.Spinal cord injury model was established by Impactor M-Ⅲ spinal cord striker.The recovery condition of lower limbs in mice was evaluated by BBB locomotion score,and the changes of spinal cord tissues were observed by HE staining.Expression of SSTR2 mRNA was detected by real-time PCR and expressions of iNOS protein and SSTR2 protein were detected by immunofluorescence method.Results At day 3,day 7,and day 14 of modeling,the spinal cord tissues were destroyed and necrotic with vacuolization,and collagenous fiber was markedly increased.At day 14 of modeling,when compared with the control group,the expression of SSTR2 mRNA was significantly higher(P<0.05),and the expression quantities of iNOS protein and SSTR2 protein were significantly higher in the FVB group(P<0.05).In the microRNA-31 transgenic mice model group,when compared with the control group,the expression of SSTR2 mRNA was significantly higher(P<0.05),and the expression quantities of iNOS protein and SSTR2 protein were significantly higher(P<0.05).When compared with the FVB model group,the expression of SSTR2 mRNA was significantly lower(P<0.05)and the expression quantities of iNOS protein and SSTR2 protein were significantly lower in the microRNA-31 transgenic mice model group.Conclusion Gastrointestinal motility disorder after spinal cord injury is possibly related to up-regulation of SSTR2 mRNA expression and increase of SSTR2 protein and iNOS protein expressions.High-expressive microRNA-31 is possibly related to remission of gastrointestinal motility disorder after spinal cord injury.
[Key words]Spinal cord injury;Gastrointestinal motility factors;MicroRNA-31 transgenic mice;SSTR2;iNOS
