响应面法优化鹿角菜中岩藻多糖的提取工艺
2016-07-25宋海燕何文辉彭自然袁荣荣张泽华
宋海燕,何文辉,彭自然,袁荣荣,张泽华
响应面法优化鹿角菜中岩藻多糖的提取工艺
宋海燕,何文辉,彭自然,袁荣荣,张泽华
(上海海洋大学 省部共建水产种质资源发掘与利用教育部重点实验室,上海 201306)
摘要:在单因素试验的基础上,利用 Box-Benhnken中心组合实验设计,采用响应面法对鹿角菜(Pelvetia siliquosa)中岩藻多糖的提取工艺进行优化。结果表明,液料比、水浴温度和水浴时间对岩藻多糖提取率均有显著影响; 最佳提取工艺条件为: 液料比(mL/g)32、 水浴温度90℃、水浴时间8.4 h,此时岩藻多糖最高提取率为5.2005%,与理论值5.2153%相比,相对误差很小。响应面模型与实际情况拟合良好,采用响应面法对鹿角菜中岩藻多糖提取条件进行优化合理可行。
关键词:鹿角菜; 岩藻多糖; 提取; 响应面分析
鹿角菜(Pelvetia siliquosa)隶属褐藻门(Phaeophyta)、圆子纲(Cyclosporeae)、鹿角菜目(Fucales)、鹿角菜科(Fucaceae)、鹿角菜属(Pelvetia)[1]。我国沿海岸的鹿角菜藻体骨小,软骨质,叉状分枝角度较宽,生长托是长角果形[2]。鹿角菜藻体呈黄绿色,干燥后呈深褐色,藻体长度可达 14~15 cm[1]。岩藻多糖是褐藻中重要的杂多糖,其主要单糖组成是L-岩藻糖。它是一种硫酸多糖,不同产地、不同种类以及不同提取方法所得的岩藻多糖的结构不同,目前,尚未有对鹿角菜中岩藻多糖进行研究的报告。由于其岩藻多糖具有抗病毒,抗氧化和抗肿瘤等[3]特性,受到许多专家的关注,在医药、保健品以及功能性食品等领域都有所研究[3]。
褐藻中岩藻多糖的含量较低,并且结构复杂,为得到纯度高且优质的岩藻多糖,并使其产业化,提取工艺备受关注。响应面法[4-5]是利用二次回归方程拟合不同影响因素和响应值之间的函数关系。通过二次回归方程模型预测并确定最佳工艺参数[6-7],目前,响应面越来越多的被用于多糖提取工艺的优化[8-10]。水提法主要是利用岩藻多糖溶于热水,不溶于乙醇的特点来提取岩藻多糖。
本实验以鹿角菜为原材料,采用传统水浴提取鹿角菜岩藻多糖,通过单因素和响应面优化岩藻多糖提取工艺的液料比、水浴温度和水浴时间三个主要参数,为鹿角菜岩藻多糖的工业化生产以及深度开发提供理论依据。
1 材料与方法
1.1 实验材料及其预处理
鹿角菜产自海南省西岛附近潮间带小型岛屿的岩石上,在实验室人工培养稳定(pH8.2,盐度33,水温25℃,光照强度为150 μmol/(m2·s)。挑选无损伤、色泽均匀、生长状态良好的鹿角菜藻体作为试验原材料,用海水洗净之后,晾干,-80℃预冻24 h,冷冻干燥24 h,研磨粉碎过60目筛,用95%乙醇90℃回流脱脂3次,每次4 h,40℃烘干备用。
1.2 实验试剂与仪器设备
无水乙醇、95%乙醇、浓硫酸,均为分析纯; L-岩藻糖标准品(Fuc): 西格玛奥德里奇(上海)贸易有限公司;重蒸酚: 生工生物工程(上海)股份有限公司。
DHG-9041A型电热恒温干燥箱: 上海精宏实验设备有限公司; SP-722可见分光光度计: 上海光谱仪器有限公司; SXT-06索氏提取器: 上海洪纪仪器设备有限公司; DK-S24型电热恒温水浴锅: 上海精宏实验设备有限公司; LXJ-IIB低速大容量离心机: 上海安亭科学仪器
[Fundation: Shanghai major scientific and technological projects in the field of Science and Technology for Social Development Board (09DZ120010C);Shanghai College of Fisheries Science class Academic Discipline Project]
1.3 实验方法
1.3.1 岩藻多糖的提取
脱脂藻粉加入适量的蒸馏水溶胀,水浴处理一段时间后,提取液冷却至室温,5 000 r/min离心20 min后,弃沉淀,上清液浓缩至1/5体积,冷却后加无水乙醇至浓度为30%,以除去褐藻酸钠,静置1 h,4 000 r/min离心20 min,上清液浓缩至1/5体积,蒸馏水稀释至一定倍数后,按照苯酚硫酸法[11]测定岩藻多糖的含量。
1.3.2 岩藻多糖含量的测定
制备标准曲线: 量取 L-岩藻糖标准品溶液 0,0.2,0.4,0.6,0.8,1.0 mL,加蒸馏水至2.0 mL,再加入6%苯酚1.0 mL,混匀后,迅速加入5.0 mL浓硫酸,摇匀,静置5 min,沸水浴加热20 min后,冷却至室温。490 nm处测吸光度,以 L-岩藻糖的浓度(C,μg/mL)为横坐标,吸光度(A)为纵坐标,绘制标准曲线,如图1所示。

图1 L-岩藻糖含量测定标准曲线Fig. 1 Standard curve for L-glucose
样品溶液的制备: 将浓缩后的上清液稀释至125 mL后取1 mL,置于试管中,加蒸馏水至2.0 mL,再加入6 %苯酚1.0 mL,混匀,迅速加入5.0 mL浓硫酸,摇匀,静置5 min,沸水浴加热20 min后,冷却至室温。490 nm处测定吸光度,根据回归方程计算岩藻多糖提取率。
C为 L-岩藻糖含量测定标准曲线对应的回归方程计算所得的浓度值。
2 试验设计及数据分析
2.1 标准曲线
采用苯酚-硫酸法以 L-岩藻糖为标准品制作标准曲线,如图1所示,得回归方程
Y=0.0198C+0.0527,R2=0.9976
2.2 单因素实验结果与分析
在水浴温度为90℃,提取时间6 h条件下,设定液料比(mL/g)在20~60之间,研究液料比(mL/g)为20、30、40、50、60对岩藻多糖提取率的影响,如图2所示。随着液料比(mL/g)的增加,岩藻多糖提取率先增加后降低,在 30~60之间,岩藻多糖提取率迅速降低。当液料比为30,提取率有最大值为3.41%。因此选择30 作为响应面实验中心点。
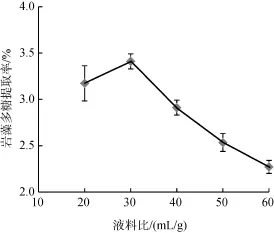
图2 液料比对岩藻多糖提取率的影响Fig. 2 Effect of liquid-solid ratio on the extraction of fucoidan
2.2.2 水浴温度对岩藻多糖提取率的影响
固定液料比(mL/g)30,提取时间 6 h,在水浴温度60、70、80、90、100℃下进行单因素实验,如图3所示。随着水浴温度的不断提高,岩藻多糖提取率不断提高,当温度达到100℃,岩藻多糖提取率明显下降,而在 90℃时,岩藻多糖提取率最高,因此选择80、90、100℃作为中心组合实验。
2.2.3 水浴时间对岩藻多糖提取率的影响
选择液料比(mL/g)为 30,水浴温度为 90℃,水浴时间为6、7、8、9、10 h来研究对岩藻多糖提取率的影响。如图4所示。随着水浴时间的延长,岩藻多糖提取率逐渐提高,原因是随着时间的不断延长,多糖逐渐浸出,当水浴时间达到8 h时,岩藻多糖提取率趋于稳定,而延长至10 h时,岩藻多糖提取率反而降低。因此选择8、9、10 h进行响应面优化实验。

图3 水浴温度对岩藻多糖提取率的影响Fig. 3 Effect of water bath temperature on the extraction of fucoidan
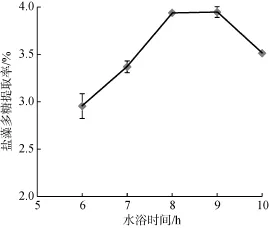
图4 水浴时间对岩藻多糖提取率的影响Fig. 4 Effect of water bath time on the extraction of fucoidan
2.3 响应面试验设计与结果分析
2.3.1 岩藻多糖提取因素水平
在单因素实验结果的基础上,以较少的实验次数对影响因素进行全面分析,根据中心组合试验(Box-Benhnken)设计原理[12],选取液料比、水浴温度、水浴时间三个因素,以岩藻多糖提取率(R1)作为响应值,采用三因素三水平二次多项回归组合设计试验。原始因素液料比、水浴温度、水浴时间分别以 A1、B1、C1表示,以-1 、0、1 代表自变量低、中、高三个水平,对三因素做相应变换: A=(A1-30)/10;B=(B1-90)/10; C=(C1-9)/1。响应面因素水平表见表1。
有研究发现髋关节手术后发生认知功能障碍患者术后血清S100β水平高于正常患者,提示脑损伤可能参与术后认知功能障碍的发生发展过程[19]。本研究通过对患者手术前后S100β蛋白表达水平的比较,发现C组患者术后6小时和术后24小时外周血S100β蛋白水平较术前明显增加,而M组外周血S100β蛋白水平无明显变化,表明褪黑素可减少围术期脑组织的损害,对围术期脑功能有保护作用。

表1 响应面因素水平表Tab. 1 Analytical factors and levels for RSM
2.3.2 数据分析
采用Design-Expert 8.05软件对响应面试验数据进行二次多项回归拟合、方差分析、显著性检测和响应面分析。多项回归方程的拟合度由 R2表达[13],影响因素的显著性由P值检验,P<0.05表示具有显著性差异,P<0.001表示差异极显著[14-15]。
2.3.3 响应面试验结果
采用Box-Benhnken对岩藻多糖提取工艺进行响应面分析,17个试验点,12个析因实验点,分别为A、B和C所构成三维空间的顶点,5个零点是三维空间的中心点,零点试验重复 5次,用作估计实验误差,响应面试验方案及结果见表2。
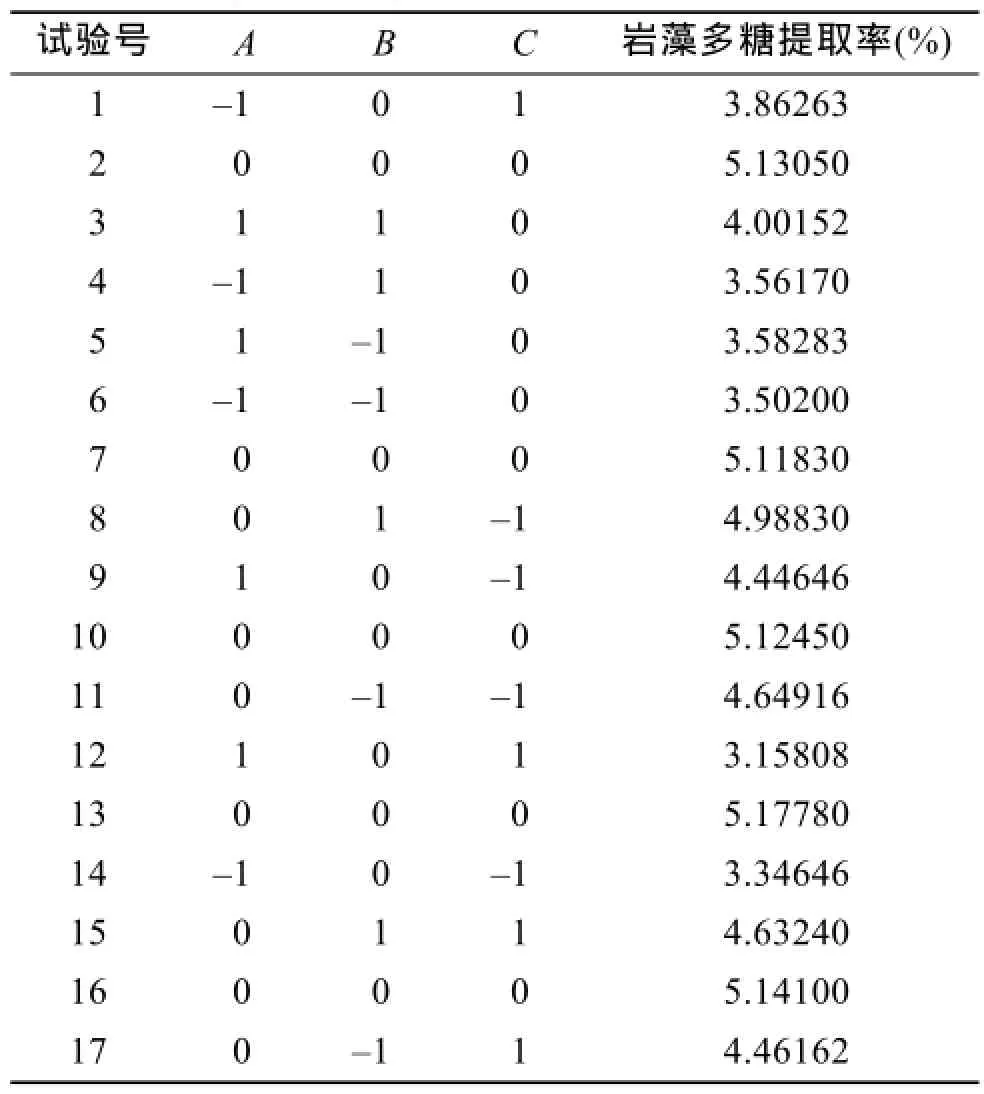
表2 响应面试验方案及结果Tab. 2 Design and experimental results of RSM
利用Design Expert8.05软件对表2中数据进行拟合,得到岩藻多糖提取率(R1)对编码自变量(液料比、水浴温度、水浴时间)二次回归方程如下所示:

由岩藻多糖提取率二次回归方程可知,各个系数绝对值越大,则该因素对响应面的影响程度就越大[16],二次项 A2、B2、C2的系数均为负数,因而推断回归方程所对应的抛物面开口向下,说明有极大值点。可以用以进行优化分析[17]。通过方程一次项系数以及表3中一次项的F值和P值,可以得出影响鹿角菜岩藻多糖提取率的因素的顺序依次为水浴时间(C)>水浴温度(B)>液料比(A)。
为检验回归方程的有效性,对岩藻多糖提取的回归模型进行方差分析,方差分析结果见表3。回归模型项 P<0.0001,说明该回归模型极显著,且模型失拟项在 α=0.05水平上不显著(P=0.0729>0.05),说明未知因素对该实验结果干扰小。因此可以说明该回归模型可以较显著的拟合液料比(A)、水浴温度(B)、水浴时间(C)对岩藻多糖提取率(R1)的影响,可以用于对鹿角菜岩藻多糖提取率的分析。决定系数R2= 0.9987,说明该二次回归模型与实际试验值拟合度好且可靠性高。调整系数 R2adj=0.9970,说明该二次回归模型可以解释 99.70%的响应值的变化。只有0.30%的总变异不能用该二次回归模型解释。表明该回归模型拟合度好,可以用此模型对鹿角菜岩藻多糖提取工艺进行优化。

变异来源 平方和 自由度 均方Model 8.41340 9 0.93482 A 0.10490 1 0.10490 B 0.12209 1 0.12209 C 0.21637 1 0.21637 AB 0.03222 1 0.03222 AC 0.81410 1 0.81410 BC 0.00709 1 0.00709 A^2 6.34873 1 6.34873 B^2 0.25995 1 0.25995 C^2 0.18055 1 0.18055残差误差 0.01084 7 0.00155失拟差 0.00863 3 0.00288纯误差 0.00222 4 0.00055总和 8.42424 16 R2=0.9987 R2adj=0.9971 F值 P值 显著性603.42477 < 0.0001 ** 67.71578 < 0.0001 ** 78.81167 < 0.0001 ** 139.66413 < 0.0001 ** 20.79691 0.0026 * 525.49910 < 0.0001 ** 4.57417 0.0698 4098.08788 < 0.0001 ** 167.79815 < 0.0001 ** 116.54572 < 0.0001 ** 5.18347 0.0729
一次项中A、B和C均为差异极显著(P<0.001),说明在鹿角菜岩藻多糖提取工艺过程中,液料比,水浴温度和水浴时间对岩藻多糖的提取有极其显著的影响,是多糖提取率的主要限制因子,三因素的变化可引起岩藻多糖提取率很大的改变。交互项中AB差异显著(P<0.05),AC差异极显著(P<0.001),表明液料比和水浴温度对岩藻多糖的提取率有显著的影响,液料比和水浴时间对岩藻多糖的提取率有极其显著的影响。
2.3.4 鹿角菜岩藻多糖提取率的响应面分析图
根据二次回归方程建立响应面分析图,分析响应面曲面形状,分析液料比、水浴温度和水浴时间对岩藻多糖提取率的影响。

图 5 液料比和水浴温度对岩藻多糖提取率影响的响应面图Fig. 5 Response surface of the liquid-solid ratio and water bath temperature on the extraction of fucoidan
图 5显示了水浴时间在中心水平时,液料比和水浴温度对岩藻多糖提取率的影响。由图中等高线可判断出,液料比和水浴温度的交互作用较强,当液料比或者水浴温度一定时,岩藻多糖提取率均随着水浴温度或者液料比先增加后降低。并且图中可以看出液料比对岩藻多糖提取率的曲线很陡峭,说明在液料比和水浴温度交互作用中,液料比影响更大。
图 6显示了水浴温度在中心水平时,液料比和水浴时间对岩藻多糖提取率的影响。由图中等高线可判断出,液料比和水浴时间交互作用较强。水浴温度固定在中心水平,岩藻多糖提取率随着液料比的增加,呈先增加后减小趋势,且增加幅度较大。岩藻多糖提取率随着水浴时间延长先增加,后趋于平稳。

图6 液料比和水浴时间对岩藻多糖提取率影响的响应面图Fig. 6 Response surface of the liquid-solid ratio and water bath time on the extraction of fucoidan

图7 水浴温度和水浴时间对岩藻多糖提取率影响的响应面图Fig. 7 Response surface of water bath temperature and water bath time on the extraction of fucoidan
图 7显示了液料比在中心水平时,水浴温度和水浴时间对岩藻多糖提取率的影响。由图中等高线可判断出,水浴温度和水浴时间对岩藻多糖提取率影响十分显著。液料比固定在中心水平,岩藻多糖提取率随着水浴温度的升高而不断增加,随着水浴时间的延长而呈现先增加后减小的趋势。
2.4 最佳工艺条件确定以及工艺验证
为进一步确定最佳提取工艺条件,对回归模型求一阶偏导,并令其等于零,则可以得到曲面最大点。
则求导方程为:

求解方程组得: A=0.1641,B=0.3190,C=-0.5886。由中心组合实验设计[18-19]优化得试验最优工艺条件为: 液料比(mL/g)31.64、水浴温度93.19℃、水浴时间8.41 h,
此时,岩藻多糖最大提取率理论预测值可达5.2153%。考虑到实际操作,将鹿角菜岩藻多糖提取的最佳提取工艺条件修改为液料比32(mL/g) 、水浴温度90℃、水浴时间8.4 h。采用最佳提取工艺条件进行三次重复验证试验结果如表 4,岩藻多糖平均提取率为5.2005%,与理论预测值相近。因而可以采用响应面法来优化岩藻多糖的提取工艺条件。
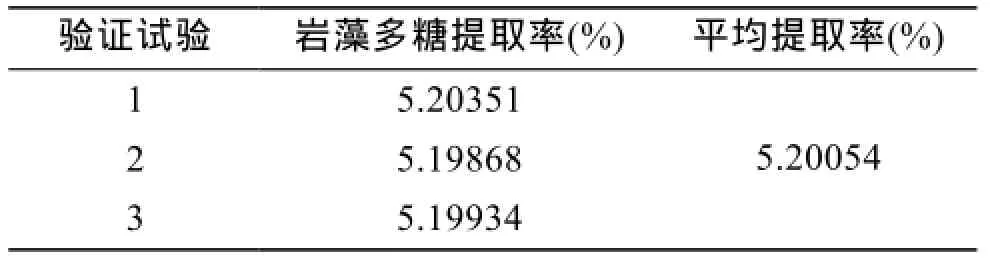
验证试验 岩藻多糖提取率(%) 平均提取率(%)1 5.20351 2 5.19868 3 5.19934 5.20054
2.5 讨论
本研究首先通过岩藻多糖的单因素实验,确定了三个影响因素的最佳条件,以用于响应面分析,采用 Box-Behnken中心组合实验设计以及响应面分析,建立二次回归模型,通过对三因素进行方差分析以及交互作用分析,最终得到鹿角菜岩藻多糖水浴提取的最优工艺条件。
在单因素实验中,岩藻多糖的提取率随着液料比、水浴温度和水浴时间均呈现先增加后降低的趋势。当液料比(mL/g)为 20~30之间,提取率从 3.173% 升高至3.410% ,原因是液料比增加,细胞内和外部溶剂浓度差加大,溶剂迅速扩散进入细胞,并且增强多糖的脱附作用,但在30~60之间,液料比过大,使溶剂扩散到细胞内部的距离延长,因此提取率迅速降低[20,21]。姚兰[22]通过水提法获取海带中岩藻多糖时,在30时提取率最大。
液料比在 60~69之间,温度提高使得多糖扩散系数增大,溶剂对藻粉中多糖的溶解能力提高,且分子热运动加快促进多糖从细胞中不断溶出[23],因此提取率从2.297%增加至3.414%,增幅明显。当温度达到 100℃,岩藻多糖提取率显著下降,可能是高温破快了多糖结构,使糖链断裂,多糖降解。且高温生产对设备要求严格[24]且加大能耗[25]。试验结果与姚兰[22]水提醇沉获取海带岩藻多糖结果相符,均在90℃时,提取率最大。熊皓平等[26]在优化硇洲马尾藻多糖提取工艺的单因素实验中发现在 60~90℃之间,提取率随着温度的升高而不断增加,超过 90℃,提取率变化不大,但不再升高。
在6~8 h之间,随着时间延长,液体不断渗入藻粉中,多糖溶解加快,随后扩散到热水介质中[27,28],从而使提取率从3.353%增加到3.939%,当水浴时间延长至 10 h时,岩藻多糖提取率反而降低,说明水浴时间过长可能导致多糖降解,且增加能耗[29]。丁晓平等[30]通过热水浸提海带中岩藻多糖,发现最佳提取时间为8 h。
从响应面分析图可直观地看出各因素之间的相互作用。当特征值均为正数时,响应面分析图为山谷形曲面,有极小值存在; 当特征值为负值时,为山丘曲面,有极大值存在; 当特征值有正有负时,为马鞍形曲面,无极值存在[31]。因为等高线的形状反映交互作用的强弱,等高线为椭圆形时,则交互作用较强,等高线为圆形时,则反之[32-33]。
3 结论
利用传统水浴提取鹿角菜中的岩藻多糖的方法,不需要特殊设备,操作简单,成本低,更便于进行工业化生产,是一种可取的方法。通过单因素实验的设计,在此基础上,采用中心组合试验(Box-Benhnken)设计,利用响应面进行分析,建立水浴提取岩藻多糖的二次回归模型。通过方差分析,该归回模型拟合度良好,可用于对岩藻多糖提取工艺进行优化。考虑到实际操作,最终确定岩藻多糖最佳提取工艺条件为液料比(mL/g)32、水浴温度90℃、水浴时间8.4 h。采用最佳工艺条件进行三次验证试验,三次所得平均提取率为 5.2005%,标准偏差为 0.00265,与理论预测值5.2153%相比,相对误差较小。说明响应面法适用鹿角菜岩藻多糖提取工艺进行参数优化及数学模型的建立。
参考文献:
[1] 黄礼娟,蔡洪波,张华杰,等. 鹿角菜采苗育苗技术的研究[J]. 海洋水产研究,2008,29(1): 70-76. Huang Lijuan,Cai Hongbo,Zhang Huajie,et al. Development and utilization of a seaweed natural resourcestudies on seedling-rearing of Pelvetia siliquosa[J]. Marine Fisheries Research,2008,29(1): 70-76.
[2] 曾呈奎,张峻甫. 鹿角菜及其分布[J]. 植物学报,1953,2(2): 280-297. Zeng Chengkui,Zhang Junfu. On a new species of Pelvetia and its distribution[J]. Journal of Integrative Plant Biology,1953,2(2): 280-297.
[3] Fedorov S N,Ermakova S P,Zvyagintseva T N,et al. Anticancer and cancer preventive properties of marine polysaccharides: some results and prospects[J]. Marine Drugs,2013,11(12): 4876-4901.
[4] Zhang J,Jia S Y,Liu Y. Optimization of enzyme- assisted extraction of the Lycium barbarum polysaccharides using response surface methodology[J]. Carbohydrate Polymers,2011,86: 1089-1092.
[5] 刘冬莲. 响应面法优化花生壳中高费醇木质素提取工艺研究[J]. 化学研究与应用,2011,23(11): 1566-1569. Liu Donglian. Optimization for high boiling solvent extraction of lignin from peanut shell with response surface method[J]. Chemical Research and Application,2011,23(11): 1566-1569.
[6] 黄璞,谢明勇,聂少平,等. 响应曲面法优化微波辅助提取黑灵芝孢子多糖工艺研究[J]. 食品科学,2007,28(10): 200-203. Huang Pu,Xie Mingyong,Nie Shaoping,et al. Study on Microwave-assisted Extraction of Polysaccharides from Spores of Ganoderma atrum with Response Surface Analysis[J]. Food science,2007,28(10): 200-203.
[7] Hou X J,Chen W. Optimization of extraction process of crude polysaccharides from wild edible BaChu mushroom by response surface methodology[J]. Carbohydrate Polymers,2008,72(7): 67-74.
[8] 王明艳,鲁加峰,王晓顺,等. 响应面法优化天冬多糖的提取条件[J]. 食品科学,2010.31(6): 91-95. Wang Minyan,Lu Jiafeng,Wang Xiaoshun,et al. Optimization of Extraction of Radix Asparagi Polysaccharides Using Response Surface Methodology[J]. Food science,2010.31(6): 91-95.
[9] 沈霞,张艳红,袁慧慧,等. 响应面分析法优化艾叶粗多糖提取工艺的研究[J]. 中成药,32(1): 48-51. Shen Xia,Zhang Yanhong,Yuan Huihui,et al. Optimium extraction of polysaccharides from folium Artemisia argyiby responsesurface methodology[J]. Chinese Traditional Patent Medicine,32(1): 48-51.
[10] 张海容,白娟,魏增云,等. 超声萃取-响应面优化淡竹叶多糖提取方法研究[J]. 化学研究与应用,2013,25(3): 303-310. Zhang Hairong,Bai Juan,Wei Zengyun,et al. Optimization of ultrasound-assisted extraction of polysaccharides from Lophantherum gracile brongn by response surface methodology[J]. Chemical Research and Application,2013,25(3): 303-310.
[11] 李建,杨波,季宇彬. 超声波法提取裙带菜多糖的工艺研究[J]. 食品与药品,2010,12(11): 404-406. Li Jian,Yang Bo,Ji Yubin. Study on Extraction Technology of Undaria pinnatifi da Polysaccharide by Ultrasonic Wave[J]. Food and Drug,2010,12(11): 404- 406.
[12] 费荣昌. 试验设计与数据处理[M]. 第 4版.无锡: 江南大学教材,2001,59-63. Fei Rongchang. Experimental design and data processing[M]. 4th edition .Wuxi: Jiangnan University Textbooks,2001,59-63.
[13] Kshirsagar A C,Singhal R S. Optimization of starch oleate derivatives from native corn and hydrolyzed corn starch by response surface methodology[J]. Carbohydrate Polymers,2007,69(10): 455-461.
[14] 王明艳,张小杰,王涛,等. 响应面法优化香椿叶多糖的提取条件[J]. 食品科学,2010,31(4): 106-110. Wang Mingyan,Zhang Xiaojie,Wang Tao,et al. Response Surface Methodology for Optimizing Extraction of Polysaccharides from Toona sinensis (A.Juss.)Roem Leaves[J]. Food science,2010,31(4): 106-110.
[15] 吴海健,王建新,黄建明,等. 星点设计-效应面法优化柘树提取物片剂处方[J]. 复旦学报: 医学版,2008,35(3): 363-367. Wu Haijian,Wang Jianxin,Huang Jianmin,et al. Optimization of Cudrania extractum tablets formulation by central composite design-responsesurface methodology[J].Fudan Univ J Med Sci ,2008,35(3): 363-367.
[16] 肖卫华,韩鲁佳,杨增玲,等. 响应面法优化黄芪黄酮提取工艺的研究[J]. 中国农业大学学报,2007,12(5): 52-56. Xiao Weihua,Han Lujia,Yang Zengling,et al. Optimization of alcohol extraction techniques of flavonoids from Radix Astragali using responsesurface methodology[J]. Journal of China Agricultural University,2007,12(5): 52-56.
[17] 乔小瑞,烟利亚,刘兴岚,等.荔枝壳多酚提取工艺的响应面法优化及自由基清除活性研究[J]. 中国食品学报,2010,10(5): 22-29. Qiao Xiaorui,Yan Liya,Liu Xinglan,et al. Studies on Optimization of Technology for Extraction of Litchi Pericarp Polyphenols by Response Surface Method and Their Free-radical Scavenging Activity[J]. Journal of Chinese Institute of Food Science and Technology,2010,10(5): 22-29.
[18] 王桃云,邱业先,郭伟强,等. 响应面法优化藜根总黄酮提取工艺的研究[J]. 化学研究与应用,2012,24(6): 884-889. Wang Taoyun,Qiu Yexian,Guo Weiqiang,et al. Optimization of extraction technology of total flavonoids from toots of chenopodium glaucum(L.) using response surface methology[J]. Chemical Research and Application,2012,24(6): 884-889.
[19] 黄礼德,郭立强,刘胜利,等. 正交设计优化木贼多糖的超声提取工艺(英文)[J]. 化学研究与应用,2012,24(6): 990-995. Huang Li,Guo Liqiang,Liu Shengli,et al. Study on the extraction technology of polysaccharides from equisetum by ultrasonic[J]. Chemical Research and Application,2012,24(6): 990-995.
[20] Samavati V,Manoochehrizade A. Polysaccharide extraction from Malva sylvestris and its anti-oxidant activity[J]. International Journal of Biological Macromolecules,2013,60: 427-436.
[21] Li X Y,Wang Z Y,Wang L,et al. Ultrasonic-assisted extraction of polysaccharides from Hohenbuehelia serotina by response surface methodology[J]. International Journal of Biological Macromolecules,2012,54(4): 523-530.
[22] 姚兰. 海带中多糖的提取及其综合利用[D]. 济南:山东轻工业学院,2007. Yao Lan.The polysaccharide-extraction and comprehensive utilization of Laminaria japonica[D]. Jinan:Shandong Institute of Light Industry,2007.
[23] Ye C L,Jiang C J .Optimization of extraction process of crude polysaccharides from Plantago asiatica L. by response surface methodology[J]. Carbohydrate Polymers,2011,84: 495-502.
[24] 燕航,钟耀广. 影响香菇多糖提取的因素研究[J]. 现代食品科技,2006,22(2): 179-180. Yan Hang,Zhong Yaoguang. The Study on Extraction of Polysaccharides from Lentinus[J]. Modern Food Science and Technology,2006,22(2): 179-180.
[25] 胡斌杰,陈金锋,王宫南. 超声波法与传统热水法提取灵芝多糖的比较研究[J]. 食品工业科技,2007(2):190-192. Hu Binjie,Chen Jinfeng,Wang Gongnan. Ultrasonic method and the traditional method of hot water comparative Study on the extraction of Ganoderma Lucidum polysaccharides [J]. Science and Technology of Food I ndustry,2007(2): 190-192.
[26] 熊皓平,黄和,王博,等. 响应面法优化硇洲马尾藻多糖提取工艺[J]. 食品研究与开发,2011,32(5): 52-56. Xiong Haoping,Huang He,Wang Bo,et al. Optimization of Extraction Conditions of S. Naozhouense sp. nov. Polysaccharides by Using Response Surface Methodology[J]. Food Research And Development,2011,32(5): 52-56.
[27] Masmoudi M,Besbes S,Chaabouni M,et al. Optimization of pectin extraction from lemom by-product with acidified date juice using response surface methodology[J]. Carbohydrate Polymer,2008,74: 185-192.
[28] Afshari K,Samavati V,Shahidi S A. Ultrasonic-assiste extraction and in-vitro antioxidant activity of polysaccharide from Hibiscus leaf[J]. International Journal of Biological Macromolecules,2015,74: 558-567.
[29] Shao Q S,Deng Y M,Shen H J,et al. Optimization of polysaccharides extraction from Tetrastigma hemsleyanum Diels et Gilg using response surface methodology [J]. International Journal of Biological Macromolecules,2011,49(5): 958-962.
[30] 丁晓平,谢玲,颜秀花. 海带中提取岩藻多糖[J]. 广州化工,2012,40(16): 82 -84. Ding Xiaoping,Xie Ling,Yan Xiuhua. Extraction Technology of Fucoidin from Kelp[J]. Guangzhou Chemical Industry,2012,40(16): 82 -84.
[31] Gupta S,Manohar C S. An improved response surface method for the determination of failure probability and importance measures [J]. Structural Safety,2004,26:123-139.
[32] 万俊,蒋爱民,曲直,等. 响应面法优化 Camembert干酪加工工艺[J]. 现代食品科技,2012,28(7): 840-844. Wan Jun,Jiang Aimin,Qu Zhi,et al. Optimization of processing conditions for Camembert cheese by response surface method[J]. Modern Food Science and Technology,2012,28(7): 840-844.
[33] Xu H,Sun L P,Shi Y Z,et al. Optimization of cultivation conditions for extracellular polysaccharide and mycelium biomass by Morchella esculenta As51620[J]. Biochemical Engineering Journal,2008,39(1): 66-73.
(本文编辑: 康亦兼)
中图分类号:S985.4
文献标识码:A
文章编号:1000-3096(2016)04-0073-08
doi:10.11759/hykx20150509001
收稿日期:2015-05-09; 修回日期: 2015-08-05
基金项目:上海市科学技术委员会社会发展领域重大科技项目(09DZ120010C); 上海高校水产学一流学科建设项目资助
作者简介:宋海燕(1991-),女,江苏宿迁人,硕士研究生,主要从事大型海藻多糖提取,结构和活性研究,E-mail: shynina@163.com; 何文辉,通信作者,男,副教授,主要从事大型海藻的应用以及生态修复,E-mail:whhe@shou.edu.cn厂; 美国LABCONCO冷冻干燥机: 无锡凯派克斯科技有限公司; FB224自动内校电子分析天平: 上海舜宇恒平科学仪器有限公司; Alpha-Pure 15纯水系统: 上海瑞枫生物科技有限公司; R-201 型旋转蒸发仪: 上海申胜生物技术有限公司; Q-150A3粉碎机: 上海冰都电器有限公司。
Optimization of fucoidan extraction process from Pelvetia siliquosa Tsenget C. F. Chang by using response surface methodology
SONG Hai-yan,HE Wen-hui,PENG Zi-ran,YUAN Rong-rong,ZHANG Ze-hua
(Key Laboratory of Exploration and Utilization of Aquatic Genetic Resources,Shanghai Ocean University,Ministry of Education,Shanghai 201306,China)
Received: May 8,2015
Key words:Pelvetia siliquosa Tsenget C.F. Chang; Fucoidan; extraction; response surface methodology
Abstract:For the development of fucoidan obtained from Pelvetia siliquosa Tsenget C. F. Chang (P. siliquosa Tsenget C. F. Chang),fucoidan from P. siliquosa Tsenget C. F. Chang were extracted using the traditional water bath method. Based on a single factor experiment using the Box-Benhnken central composite design method,the process of extracting fucoidan from P. siliquosa Tsenget C. F. Chang was optimized using the response surface method (RSM). Results show that the liquid material ratio,water bath temperature,and water bath time have a significant effect on the extraction rate of fucoidan. Optimum extraction conditions were as follows: liquid-solid ratio of 32 ml/g,temperature of 90℃,and water bath time of 8.4 h. The extraction rate of fucoidan reached 5.2005%,and compared with the theoretical value of 5.2153% the relative error of the true value was small. The response surface method was found to match well with the actual process,which shows good applicability and feasibility of using the RSM for the optimization of the extraction process of fucoidan from P. siliquosa Tsenget C. F. Chang.
