不同氮、磷浓度对布氏双尾藻休眠孢子形成的影响
2016-07-25高亚辉刘广发梁君荣徐华林陈长平
李 朗,高亚辉,2,刘广发,2,梁君荣,2,赵 龙,胡 肖,徐华林,章 军,陈长平,2
(1. 厦门大学生命科学学院,福建 厦门 361102; 2. 滨海湿地生态系统教育部重点实验室,福建 厦门 361102;3. 广东内伶仃-福田国家级自然保护区管理局,广东 深圳 518040)
不同氮、磷浓度对布氏双尾藻休眠孢子形成的影响
李 朗1,高亚辉1,2,刘广发1,2,梁君荣1,2,赵 龙1,胡 肖1,徐华林3,章 军1,陈长平1,2
(1. 厦门大学生命科学学院,福建 厦门 361102; 2. 滨海湿地生态系统教育部重点实验室,福建 厦门 361102;3. 广东内伶仃-福田国家级自然保护区管理局,广东 深圳 518040)
摘要:有些海洋硅藻在不良的环境下会形成休眠孢子,这种过程与环境中的氮、磷浓度密切相关。本文研究了培养基中不同氮、磷浓度下布氏双尾藻(Ditylum brightwellii)休眠孢子的形成过程。结果表明:氮浓度在27 μmol/L以下时即可形成休眠孢子,且培养基中氮初始浓度越低,休眠孢子出现得越早; 单因子变量为磷浓度时,各组均在第3天形成休眠孢子,且培养基中磷浓度变化不大,其中磷浓度较高(50 μmol/L)时,培养基中休眠孢子的密度和形成率均明显高于磷浓度较低的培养基(20 μmol/L和10 μmol/L)。低氮高磷(氮: 20 μmol/L,磷: 50 μmol/L)组休眠孢子密度和形成率在四组中最高,说明布氏双尾藻休眠孢子的形成受氮、磷两种因子的共同影响。
关键词:布氏双尾藻(Ditylum brightwellii); 氮; 休眠孢子; 磷
休眠孢子是硅藻生活史中的一种特殊形态。形成休眠孢子不仅是硅藻的一种繁殖方式,同时也是硅藻在环境条件不利于自身生长时的一种生存策略[1]。从外观上看,重硅质化是休眠孢子最明显的特征之一[2]。与营养细胞相比,休眠孢子的形成需要3倍以上的硅[3],即硅藻细胞硅浓度的增加是休眠孢子形成的迹象[4]; 除此之外,休眠孢子的壳环带常消失,形状和壳面纹饰也会有所改变[2,5]。一般情况下,诱导休眠孢子形成要求硅藻生长环境的快速变化,如营养盐贫乏、盐度升高、光照减弱、温度和pH值降低等[6]。休眠孢子的形成还有可能是为了避免藻类病毒感染[5],如在接种CsfrRNAV病毒23天后,聚生角毛藻 (Chaetoceros solialis f. radians)的藻液中出现了休眠孢子[7]。休眠孢子形成所需时间由几小时、几天至几星期不等且其对营养细胞大小有物理选择性[6]。
利用氮限制与低温、黑暗或高盐度等双因子条件诱导硅藻休眠孢子形成的结果表明: 氮限制是硅藻休眠孢子形成的必需条件,而其他因子的变化可促成这一过程的形成,并且辅助因子具有种间差异性[6,8-9]。磷和碳、氮一样都是海洋生态系统所必需的生物活性元素之一[10],浮游植物能够从周围水体中吸收无机磷并将之转化为细胞内参与许多生命活动的各种重要含磷化合物。磷也能影响硅藻休眠孢子的形成,如拟旋链角毛藻(C. pseudocurvisetus Mangin)和扁面角毛藻(C. compressus Lauder)既能在缺氮时形成休眠孢子,也能在缺磷时形成休眠孢子[3]。
布氏双尾藻(Ditylum brightwellii (West)Grunow)为温带近海浮游种,在世界上分布很广。目前国内外关于布氏双尾藻的研究主要集中在营养细胞,而且现有关于休眠孢子的少量报道也仅局限于形态学和生态学方面。氮、磷是海洋硅藻生长所必需的元素。本文旨在了解不同氮、磷浓度对布氏双尾藻休眠孢子形成的影响,通过比较各组休眠孢子的形成时间、形成密度和形成率以及培养基中氮、磷等营养盐的消耗情况,分析氮、磷浓度对休眠孢子形成的综合效应,从而为自然海区硅藻休眠孢子的研究提供理论依据和线索。
1 材料与方法
1.1 藻种
本实验用布氏双尾藻(厦门大学硅藻研究室藻种
[Foundation: Natural Science Foundation of China,No. 41276100; CAS Strategic Priority Research Program,NO. XDA11020103; Project supported by the Natural Science Foundation of Fujian Province,China (NO. 2101J01232)]
1.2 培养条件
实验用培养基为ESAW (Enriched Seawater,Artificial Water)培养基[11],盐度为32,培养温度为19℃±1℃,光照强度为150 μmol/(m2·s),光暗比(L︰D)12 h︰12 h。
1.3 实验方法
实验设置4个组别,每组3个重复,接种处于对数生长期并经无氮ESAW培养基淋洗3次后的布氏双尾藻,起始接种密度为 80个/mL。各组培养基中氮源(NaNO3)、磷源)浓度如表1所示。接种当天从每瓶培养液中取样用于氮(NO3-+ NO2--N)和磷)浓度的测定,此后每天仅取样于显微镜下观察休眠孢子是否形成。待孢子形成后,每隔1天定时取样分别用于计数和营养盐测定。用于营养盐测定的样品经 0.22μm混合纤维滤膜过滤后-80℃冷冻保存,测定前转移至 4℃冰箱缓慢融解,使用荷兰 Skalar公司的 San++连续流动分析仪进行检测。采用铜-镉还原法采用磷钼蓝法测定,相关试剂配制及操作均需按照《海洋监测规范》[12]要求进行。

表1 各组培养基中氮、磷营养盐初始浓度Tab. 1 Initial N and P concentrations in the culture medium of each group
2 结果与分析
2.1 培养基中氮、磷浓度的变化
从接种当天到第3天,A组培养基中的氮浓度减少了25.53 μmol/L,B组则减少了4.97 μmol/L,A组的藻细胞可以利用更多的氮源用于自身的生长繁殖。从第 3天开始,A、B两组培养基中的氮浓度变化相似,并无明显差异(P>0.05)。第5天前,两组的氮浓度仍都快速减少,第5天以后,两组的氮浓度均一直保持相对平稳的趋势。休眠孢子形成过程中,A组第5天至11天的氮浓度变化范围为16.12~19.68 μmol/L,B组第3天至11天氮浓度变化范围为14.15~26.11 μmol/L(图1)。两组培养基中的氮浓度均在第9天出现最低值,第9天以后,两组的氮浓度均略有增加。
整个实验过程中,培养基中的磷浓度除第3天C组和D组无明显差异(P>0.05)外,其余时间各组的磷浓度保持着B组>C组>D组的趋势(P<0.05)。接种当天至第3天各组磷浓度均明显减少。第3天,B组、C组和D组的磷浓度分别为40.59、13.93和5.86 μmol/L。第3天以后,除B组磷浓度变化略有波动外,C组和D组磷浓度均保持相对稳定。从第3天至11天,B组的磷浓度变化范围为36.57~43.72 μmol/L,C组的磷浓度变化范围为13.93~14.90 μmol/L,D组的磷浓度变化范围为4.82~6.65 μmol/L。
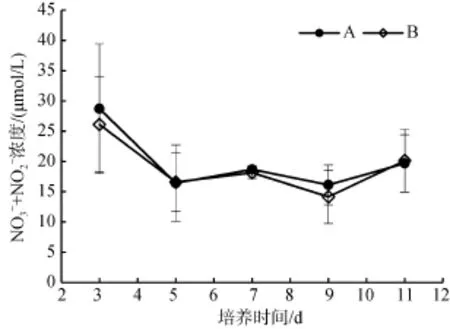
图1 A组和B组培养基中氮浓度随时间的变化Fig. 1 Changes in N concentration in the culture medium of groups A and B

图2 B组、C组和D组培养基中磷浓度随时间的变化Fig. 2 Changes in P concentration in the culture medium of groups B,C,and D
2.2 培养基氮浓度与布氏双尾藻休眠孢子形成的关系
显微镜观察发现,B组在第3天先形成休眠孢子,A组则在第4天形成。此后,A组和B组的休眠孢子密度均持续增加。其中,A组在第7天达到最高值,为430个/mL; B组在第9天达到最高值,为560个/mL。整个实验过程中,A组和B组的休眠孢子密度无明显差异(P>0.05,图3)。在休眠孢子的形成过程中,B组休眠孢子形成率由第 3天的 1.64%增加到第 9天的46.45%; A组则由第3天的0%增加到第9天的41.05%,但两组的休眠孢子形成率也没有明显差异(P>0.05,图4)。此外,B组休眠孢子形成速度比A组先达到最大值,A组在第7天达到最大值,平均每天新增115个/mL,B组在第5天达到最大值,平均每天新增128个/mL。

图3 A组和B组布氏双尾藻休眠孢子形成密度的变化Fig. 3 Changes in the densities of Ditylum brightwellii resting spores in groups A and B

图4 A组和B组布氏双尾藻休眠孢子形成率的变化Fig. 4 Changes in the percentages of Ditylum brightwellii resting spores in groups A and B
2.3 培养基磷浓度与布氏双尾藻休眠孢子形成的关系
B、C、D 3组均在第3天形成休眠孢子,密度分别为10、7和17个/mL。形成休眠孢子后,B组和C组休眠孢子密度继续增加,均在第 9天达到最高值,分别为560和250个/mL。而D组在第7天即已达到最高值,为257个/mL(图5)。
在休眠孢子形成过程中,B组的休眠孢子形成率由第3天的1.64%增加到第9天的46.45%,C组的休眠孢子形成率由第 3天的 1.39%增加到第 9天的24.47%,D组的休眠孢子形成率由第3天的2.95%增加到第7天的24.69%(图6)。第3天以后,B组的休眠孢子形成率大部分时间高于C组和D组(第7天B组和D组的休眠孢子形成率无显著差异,P>0.05)。B组的休眠孢子形成速度比C组和D组先达到最大值,B组在第5天达到最大值,每天新增128个/mL,C组和D组则至第7天达到最大值,每天分别新增60个/mL和72个/mL。

图5 B组、C组和D组布氏双尾藻休眠孢子形成密度的变化Fig. 5 Changes in the densities of Ditylum brightwellii resting spores in groups B,C,and D *P<0.05,**P<0.01,***P<0.001

图6 B组、C组和D组布氏双尾藻休眠孢子形成率的变化Fig. 6 Changes in the percentages of Ditylum brightwellii resting spores in groups B,C,and D *P<0.05,**P<0.01
3 讨论与结论
3.1 氮对布氏双尾藻休眠孢子形成的影响
大量的研究表明,海洋生态系统中浮游植物的生长和繁殖经常会受到海洋中氮、磷的影响[13-15]。同时,浮游植物在消耗水体中的营养盐特别是氮的过程中有着重要作用[16-19]。氮是所有浮游植物生长所必需的营养元素,并在许多海区成为浮游植物生长的限制因子[20]。硅藻是氮限制类型,通常在富含硝酸盐的海域中占据优势地位[21]。我国长江口是赤潮高发区,硝酸盐是该水域 DIN的主要形态,而硝态氮的浓度在春季高于秋季,春季由于硅藻的生长,Si/DIN小于1,为异常降低,秋季Si/DIN则大于1[22],这些营养盐结构的变化与休眠孢子作为“种子库”引起春季硅藻赤潮爆发的观点[23]相一致。
浮游植物休眠期和营养细胞阶段之间的周期交替是一个复杂的生态过程,也是自然界调节藻类种群发生和消亡的一个重要方面[24]。许多种类的硅藻都能形成休眠孢子。总结A、B、C、D 4组的相关数据,在本实验中,布氏双尾藻休眠孢子形成所对应的氮浓度变化范围是13.13~26.11 μmol/L(图7)。A组和 B组在休眠孢子刚形成时,培养基中的氮浓度均低于27 μmol/L,此后氮浓度始终低于该值且不断有休眠孢子形成。双突角毛藻(Chaetoceros didymus)和扁面角毛藻形成休眠孢子时,培养基中氮浓度分别保持在4 μg/L(0.29 μmol/L)和10 μmol/L以下[25-26],由此可见布氏双尾藻比双突角毛藻和扁面角毛藻对环境中氮浓度的降低更敏感。说明在形成休眠孢子时,硅藻对环境中的氮浓度敏感程度不一,具有种间差异性,这与郑磊等[1]在比较了中华半管藻(Hemiaulus sinensis)、范氏角毛藻(C. vanheurckii)、诺氏海链藻(Thalassiosira nordenskioldi)等种类后得出的结论一致。

图7 各组培养基中氮浓度与布氏双尾藻休眠孢子密度的关系Fig. 7 Relationship between N concentration in the Ditylum brightwellii resting spore formation culture medium and the density of the resting spores
培养基中氮的初始浓度对休眠孢子出现时间有影响。 氮的初始浓度越低,休眠孢子出现越早(B组,3天); 氮的初始浓度越高,休眠孢子出现越晚(A组,4天)。虽然A组在第3天培养基中的氮浓度已明显下降至28.72 μmol/L,但仍高于27 μmol/L,因此未观察到有休眠孢子出现。
3.2 磷对布氏双尾藻休眠孢子形成的影响
休眠孢子开始形成时(第3天),B组、C组和D组培养基中的磷浓度与最初相比分别减少了 11.86%、18.69%、37.78%,即在孢子形成前,培养基中磷初始浓度越低,磷的相对消耗量越高。总体上,各组培养基中的磷浓度保持相对稳定,说明布氏双尾藻对磷的需求相对较小。本实验中B组、C组和D组在第3天都形成了休眠孢子,形成时间并无差异,且各组氮浓度的变化也无明显差异(P>0.05,图 8),说明氮对布氏双尾藻休眠孢子的形成仍是主导因素。

图8 B组、C组和D组氮浓度随时间的变化Fig. 8 Changes in N concentration in the culture medium ofgroups B,C,and D
培养基中磷的初始浓度对休眠孢子密度和形成率有影响。磷初始浓度最高的 B组,其休眠孢子形成率及休眠孢子密度的最大值(46.45%,560个/mL)远远高于C组(24.47%,250个/mL)和D组(24.69%,257个/mL); C组和D组的休眠孢子形成率及休眠孢子密度最大值分别相近(P>0.05)。说明较高浓度的磷具有促进布氏双尾藻休眠孢子形成的作用,磷浓度的改变在这一过程中为次要因素。Oku和Kamatani[3]的结果表明,拟旋链角毛藻在培养过程中,磷初始浓度较低(2 μmol/L)时,休眠孢子形成率最终维持在大概65%的水平; 而磷初始浓度较高(10 μmol/L)时,休眠孢子形成率最终为34%。两个实验结果的差异可能是因为当培养基中的氮浓度下降到能够形成休眠孢子的水平时,较高浓度的磷(初始浓度为 50 μmol/L)更有利于布氏双尾藻细胞储存磷脂、蛋白质和糖类等物质[3],保证其休眠需要,从而有更多孢子的形成。
休眠孢子形成率取决于氮、磷的共同作用。低氮高磷的B组(氮: 20 μmol/L,磷: 50 μmol/L)休眠孢子形成率最高,其休眠孢子密度也最高,同时该组的休眠孢子形成速度在第 5天也最先达到最大值其余3组均在第7天。这是本实验中诱导休眠孢子形成的最佳氮磷比。
综上所述,布氏双尾藻在培养过程中,当培养基中的氮(NO3-+NO2-)浓度在27 μmol/L以下时,休眠孢子即可形成。较高浓度(50 μmol/L)的磷具有促进休眠孢子形成的作用,休眠孢子的形成受培养基氮、磷浓度的共同影响。
参考文献:
[1] 郑磊,林均民,金德祥. 中华半管藻休眠孢子的形成和萌发[J]. 厦门大学学报(自然科学版),1995,34(2):276-281. Zheng Lei,Lin Junmin,Jin Dexiang. Formation and germination of resting spores in Hemiaulus sinensis Grev[J]. Journal of Xiamen University (Natural Science),1995,34(2): 276-281.
[2] McQuoid M R,Hobson L A. Diatom resting stages[J]. Journal of Phycology,1996,32(6): 889-902.
[3] Oku O,Kamatani A. Resting spore formation and phosphorus composition of the marine diatom Chaetoceros pseudocurvisetus under various nutrient conditions[J]. Marine Biology,1995,123: 393-399.
[4] Kudo I,Yoshimura T,Yanada M,et al. Exhaustion of nitrate terminates a phytoplankton bloom in Funka Bay,Japan: change in SiO4: NO3consumption rate during the bloom[J]. Marine Ecology Progress Series,2000,193: 45-51.
[5] Seckbach J,Kocielek J P. The Diatom World[M]. New York: Springer,2011: 222.
[6] 谢文玲,康燕玉,高亚辉. 硅藻休眠孢子生活史的研究进展[J]. 海洋科学,2006,30(9): 75-78. Xie Wenling,Kang Yanyu,Gao Yahui. Review on the life history of diatom resting spores[J]. Marine Sciences,2006,30(9): 75-78.
[7] Tomaru Y,Takao Y,Suzuki H,et al. Isolation and characterization of a single-stranded RNA virus infecting the bloom forming diatom Chaetoceros socialis[J]. Applied and Environmental Microbiology,2009,75:2375-2381.
[8] Oku O,Kamatani A. Resting spore formation of the marine planktonic diatom Chaetoceros anastomosans induced by high salinity and nitrogen depletion[J]. Marine Biology,1997,127(3): 515-520.
[9] Durbin E G. Aspects of the biology of resting spores of Thalassiosira nordenskioeldii and Detonula confervacea[J]. Marine Biology,1978,45: 31-37.
[10] Yoshimura T,Nishioka J,Ogawa H,et al. Dissolved organic phosphorus production and decomposition during open ocean diatom blooms in the subarctic pacific[J]. Marine Chemistry,2014,165: 46-54.
[11] Berges J A,Franklin D J,Harrison P J. Evolution of an artificial seawater medium: Improvements in enriched seawater,artificial water over the past two decades[J]. Journal of Phycology,2001,37(6): 1138-1145.
[12] 中华人民共和国国家技术监督局. GB17378-1998海洋监测规范[S]. 北京: 中国标准出版社,1999. General Administration of Quality Supervision,Inspection and Quarantine of the People's Republic of China (CSBTS). GB17378-1998 The specification for marine monitoring[S]. Beijing: Standards Press of China,1999.
[13] Hecky R E and Kilham P. Nutrient limitation of phytoplankton in freshwater and marine environments: a review of recent evidence on the effects of enrichment[J]. Limnology and Oceanography,1988,33: 796-822.
[14] Vitousek P M and Howarth R W. Nitrogen limitation on land and in the sea - how can it occur?[J]. Biogeochemistry,1991,13: 87-115.
[15] Elser J J,Bracken M E S,ClelandE E,et al. Global analysis of nitrogen and phosphorus limitation of primary producers in freshwater,marine and terrestrial ecosystems[J]. Ecology Letters,2007,10: 1135-1142.
[16] Leakey R J L,Burkill,P H,Sleigh M A. Planktonic ciliates in Southampton Water: abundance,biomass,production,and role in pelagic carbon flow[J]. Marine Biology,1992,114: 67-83.
[17] Kifle D,Purdie D A. The seasonal abundance of the phototrophic ciliate Mesodinium rubrum in Southampton Water,England[J]. Journal of Plankton Research,1993,15(7): 823-833.
[18] Iriarte A,Purdie D A. Size distribution of chlorophyll a biomass and primary production in a temperate estuary (Southampton Water): the contribution of photosynthetic picoplankton[J]. Marine Ecology Progress Series,1994,115: 283-297.
[19] Howard A G,Comber S D W,Kifle D,et al. Arsenic speciation and seasonal changes in nutrient availability and microplankton abundance in Southampton Water,U.K[J]. Estuarine coastal and shelf science,1995,40:435-450.
[20] Ryther J H,Dunstan W M. Nitrogen,phosphorus and eutrophication in the coastal marine environment[J]. Science,1971,171: 1008-1013.
[21] 李青俞. 不同光照和温度条件下中肋骨条藻休眠孢子萌发中氮代谢过程的初步研究[D]. 厦门: 厦门大学,2011. Li Qingyu. The primary study on the nitrogen metabolism of Skeletonema costatum resting spores during germination under different light intensity and temperature[D]. Xiamen: Xiamen University,2011.
[22] 李亚力,沈志良,线薇微,等. 长江口营养盐结构特征及其对浮游植物的限制[J]. 海洋科学,2015,39(4): 125-134. Li Yali,Shen Zhiliang,Xian Weiwei,et al. Structure characteristics of nutrients and their restrictive effect on phytoplankton in the Yangtze River Estuary[J]. Marine Sciences,2015,39(4): 125-134.
[23] Itakura S,Imai I,Itoh K. Seed bank of coastal planktonicdiatom s in bottom sediments of Hiroshima Bay,Seto Inland Sea,Japan[J]. Marine Biology,1997,128: 497-508.
[24] 谢文玲,高亚辉. 海洋浮游植物休眠期的生态学研究[J].厦门大学学报(自然科学版),2006,45: 240-244. Xie Wenling,Gao Yahui. A review on the ecology of resting stages of the marine phytoplankton[J]. Journal of Xiamen University (Natural Science),2006,45: 240-244.
[25] 林均民,金德祥. 双突角毛藻休眠孢子的形成和萌发[J].海洋学报,1986,8(1): 92-99. Lin Junmin,Jin Dexiang. Formation and germination of resting spores in Chaetoceros didymus[J]. Acta Oceanologica Sinica,1986,8(1): 92-99.
[26] 孙琳,高亚辉,陈长平,等. 氮、硅限制对赤潮藻扁面角毛藻休眠孢子形成的影响[J]. 植物学报,2009,44(5): 601-607. Sun Lin,Gao Yahui,Chen Changping,et al. Effects of nitrogen and silicon limitation on resting spore formation of red tide-causing alga Chaetoceros compressus (Bacillariophyta)[J]. Chinese Bulletin of Botany,2009,44(5): 601-607.
(本文编辑: 张培新)
中图分类号:Q945.78
文献标识码:A
文章编号:1000-3096(2016)04-0040-06
doi:10.11759/hykx20150206003
收稿日期:2015-02-06; 修回日期: 2015-07-08
基金项目:国家自然科学基金(NO. 41276100); 中国科学院战略性先导科技专项(XDA11020103); 福建省自然科学基金(2010J01232)
作者简介:李朗(1991-),男,回族,安徽阜阳人,硕士研究生,主要从事海洋硅藻学研究,电话: 18030179752,E-mail: imlilang1991@163.com; 陈长平,通信作者,E-mail: chencp@xmu.edu.cn; 章军,通信作者,E-mail: jzhang@xmu.edu.cn库株系号: MMDL5153)分离自厦门海域,采用改良后的f/2培养基保种培养。
Effects of different concentrations of nitrogen and phosphorus on the resting spore formation of Ditylum brightwellii (West)Grunow
LI Lang1,GAO Ya-hui1,2,LIU Guang-fa1,2,LIANG Jun-rong1,2,ZHAO Long1,HU Xiao1,XU Hua-lin3,ZHANG Jun1,CHEN Chang-ping1,2
(1. School of Life Sciences,Xiamen University,Xiamen 361102,China; 2. Key Laboratory of the Coastal and Wetland Ecosystems,Ministry of Education,Xiamen 361102,China; 3. The Administrative Bureau of Neilingding-Futian National Nature Reserve,Shenzhen 518040,China)
Received: Feb. 6,2015
Key words:Ditylum brightwellii; Nitrogen; Resting spores; Phosphate
Abstract:In some species of diatoms,resting spore formation is a common phenomenon observed during adverse environmental conditions and is usually related to the level of nitrogen (N)and phosphorus (P). This study presents the effects of different concentrations of N and P on Ditylum brightwellii (West)Grunow resting spore formation. We counted the resting spores,calculated the resting spore densities,and quantified the nutrients in the medium. The results revealed that D. brightwellii formed resting spores when the N concentration in the culture medium fell below 27 μmol/L. Moreover,D. brightwellii formed resting spores earlier when the initial N concentration was low. Resting spores all appeared at day 3 when P concentration was the single variable factor. P concentrations in these groups changed slightly. Under higher P concentrations (50 μmol/L),the density and ratio of resting spores were both markedly higher than those under lower P concentrations (20 μmol/L and 10 μmol/L). The group with the lowest N and highest P concentrations (N: 20 μmol/L,P: 50 μmol/L)had the highest density and ratio of spores; thus,N and P had a mutual influence on resting spore formation.
