木质纤维素水解液中酚类抑制物去除的研究进展1
2016-07-25谢瑶嬛曹淑贞王风芹宋安东
谢瑶嬛, 曹淑贞, 王风芹, 谢 慧, 宋安东
(河南农业大学 生命科学学院 农业部农业微生物酶工程重点实验室,河南 郑州 450002)
木质纤维素水解液中酚类抑制物去除的研究进展1
谢瑶嬛, 曹淑贞, 王风芹, 谢 慧, 宋安东
(河南农业大学 生命科学学院 农业部农业微生物酶工程重点实验室,河南 郑州 450002)
摘 要:利用木质纤维素水解液发酵产乙醇、丁醇已成为一种极具发展前景的可再生能源生产方式。然而,木质纤维素水解液中产生的酚类物质对发酵起抑制作用并严重阻碍溶剂产生。文章系统介绍了木质纤维素水解液中产生的酚类物质含量及其对终产物发酵的影响,综述了近年来国内外利用生物法去除酚类的效果,阐述了自脱毒发酵菌株的构建。最后,对如何提高水解液中抑制物去除率提出建议与展望。
关键词:木质纤维素;抑制物;酚类;漆酶
随着能源和资源全球化及其不断损耗,可再生能源成为人们日益关注的焦点。乙醇和丁醇作为新型可再生能源,因其良好的燃料性能,化石能源逐步为其所替代[1]。木质纤维素(lignocellulose)是自然界存在的一种可再生资源,贮藏丰富并蕴含着巨大的生物质能,以木质纤维素为原料来生产燃料乙醇、丁醇是缓解能源危机的重要途径之一,也是在环境保护和能源危机之间寻求平衡的令人瞩目的新领域。
然而,木质纤维素经预处理和酶解所得水解液中存在着大量繁杂的有毒物质,主要包括酸类、酚类和醛类三大类。纤维素大分子包裹着木质素和半纤维素的特殊结构使得木质纤维素在利用前必须对原料进行预处理,此过程中纤维素转化为葡萄糖、木糖等多糖,木质素则降解成多种单环芳香族化合物[2]。高温下,上述产物会进一步发生多种形式的分解和氧化,产生甲酸、乙酸等有机酸,糠醛、羟甲基糠醛等呋喃类发酵抑制物,这些抑制物通过抑制微生物的生长而影响了后期的发酵。因此,去除水解液中的抑制物是木质纤维素高效利用的关键环节之一。
本文综述了木质纤维素水解液中酚类物质的种类、含量、对微生物的抑制作用及脱毒方法的研究进展,为实现木质纤维素与可再生能源的高效转化提供了参考。
1 木质纤维素水解液中酚类抑制物的种类与含量
木质纤维素水解液中的酚类物质主要来源于木质素的降解,它们通常是含苯环的芳香族化合物,虽然含量相对醛类较低,但其抑制作用较于其他物质更为严重。
Carlos Martin对甘蔗渣进行两种不同条件的爆破预处理,在205℃的爆破条件下水解液经纤维素酶水解,总酚量达4.1 g/L,而215℃条件下的总酚多达4.5 g/L[3]。Martin也对烟秆进行了不同爆破条件处理,205℃下5 min得到的水解液总酚含量0.3 g/L,而10 min处理的水解液总酚含量达0.6 g/L[4]。小麦秸秆经蒸汽爆破预处理后,在酶解得到的水解液中测得香草醛21 mg/L,丁香醛10 mg/L,香豆酸和阿魏酸分别为17 mg/L 和26 mg/L[5],其中香草醛的抑制作用最为显著。林贝用稀酸预处理玉米秸秆,后期为了提高发酵培养基中糖浓度将水解液浓缩大约 3倍,致使香草醛含量达到5.6 g/L[6],尽管糖含量提高,但如此多的香草醛会严重影响菌体的生长,糖的利用率也随之降低。表1总结了文献报道的不同木质纤维素水解液中各种酚类物质的含量。

表1 不同木质纤维素水解液中酚类抑制物的含量
2 木质纤维素水解液中酚类物质对微生物的抑制作用
木质素的降解物会渗透到细胞膜内,破坏细胞膜结构的完整性,从而影响发酵微生物的正常生长,降低发酵效率[13]。有研究表明,氯代酚类化合物会降低微生物的呼吸率,严重抑制微生物的呼吸反应[14]。表2总结了香草醛、丁香醛和4-羟基苯甲醛对微生物发酵的影响,其中香草醛的抑制作用最为显著。
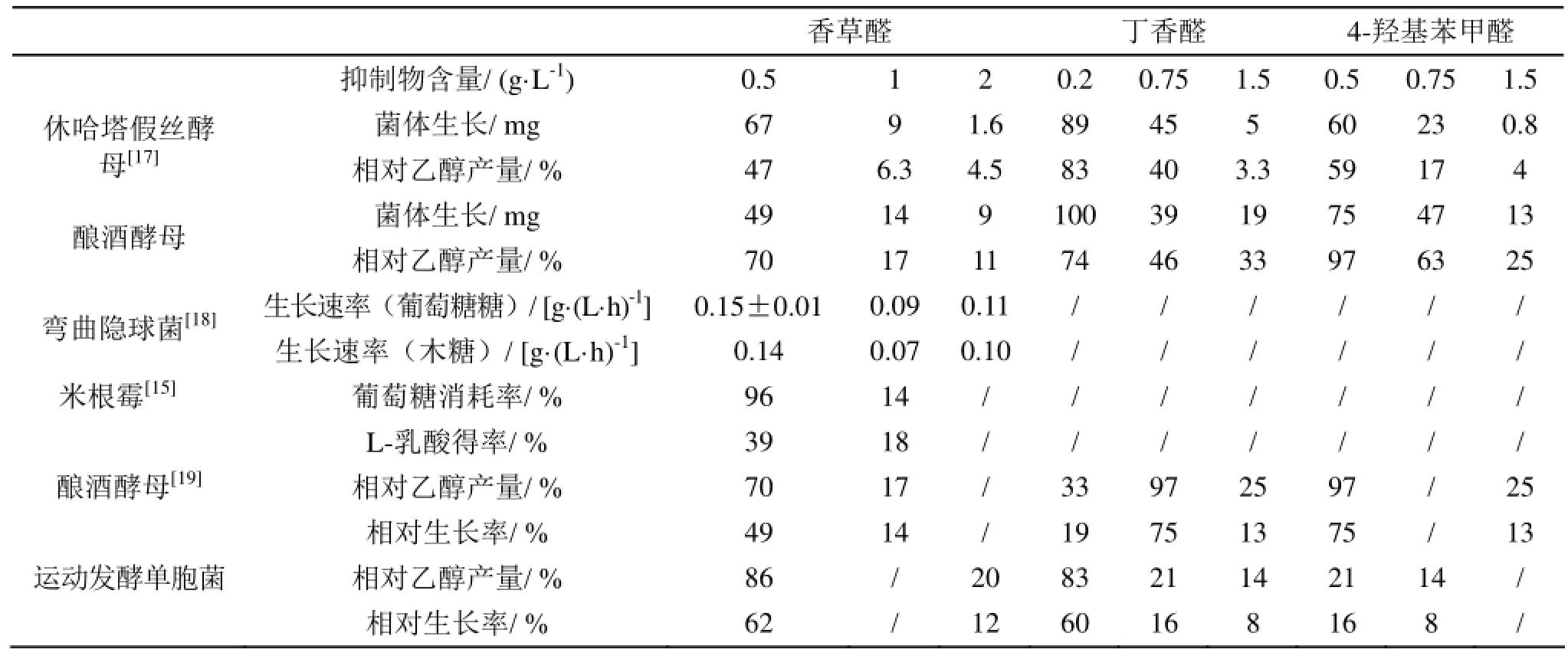
表2 水解液中酚类抑制物对菌体及发酵结果的影响
相对乙醇产量=实验组乙醇产量/对照组乙醇产量;相对生长率=实验组菌体生长量/对照组菌体生长量;
葡萄糖消耗率=葡萄糖残余量/糖初始含量;L-乳酸得率=L-乳酸最大生成量/糖初始含量4 g/L香草醛完全抑制了酿酒酵母6508-127对木糖的利用,菌体自身生长也被完全抑制,同时乙醇生成缓慢,6 g/L香草醛的存在使得乙醇发酵完全受到抑制[6]。刘哲对米根霉AS3.819的发酵进行研究,在香草醛含量较低时(<0.5 g/L)可显著促进葡萄糖的代谢,48 h即可全部消耗尽,而含量超过0.8 g/L,葡萄糖的代谢受到明显抑制[15]。目前,通过对菌株进行驯化以获得耐受性强且性状稳定的发酵菌株同样成为一种经济可行的高产发酵手段[16]。
3 木质纤维素水解液中酚类物质的去除方法
目前对木质纤维素水解液中发酵抑制物的脱毒方法主要分为三类,物理法脱毒、化学法脱毒、生物法脱毒。Converti等[20]在2000年研究证明,旋转蒸发只适用于乙酸、糠醛等易挥发性物质的去除,并伴随酚类物质增加,同时损失葡萄糖和木糖等可发酵糖。离子交换法的脱毒效果较好,但糖损失率高。化学方法中以overliming应用最为广泛,通过Ca(OH)2与硫酸盐的结合部分解除无机离子对发酵的抑制作用,但其酚类抑制的解除尚不显著,仍需其他方法辅助,这些理化脱毒法效果并不理想且能源消耗严重,甚至导致环境恶化[21]。生物法脱毒作为有效脱毒方式,通过改变抑制物的结构而降低其毒性,相对于理化脱毒具有操作简单明确,目的准确直接且对水解液中多糖物质无影响的优势,因此是一种高效且环保的脱毒方法。
3.1 酚类物质的酶法脱除
木质纤维素水解液酶法脱毒研究中应用最广泛的是利用漆酶脱除水解液中的酚类物质。
漆酶属于多铜氧化酶,是由多种植物和真菌产生的一种胞外酶,它利用自己的催化功能将1分子的氧转化成为2分子的水,同时将4分子的底物氧化成为4分子自由基,利用这种催化剂可以实现对酚类物质的高效转化。作为水解液中酚类物质去除的有效方法,漆酶的酶法脱毒具有独特的优势。与化学脱毒法和物理脱毒法相比,酶法脱毒更具专一性和高效性。Martinez经研究发现使用overliming进行脱毒总酚的最大去除率仅为41±6%[22]。而Converti等证明漆酶去酚率可达80%左右[20]。同时漆酶酶法脱毒过程操作简单,不用消耗过多额外能量,漆酶的这些优势和它的广泛存在使其具有广泛的工业实用性。
尽管漆酶是一种高效的酚类脱毒方法,但其脱毒效果与诸多因素相关。Moreno发现漆酶的脱毒效果与漆酶的添加时期相关,爆破预处理的小麦秸秆经酶解糖化,对其水解液进行两种不同漆酶脱毒方式,结果显示,酶解前进行脱毒,香草醛含量由26 mg/L减少到3 mg/L,而酶解后进行脱毒其含量由22 mg/L减少到15 mg/L,这说明酶解前脱毒的去酚率高于酶解后,然而比较糖得率与发酵周期,酶解后脱毒的糖得率与发酵周期都低于酶解前脱毒[5]。漆酶的添加时间除了影响到脱毒效果,对纤维素酶的活性也有一定影响。Alfredo Oliva-Taravilla对纤维素酶活性受漆酶脱毒抑制的机理进行了探究,发现糖化过程中加入漆酶,纤维素酶活性受到抑制,于是作者猜想酶活降低的现象是被漆酶催化后的低聚酚类与纤维素形成复合物而产生的,为了克服这种情况,经实验得出当纤维素酶反应30 h后添加漆酶为最佳添加时间,此时水解作用不再受影响[23]。
另外,预处理方式也会影响到漆酶脱毒效果。Miguel Jurado将小麦秸秆爆破处理,随后对经水和1% H2SO4两种不同浸泡处理后的水解率和漆酶脱毒率分别进行比较。实验证明水处理的得糖率高于酸处理,但酸处理的漆酶去酚率相对较高。此实验也找到了反应的最适条件:调pH至5,加漆酶量0.5 U/mL,150 r/min的转速28℃下反应2 h[24]。Carlos Martin通过两种不同蒸汽爆破条件(205℃、215℃)处理甘蔗渣,酶解后用漆酶脱毒,比较两种水解液的的去酚率均为约80%,得此结果可说明此两种爆破条件并不影响漆酶的脱毒效果[3]。Moreno采用200℃、2.5 min和210℃、2.5 min的蒸汽爆破条件对小麦秸秆进行研究,与Miguel Jurado[24]不同的是,作者将爆破料进行不同条件的稀释并在水解前进行漆酶处理,经总酚测定,去除总酚60%~80%,在蒸气爆破200℃、稀释20% DM(w/V)的条件下,去酚量达最高,以S. cerevisiae F12为发酵菌株,此脱毒的水解液作为培养基,乙醇产量相对于未脱毒对照组有明显提升[25]。
除漆酶外,酪氨酸酶和辣根过氧化物酶等也被用于去除木质纤维素水解液酚类物质的研究。安林坤将酪氨酸酶固定化到疏水基团修饰的琼脂珠上,通过对酪氨酸酶的固定化处理,蛋白的吸附率及酶活力的回收分别达到90%和80%,有效地去除了邻苯二酚、苯酚等酚类物质[26]。Wagner等[27]研究发现,辣根过氧化物酶在过氧化氢存在情况下,3 h内可除去约95%的酚类化合物。Jonsson对三种酶脱毒效果进行了比较,将柳木进行蒸汽爆破预处理并水洗,对水洗液进行不酶组合同方式的处理,分别用漆酶、过氧化物酶和两种酶结合,然后发酵,乙醇产量显示单独漆酶脱毒效果比两种酶同时脱毒效果好,然单独漆酶脱毒发酵后糖利用率较低,但总得率单用漆酶的效果最好[28]。
3.2 自脱毒发酵菌株的构建与应用
目前应用于木质纤维素转化的自脱毒发酵菌株最广泛的是漆酶的异源表达菌,漆酶虽已被商业化,但考虑其购买成本,通过异源表达漆酶构建工程菌逐渐受到广泛关注。漆酶基因广泛存在于多种担子真菌和子囊真菌中,并且在许多真菌中漆酶的基因通常成簇状排列[29-30]。对于酚类抑制物的去除,可以通过构建基因工程菌株使发酵微生物具备一定的脱毒能力,进而在发酵的同时去除抑制物,这种脱毒方法无需在发酵前对水解液中强抑制物酚类进行任何脱毒处理,可直接通过生物脱毒与发酵协同进行,进而减少脱毒环节的成本,同时避免了还原糖的损失。Thomas将来自于Myceliophthora thermophila的漆酶基因MtL表达于Saccharomyces cerevisiae中,通过酶活性分析,这种工程菌表达出的漆酶活力提高了约170倍[31]。Bleve 将Pleurotus eryngii中编码胞外漆酶的基因Ery3表达于Saccharomyces cerevisiae 中,经细胞固定化,酶产量139 mU/mL,提升1.6倍,且稳定性好[32]。来自于白腐真菌Trametes versicolor的漆酶基因在启动子PGKI的作用下表达于酿酒酵母 Saccharomyces cerevisiae中,Sso2p的超表达提升了漆酶活力,酶活高达0.002 2 nKat/mL。此外,在1.25 mM松伯醇的SC-Ura培养基中发酵产乙醇10 g/L[33]。
3 展望
对于日渐枯竭的石油资源和日益恶化的环境,以木质纤维素为原料生产乙醇、丁醇具有广阔的发展前景。当今国内外不论是在木质纤维素前处理还是后期的发酵上的研究都在不断进步,但大规模的工厂化仍存在一定困难,难以实现商业化。因此今后的发展可以从以下几点重点考虑:1)对于研究较为深入的三种关键抑制物,多种脱毒方式已显示出高效的酚类、醛类去除率,但甲酸、乙酸的去除尚未有明确可行的方案,因此水解液中小分子酸的去除应成为我们今后努力研究的方向。2)构建高效复合脱毒方法。根据不同脱毒方法的各种抑制物去除效果,协调结合多种有效脱毒方式,例如将去除醛类的物理化学法与去除酚类的生物酶法结合,在尽可能环保节能的基础上,实现最大脱毒率。3)通过基因工程技术修饰或改造发酵菌株的代谢途径,或通过菌种驯化筛选有抗性的发酵菌株,以期提高菌种的耐毒性或糖醇转化率。此方法减少发酵前脱毒步骤与成本,实现了脱毒与发酵同步进行。
参考文献:
[1] 张九花, 蚁细苗, 柳颖, 等. 木质纤维原料制备燃料丁醇的研究进展[J]. 甘蔗糖业, 2014(04): 38-45.
[2] 赵志国, 陈海珊, 覃香香, 等. 木质纤维素水解物生物脱毒的研究进展[J]. 桂林理工大学学报, 2011, 31(3): 443-449.
[3] Carlos Mart´ ın, Galbe M, Wahlbom C F, et al. Ethanol production from enzymatic hydrolysates of sugarcane bagasse using recombinant xylose-utilising Saccharomyces cerevisiae[J]. Enzyme and Microbial Technology, 2002, 31(3): 274-282.
[4] Martín C, Fernández T, García R, et al. Preparation of hydrolysates from tobacco stalks and ethanolic fermentation by Saccharomyces cerevisiae[J]. World Journal of Microbiology & Biotechnology, 2002, 18(9): 857-862.
[5] Moreno A D, Ibarra D, Fernández J L, et al. Different laccase detoxification strategies for ethanol production from lignocellulosic biomass by the thermotolerant yeast Kluyveromyces marxianus CECT 10875[J]. Bioresource Technology, 2012, 106(2): 101-109.
[6] 林贝, 赵心清, 葛旭萌, 等. 玉米秸秆酸解副产物对重组酿酒酵母 6508-127发酵的影响[J]. 中国生物工程杂志, 2007, 27(7): 61-67.
[7] Maria C, Laura C, Alberto G, et al. Effect of inhibitors released during steam-explosion treatment of poplar wood on subsequent enzymatic hydrolysis and SSF[J]. Biotechnology Progress, 2004, 20(1): 200-206.
[8] Larsson S, Reimann A, Nilvebrant N O, et al. Comparison of different methods for the detoxification of lignocellulose hydrolyzates of spruce[J]. Applied Biochemistry & Biotechnology, 1999, 77(1-3): 91-103.
[9] Chundawat S P S, Vismeh R, Sharma L N, et al. Multifaceted characterization of cell wall decomposition products formed during ammonia fiber expansion (AFEX) and dilute acid based pretreatments[J]. Bioresource Technology, 2010, 101(21): 8429-8438.
[10] Prado García-Aparicio M A, Ballesteros I, González A, et al. Effect of inhibitors released during steam-explosion pretreatment of barley straw on enzymatic hydrolysis.[J]. Applied Biochemistry & Biotechnology, 2006, 129-132(1-3): 278-288.
[11] Du B, Sharma L N, Christopher B, et al. Effect of varying feedstock-pretreatment chemistry combinations on the formation and accumulation of potentially inhibitory degradation products in biomass hydrolysates.[J]. Biotechnology & Bioengineering, 2010, 107(3): 430-440.
[12] 金显春, 苏同福, 宋安东, 等. 有机酸、酚类、呋喃等木质纤维素汽爆抑制物对纤维素酶酶解不添加化学物质的汽爆玉米秸秆的影响[J]. 高校化学工程学报, 2013, 27(1): 174-177.
[13] 庄军平, 林鹿, 庞春生, 等. 木质纤维素稀水解液脱毒研究进展[J]. 现代化工, 2009, 29(2): 19-23.
[14] 王金梅, 柯艳霞, 马丽雅, 等. 氯代酚类化合物对微生物呼吸的抑制影响[J]. 承德石油高等专科学校学报, 2007, 9(1): 10-13.
[15] 刘哲. 玉米秸秆水解产物对L-乳酸发酵的影响[D]. 大连工业大学, 2011.
[16] 范超. 通过菌种驯化及循环发酵高效利用木质纤维素水解液生产燃料乙醇的研究[D]. 上海交通大学, 2013.
[17] Delgenes J P, Moletta R, Navarro J M. Effects of lignocellulose degradation products on ethanol fermentations of glucose and xylose by Saccharomyces cerevisiae, Zymomonas mobilis, Pichia stipitis, and Candida shehatae[J]. Enzyme & Microbial Technology, 1996, 19(95): 220-225.
[18] Yu X, Zeng J, Zheng Y, et al. Effect of lignocellulose degradation products on microbial biomass and lipid production by the oleaginous yeast Cryptococcus curvatus[J]. Process Biochemistry, 2014, 49(3): 457-465.
[19] Pol E C V D, Bakker R R, Baets P, et al. By-products resulting from lignocellulose pretreatment and their inhibitory effect on fermentations for (bio)chemicals and fuels.[J]. Applied Microbiology & Biotechnology, 2014, 98(23): 9579-9593.
[20] Converti A, Domínguez J M, Perego P, et al. Wood hydrolysis and hydrolyzate detoxification for subsequent xylitol production[J]. Chemical Engineering & Technology, 2000, 23(11): 1013-1020.
[21] Olofsson K, Bertilsson M, Liden G. A short review on SSF-an interesting process option for ethanol production from lignocellulosic feedstocks[J]. Biotechnology for Biofuels, 2008, 1(7): 1-14.
[22] Martinez A, Rodriguez M E, Wells M L, et al. Detoxfication of dilute acid hydrolysates of lignocellulose with lime[J]. Biotechnol Progr, 2001, 17(2): 287-293.
[23] Oliva-Taravilla A, Tomás-Pejó E, Demuez M, et al. Inhibition of cellulose enzymatic hydrolysis by laccase-derived compounds from phenols[J]. Biotechnology Progress, 2015, 31(3): 700-706.
[24] Jurado M, Prieto A, Ángeles Martínez-Alcalá. Laccase detoxification of steam-exploded wheat straw for second generation bioethanol[J]. Bioresource Technology, 2009(9): 6378-6384.
[25] Moreno A D, Tomás-Pejó E, Ibarra D, et al. In situ laccase treatment enhances the fermentability of steam-exploded wheat straw in SSCF processes at high dry matter consistencies[J]. Bioresour Technol, 2013, 143(1): 337-343.
[26] 安林坤, 马林, 全军民, 等. 固定化酪氨酸酶去除水中酚类物质的研究[J]. 广州环境科学, 1999, 14(4): 16-19.
[27] Wagner M. Detoxification of phenolic solutions with horseradish peroxidase and hydrogen peroxide[J]. Water Research, 2002, 36(16): 4041-4052.
[28] Jönsson L J, Palmqvist E, Nilvebrant N O, et al. Detoxification of wood hydrolysates with laccase and peroxidase from the white-rot fungus Trametes versicolor[J]. Applied Microbiology & Biotechnology, 1998, 49(6): 691-697.
[29] Pezzella C, Autore F, Giardina P, et al. The Pleurotus ostreatus laccase multi-gene family: Isolation and heterologous expression of new family members[J]. Current Genetics, 2009, 55(1): 45-57.
[30] Kilaru S, Hoegger P J, Kües U. The Laccase multi-gene family in Coprinopsis cinerea has seventeen different members that divide into two distinct subfamilies[J]. Current Genetics, 2006, 50(1): 45-60.
[31] Thomas B, Miguel A, Volker S, et al. Functional expression of a fungal laccase in Saccharomyces cerevisiae by directed evolution[J]. Applied & Environmental Microbiology, 2003, 69(2): 987-95.
[32] Bleve G, Lezzi C, Mita G, et al. Molecular cloning and heterologous expression of a laccase gene from Pleurotus eryngii in free and immobilized Saccharomyces cerevisiae cells[J]. Applied Microbiology & Biotechnology, 2008, 79(5): 731-741(11).
[33] Larsson S, Cassland P, Jonsson L J. Development of a Saccharomyces cerevisiae strain with enhanced resistanceto phenolic fermentation inhibitors in lignocellulose hydrolysates by heterologous expression of laccase[J]. Applied & Environmental Microbiology, 2001, 67(3): 1163-1170.
中图分类号:TQ35
文献标识码:A
文章编号:1004-8405(2016)02-0093-06
DOI:10.16561/j.cnki.xws.2016.02.12
收稿日期:2016-01-18
基金项目:国家自然科学基金项目(21206033);河南省高校科技创新团队支持计划(15IRTSTHN014)。
作者简介:谢瑶嬛(1991~),女,硕士研究生;研究方向:微生物能源工程。annayaohuan@163.com
* 通讯作者:宋安东,男,博士,教授;研究方向:微生物能源工程,发酵工程。Song1666@126.com
Recent Advances in Detoxification of Phenolic Compounds in Lignocellulose Hydrolysate
XIE Yao-huan, CAO Shu-zhen, WANG Feng-qin, XIE Hui, SONG An-dong
(Key Laboratory of Enzyme Engineering ofAgricultural Microbiology, Ministry ofAgriculture, College of Life Sciences, Henan Agricultural University, Zhengzhou 450002, China)
Abstract:The fermentation to produce ethanol or butanol by using the lignocellulose hydrolysate has become a renewable energy production mode that provide development prospect extremely. Phenolic compounds have a considerable inhibitory effect on the fermentation and hinder the solvent to produce. The paper systematically introduced the phenolic content in the lignocellulose hydrolysate and the effect onfermented product. Reviewed the domestic and foreign effect of removing phenols by using biological method, and narrated the construction of its own detoxification fermentation strains. Last, make recommendations and prospect on how to improve the removal rate of inhibitor in the hydrolysate.
Key words:lignocellulose; inhibitor; phenolic compound; laccase
