活体动物中大环内脂类残留检测微生物抑制法的建立
2016-07-25陈本龙王乃福李卫华天津出入境检验检疫局动植物与食品检测中心天津30046中国动物卫生与流行病学中心青岛66000
黄 晨,陈本龙,王乃福,李卫华(.天津出入境检验检疫局动植物与食品检测中心,天津 30046;.中国动物卫生与流行病学中心,青岛 66000)
活体动物中大环内脂类残留检测微生物抑制法的建立
黄 晨1,陈本龙1,王乃福1,李卫华2
(1.天津出入境检验检疫局动植物与食品检测中心,天津 300461;2.中国动物卫生与流行病学中心,青岛 266000)
摘要:[目的]建立活体动物中大环内酯类残留的检测方法。[方法]采用微生物抑制方法,对藤黄微球菌CMCC 28001的选择性和特异性、样品提取方法、平板制备条件、方法检出限等技术参数进行研究。[结果]建立的方法可用于活体动物中红霉素、泰乐菌素、螺旋霉素、林可霉素、吉他霉素和克林霉素等6种大环内脂类药物的残留检测。当菌悬液添加浓度为10-3倍稀释液(5.5×106CFU/mL)以及培养基PH值为7.5且培养温度为30℃时,可产生直径最大,边缘光滑、完整、清晰的抑菌圈。[结论]该方法具有良好的敏感性和重复性,成本低,操作简便,是色谱分析、免疫分析等其它方法的有益补充。
关键词:微生物抑制法;藤黄微球菌;大环内脂;残留;活体动物;抗生素
大环内酯类抗生素(macrolide antibiotics,MALs)是一类化学结构和抗菌作用相近的碱性抗生素群,属于中谱抗生素。根据其化学结构的差异,大环内酯类抗生素可分为14元环类,如红霉素(Erythromycin)、罗红霉素(Roxithromycin)、地红霉素(Dirthromycin);15元环类,如阿奇霉素(Azithromycin);16元环类,如螺旋霉素(Spiramycin)、交沙霉素(Josamycin)、柱晶白霉素(Kitasamycin)和麦迪霉素(Midecamycin)[1-2]。兽医临床中常将其用于治疗和预防畜禽呼吸道及消化道疾病,其对需氧革兰阳性细菌、革兰阴性球菌、厌氧球菌及军团菌属、支原体属、衣原体属等病原体有较强的抗菌活性,如红霉素、泰乐菌素被广泛用于家禽呼吸道疾病的治疗[3]。可是,如果大环内酯类抗生素的使用方法不当或非法超量添加,可造成其在动物体内或组织中的残留。尽管大环内酯类抗生素本身对机体没有很强的毒性,但一些敏感个体食用了含有大环内酯类抗生素的肉品后会产生剧烈的过敏反应或胃肠道紊乱、腹泻、恶心和呕吐、肝损害等[4]。兽药残留的问题已引起国际社会的广泛关注和各国政府的高度重视[5]。因此许多国家对动物使用大环内酯类抗生素进行了严格控制。本研究可应用于进出口活动物大环内酯类抗生素的快速筛选检测,同时对大环内酯类抗生素的残留监控及强化食品安全有着重要意义。
1 材料和方法
1.1 设备
培养皿、离心机、牛津杯、恒温培养箱(0~50℃)、游标卡尺、电子天平(感量0.0001 g)、高压灭菌器、可调移液器等。
1.2 菌种
藤黄微球菌 Micrococcus luteus CMCC 28001。
1.3 培养基
1.3.1 细菌保存和传代培养基。称量蛋白胨10.0 g、牛肉膏3.0 g、氯化钠5.0 g、琼脂15.0 g ,加入蒸馏水定容至1 000 mL,调节pH值为7.3±0.1,将各成分加热溶解,分装试管,121℃高压灭菌15 min。
1.3.2 增菌固体培养基。称量牛肉膏1.5g、酵母膏3.0 g、胰酪蛋白4.0 g、蛋白胨6.0 g、葡萄糖1.0 g、琼脂15.0 g,加入蒸馏水定容至1 000 mL,调节pH值为6.55±0.05,将各成分加热溶解,分装300 mL于克氏瓶内,121℃高压灭菌15 min。
1.3.3 检定培养基。称量牛肉膏1.5 g、酵母膏3.0 g、蛋白胨6.0 g、琼脂15.0 g、加入蒸馏水定容至1 000 mL,调节pH值为7.5±0.1,将各成分加热溶解,分装每瓶100 mL,121℃高压灭菌15 min。
1.4 试剂
除另有规定外,所用试剂均为分析纯,实验用水为蒸馏水,符合GB/T 6682的规定。
1.4.1 甲醇。
1.4.2 pH8.0磷酸盐缓冲液。称取0.523 g磷酸二氢钾(KH2PO4)及16.73 g磷酸氢二钾(K2HPO4),用蒸馏水溶解并定容至1000 mL,121 ℃高压灭菌15 min。
1.4.3 标准物质红霉素。纯度≥98%。
1.4.4 红霉素标准储备液。浓度为10μg/mL。称取标准物质红霉素20.0 mg(精确至0.1mg),先用少量甲醇溶解,再用pH8.0磷酸盐缓冲液定容至2 000 mL,置2~8℃冰箱中保存,可使用7 d。
1.4.5 红霉素标准工作液。取红霉素标准储备液,用pH8.0磷酸盐缓冲液稀释成浓度为0.025μg/mL、0.05μg/mL、0.1μg/mL、0.2μg/mL、0.4μg/mL、0.8μg/mL的标准工作液,须当日配制使用。
1.5 测定步骤
1.5.1 样液制备
1.5.1.1 血液。未加入抗凝剂的全血样品于室温(20~22℃)静置2~4 h(防止暴晒),待全血凝固并析出血清,将上层血清3 000 g离心15 min,取上清液进行检测。
1.5.1.2 尿液。样液经3 000 g离心15 min后,取上清液进行检测。
1.5.2 菌悬液的制备[6]。将复活的菌种接种于盛有增菌用固体培养基的克氏瓶中,反复倾斜克氏瓶,使菌液均匀覆盖在培养基表面,30℃培养(18±1)h后,用10 mL灭菌生理盐水洗下菌苔,制成菌悬液,2~8 ℃冰箱中保存,贮存期15 d。
1.5.3 菌悬液用量的测定。实际测定前,把不同量的菌悬液加入到检定培养基中,制成平板,能使0.05μg/mL红霉素标准工作液产生大于等于10 mm清晰、完整的抑菌圈为最佳菌悬液用量。
1.5.4 检定用平板的制备。将检定培养基熔化后,冷却至45~50℃,加入适量菌悬液,混匀。立即取15 mL,注入培养皿中,使培养基均匀覆盖在其底面,保持水平使其凝固。制备好的平板置2~8℃冰箱中保存,贮存期2~3 d。
1.5.5 测定。取制备好的检定用平板3个,在平板底部做好标记,把牛津杯适当间隔置于平板上,每个平板最多不超过6个。在相间隔的3个牛津杯中滴满标准参考浓度工作液,另外3个牛津杯内加满被测样液,将陶瓦盖盖好,置30℃培养(18 ±1)h,翻转平板,除去牛津杯,如有抑菌圈产生,精确测量其直径。
1.5.6 结果判定。检定平板上待测样品不产生抑菌圈或抑菌圈直径<10 mm的判定为“阴性”。检定平板上待测样品产生抑菌圈,抑菌圈直径≥10mm的判定为“初筛阳性”。
2 结果与讨论
2.1 菌悬液浓度的影响
取藤黄微球菌增菌克氏瓶,用适量无菌生理盐水洗下全部菌苔,充分震荡后作为原液,并依次稀释到10-1、10-2、10-3、10-4直至10-8倍,然后利用平板菌落计数法计数,同时以无菌生理盐水作为空白,在600 nm波长下测定OD值,结果见表1。分别取10-2、10-3、10-4、10-5倍稀释液,作为菌悬液加入到测定培养基中,培养18 h后发现10-5倍稀释液平板上抑菌圈非常模糊,边缘不清晰,难以测量。10-2、10-3、10-4倍稀释液的标准曲线见图1。
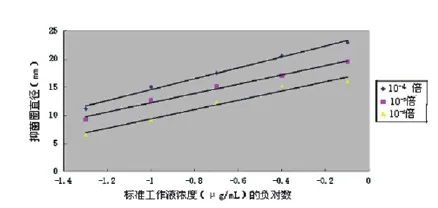
图1 菌悬液浓度的影响

表1 不同浓度菌悬液的OD值
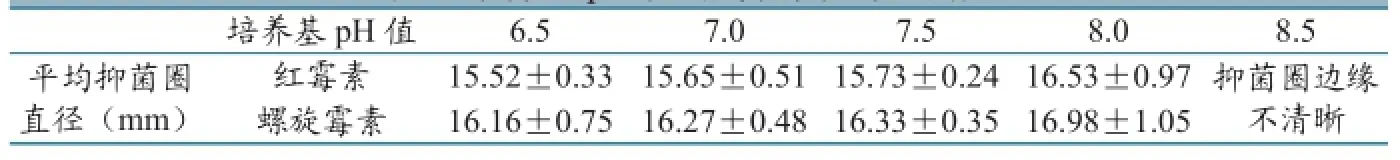
表2 培养基pH 值对抑菌圈直径的影响
从图1可以看出,10-2、10-3、10-4倍稀释液三者的准确度比较接近,灵敏度依次增加。10-3倍稀释度的菌悬液准确度最高,虽然其灵敏度稍低于10-2倍稀释度,但其产生的抑菌圈非常清晰,最容易观察和测量。
2.2 培养基pH值对抑菌圈大小的影响
分别配置pH值为6.5、7.0、7.5、8.0、8.5的检定培养基制备平板,每一工作pH值重复制备3个平板,30℃培养,测定不同pH值培养平板上各标准品中心参照浓度所产生的抑菌圈直径的平均值,不同时间重复测定3次,比较pH值在6.5~8.5范围的检定培养基对抑菌圈大小的影响,结果见表2。
结果表明:pH值为6.5、7和7.5时,虽然抑菌圈直径并不都是愈来愈大,但其差异不显著;pH值为8.0和8.5时,随pH值的增大,细菌的生长受到抑制,抑菌圈边缘愈来愈不平整、不清晰。就整体而言,pH值为7.5时菌落生长致密,可产生最大的、边缘清晰完整的抑菌圈,所以本实验的最适pH值选定为7.5。
2.3 单双层平板的比较
2.3.1 单层平板的比较。取4套平板,均铺成单层平板,每套平板中单个培养基的加量分别为10 mL、15 mL、20 mL、25 mL,所得数据见图2。从比较结果可以看出,随着培养皿中检测培养基加量的增加,检测的灵敏度逐渐降低,但其斜率变化不大,加量为15 mL时准确度较高。
2.3.2 双层平板的比较。变换各种不同底层和菌层培养基的配比,依次制成双层(20+5) mL、(15+5) mL、(15+10) mL、(10+10) mL(“+”号前后两个数字分别代表底层和菌层培养基的加量)平板各一套,30℃培养18 h后测量各抑菌圈直径,所得标准曲线见图3。从比较结果可以看出,各曲线斜率比较接近,即对检测的准确度影响不大,但对同一菌层而言,较小底层培养基加量的灵敏度较高,这可能是由于提高了指示菌敏感性的缘故。
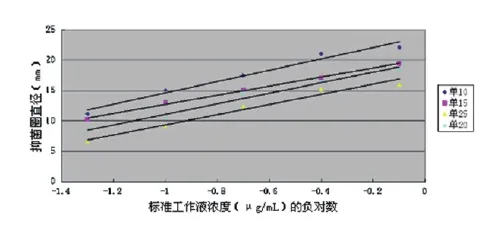
图2 单层平板的比较

图3 双层平板的比较
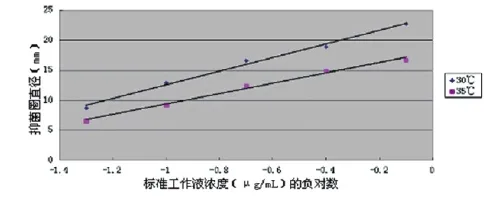
图4 温度的影响
2.3.3 比较。结合两种平板的比较结果发现,采用单层加量15 mL或者双层(15+5)mL的培养基都可以得到较好的结果,但考虑到操作的方便性,选用单层加15 mL培养基。
2.4 培养温度的影响
采用三种不同的培养温度(25℃、30℃、35℃),培养18 h后,在30℃和35℃培养的平板均出现较清晰的抑菌圈,而在25℃的培养平板上培养至48 h时,抑菌圈边缘仍比较模糊。30℃和35℃的标准曲线见图4。从结果可以看出,30℃培养的斜率较大,x轴截距较小,所以选择30℃作为检测的培养温度比较合适。
2.5 最低检测限的确定
取红霉素和螺旋霉素标准储备液用磷酸盐缓冲液稀释成不同浓度,以相应标准溶液的中心浓度为参照浓度,加入到相间隔的3个牛津杯中,其余3个牛津杯中加入其它浓度中的1个,重复3个平板。用藤黄微球菌做抑菌实验,测定各浓度标准品稀释液所产生的抑菌圈直径,以产生明显抑菌圈的最小浓度为最低检测限,结果见表3。
由测定结果可知,本方法在活体动物血液和尿液中大环内酯类抗生素的最低检测限为0.05 mg/kg。查阅资料可知,大环内酯类抗生素在体内分布广泛,由于其呈弱碱性和脂溶性,在组织/血浆中的比值为(5~10)∶1,且在低pH值的组织特别是肺组织中浓度较高,一般肝>肺>肾>血浆,肌肉和脂肪中浓度最低[7]。 由此可知,按照此方法检出活体动物大环内酯类抗生素阳性后,可按照5~10倍含量推算该动物肌肉组织中的大环内酯类抗生素残留量。
2.6 交叉反应与特异性测定

表3 测定低限
2.6.1 交叉反应性测定。为了验证本方法对大环内酯类药物的选择性,选取红霉素、螺旋霉素、泰乐菌素、林可霉素、吉他霉素、克林霉素进行交叉反应试验。在磷酸盐缓冲液中加入一定浓度的药物标准品,分别测定其抑菌圈直径(重复6次),计算平均值,结果见表4。结果表明本方法对各大环内酯类药物高度敏感。
2.6.2 特异性测定。用磷酸盐缓冲溶液配制0.05μg/mL的红霉素、螺旋霉素、恩诺沙星、链霉素、氯霉素、四环霉素的标准溶液,分别培养,测定6次样品抑菌圈直径,计算平均值,结果见表5。结果表明其他类药物经培养不能产生边缘清晰的抑菌圈,说明本方法对各大环内酯类药物特异性良好。
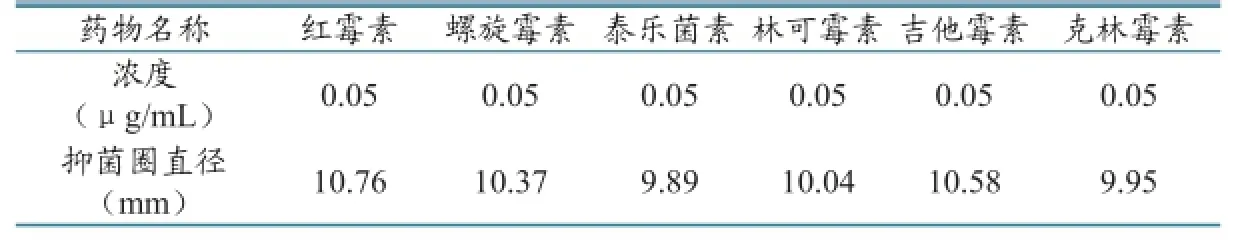
表4 交叉反应测定结果(n=6)
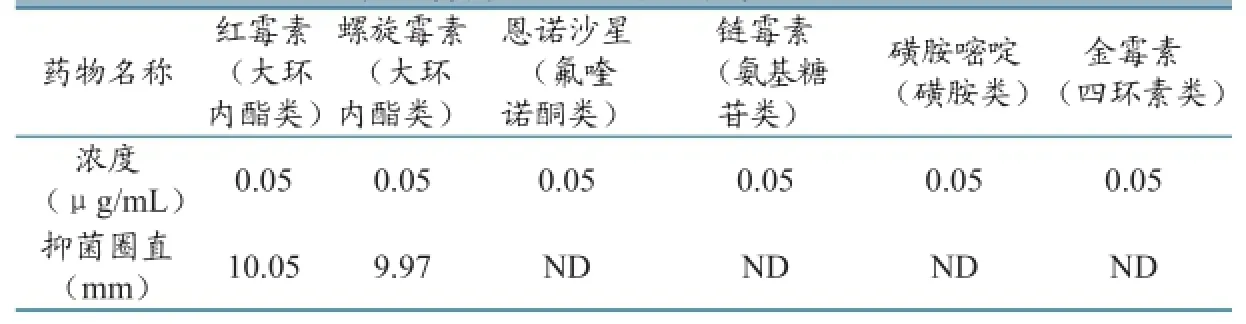
表5 特异性反应测定结果(n=6)
2.7 精密度试验
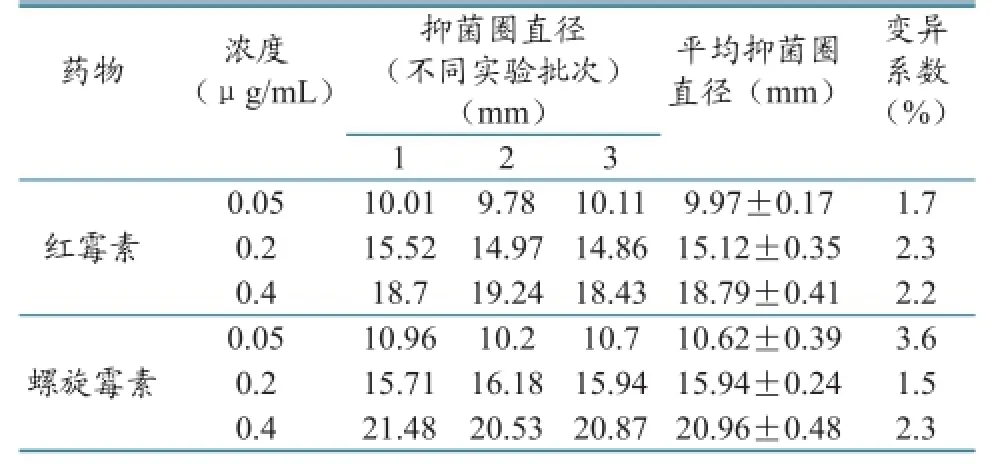
表6 日内差异(n=3)
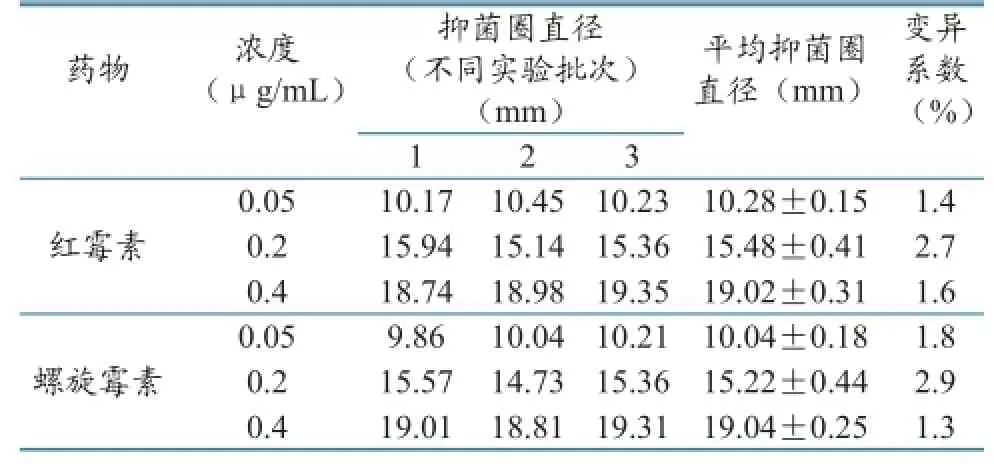
表7 日间差异(n=3)
精密度是指用某种方法重复测定同一均值样品所得测定值的彼此接近程度,表示分析结果的重复性,常用变异系数(CV)表示。选择高、中、低3个浓度在同一日和不同日分别测定3批,计算其日内及日间差异,结果见表6、表7。公式如下:
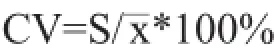
式中:S为标准偏差;—x为各测量值的平均值。
实验结果表明,本实验的日内和日间差异变异系数均低于10%,说明本实验具有较高的精密度,可满足实验的要求。
3 小结
本研究建立的活体动物中大环内酯类药物残留微生物抑制检测方法的检测结果准确可靠。该方法简便易行,样品前处理简单,成本相对较低,可快速、准确地对采集的血液、尿样样品进行大环内酯类药物残留测定,具有很好的重复性和再现性,而且不需要昂贵的检测仪器,是色谱分析、免疫分析等其他方法的有益补充。本方法不会产生假阴性结果,但对可能产生的假阳性结果应进一步采用仪器分析的方法进行确证。
参考文献:
[1]徐 娜,王亚立,王爱芹,等.液相色谱串联质谱法测定动物组织中大环内酯类残留量[J].分析仪器,2013(6):98-103.
[2]郭春海,陈瑞春,艾连峰,等.液相色谱-串联质谱法测定牛奶和奶粉中6种大环内酯类药物的残留量[J].食品工业科技,2012,33(6):79-82,86.
[3]李喆宇,崔玉彬,张静霞,等.大环内酯类抗生素的研究新进展[J].国外医药(抗生素分册),2013,34(1):6-15.
[4]杨臻峥.大环内酯类抗生素[J].药学进展,2012(2):94-95.
[5]李冰,李剑勇,周绪正.动物性食品中兽药残留分析检测技术研究进展[J].畜牧与兽医 2012,44(5):82-86.
[6]胡晓苗,靳宇田,张玉晴,等.藤黄微球菌检测氧氟沙星残留方法的研究[J].安徽农学通报,2011,17(3):37-38,55.
[7]李俊锁,邱月明,王 超.兽药残留分析[M].第一版.上海:上海科学技术出版社,2002:416.
(责任编辑:杜宪)
Establishment of Microbial Inhibition Method for Lipid Residues Detection in Living Animals
Huang Chen1,Chen Benlong1,Wang Naifu1,Li Weihua2
(1.Animal & Plant & Foodstuffs Inspection Center, Tianjin Import & Export Inspection and Quarantine Bureau,Tianjin 300461;2.China Animal Health and Epidemiology Center,Qingdao,Shandong 266000)
Abstract:[Objective] To establish a detection method for Macrolide Antibiotics in living animals.[Methods]The conditions of Microbiological inhibition assay method were optimized, such as selectivity and specifi city of the Micrococcus Luteus CMCC28001, which was a sensitive strain to the test, the sample extraction method, the condition of plate preparation and the detection limit of the procedure.[Results]The procedure was suitable for testing the residue of Macrolide Antibiotics(Erythrocin, Tylosin, Spriamycin, Lincomycin, Kitasamycin, Clindamycin).When the inoculum concentration were 10-3(5.5×106CFU/mL)of the Micrococcus Luteus, the inhibition zone diameters were the biggest of the center concentration and the edges were clearly.And the best pH of substrate was 7.5, and the best culture temperature was 30℃.[Conclusions]The microbial inhibition method of Micrococcus Luteus used as an indicator is capable of detecting antibiotic residues in animal sera, simple for operation, and low in cost and has good sensitivity and repeatability.This study provides useful supplement for other methods such as color spectrum analysis and immune analysis.
Key words:Microbiological inhibition assay method;Micrococcus Luteus;Macrolide;residue;living animals;antibiotics
中图分类号:S859.84
文献标识码:B
文章编号:1005-944X(2016)02-0029-05
