基于rbcL条形码的鸡血藤真伪鉴别
2016-07-25黄琼林马新业詹若挺陈蔚文
黄琼林+马新业+詹若挺++陈蔚文

摘要:为了建立鸡血藤基于rbcL基因的DNA条形码鉴别体系,为其资源保护和用药安全提供分子依据,采用商业试剂盒提取鸡血藤样品的基因组DNA,以及rbcL通用引物进行PCR扩增和测序;并从GenBank数据库获取鸡血藤混伪品的rbcL基因序列。采用DNAMAN、ClustalX软件进行序列比对分析,MEGA 5.1软件构建系统发生树。结果表明:获取的鸡血藤及其混伪品rbcL序列均为498 bp,GC含量分布在40.0%~44.4%间,存在64处变异,种间遗传距离远远大于种内遗传距离。基于rbcL基因的系统发生树能很好地区分鸡血藤及其混伪品。因此,rbcL基因可用作鸡血藤及其混伪品鉴别的DNA序列。
关键词:鸡血藤;rbcL条形码;鉴别;混伪品
中图分类号: R284.1文献标志码: A文章编号:1002-1302(2016)06-0057-03
收稿日期:2015-05-14
基金项目:广东省高等院校学科与专业建设专项资金(编号:2013CXZDA011);国家工信部中药材生产建设项目(编号:[2014]737号);广东省自然科学基金博士启动项目(编号:2015A030310519)。
作者简介:黄琼林(1986—),男,广东湛江人,博士,讲师,主要从事分子生物学研究。E-mail:perfecthql@163.com。
通信作者:陈蔚文,博士,教授,主要从事创新中药开发与研究。E-mail:chenww@gzucm.edu.cn。鸡血藤为中国常用大宗药材,主产于广东、广西,味苦甘、性温,具有补血活血、祛风通络之功效,用于治疗月经不调、血虚萎黄、麻木瘫痪、风湿痹痛等病症[1]。《中华人民共和国药典》收载的鸡血藤药材为豆科植物密花豆(Spatholobus suberectus Dunn.)的干燥藤茎,但在市场流通过程中,大血藤(Sargentodoxa cuneata)、香花崖豆藤(Callerya cinerea)、鱼藤(Derris trifoliata)、榼藤(Entada phaseoloides)等多种植物的藤茎被混淆为鸡血藤药材。这些混伪品的成分和功效与鸡血藤均存在差异,严重影响了鸡血藤的临床用药安全及其资源的可持续性利用。因此,有必要建立鸡血藤及其常见混伪品的有效鉴别体系。
DNA条形码是指利用一段短的标准DNA序列来实现物种的快速、准确鉴别[2]。2012年,国家药典委颁布了《中药材DNA条形码分子鉴定指导原则》,新版药典或将新增DNA条形码鉴定,表明DNA条形码具有良好的推广和应用价值。应用于中药材鉴别的推荐DNA条形码片段主要位于叶绿体DNA、核糖体DNA转录间隔区。rbcL基因编码1,5-二磷酸核酮糖羧化酶大亚基,位于叶绿体DNA的大单拷贝区,是植物分子系统学研究中应用最普遍的基因之一[3-5]。rbcL基因目前已被用于青天葵[6]、十大功劳[7]、溪黄草[8]等中药的真伪鉴别,但尚未见其应用于鸡血藤及其混伪品的快速鉴别。因此,本研究分析鸡血藤与4种常见混伪品的rbcL基因序列差异,为鸡血藤的真伪鉴别和临床用药提供分子依据。
1材料与方法
1.1材料与试剂
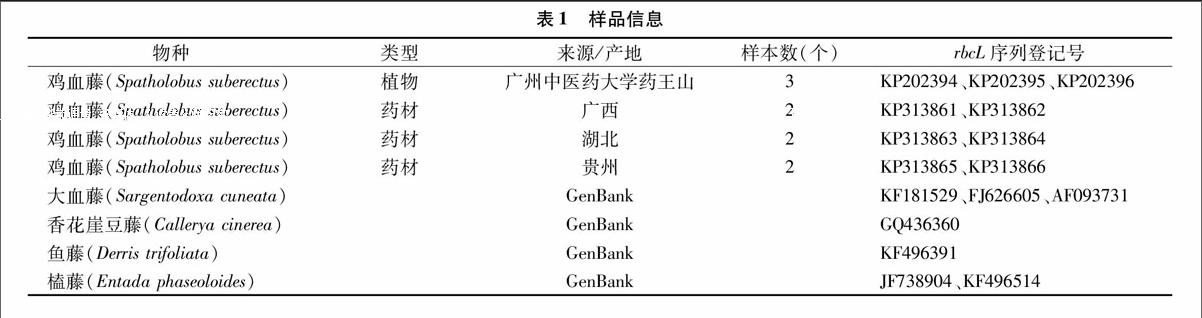
鸡血藤及其混伪品的rbcL基因序列来源于植物样品或GenBank数据库(表1)。鸡血藤样品包括植物叶片和干药材,植物叶片采自广州中医药大学城校区药王山,药材购自广东省湛江市连锁药店,均经广州中医药大学鉴定为豆科植物密花豆。以鸡血藤混伪品的拉丁学名为主题词,从NCBI(National Center for Biotechnology Information)的GenBank 数据库(http://www.ncbi.nlm.nih.gov/genbank/)下载相应物种的rbcL基因序列。
植物基因组DNA提取试剂盒购自北京天根生物科技公司;Ex Taq、10×Ex Taq buffer、dNTPs、DL2000 marker等PCR试剂购自宝生物工程(大连)有限公司;其他试剂均为分析纯。引物合成和测序由北京六合华大基因科技股份有限公司广州分公司完成。
1.2DNA提取
称取100 mg鸡血藤叶片或30 mg药材,用无水乙醇擦拭表面,叶片用剪刀剪成小片状或药材用铜盅砸碎成小细块后,置于研钵中,加入液氮快速研磨成粉末,参照植物基因组DNA提取试剂盒的说明书提取总DNA,并适当延长药材样品在提取液中的残解和温育时间。
1.3PCR扩增
用于扩增rbcL基因的引物为rbcLa-F(5′-ATGTCACCACAAACAGAG ACTAAAGC-3′)、rbcLa-R(5′-GTAAAATCAAGTCCACCRCG-3′),其中简并碱基R=A/G。PCR反应体系包括5 μL 10×Ex Taq buffer 、3.0 μL dNTP(10 mmol/L)、各1.0 μL 正反向引物(10 μmol/L)、50 ng 模板DNA、0.5 μL Ex Taq DNA聚合酶(2.5 U/μL),并用灭菌蒸馏水补至50 μL。PCR反应程序为:94 ℃ 3 min;94 ℃ 0.5 min,55 ℃ 0.5 min,72 ℃ 1.0 min,32个循环;72 ℃ 5 min。目的产物经0.8%琼脂糖电泳检测确定,送样纯化并用上下游引物进行双向测序。
1.4序列分析
将测得的rbcL序列导入DNAMAN 6.0软件进行拼接和校对,去掉5′和3′端的低可信区序列。将拼接序列进行Blastn(Nucleotide Blast)比对确认后,运用Bankit软件提交至GenBank数据库,获取序列登记号。采用ClustalX 1.83软件进行序列多重比对,并基于Kimura 2-Parameter(K2P)双参数和Neighbor-Joining(NJ)邻接法,利用MEGA 5.1软件计算鸡血藤及其混伪品的遗传距离并构建系统发育树(1 000次重复bootstrap检验各分支的支持率)。
2结果与分析
2.1DNA提取和PCR扩增
不同鸡血藤样品的DNA提取效果不尽相同,叶片样品DNA经电泳检测后条带较为清晰,浓度为80 ng/mL;鸡血藤药材DNA条带则呈弥散状态,说明药材DNA存在较为明显的降解和断裂。取50 ng上述鸡血藤DNA为模板进行PCR扩增,均获得约600 bp的rbcL基因片段(图1),目的产物条带清晰,符合预期结果。取30 μL PCR产物送样,进行纯化以及双向测序,并将序列提交到GenBank,序列登记号见表1。
2.2序列差异分析
经过序列多重比对分析,本研究获得鸡血藤及其混伪品rbcL序列共16条,长度均为498 bp,GC含量分布范围为 40.0%~44.4%(图2)。鸡血藤不同叶片和药材样品的rbcL序列完全一致,鸡血藤及其混伪品之间存在64个差异位点,表明鸡血藤及其混伪品的rbcL基因存在着较大程度的变异。
2.3遗传距离分析
基于K2P模型计算的供试样品间遗传距离见表2。鸡血藤种内不同个体的遗传距离为0.000,种内没有存在变异。
在不同物种之间,鸡血藤与大血藤的种间遗传距离最大,为0.081;与香花崖豆藤种间遗传距离最小,为0.044。鸡血藤与混伪品的种间距离远大于鸡血藤的种内距离,表明在rbcL基因中有足够的差异鉴别鸡血藤及其混伪品。
2.4聚类分析
以rbcL序列构建的鸡血藤及其混伪品的系统发生树见图3,16个样品聚成2个主分支。不同个体的鸡血藤先聚成1个小分支,然后再与同科的香花崖豆藤、鱼藤和榼藤聚成1支;木通科的大血藤则单独成为1支,系统发生树聚类结果与传统分类学相符合。各分支的boostrap支持率均在70%以上,具有较好的单系性。基于rbcL基因建立的鸡血藤及其混伪品系统发生树鉴别效果良好,表明rbcL基因可作为鉴别鸡血藤及其混伪品的DNA标准序列。
3讨论
对于鸡血藤及其混伪品的鉴定,相关报道主要是采取性状鉴别[9]、显微鉴别[10]、理化鉴别[11]等传统方法,但这些方法的鉴定标识在生物学上增多为物种的遗传表观型,不仅受到遗传因素的影响,还与物种的发育阶段、生长环境以及人类活动如引种、炮制等有密切的关系,而且鉴别人员需有专业的知识背景,主观性强,重复性和稳定性差。翟明等也曾用RAPD分子标记鉴别鸡血藤及常见混伪品[12],但RAPD鉴别物种需要多条引物,操作复杂,而且试验结果的重复性容易受PCR试剂用量等多种因素的影响。
近年来,DNA条形码技术已被公认为中药材鉴定的有效手段,它以遗传信息DNA为鉴定依据,鉴别特征不因物种所处的发育阶段和药材的状态影响,具有很好的可重复性和稳定性。只需1个或少数几个基因片段就可以完成绝大多数物种的鉴定,试验过程标准化,容易实现物种鉴定的自动化。DNA序列可以通过互联网和信息平台进行收集和共享,任何人都可以用来鉴定物种[13]。作为植物DNA条形码的热门片段之一,rbcL基因具有通用性好、易PCR扩增和序列比对等优点,在种属水平有良好的鉴别效果[14]。本研究中,采用1对通用引物进行PCR扩增,仅需1次试验就可以成功扩增目的片段,简单快捷,并且测得序列在不同的鸡血藤样品中也有很好的重复性和稳定性。在鸡血藤与混伪品的496 bp序列中,存在变异碱基64个,变异程度达12.9%,种间变异程度也远大于种内变异程度。rbcL基因有足够的差异区别鸡血藤及其混伪品, 基于rbcL基因的系统发生树也能直观地证实这
一结论。
本研究采用DNA条形码技术分析鸡血藤及其混伪品的rbcL基因,序列中存在着多处鉴别位点,基于rbcL基因构建的系统发生树可直观地鉴别鸡血藤及4种混伪品,为其资源保护和临床用药安全提供了一定的保障。
参考文献:
[1]国家药典委员会.中华人民共和国药典:一部[M]. 北京:化学工业出版社,2005:134.
[2]Hebert P,Gregory T R. The promise of DNA barcoding for taxonomy[J]. Systematic Biology,2005,54(5):852.
[3]Blaxter M,Floyd R. Molecular taxonomics for biodiversity surveys:already a reality[J]. Trends in Ecology & Evolution,2003,18(6):268-269.
[4]Chase M W,Salamin N,Wilkinson M,et al. Land plants and DNA barcodes:short-term and long-term goals[J]. Philosophical Transactions of the Royal Society of London. Series B,Biological Sciences,2005,360(1462):1889.
[5]Newmaster S G,Fazekas A J,Ragupathy S. DNA barcoding in land plants:evaluation of rbcL in a multigene tiered approach[J]. Canadian Journal of Botany,2006,84(3):335-341.
[6]黄琼林,梁凌玲,何瑞,等. 青天葵及其混伪品的rbcL基因序列鉴定研究[J]. 热带作物学报,2012,33(9):1630-1634.
[7]谭丽盈,郑婕. 基于rbcL序列鉴别十大功劳叶及其伪品[J]. 北方药学,2012,9(4):1-2.
[8]张慧晔,刘锋,王德勤,等. 溪黄草DNA条形码鉴定研究[J]. 世界科学技术:中医药现代化,2014,16(7):1487-1490.
[9]胡旻. 鸡血藤与常用混淆品的真伪鉴别[J]. 浙江中西医结合杂志,2013,23(5):419.
[10]林君清,洪侃,吴敏. 鸡血藤药材与易混品的鉴别[J]. 海峡药学,2010,22(5):47-48.
[11]翟明,刘军民. 鸡血藤与其常见混淆品的薄层色谱鉴别研究[J]. 广州中医药大学学报,2012,29(3):305-307,340.
[12]翟明,刘军民,安冉,等. 鸡血藤类药材种质资源的RAPD分析[J]. 中药新药与临床药理,2010,21(4):413-415.
[13]陈士林,庞晓慧,姚辉,等. 中药DNA条形码鉴定体系及研究方向[J]. 世界科学技术:中医药现代化,2011,13(5):747-754.
[14]CBOL Plant Working Group. A DNA barcode for land plants[J]. Proceedings of the National Academy of Sciences of the United States of America,2009,106(31):12794-12797.吴秀林,丁炜东,曹哲明,等. 环境因子对黄鳝DMRT基因甲基化的影响[J]. 江苏农业科学,2016,44(6):60-63.
