重组酶Xar的表达纯化及性质研究
2016-07-24王锐丽叶兆伟薛业敏
王锐丽,叶兆伟,薛业敏
(1.信阳农林学院 生物与制药工程学院,河南 信阳 464000; 2.南京师范大学 金陵女子学院,江苏 南京 210097)
重组酶Xar的表达纯化及性质研究
王锐丽1,叶兆伟1,薛业敏2
(1.信阳农林学院 生物与制药工程学院,河南 信阳 464000; 2.南京师范大学 金陵女子学院,江苏 南京 210097)
为获得高效的半纤维素类饲料酶制剂,将含嗜热厌氧乙醇菌α-阿拉伯糖苷酶/木糖苷酶(Xar)基因的重组质粒pET-20b-xar导入大肠杆菌DH10B中,经IPTG诱导进行高效表达,将表达的重组酶进行热处理和Ni2+亲和层析纯化,并对纯化的重组酶Xar的性质进行研究。结果表明,以对硝基苯酚-α-阿拉伯呋喃糖苷(pNPAF)为底物,重组酶Xar的最适反应温度和最适pH值分别是75~80 ℃和6.0,米氏常数(Km)、最大反应速度(Vmax)分别为2.42 mmol/L、20.7 μmol/(min·mg);以对硝基苯酚-β-木糖苷(pNPX)为底物,重组酶Xar的最适反应温度和最适pH值分别为93 ℃和5.8~6.2,Km、Vmax值分别为0.60 mmol/L、43.8 μmol/(min·mg)。将重组酶Xar置于80 ℃保温1 h,木糖苷酶的相对活性仍为56.4%,在pH值4.2~8.2条件下仍保持较高的稳定性。当木糖浓度达到400 mmol/L时,木糖苷酶的相对活性仍有97.9%。Mn2+对重组酶Xar有明显的激活作用,而Cu2+和Zn2+对其有明显的抑制作用。可见,重组酶Xar具有良好的热稳定性。
木糖苷酶; 耐热性; 纯化; 酶学性质
我国是农业大国,秸秆和玉米芯等是畜牧业植物性饲料的主要来源。反刍动物由于瘤胃中微生物体系可以分泌功能各异的酶,对秸秆和玉米芯的利用率可达到60%~80%,但单胃动物对秸秆和玉米芯的利用率很低[1-2]。在生产中通常将多种半纤维素酶,如β-1,4-木聚糖酶、β-甘露聚糖酶、β-木糖苷酶和α-L-阿拉伯糖苷酶等制成复合酶,作为饲料酶制剂添加到饲料中,以降低饲料中多糖的黏度,促进动物肠道对蛋白质、脂肪的消化吸收,提高饲料的利用率,进而减少饲料的投放量,降低成本。目前已发现多种微生物来源的饲用半纤维素酶[3],相关研究主要集中在产酶菌株筛选与驯化、酶学性质以及酶的纯化等方面[4],但在饲料业中仍缺少在高温和酸性环境条件下性质稳定和活性高的酶源[5]。前人研究发现,嗜热厌氧乙醇菌(Thermoanaerobacterethanolicus)是多种极耐热半纤维素酶类的重要来源,双功能α-L-阿拉伯糖苷酶/木糖苷酶就是其中的一种[6-8]。本研究将含嗜热厌氧乙醇菌的α-阿拉伯糖苷酶/木糖苷酶基因的重组质粒pET-20b-xar导入大肠杆菌DH10B中,表达重组酶Xar,同时对重组酶Xar的性质进行研究,旨在为开发饲料中的添加剂酶提供理论依据。
1 材料和方法
1.1 材料
菌株:嗜热厌氧乙醇菌(T.ethanolicus)JW200由美国佐治亚大学微生物系分离,大肠杆菌DH10B 购于普洛麦格生物技术有限公司。
试剂:对硝基苯酚-ɑ-阿拉伯呋喃糖苷(pNPAF)和对硝基苯酚-β-木糖苷(pNPX)购自Sigma公司。
1.2 方法
1.2.1 重组酶的表达及纯化 将含T.ethanolicusJW200的α-阿拉伯糖苷酶/木糖苷酶(Xar)基因的重组质粒pET-20b-xar转化至大肠杆菌DH10B的感受态细胞中,经SOC培养基振荡培养,涂布至含氨苄青霉素(Amp)的LB抗性平板上,37 ℃培养过夜。挑选单菌落接入含有Amp抗性的LB液体培养基中, 200 r/min转速37 ℃振荡培养过夜。以1%的接种量接入发酵罐中,培养至OD600为0.6~0.8时,加终浓度为0.8 mmol/L的 IPTG,继续培养5 h后,离心收集细胞。
用 Rapid Affinity Purification试剂盒中的 Bin-ding Buffer悬浮细胞,高压破碎,离心20 min,取上清液于80 ℃下热处理20 min,离心得粗酶液。粗酶液再经Ni2+亲和层析纯化,纯化后的酶液采用SDS-PAGE检测纯度。
1.2.2 酶活性的测定 采用分光光度法测定阿拉伯糖苷酶/木糖苷酶活性,根据底物pNPAF/pNPX释放确定硝基苯酚(pNP)的量[9]。1个酶活性单位(U)定义:在一定反应条件下,1 min内催化产生1 μmolpNP的酶量。
1.2.3 重组酶的酶学性质及动力学参数的测定 以pNPX和pNAF为底物,测定重组酶Xar的酶学性质及最适反应温度、温度稳定性、最适pH值及其稳定性、动力学参数。
最适反应温度的测定:将重组酶液pH值调节为6.2,温度设为30~95 ℃间隔5 ℃,反应5 min后以pNPAF/pNPX为底物测定重组酶Xar的活性,以最高酶活性为100%,计算酶相对活性。
温度稳定性的测定:将重组酶置于最适pH值条件下,在65~95 ℃每隔5 ℃保温1 h,然后加底物于最适温度和pH值条件下测定其活性,以保存于冰浴中(未保温)的酶活性为100%,制作重组酶温度稳定性曲线。
最适pH值的测定:将重组酶液置于不同pH值下,在最适温度下测定其活性,以最高酶活性为100%,计算酶相对活性。
pH值稳定性的测定:将重组酶置于20 μL不同pH值(3.8~8.2)的100 mmol/L邻苯二甲酸氢钾-咪唑(PIB)缓冲液中,于37 ℃下保温1 h,冷却后补加相应的底物和缓冲液达到200 μL,再于最适条件测定其活性,以保存于冰浴中(未保温)的酶活性为100%,制作重组酶pH值稳定性曲线。
动力学参数的测定:用pH值6.2的PIB缓冲液分别配制不同浓度的pNPX和pNPAF作为底物,分别于最适反应条件测定重组酶的木糖苷酶和阿拉伯糖苷酶的活性。采用Lineweaver-Burk作图法,计算重组酶的米氏常数(Km)、最大反应速度(Vmax)、转换数(Kcat)和转换效率(Kcat/Km)值。
1.2.4 终产物木糖和阿拉伯糖对重组酶相对活性的影响试验 先将缓冲液、酶和木糖(或阿拉伯糖)置于37 ℃作用30 min,再加入底物。反应条件如下:适当酶液+100 mmol/L PIB缓冲液+木糖(或阿拉伯糖)溶液+底物pNPX或pNPAF(终浓度1 mmol/L),在最适温度下反应5 min,然后终止反应,测定波长405 nm处的吸光值。以不加终产物时的酶活性为100%,计算酶相对活性。
1.2.5 金属离子和EDTA对重组酶相对活性的影响试验 将酶液与不同金属离子(终浓度1 mmol/L)或EDTA溶液(终浓度10 mmol/L)混匀后于37 ℃作用30 min,再加底物于最适条件下测定酶活性。以未加金属离子和EDTA的酶活性为100%,计算酶相对活性。
2 结果与分析
2.1 重组酶的表达及纯化
由图1可以看出,纯化后的重组酶Xar条带在泳道中呈单一均匀分布,大小约为85 ku,与预期的蛋白质分子质量一致。表明成功表达了重组酶Xar,且纯度较高。
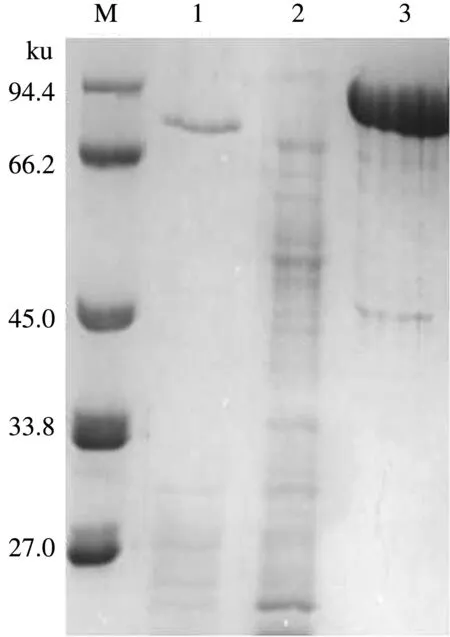
M.标准蛋白质Marker; 1.热处理后的重组酶Xar; 2.未诱导的pET-20b-xar; 3.纯化的重组酶Xar图1 SDS-PAGE电泳检测重组酶Xar的结果
2.2 重组酶Xar的酶学性质及动力学参数
分别以pNPAF和pNPX为底物,测得重组酶的最适反应温度、最适pH值、pH值和温度的稳定性、动力学参数,其结果见表1和图2—3。
由表1可以看出,以pNPAF作为底物,测得重组酶Xar的最适反应温度和最适pH值分别为75~80 ℃和6.0。以pNPX作为底物,重组酶Xar的最适反应温度和最适pH值分别为93 ℃和5.8~6.2,说明重组酶Xar属于耐高温酶。由图2可知,将重组酶Xar于80 ℃保温1 h,木糖苷酶相对活性仍有56.4%,于75 ℃保温1 h阿拉伯糖苷酶的相对活性仍为57.6%。说明该酶具有较好的热稳定性。由图3可知,将重组酶Xar置于100 mmol/L、 pH值为4.2~8.2的缓冲液中,37 ℃保温1 h,酶的相对活性能保持在50%以上,说明重组酶Xar具有很高的pH值稳定性。在已报道的β-木糖苷酶中,大部分β-木糖苷酶的最适反应温度为40~60 ℃,只有少数从嗜热细菌和耐热真菌Thermotogathermarum、Geobacillussp.strain WSUCF1、Scytalidiumthermophilum中分离到的β-木糖苷酶具有较好的热稳定性和最适反应温度[10-12]。可见,重组酶Xar具有较好的热稳定性和pH值稳定性,有利于该酶在饲料添加中的使用,以及饲料添加剂的保存和运输。
从表1还可以看出,以pNPAF为底物时,Km值为2.42 mmol/L,Kcat/Km值为246.7 L/(mmol·s);以pNPX为底物时,Km值为0.60 mmol/L,Kcat/Km值为118.3 L/(mmol·s)。重组酶Xar对底物pNPX的亲和性好于底物pNPAF,对pNPAF的催化效率明显高于pNPX。

表1 重组酶Xar的部分性质比较
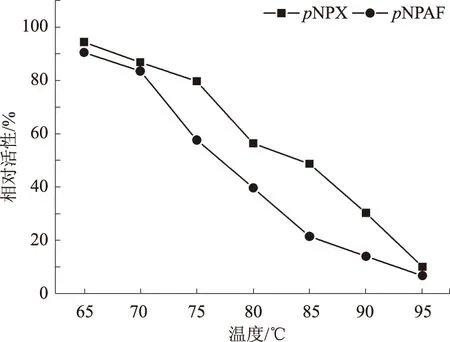
图2 重组酶Xar的热稳定性
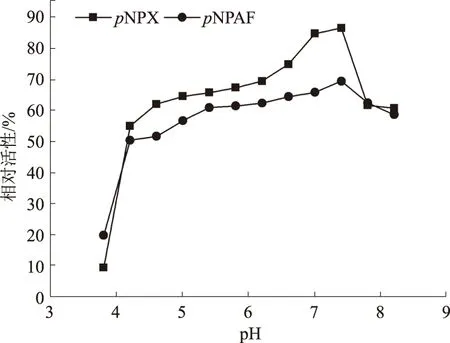
图3 重组酶Xar的pH值稳定性
2.3 终产物木糖和阿拉伯糖对重组酶Xar相对活性的影响
由表2可知,当木糖浓度达到400 mmol/L时,重组酶Xar的木糖苷酶的相对活性仍有97.9%,说明重组酶Xar能耐受木糖,高于Yanai 等[13]发现的CandidautilisIFO 0639中β-木糖苷酶对木糖的耐受性(300 mmol/L)。当阿拉伯糖浓度达到200 mmol/L时,木糖苷酶的相对活性为113.2%,阿拉伯糖酶的相对活性只有53.0%残留。在阿拉伯糖浓度达到700~2 000 mmol/L时,其对木糖苷酶活性的激活作用趋于稳定。
2.4 金属离子和EDTA对重组酶Xar相对活性的影响
由表3可知, Mn2+对重组酶Xar的正向影响最大,其木糖苷酶和阿拉伯糖苷酶活性高达232%和147%。作为饲料添加剂,这种正向影响有利于抵制消化系统中胃蛋白酶和胰蛋白酶的活性[14]。Sr2+对重组酶Xar的双活性有一定激活作用,Cu2+和Zn2+能够明显抑制Xar的双活性,Mg2+、Ni2+和EDTA对重组酶Xar的活性影响较小。
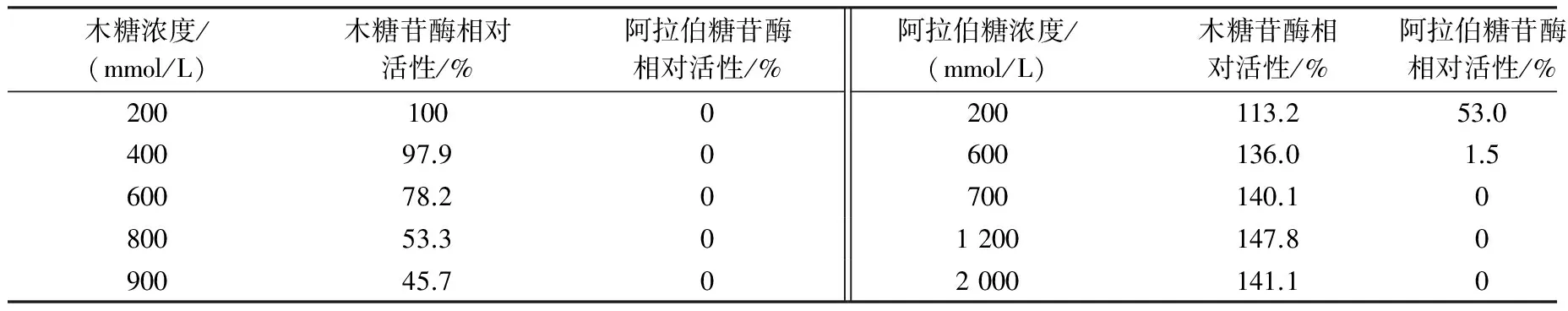
表2 终产物木糖和阿拉伯糖对重组酶Xar相对活性的影响
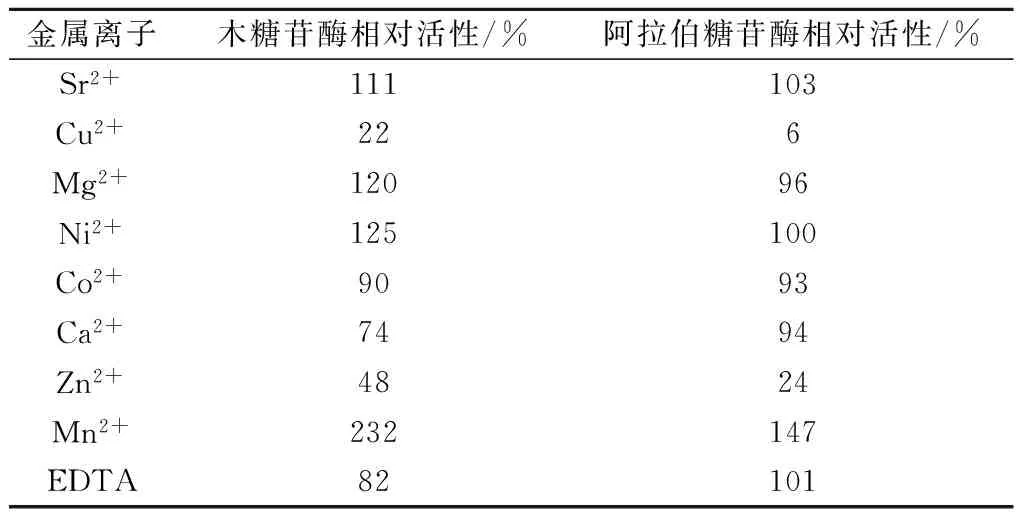
表3 金属离子和EDTA对重组酶Xar相对活性的影响
3 结论与讨论
饲用半纤维素酶在饲料添加剂中的应用已成为研究热点之一,但饲用纤维素酶在应用中仍存在产量低、易失活和成本高等问题[15-20]。为获得高效的半纤维素类饲料酶制剂,本研究成功表达重组酶Xar,并对纯化的重组酶Xar的酶学性质进行研究。结果表明,重组酶Xar表现出木糖苷酶活性和阿拉伯糖酶活性,即为双功能性酶。具有2种活性的酶在降解半纤维素饲料方面本身就是一种优势,可以与其他饲用酶协同作用而降解大部分植物性饲料,简化制料工艺和节约成本。以pNPAF为底物,重组酶Xar的最适温度和最适pH值分别是75~80 ℃和6.0,Km与Vmax值分别为2.42 mmol/L和20.7 μmol/(min·mg)。以pNPX为底物,重组酶Xar的最适温度和最适pH值分别为93 ℃和5.8~6.2,Km与Vmax值分别为0.60 mmol/L和43.8 μmol/(min·mg)。将重组酶Xar于80 ℃保温1 h木糖苷酶的相对活性仍有56.4%,在pH值为 4.2~8.2时仍保持较高的稳定性。酶的耐热性会直接影响其饲用效果,因为饲料制粒过程中酶要经过80 ℃、30 s的热处理。基于重组酶Xar良好的耐热性及pH值稳定性等优良性质,其在饲料行业具有广阔的开发应用前景。
[1] 张晓军,沈佳佳,王浩,等.半纤维素酶在饲料工业中的应用研究[J].饲料工业,2005,26(20):22-23.
[2] 奥托迎,张兰草.家禽日粮中酶制剂使用的现状和展望[J].山西农业科学,2013,41(3):93-97.
[3] 国春艳,刁其玉,乔宇,等.酸性木聚糖酶产生菌株的筛选和酶学性质分析[J].中国农业科学,2010,43(7):1524-1530.
[4] 郄卫那,张兰英,何健,等.1株饲用木聚糖酶产生菌的分离、鉴定、发酵、酶学性质及应用[J].江苏农业科学,2014,42(10):196-200.
[5] 刘新育,李学琴,王明道,等.耐酸及耐蛋白酶的木聚糖酶产生菌的筛选[J].河南农业科学,2012,41(6):158-160.
[6] Wagschal K,Heng C,Lee C C,etal.Biochemical characterization of a novel dual-function arabinofuranosidase/xylosidase isolated from a compost starter mixture[J].Applied Microbiology and Biotechnology,2009,81(5):855-863.
[7] Kotake T,Tsuchiya K,Aohara T,etal.An alpha-L-arabinofuranosidase/beta-D-xylosidase from immature seeds of radish (RaphanussativusL.)[J].Journal of Experimental Botany,2006,57(10):2353-2362.
[8] Jordan D B,Li X L.Variation in relative substrate specificity of bifunctional beta-D-xylosidase/alpha-L-arabinofuranosidase by single-site mutations:Roles of substrate distortion and recognition[J].Biochimica et Biophysica Acta,2007,1774(9):1192-1198.
[9] 薛业敏,卢晨,毛忠贵,等.阿拉伯糖苷酶基因的克隆、表达及表达产物的酶稳定性[J].中国农业大学学报,2003,8(5):9-13.
[10] Shi H,Li X,Gu H,etal.Biochemical properties of a novel thermostable and highly xylose-tolerant β-xylosidase/α-arabinosidase fromThermotogathermarum[J].Biotechnology for Biofuels,2013,6(1):27-36.
[11] Bhalla A,Bischoff K M,Sani R K.Highly thermostable GH39 β-xylosidase from aGeobacillussp.strain WSUCF1[J].BMC Biotechnology,2014,14(1):963-972.
[12] Zanoelo F F,Polizeli Md Mde L,Terenzi H F,etal.Purification and biochemical properties of a thermostable xylose-tolerant beta-D-xylosidase fromScytalidiumthermophilum[J].Journal of Industrial Microbiology & Biotechnology,2004,31(4):170-176.
[13] Yanai T,Sato M.Purification and characterization of a beta-xylosidase fromCandidautilisIFO 0639[J].Bioscience,Biotechnology,and Biochemistry,2001,65(3):527-533.
[14] Zhang M,Chen X L,Zhang Z H,etal.Purification and functional characterization of endo-beta-mannanase MAN5 and its application in oligosaccharide production from konjac flour[J].Applied Microbiology and Biotechnology,2009,83(5):865-873.
[15] Peyer C,Bonay P,Staudacher E.Purification and characterization of a beta-xylosidase from potatoes(Solanumtuberosum)[J].Biochim Biophys Acta,2004,1672:27-35.
[16] 巍川子,王兆斌,李燕蒙,等.半纤维素酶在畜禽饲料中的应用及研究进展[J].畜牧与饲料科学,2015,36(12):44-46.
[17] 张贝贝,赵晓兵,何丽丽,等.牛瘤胃细菌产木聚糖酶菌株的筛选及酶学性质研究[J].河南农业科学,2014,43(4):134-138.
[18] 张丽萍,李亚冰,程辉彩,等.一株兼性厌氧纤维素酶产生菌的筛选、鉴定及其酶学性质研究[J].华北农学报,2010,25(6):139-143.
[19] 殷尔康.木聚糖酶基因xynA在大肠杆菌中的高效表达[J].现代农业科技,2011(12):326-327.
[20] 刘士清,李文鹏,孙传伯,等.产生木聚糖酶的兼性厌氧菌的生物学特性与酶的酶学特征[J].现代农业科技,2007(24):188-192.
Production and Characterization of a Recombinase Xar
WANG Ruili1,YE Zhaowei1,XUE Yemin2
(1.Department of Biotechnology and Pharmaceutical Engineering,Xinyang College of Agriculture and Forestry,Xinyang 464000,China; 2.Jinling College,Nanjing Normal University,Nanjing 210097,China)
To obtain an efficient hemicellulose feed enzyme preparation,the thermostable bifunctional α-arabinosidase/xylosidase(Xar) fromThermoanaerobacterethanolicuswas over-expressed inEscherichiacoliDH10B.The expressed Xar was purified by heat treatment and immobilized metal affinity chromatography.pNP-β-D-arabinofuranoside(pNPAF)as substrate,the maximum activity was found at 75—80 ℃ and pH 6.0,KmandVmaxof Xar was 2.42 mmol/L and 20.7 μmol/(min·mg),respectively.WhilepNP-α-D-xylopyranoside(pNPX) as substrate,the maximum activity was found at 93 ℃ and pH 5.8—6.2,KmandVmaxof Xar was 0.60 mmol/L and 43.8 μmol/(min·mg),showed better specificity forpNPX.Xar was found to be stabile which kept 56.4% activity of 1 h at 80 ℃ and it was stable over a range of pH 4.2—8.2.When the xylose concentration reached 400 mmol/L,the residual activity of xylosidase was still 97.9%.Mn2+activated the enzyme,Cu2+and Zn2+showed various degrees of inhibitory effect on the enzymes.The recombinant enzyme Xar had good thermal stability.
xylosidase; thermostablity; purification; enzymatic properties
2015-08-06
河南省科技攻关项目(132102110047)
王锐丽(1985-),女,河南信阳人,讲师,硕士,主要从事微生物学研究。E-mail:wrl0376@163.com
S816.7
A
1004-3268(2016)05-0140-05
