转抗菌肽D基因中华猕猴桃的鉴定及抗病性相关酶活性研究
2016-07-24韦鹏飞申炎龙郑先波李继东冯建灿
韦鹏飞,申炎龙,叶 霞,郑先波,谭 彬,李继东,冯建灿
(河南农业大学,河南 郑州 450002)
转抗菌肽D基因中华猕猴桃的鉴定及抗病性相关酶活性研究
韦鹏飞,申炎龙,叶 霞,郑先波,谭 彬,李继东,冯建灿*
(河南农业大学,河南 郑州 450002)
以转抗菌肽D基因的中华猕猴桃抗性芽为材料,通过诱导生根和移栽获得猕猴桃盆栽苗。对盆栽苗进行PCR和RT-PCR鉴定表明,抗菌肽D基因已经整合到猕猴桃基因组中,并进行了转录。对盆栽苗叶片中的过氧化氢酶(CAT)、过氧化物酶(POD)和苯丙氨酸解氨酶(PAL)的活性分析结果表明,在喷施猕猴桃细菌性溃疡病病原菌(1.2×107~1.2×108,OD600值为0.2)的条件下,转基因植株的CAT和POD活性比未转基因植株明显降低,PAL活性比未转基因植株明显升高。
中华猕猴桃; 抗菌肽D; 过氧化氢酶; 过氧化物酶; 苯丙氨酸解氨酶
猕猴桃(Actinidiachinensis)隶属猕猴桃科猕猴桃属,富含维生素C、膳食纤维、多种矿物营养,并具有清肠健胃等功效,已得到广泛的青睐,成为重要的水果种类之一。猕猴桃细菌性溃疡病,是一种毁灭性细菌病害,对世界猕猴桃产业的发展造成了严重的威胁。该病主要危害猕猴桃的主干、枝蔓、新梢和叶片,极易造成植株死亡[1-2],该病1980年在日本首次发现[3],1983年后在美国等地陆续发现[4],1987年病原菌被鉴定为丁香假单孢杆菌猕猴桃致病性变种[3]。目前尚无有效方法抑制猕猴桃溃疡病害的发生,而采取基因工程技术、定向改造生物基因结构、生产抗病性强的品种是避免溃疡病带来损失的有效方法之一。抗菌肽(antibacterial peptides)是一种小分子多肽物质,因为发现其对微生物,如细菌[5]、真菌[6]、抗原虫[7]等具有抑制作用,因此又将其称为抗微生物多肽(antimicrobial peptides)。目前,已有相关的研究将抗菌肽转入到植物中,如黄大年等[8]应用基因枪转化法将含有抗菌肽B基因的转化载体导入水稻未成熟胚,获得了一些转基因水稻植株,转基因水稻植株增强了对水稻白叶枯病和细条病的抗性。田长恩等[9]用花粉管通道法将柞蚕抗菌肽D基因导入番茄,获得了转基因植株,部分转基因植株的子一代具有较强的抗青枯病能力。
为了增强中华猕猴桃的抗性,河南农业大学经济林良种选育与栽培实验室已通过农杆菌介导法将抗菌肽D基因导入到中华猕猴桃植株中,获得了大量的抗性芽[10]。为了进一步检测目的基因是否在猕猴桃基因组中进行转录表达,并表现抗猕猴桃细菌性溃疡病特性,分别利用PCR和RT-PCR的方法对抗性植株进行分子鉴定;对移栽到温室的猕猴桃幼苗喷施猕猴桃细菌性溃疡病病原菌,分析喷施菌液前后猕猴桃相关酶活性的变化,研究转基因植株的抗性变化,为获得抗病新种质打下基础。
1 材料和方法
1.1 试验材料
以课题组获得的转抗菌肽D 基因的3个中华猕猴桃株系(L1、L2、L3)及未转基因的中华猕猴桃植株(对照)为供试材料。
1.2 试验方法
1.2.1 生根培养及移栽 将2 cm左右的茎段(带叶片)接种到分别含有0.6、1.0 mg/L NAA,0.6、1.0 mg/L IBA的基本培养基中(处理1—4);使用1.0 g/L 的 IBA处理15 s,然后使用滤纸吸附多余的溶液后接种于基本培养基中(处理5)。基本培养基为MS+0.3 mg/L GA3+6 g/L琼脂+30 g/L蔗糖。每个处理接种20个茎段,重复3次。30 d后统计愈伤组织诱导率和生根率,以愈伤组织直径大于0.5 cm为统计标准。
移栽时使用自来水清洗根部,洗去残留的培养基,然后使用0.1%的多菌灵进行杀菌处理。基质组成为蛭石、珍珠岩、草炭(体积比为1︰1︰1),经过高温灭菌处理,含水量以手握微渗出水滴为宜,移栽后不进行浇水,使用700 mL一次性透明塑料杯进行保湿处理。1个月后放置于人工气候箱中,光周期为14 h/10 h(光/暗),温度为20~22 ℃。
1.2.2 盆栽苗叶片的DNA提取及目的产物检测 基因组DNA的提取、PCR扩增程序和反应体系参照文献[10],PCR反应的上游引物序列:5'-GGCCCCGGGATGTGGAACCCTTTCAAG-3',下游引物序列:5'-GCCGAGCTCTTACTTAGCCAAAGCAGT-3',扩增的目的基因片段的长度为122 bp。
1.2.3 盆栽苗叶片的RNA提取及RT-PCR检测 RNA分离采用试剂盒提取法(上海生工生物工程有限公司),采用ABI公司的High Capacity cDNA Reverse Transcription Kit进行cDNA的合成。cDNA的合成使用1 μg总RNA建立20 μL的体系,将反转录获得的cDNA稀释至200 ng/μL,保存于-20 ℃备用。
RT-PCR反应引物参照文献[10]等,内参基因选用18S RNA,上游引物:5'-TGCCCGTTGCTCTGATGAT-3';下游引物:5'-TTGGATGTGGTAGCCGTTTCT-3',目的片段长度为189 bp。
以稀释过的cDNA为模板,反应体系为:1 μL cDNA模板、上下游引物(浓度5 μmol/L)各1 μL、10 μL Real Master Mix、7 μL ddH2O,共20 μL,混匀后进行扩增。扩增程序参照文献[10]。1.2.4 酶活性的测定 猕猴桃细菌性溃疡病病原菌由中国农业科学院郑州果树研究所提供,菌液浓度为1.2×107~1.2×108cfu/mL,OD600值为0.2。盆栽苗的菌液接种时使用100 mL喷壶,距离叶片20 cm左右,直接喷洒。为了分析转基因植株和对照植株的酶活性的变化,分别于喷施菌液处理前1 d和处理后20 d(溃疡病发病周期约为15 d)各采样1次。采样部位为茎尖以下完全展开的第2—4片叶子,然后液氮速冻后,保存-80 ℃备用。每个株系每次取6个植株的叶片,重复3次。叶片的过氧化氢酶(CAT)活性、过氧化物酶(POD)活性、苯丙氨酸解氨酶(PAL)活性按照试剂盒说明进行测定,试剂盒购买自苏州科铭生物技术有限公司。
1.3 数据分析
所有数据使用SPSS进行处理,方差分析采用T检验。
2 结果与分析
2.1 不同处理对猕猴桃茎段生根的影响
试验结果表明,在培养基中添加NAA、IBA均能诱导茎段生根,且生根率均可达到100%。不同的生根处理产生的愈伤组织数量有很大的差异,其中处理1—4根系愈伤组织诱导率均达100%(图1);而处理5使用1.0 g/L IBA处理15 s,可以产生大量的根系而仅有极少量愈伤组织,直径大于0.5 cm的愈伤组织诱导率为0,处理5组培苗移栽后成活率达到95%,生长状况良好(图2)。

1、2.IBA 0.6、1.0 mg/L;3、4.NAA 0.6、1.0 mg/L;5.1.0 g/L IBA处理15 s图1 不同处理的中华猕猴桃生根状况

图2 中华猕猴桃移栽45 d后的生长状况
2.2 转基因猕猴桃抗菌肽D基因的 PCR检测结果
以未转化的盆栽苗DNA为阴性对照、以含抗菌肽D基因的质粒为阳性对照进行PCR检测,以抗菌肽D基因两端序列设计特异引物进行扩增,结果表明(图3),质粒和转基因盆栽苗均扩增出122 bp的特异目的条带。这表明农杆菌介导的外源抗菌肽D基因已经整合到猕猴桃基因组中。

M.DL2000 Marker; 1.阳性对照;2.阴性对照; 3.L1; 4.L2; 5.L3图3 转基因猕猴桃抗菌肽D基因的 PCR检测结果
2.3 转基因猕猴桃抗菌肽D基因的RT-PCR检测结果
对转基因和对照植株的RNA进行提取,RT-PCR的扩增结果表明,抗菌肽D基因已在中华猕猴桃基因组中进行转录(图4)。从条带的亮度上可以看出,目的基因的表达量是有差异的,其中L1的亮度最强,L2次之,L3的亮度最弱,而内参基因的亮度基本一致,这表明目的基因在猕猴桃基因组中有转录,其中在L1株系中的转录量最高。

M.DL2000;1—5分别为阳性对照、阴性对照、L1、L2、L3的D基因;6—9分别为阴性对照、L1、L2、L3的内参基因图4 转基因猕猴桃抗菌肽D基因的RT-PCR检测结果
2.4 喷施菌液前后转基因猕猴桃CAT、POD、PAL活性的变化
2.4.1 CAT活性 由图5可以看出,在喷施菌液前,3个转基因株系CAT活性与对照相比无显著差异,其中转基因株系L1和L2 CAT活性比对照略高,而L3比对照略低。在喷施菌液后20 d,盆栽苗未表现发病症状,但是CAT活性发生变化,其中对照植株和L3的CAT活性上升,而L1和L2的CAT活性略有下降,但是所有转基因植株的CAT活性均比对照低。

同一时间不同小写字母表示不同株系间差异显著(P<0.05),下同图5 转基因猕猴桃植株和对照的CAT活性比较
2.4.2 POD活性 从图6可以看出,在喷施菌液前,转基因株系和对照的POD活性虽有差别,但差异不显著。喷施菌液后20 d,所有株系的POD活性均有所降低,但3个转基因株系下降的幅度较对照植株大。其中,L1、L2、L3的POD活性分别比处理前1 d下降50.3%、78.2%、56.2%,而对照仅下降18.0%。所有转基因株系 POD活性均低于对照。
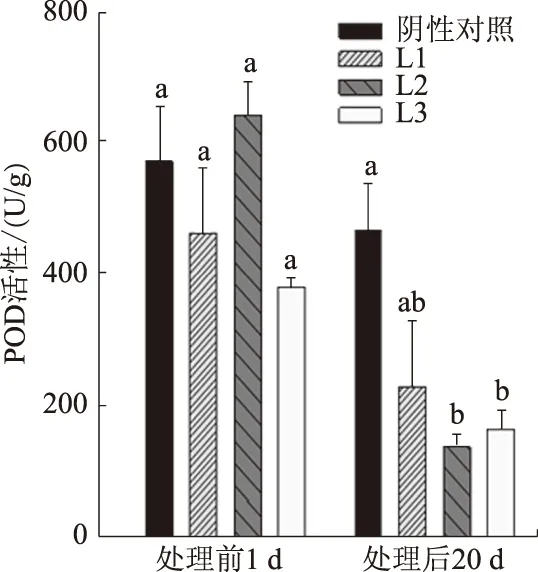
图6 转基因猕猴桃植株和对照的POD活性比较
2.4.3 PAL活性 由图7可以看出,喷施菌液前转基因株系和对照的PAL活性差异不显著,但在喷施菌液后20 d,3个转基因株系的PAL活性均比对照植株显著增加。同时,3个转基因株系和对照的PAL活性均比菌液处理前升高,其中对照的PAL活性增加63.4%,转基因株系L1、L2、L3分别增加135.0%、311.4%、60.3%。
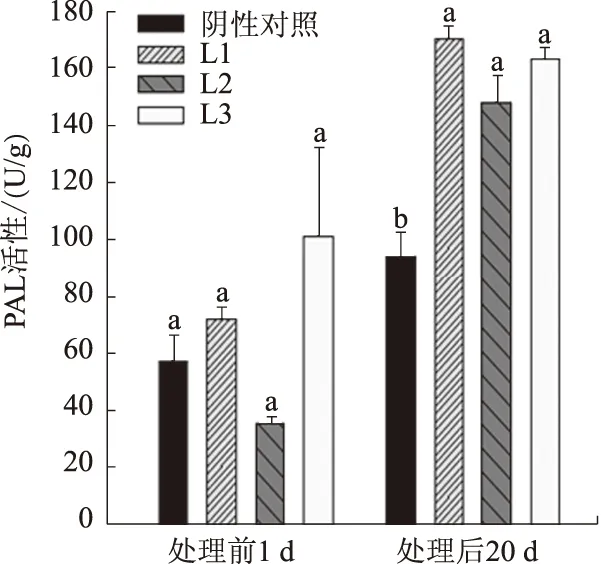
图7 转基因猕猴桃植株和对照的PAL活性比较
3 结论与讨论
CAT是一种酶类活性氧清除剂,又称为触酶,是以铁卟啉为辅基的结合酶。它可促使H2O2分解为分子氧和水,清除体内的H2O2,从而使细胞免于遭受H2O2的毒害,是生物防御体系的关键酶之一。石志军等[11]研究指出,健康猕猴桃的叶片CAT活性与病情指数有很高的相关性。本研究的结果显示,转基因株系L1和L2的CAT活性比对照高,预示着转基因株系L1和L2的抗病性有提高的可能性。接种菌液后20 d,3个转基因株系的CAT活性却均比对照低。所以转抗菌肽D的猕猴桃植株的抗病性是否能有效提高,还需进一步病菌接种验证。
POD是由微生物或植物所产生的一类氧化还原酶,是以H2O2为电子受体催化底物氧化的酶。对于POD活性在植物抗病性方面的作用,有研究认为POD活性与植物的抗病性具有负相关关系,例如1991年田秀明等[12]对抗病性不同的棉种和品种的幼苗叶片内POD活性进行比较,结果表明,抗病性强的植株酶活性低。但是也有研究表明,植物的抗病性与叶片的POD活性呈正相关,如Joseph等[13]连续3 a对4个大豆品种和5个品系的根部、茎部的病害调查及对其叶片POD活性的分析表明,发病轻的POD活性较高,而发病重的POD活性较低。本研究结果表明,转基因植株的POD活性在细菌性溃疡病病原菌接种前后总体上均比对照低,可能暗示着POD活性与抗病性呈负相关关系。
植物体内的PAL是苯丙烷类代谢途径的关键酶和限速酶,其活性和植物抗病性有着密切关系[14],根据有关PAL与抗病性关系的研究报道[15-16],植物在受到各种病原菌感染后,可以观察到PAL活性升高,PAL活性的变化与抗病性呈正相关性。本试验结果显示,抗菌肽D基因可以有效地提高细菌性溃疡病病原菌感染后转基因植株的PAL活性。
[1] 李泉厂,陈金焕,王西红.不同药剂防治猕猴桃溃疡病效果研究[J].现代农业科技,2013(11):130-131.
[2] 王永兰,杜永章,施正伟.猕猴桃溃疡病发生特点及综合防治技术[J].现代农业科技,2009(23):188.
[3] Takikawa Y,Serizawa S,Ichikawa T,etal.Pseudomonassyringaepv.actinidiaepv.nov:The causal bacterium of canker of kiwifruit in Japan [J].Japanese Journal of Phytopathology,1989,55(4):437-444.
[4] Dan C O.Pseudomonas canker of kiwifruit[J].Plant Disease,1983,67(11):1283-1284.
[5] Vizioli J,Salzet M.Antimicrobial peptides from animals:Focus on invertebrates[J].Trends in Pharmacological Sciences,2002,23(11):494-496.
[6] Iijima R,Kurata S,Natori S.Purification,characterization,and cDNA cloning of an antifungal protein from the hemolymph ofSarcophagaperegrina(flesh fly) larvae[J].Journal of Biological Chemistry,1993,268(16):12055-12061.
[7] Boman H G,Wade D,Boman I A,etal.Antibacterial and antimalarial properties of peptides that are cecropin-melittin hybrids[J].Febs Letters,1989,259(1):103-106.
[8] 黄大年,朱冰,杨炜,等.抗菌肽B基因导入水稻及转基因植株的鉴定[J].中国科学(C辑),1997,27(1):55-62.
[9] 田长恩,王正询,陈韬,等.抗菌肽D基因导入番茄及转基因植株的鉴定[J].遗传,2000,22(2):86-89.
[10] 尚霄丽.猕猴桃、枣高效再生体系的建立及农杆菌介导的遗传转化研究[D].郑州:河南农业大学,2010.
[11] 石志军,张慧琴,肖金平,等.不同猕猴桃品种对溃疡病抗性的评价[J].浙江农业学报,2014,26(3):752-759.
[12] 田秀明,杜利锋.棉花对枯、黄萎病的抗性与过氧化物酶活性的关系[J].植物病理学报,1991,21(2):94,381.
[13] Joseph L M,Tan T K,Man W S.Antifungal effects of hydrogen peroxide and peroxidase on spore germination and mycelial growth ofPseudocercosporaspecies[J].Canadian Journal of Botany,2011,76(12):2119-2124.
[14] 欧阳光察,薛应龙.植物苯丙烷类代谢的生理意义及其调控[J].植物生理学通讯,1988(3):9-16.
[15] 张俊华,崔崇士.不同抗性南瓜品种感染Phytophthoracapsici病菌后几种酶活性测定[J].东北农业大学学报,2003,34(2):124-128.
[16] 刘亚光,李海英,杨庆凯.大豆品种的抗病性与叶片内苯丙氨酸解氨酶活性关系的研究[J].大豆科学,2002,21(3):195-198.
Identification of TransgenicActinidiachinensisPlants with Antibacterial Peptide D Gene and Analysis of Disease-resistant Related Enzyme Activities
WEI Pengfei,SHEN Yanlong,YE Xia,ZHENG Xianbo,TAN Bin,LI Jidong,FENG Jiancan*
(Henan Agricultural University,Zhengzhou 450002,China)
In the present study,the transgenicActinidiachinensisshoots with antibacterial peptide D gene was used as materials,and manyActinidiachinensisplants via root induction and transplanting in greenhouse were obtained.The PCR and RT-PCR analysis results of transgenic kiwifruit plants indicated that antibacterial peptide D had been integrated in theActinidiachinensisgenome and transcribed.The activity analysis of catalase(CAT),peroxidase(POD),and phenylalanine ammonialyase(PAL) showed that in response to canker bacteria treatment,enzyme activities of CAT and POD in transgenic plants were greatly reduced,and PAL enzyme activity was enhanced compared with the controls.
Actinidiachinensis; antibacterial peptide D; catalase; peroxidase; phenylalanine ammonialyase
2016-01-20
河南省现代农业产业技术体系大宗水果产业技术创新团队项目(S2014-11-G02);河南省高校科技创新团队支持计划项目(14IRTSTHN011)
韦鹏飞(1988-),男,河南临颍人,在读硕士研究生,研究方向:经济林栽培与生理。E-mail:444192771@qq.com
*通讯作者:冯建灿 (1963-),男,河南新密人,教授,博士,主要从事经济林栽培与生理研究。E-mail:jcfeng@henau.edu.cn
S663.4
A
1004-3268(2016)05-0130-05
